Способ моделирования острого деструктивного инфицированного панкреонекроза
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к экспериментальной хирургии, и может быть использовано для моделирования острого деструктивного инфицированного панкреонекроза. Способ включает лапаротомию у крыс линии Вистар с выведением в рану комплекса селезенки и поджелудочной железы. Затем выполняют криодеструкцию участка железы в течение 5 сек аппликатором площадью 0,6 см2, охлажденным в жидком азоте в течение 40 сек. Далее проводят погружение комплекса поджелудочной железы и селезенки в заранее сформированную из наружной и внутренней косых мышц передней брюшной стенки ограниченную полость. Затем в эту полость вводят 0,3 мл 1 млрд микробной взвеси золотистого стафилококка. Перед ушиванием операционной раны к листкам наружной косой мышцы закрепляют фистулу для последующего введения в сформированную полость лекарственных препаратов. Способ обеспечивает создание управляемого моделирования панкреонекроза, близкого к таковому, развивающемуся в клинических условиях. 6 ил., 4 табл., 1 пр.
Реферат
Изобретение относиться к медицине, в частности к экспериментальной хирургии.
Наиболее близким к заявленному решению является способ моделирования деструктивного панкреатита, описанный Шалимовым С.А. и соавт., 1989 г., с применением аппарата «Криоэлектроника»: после извлечения через лапаротомное отверстие поджелудочной железы на ее поверхности устанавливают аппликатор установки «Криоэлектроника», замораживают нужных размеров участок до температуры от -25°С до -100°С и ниже, поддерживают эту температуру в течение 3-5 мин, а затем размораживают. На участке, подвергшемся криовоздействию, возникает острый геморрагический панкреатит с исходом в очаговый некроз и склероз. Прилегающие участки железы остаются интактными. Если площадь криодеструкции превышает 30% площади всей железы, животное погибает. Деструкции подвергается как эндо-, так и экзокринная ткань. После чего поджелудочная железа погружалась в брюшную полость животного.
Недостатками данного способа являются: отсутствие ограниченности воспалительного процесса от органов брюшной полости, с развитием панкреатита и ферментативного перитонита.
Технический результат изобретения: создание управляемого способа моделирования острого деструктивного инфицированного панкреонекроза, близкого к таковому, развивающемуся в клинических условиях.
Технический результат достигается тем, что после моделирования деструктивного панкреонекроза путем криодеструкции поджелудочной железы крысы аппликатором площадью 0,6 см2 в течение 5 сек, охлажденным в жидком азоте в течение 40 сек, производится погружение комплекса поджелудочной железы и селезенки крысы в заранее сформированную искусственным путем из наружной и внутренней косых мышц передней брюшной стенки животного ограниченную полость, с последующим в нее введением 0,3 мл 1 млрд микробной взвеси золотистого стафилококка. Перед ушиванием операционной раны к листкам наружной косой мышцы закреплялась фистула для последующего введения в сформированную полость лекарственных препаратов.
Изобретение поясняется чертежами.
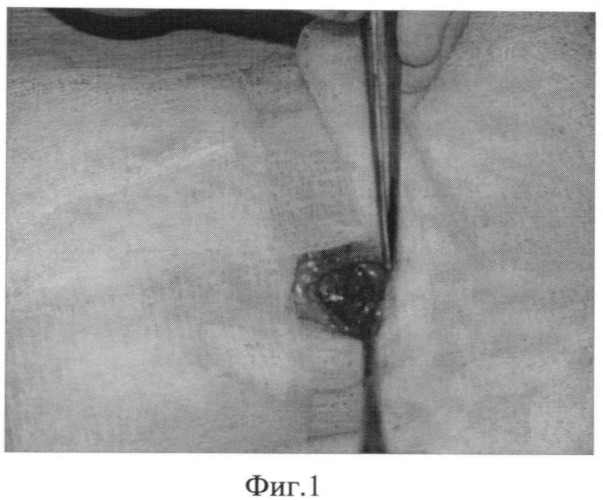
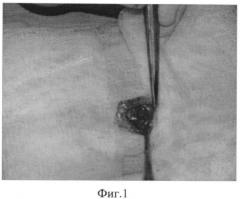
Фиг.1 - формирование полости из мышц передней брюшной стенки.
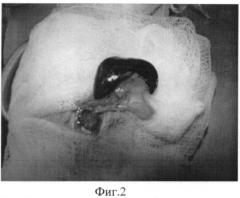
Фиг.2 - выведение из брюшной полости комплекса поджелудочной железы и селезенки.
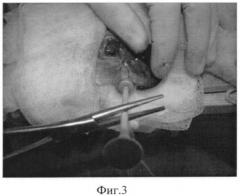
Фиг.3 - нанесение криодеструкции на поджелудочную железу.
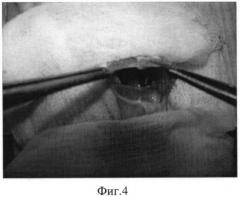
Фиг.4 - погружение комплекса поджелудочной железы и селезенки крысы в сформированную искусственным путем из мышц передней брюшной стенки животного ограниченную полость.
Фиг.5 - введение в сформированную искусственным путем из мышц передней брюшной стенки животного ограниченную полость 0,3 мл 1 млрд микробной взвеси золотистого стафилококка.
Фиг.6 - закрепление фистулы к листкам наружной косой мышцы передней брюшной стенки животного для последующего введения в сформированную полость лекарственных препаратов.
Способ осуществляется следующим образом.
Моделирование острого деструктивного инфицированного панкреонекроза проводят на половозрелых крысах линии «Wistar», средней массой тела 250-300 г, без признаков заболеваний, прошедших карантин и содержащихся на стандартном пищевом и питьевом режиме в условиях вивария.
Под общим наркозом (хлоралгидрат 300 мг/кг, внутрибрюшинно), с соблюдением правил асептики и антисептики проводят лапаротомию параректальным разрезом слева, длинной до 2 см. Выполняют моделирование острого деструктивного инфицированного панкреонекроза путем криодеструкции поджелудочной железы крысы аппликатором площадью 0,6 см2 в течение 5 сек, охлажденным в жидком азоте в течение 40 сек, производится погружение комплекса поджелудочной железы и селезенки крысы в заранее сформированную искусственным путем из наружной и внутренней косых мышц передней брюшной стенки животного ограниченную полость, с последующим в нее введением 0,3 мл 1 млрд микробной взвеси золотистого стафилококка. Перед ушиванием операционной раны к листкам наружной косой мышцы закреплялась фистула для последующего введения в сформированную полость лекарственных препаратов.
Пример конкретного выполнения
Исследование проводилось в условиях операционного блока НИИ Экологической медицины на базе Курского государственного медицинского университета. Использовались половозрелые крысы самцы линии «Wistar» без признаков заболеваний, прошедшие карантин и содержащиеся на стандартном пищевом и питьевом режиме в условиях вивария. Все манипуляции выполнялись с соблюдением требований к гуманному обращению с животными (г.Страсбург, Франция, 1986).
С соблюдением правил асептики и антисептики под общим наркозом (хлоралгидрат 300 мг/кг, внутрибрюшинно) проводилась лапаротомия параректальным разрезом слева, длинной до 2 см. В рану выводился комплекс селезенка с желудочно-селезеночной связкой. Поджелудочная железа изолировалась от органов брюшной полости путем наложения 1-2 швов на листки внутренней косой мышцы, а от окружающих тканей - стерильной салфеткой.
Перед моделированием острого деструктивного инфицированного панкреонекроза производили измерение микроциркуляции в желудочно-селезеночной связке методом лазерной доплеровской флоуметрии (ЛДФ). Исследование осуществляли при помощи аппарата - лазер-доплеровского флоуметра «Biopac-systems MP-100» и датчика «TSD-144». Запись и обработка данных производилась при помощи программы AcqKnowledge 3.8.1. Уровень микроциркуляции регистрировали в 24 точках желудочно-селезеночной связки по ходу сегментарных селезеночных артерий. Запись кривой уровня микроциркуляции проводили в течение 30 сек в каждой точке. Из полученных 24 значений выводили среднее, которое вносили в протокол и принимали за уровень микроциркуляции у данного животного.
В сосуд Дюара, содержащий жидкий азот, на 40 сек погружался аппликатор с площадью рабочей поверхности 0,6 см2, при погружении аппликатор держали за шелковую нить. После извлечения из жидкого азота аппликатор захватывался пинцетом и на 5 сек прижимался к левой доле поджелудочной железы так, чтобы избежать контакта с селезеночными сосудами. После замораживания поджелудочной железы дожидались ее оттаивания. Затем комплекс поджелудочной железы и селезенки погружался в полость, образованную наружной и внутренней косой мышцами передней брюшной стенки крысы. В полость вводилась микробная взвесь золотистого стафилококка в объеме 0,3 мл. Перед ушиванием полости к листкам наружной косой мышцы закреплялась фистула для последующего введения в сформированную полость лекарственных препаратов. Установленная фистула частично укрывалась кожей.
В эксперименте производилось 4 серии исследований:
1 серия - крысы без лечения, 2 серия - крысы, которым проводилось лечение введением в сформированную оперативным путем полость мази «Левомеколь», 3 серия - крысы, которым проводилось лечение введением в сформированную полость гипохлорита натрия в геле гидроксиметилцеллюлозы, 4 серия - крысы, которым проводилось лечение введением в сформированную полость геля гидроксиметилцеллюлозы.
Во всех сериях крысы выводились из эксперимента на 3, 5, 7, 10 сутки.
При выведении крыс из эксперимента проводилось измерение микроциркуляции в желудочно-селезеночной связке методом лазерной доплеровской флоуметрии (ЛДФ). После замера микроциркуляции проводился забор крови из левого желудочка сердца для проведения биохимического исследования, исследования OAK (плазматические клетки), забор тканей и органов для подсчета КОЕ, гистологического исследования комплекса поджелудочной железы и селезенки, печени, почек, сердца, тонкой кишки.
Результаты проведенных исследований
| Таблица 1 | |||
| Распределение экспериментальных животных по группам опытов | |||
| № п\п | Название группы | Характер эксперимента | Количество животных |
| 1 | интактная | Без лечения | 96 |
| 2 | сравнения | Введение в брюшную полость мази «Левомеколь» | 96 |
| 3 | контрольная | Введение в брюшную полость иммобилизированным гипохлоритом натрия в геле полимеров | 96 |
| Таблица 2 | ||||
| Уровень летальности в исследуемых группах | ||||
| Название группы | 3 сутки | 5 сутки | 7 сутки | 10 сутки |
| итактаная | 97,5% | 83,3% | 83,3% | 79,1% |
| сравнения | 79,3% | 70,8% | 66,6% | 62,5% |
| контрольная | 62,5% | 54,2% | 42% | 30% |
| Примечание: * - р<0,05 в сравнении с показателями первой группы |
При исследовании уровня летальности: смертность в 3 контрольной в 1,4 раза (46,8%) меньше, чем во 2 сравнения (69,7%), и в 1,8 раза ниже, чем в итактной (83,3%).
| Таблица 3 | ||||
| Динамика показателей эндогенной интоксикации у животных с экспериментальным панкреонекрозом | ||||
| показатели | Сроки после операции | Группы животных | ||
| 1 | 2 | 3 | ||
| ЛИИ, усл. ед. (здоровые животные - 1,1±0,3) | 3 | 7,6±0,5 | 6,3±0,4 | 4,5±0,5* |
| 5 | 6,3±0,4 | 4,9±0,4 | 1,9±0,4* | |
| 7 | 6,1±0,4 | 3,3±0,3* | 1,3±0,3* | |
| 10 | 4,9±0,3 | 2,1±0,3* | 1,2±0,3* | |
| Лейкоциты*103\мл (здоровые животные - 8,8±0,4) | 3 | 19,1±0,8 | 17,4±0,7 | 14,9±0,5* |
| 5 | 17,2±0,6 | 13,5±0,4 | 9,5±0,4* | |
| 7 | 12,7±0,4 | 10,7±0,3* | 8,0±0,3* | |
| 10 | 11,1±0,4 | 8,9±0,2* | 8,1±0,3* | |
| Примечание: * - р<0,05 в сравнении с показателями первой группы |
При исследовании общего анализа крови установлено, что нормализация лейкоцитоза и лейкоцитарного индекса интоксикации (ЛИИ) в контрольной группе наступала к 5-м суткам, а в группе сравнения - на 7 сутки.
| Таблица 4 | |||||
| Результаты бактериологического исследования ткани из очага инфицирования у крыс с экспериментальным панкреонекрозом | |||||
| № | Название группы | Количество микроорганизмов, КОЕ*103/мл | |||
| 3 сутки | 5 сутки | 7 сутки | 10 сутки | ||
| 1 | интактные | 89,5±7,2 | 84,2±5,8 | 81,1±4,8 | 78,1±1,8 |
| 2 | сравнения | 61,3±6,2 | 58,4±5,0 | 53,6±3,2 | 47,2±2,1 |
| 3 | контрольная | 37,8±6,7 | 32,2±4,6 | 29,4±2,2 | 26,7±1,2 |
| Примечание: достоверность различий средних, р<0,05. |
При бактериологическом исследовании количество микроорганизмов в 1 г ткани очага инфицирования на 3 сутки в контрольной группе в 1,6 раза ниже, чем в группе сравнения и почти в 2 раза ниже к 10-м суткам.
Таким образом, предложенная модель позволяет экспериментально изучать действие лекарственных препаратов на течение инфицированного панкреонекроза.
Способ моделирования острого деструктивного инфицированного панкреонекроза, включающий лапаротомию, выведение поджелудочной железы из брюшной полости и последующую криодеструкцию участка железы, отличающийся тем, что у крыс линии Вистар предварительно формируют ограниченную полость из наружной и внутренней косых мышц передней брюшной стенки, из брюшной полости выводят комплекс поджелудочной железы и селезенки, затем в течение 5 секунд осуществляют криодеструкцию участка железы аппликатором площадью 0,6 см, охлажденным в жидком азоте в течение 40 секунд, затем погружают комплекс в заранее сформированную ограниченную полость и вводят в нее 0,3 мл 1 млрд микробной взвеси золотистого стафилококка, перед ушиванием операционной раны к листкам наружной косой мышцы вшивают фистулу для последующего введения в полость лекарственных веществ.