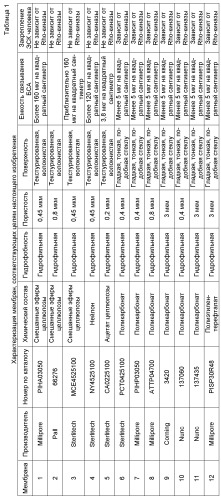
Способы и композиции для закрепления и культивирования клеток на плоских носителях
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Описан способ закрепления плюрипотентных стволовых клеток человека на плоском носителе. Способ предусматривает получение суспензии плюрипотентных стволовых клеток и добавление к суспензии соединения, способного ингибировать активность Rho-киназы. Далее проводят добавление суспензии клеток к плоскому носителю и проводят удаление соединения после закрепления клеток. 2 н. и 12 з.п. ф-лы, 32 ил., 10 табл., 14 пр.
Реферат
Настоящая заявка истребует приоритет по заявке за номером 61/116452, поданной 20 ноября 2008 г.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на создание способов выращивания, размножения и дифференцирования плюрипотентных стволовых клеток на плоских носителях, не имеющих адсорбированного слоя и слоя питающих клеток.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Культивирование клеток млекопитающих является одним из многих процессов в медико-биологических науках. Для культивирования и анализа опорнозависимых клеток млекопитающих часто используют сосуды из стекла или пластика, например полистирола, что нередко требует дополнительной обработки поверхности, обеспечивающей закрепление клеток на поверхности сосуда. Подобная обработка может включать в себя нанесение на поверхности адсорбированного слоя, например, путем адсорбции, плазмостимулированной полимеризации или привитой сополимеризации. Альтернативно, обработка поверхности может включать химическую модификацию самой поверхности сосуда, что может быть достигнуто обработкой с использованием коронного разряда в атмосфере, радиочастотной плазменной обработки в вакууме, тлеющего разряда постоянного тока и микроволновой плазменной обработки.
Существующие на сегодня способы культивирования плюрипотентных стволовых клеток, в частности, эмбриональных стволовых клеток (ЭСК), требуют сложных условий культивирования, таких как, например, культивирование эмбриональных стволовых клеток на поверхности твердого носителя с нанесенным слоем питающих клеток или на поверхности твердого носителя с нанесенным адсорбированным слоем белка внеклеточного матрикса. В использующих эти способы системах для культивирования нередко применяются питающие клетки или белки внеклеточного матрикса, полученные из организма другого вида по отношению к организму, чьи стволовые клетки культивируются (ксеногенный материал). Для культивирования эмбриональных стволовых клеток могут применяться среды, полученные при введении питающих клеток, то есть среды, кондиционируемые клетками, отличными от недифференцированных эмбриональных стволовых клеток, причем в эти среды может дополнительно вводиться сыворотка животных.
Например, в работах Reubinoff et al. (Nature Biotechnol. 18:399-404, 2000) и Thompson et al. (Science 282:1145-1147, 1998) описывается способ культивирования линий эмбриональных стволовых клеток из бластоцистов человека с использованием питающего клеточного слоя из мышиных эмбриональных фибробластов.
В другом примере, работе Xu et al. (Nature Biotechnology 19: 971-974, 2001), описывается использование препарата MATRIGEL® и ламинина для обработки поверхностей твердого носителя перед культивированием эмбриональных стволовых клеток человека без дифференцирования, причем культивирование ведется без использования питающих клеток. В другом примере, в работе Vallier et al. (J. Cell Sci. 118:4495-4509, 2005), описывается использование эмбриональной бычьей сыворотки для обработки поверхностей твердого носителя перед культивированием эмбриональных стволовых клеток человека без дифференцирования, причем культивирование ведется без использования питающих клеток.
В другом примере, в заявке на патент WO2005014799, описывается кондиционированная среда для поддержания, пролиферации и дифференцирования клеток млекопитающих. В заявке на патент US20050244962 говорится: «Приготовленная в соответствии с настоящим изобретением культуральная среда кондиционируется благодаря секреторной активности мышиных клеток, в частности дифференцированных и иммортализованных трангенных гепатоцитов под названием MMH (Met Murine Hepatocyte).»
В другом примере, в работе Wanatabe et al. (Nature Biotechnol. 35:681-686, 2007), говорится, что «ингибитор Rho-ассоциированной киназы (ингибитор ROCK) позволяет добиться выживания диссоциированных эмбриональных стволовых клеток человека», и демонстрируется снижение индуцированного диссоциацией апоптоза, повышение эффективности клонирования (с приблизительно 1% до приблизительно 27%) и облегчение субклонирования после переноса генов при использовании мышиных эмбриональных фибробластов в качестве питающих клеток, коллагена и MATRIGEL® в качестве белка внеклеточного матрикса, и Y-27632 или Fasudil в качестве ингибитора ROCK. Более того диссоциированные эмбриональные стволовые клетки человека, обработанные Y-27632, оказались защищены от апоптоза в не содержащей сыворотки суспензионной культуре.
В другом примере, работе Peerani et al. (EMBO Journal 26:4744-4755, 2007), говорится: «Сложность пространственной организации культур эмбриональных стволовых клеток человека (ЭСК) создает гетерогенные микроокружения (ниши), которые определяют дальнейшую судьбу ЭСК. Настоящее исследование демонстрирует, что скорость и траекторию дифференцирования ЭСК можно контролировать путем создания ниш стволовых клеток с заданными свойствами. Размер и состав ниши регулируют соотношение между индуцирующими и ингибирующими дифференцирование факторами. С точки зрения механизма такой регулировки, в результате антагонистических взаимодействий между ЭСК и производных от ЭСК клеток внеэмбриональной эндодермы (ExE) создается пространственный градиент сигнального каскада Smad1, зависящий от размеров ниши. Эти взаимодействия опосредуются локализованной секрецией костного морфогенетического белка BMP2 из ExE и его антагониста, фактора дифференцирования роста GDF3 из ЭСК. Микроструктурирование ЭСК, обработанных малыми интерферирующими РНК против GDF3, BMP2 и Smad1, а также обработка ингибитором Rho-ассоциированной киназы (ROCK), демонстрируют, что независимый контроль активации Smad1 может спасти зависящее от размера колонии дифференцирование ЭСК. Результаты авторов патента впервые показывают роль Smad1 в интеграции пространственной информации и в контроле самообновления и дифференцирования ЭСК в зависимости от размера ниши».
В другом примере, работе Koyanagi, M et al.(J Neurosci Res. 2008 Feb 1; 86(2): 270-80), говорится: «Участие Rho-ГТФазы предполагалось в апоптозе многих типов клеток, включая нейроны, но механизм ее действия до сих пор полностью не выяснен. В настоящей работе авторы исследуют роль Rho и ROCK в апоптозе в процессе трансплантации нейронных клеток-предшественников, происходящих от эмбриональных стволовых клеток. Авторы обнаружили, что диссоциация предшественников нейронов приводит к активации Rho и индуцирует апоптоз. Обработка ингибитором Rho, внеклеточным ферментом C3, и/или ингибитором ROCK Y-27632 снижает степень индуцированного диссоциацией апоптоза (аноикоза) на 20-30%. Ингибирование ROCK также снижает пузырение мембраны - ранний морфологический признак апоптоза; расщепление каспазы-3; и высвобождение цитохорма c из митохондрий. Полученные результаты дают основание полагать, что диссоциация нейронных клеток-предшественников активирует внутренний каскад смерти клетки, который по меньшей мере частично опосредуется через каскад Rho/ROCK. Более того, в экспериментальной модели трансплантации на животном ингибирование Rho и/или ROCK приводит к подавлению острого апоптоза трансплантированных клеток. После трансплантации вокруг трансплантата наблюдается ярко выраженная экспрессия фактора некроза опухоли альфа и профактора роста нервов. Ингибирование ROCK также подавляет апоптоз, которому способствуют эти воспалительные цитокины. Взятые вместе, полученные результаты указывают на то, что ингибирование каскада Rho/ROCK может повысить выживаемость трансплантированных клеток в заместительной клеточной терапии.»
Использование ксеногенных материалов может оказаться недопустимым в ряде применений, связанных с использованием плюрипотентных стволовых клеток. В таких случаях можно использовать альтернативные материалы. Например, в работе Stojkovic et al. (Stem Cells 23:895-902, 2005) описано применение сыворотки человека для обработки поверхности твердого носителя перед культивированием эмбриональных стволовых клеток человека без дифференцирования, причем культивирование ведется без использования питающих клеток.
В альтернативной культуральной системе используется не содержащая сыворотки среда, обогащенная факторами роста, способными стимулировать пролиферацию эмбриональных стволовых клеток.
Например, в работе Cheon et al. (BioReprod DOI:10.1095/biolreprod.105.046870; 19 Oct 2005) описана не содержащая ни питающих клеток, ни сыворотки культуральная система, в которой эмбриональные стволовые клетки поддерживаются в некондиционированной замещающей сыворотку среде с добавлением различных факторов роста, способных инициировать самообновление эмбриональных стволовых клеток.
В другом примере, в работе Levenstein et al. (Stem Cells 24:568-574, 2006), описаны способы долговременного культивирования эмбриональных стволовых клеток человека в отсутствие фибробластов или кондиционированной среды с использованием среды с добавлением базового фактора роста фибробластов FGF.
В другом примере, заявке на патент US20050148070, описывается способ культивирования эмбриональных стволовых клеток человека в среде с определенным составом, не содержащей сыворотки и не содержащей питающих клеток-фибробластов, включающий: культивирование стволовых клеток в культуральной среде, содержащей альбумин, аминокислоты, витамины, минеральные вещества, по меньшей мере один трансферин или заместитель трансферина, по меньшей мере один инсулин или заместитель инсулина, причем культуральная среда по существу не содержит эмбриональной сыворотки млекопитающих и содержит по меньшей мере приблизительно 100 нг/мл FGF, способного активировать FGF-сигнальный рецептор, где фактор роста поступает из источника, отличного от просто слоя питающих клеток фибробластов, среду, поддерживающую пролиферацию стволовых клеток в недифференцированном состоянии без слоя питающих клеток или кондиционированной среды.
В другом примере, в заявке на патент US20050233446, описывается среда с определенным составом, которая может быть использована при культивировании стволовых клеток, включая недифференцированные зародышевые стволовые клетки приматов. В растворе среда является по существу изотонической относительно культивируемых стволовых клеток. Для каждой культуры конкретно используемая среда состоит из основной среды с добавлением базового FGF, инсулина и аскорбиновой кислоты, необходимых для поддержания по существу недифференцированного роста зародышевых стволовых клеток.
В другом примере, заявке на патент US6800480, говорится: «В одном варианте осуществления предлагается культуральная среда для выращивания зародышевых стволовых клеток приматов в по существу недифференцированном состоянии, включающая основную среду с низким содержанием эндотоксина и низким осмотическим давлением, которая эффективно поддерживает рост зародышевых стволовых клеток приматов. Основная среда объединяется с питательной сывороткой, способной поддерживать рост зародышевых стволовых клеток приматов, и субстратом, выбираемым из группы, состоящей из питающих клеток и внеклеточного матрикса, полученного из питающих клеток. Среда также включает в себя заменимые аминокислоты, антиоксидант и первый фактор роста, выбираемый из группы, состоящей из нуклеозидов и соль-пируватов.»
В другом примере, в заявке на патент US20050244962, говорится: «В одном аспекте изобретения предлагается способ культивирования эмбриональных стволовых клеток приматов. Стволовые клетки культивируются в культуре, по существу свободной от эмбриональной сыворотки млекопитающих (предпочтительно также по существу свободной от сыворотки любых животных) и в присутствии фактора роста фибробластов, полученного из источника, отличного от просто слоя питающих фибробластов. В предпочтительной форме слой питающих фибробластов, ранее необходимый для поддержания культуры стволовых клеток, становится необязательным вследствие добавления достаточного количества фактора роста фибробластов.»
В другом примере, заявке на патент WO2005065354, описывается по существу свободная от питающих клеток и сыворотки изотоническая культуральная среда с определенным составом, содержащая: а. базальную среду; b. базовый фактор роста фибробластов в количестве, достаточном для поддержания роста по существу недифференцированных стволовых клеток млекопитающих; c. инсулин в количестве, достаточном для поддержания роста по существу недифференцированных стволовых клеток млекопитающих; и d. аскорбиновую кислоту в количестве, достаточном для поддержания роста по существу недифференцированных стволовых клеток млекопитающих.
В другом примере, заявке на патент WO2005086845, описан способ поддержания недифференцированных стволовых клеток, причем упомянутый способ включает в себя воздействие на стволовые клетки одним из членов семейства белков трансформирующего ростовой фактор-бета (TGFβ), одним из членов семейства белков фактора роста фибробластов (FGF) или никотинамидом (NIC) в количестве, достаточном для поддержания клеток в недифференцированном состоянии в течение периода времени, достаточного для получения желаемого результата.
Плюрипотентные стволовые клетки обладают большим потенциалом для научно-исследовательской работы и скрининга лекарственных препаратов. В настоящее время крупномасштабное культивирование линий эмбриональных стволовых клеток человека представляет большие проблемы и сталкивается с существенными трудностями. Возможные пути преодоления этих трудностей заключаются в пассировании и культивировании эмбриональных стволовых клеток человека в виде одиночных клеток. Одиночные клетки более удобны для применения стандартных методик культивирования тканей, таких как, например, подсчет клеток, трансфицирование и т.д.
Например, в работе Nicolas et al. описывается способ получения и наработки линий эмбриональных стволовых клеток человека из одиночных клеток, изолированных с помощью флюоресцентной сортировки после генетической модификации с использованием лентивирусных векторов (Stem Cells Dev. 16: 109-118, 2007).
В другом примере, заявке на патент США US2005158852, описан способ «улучшения роста и выживаемости одиночных эмбриональных стволовых клеток человека. Способ включает в себя стадии получения одиночной недифференцированной эмбриональной стволовой клетки человека; смешивания одиночной недифференцированной клетки с внеклеточным матриксом для обволакивания клетки; и посева полученной смеси на питающие клетки с питательной средой в ростовом окружении».
В другом примере, работе Sidhu et al. (Stem Cells Dev. 15:61-69, 2006), впервые сообщается о трех клонах эмбриональных стволовых клеток человека, hES 3.1, 3.2 и 3.3, полученных из родительской линии hES3 путем сортировки одноклеточных препаратов на проточном цитометре.
Однако пассирование и культивирование эмбриональных стволовых клеток человека в виде одиночных клеток приводит к генетическим аберрациям и к потере плюрипотентности. Для поддержания плюрипотентности и генетической устойчивости большое значение имеют условия культивирования. Как правило, пассирование линий эмбриональных стволовых клеток человека выполняется вручную или с использованием ферментативных веществ, таких как коллагеназа, либераза или диспаза.
Например, в работе Draper et al. отмечается наличие «кариотипических изменений, включающих в себя амплификацию 17q плеча в трех независимых линиях эмбриональных стволовых клеток человека в пяти независимых случаях.» (Nature Biotechnol. 22: 53-54, 2004).
В другом пример, работе Buzzard et al., говорится: «мы зафиксировали лишь одно изменение кариотипа…, что может быть обусловлено используемыми нами способами культивирования, поскольку наши способы существенно отличаются от способов, используемых большинством других групп. Как правило, мы пассируем эмбриональные стволовые клетки человека через семь дней, сначала подсекая колонию краем разломленной пипетки… При таком способе пассирования не используются никакие ферментативные или химические способы диссоциации клеток. Мы считаем, что именно с этим может быть связана относительная генетическая устойчивость эмбриональных стволовых клеток человека в наших руках.» (Nature Biotechnol. 22: 381-382, 2004).
В другом примере, работе Mitalipova et al., говорится: «способы группового пассирования... могут зафиксировать популяции анэуплоидных клеток после многократного пассирования в культуре, но могут применяться на более коротких промежутках времени (по меньшей мере до 15 пассажей) без угрозы изменения кариотипа…, возможно удастся поддерживать нормальный кариотип эмбриональных стволовых клеток человека в условиях продолжительного ручного ведения с последующим ограниченным числом групповых пассирований в экспериментах, требующих больших количеств эмбриональных стволовых клеток человека, чем могут обеспечить только способы ручного пассирования». (Nature Biotechnol. 23: 19-20, 2005).
В другом примере, работе Heng et al., говорится: «полученные результаты показали, что второй протокол (трипсинизация с умеренным пипетированием) наносит гораздо меньший ущерб жизнеспособности клеток по сравнению с первым протоколом (обработка коллагеназой и соскребание). Это, в свою очередь, выливается в большую вероятность выживания клеток в циклах заморозки/разморозки.» (Biotechnology and Applied Biochemistry 47:33-37, 2007).
В другом примере, работе Hasegawa et al., говорится: «мы вывели сублинии эмбриональных стволовых клеток человека, переносящих полную диссоциацию. Эти клетки имеют высокую эффективность пересева и высокую эффективность клонирования, при этом они сохраняют свою способность дифференцирования в клетки всех трех зародышевых листков.» (Stem Cells 24:2649-2660, 2006).
В другом примере, заявке на патент США 61/030544, описаны способы и композиции для закрепления клеток на, культивирования клеток на и снятия клеток с поверхности твердого носителя, содержащей от по меньшей мере приблизительно 0,9% азота до по меньшей мере приблизительно 11% азота и от по меньшей мере приблизительно 12% кислорода до по меньшей мере приблизительно 30% кислорода, не имеющей слоя питающих клеток и адсорбированного слоя. В одном из вариантов осуществления настоящего изобретения клетки обрабатывают соединением, способным ингибировать активность Rho-киназы.
Имеется значительная потребность в способах и композициях для культивирования клеток, включая культивирование плюрипотентных стволовых клеток в отсутствие слоя питающих клеток и адсорбированного слоя при сохранении плюрипотентности культивируемых клеток. В настоящем изобретении предложены способы выращивания, размножения и дифференцирования плюрипотентных стволовых клеток на плоских носителях, не имеющих адсорбированного слоя и слоя питающих клеток, причем клетки не требуют обработки соединением, способным ингибировать активность Rho-киназы, для закрепления на плоском носителе.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном варианте осуществления настоящего изобретения описаны способы закрепления клеток на, культивирования клеток на и снятия клеток с плоского носителя, содержащего до приблизительно 12% N, от по меньшей мере приблизительно 12% O до по меньшей мере приблизительно 55% O, с углом смачивания от приблизительно 18 градусов до приблизительно 32 градусов, не имеющего адсорбированного слоя и слоя питающих клеток.
КРАТКОЕ ОПИСАНИЕ ФИГУР
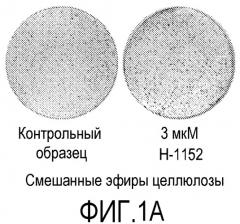
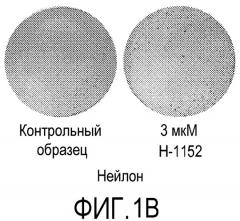
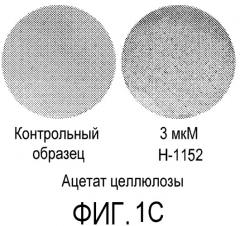
На фиг.1 показано влияние ингибитора Rho-киназы H-1152 на закрепление эмбриональных стволовых клеток человека линии H1 на плоских носителях. На фиг.1А показано закрепление клеток на мембранах из смешанных эфиров целлюлозы (мембрана № 2 в Таблице 1). На фиг.1В показано закрепление клеток на мембранах из нейлона (мембрана № 4 в Таблице 1). На фиг.1С показано закрепление клеток на мембранах из ацетата целлюлозы (мембрана № 5 в Таблице 1). На фиг.1D показано закрепление клеток на мембранах из поликарбоната (мембрана № 7 в Таблице 1). На фиг.1E показано закрепление клеток на мембранах из полиэтилентерефталата (мембрана № 12 в Таблице 1).
На фиг.2 показано влияние ингибитора Rho-киназы Y-26732 на закрепление эмбриональных стволовых клеток человека линии H9 на мембране из смешанных эфиров целлюлозы (мембрана № 1 в Таблице 1). На фиг.2A показано закрепление клеток в контрольной лунке. На фиг.2B показано закрепление клеток, обработанных 10 мкМ Y-26732. На фиг.2C показано закрепление клеток, обработанных 20 мкМ Y-26732.
На фиг.3 показаны кривые пролиферации эмбриональных стволовых клеток человека линии H1 на покрытой препаратом MATRIGEL® поверхности (сплошная линия) и на мембранах из смешанных эфиров целлюлозы (мембрана № 1 в Таблице 1) (пунктирная линия).
На фиг.4 показаны окрашенные с использованием красителя Гимза хромосомы представительных клеток из эмбриональных стволовых клеток человека линии H1. На фиг.4A показаны хромосомы клеток, культивированных в течение 10 пассажей на покрытых препаратом MATRIGEL® поверхностях. На фиг.4B показаны хромосомы клеток, культивированных в течение 10 пассажей на мембранах из смешанных эфиров целлюлозы (мембрана № 1 в Таблице 1).
На фиг.5 показано влияние ингибитора Rho-киназы Y26732 на закрепление эмбриональных стволовых клеток человека линии H9 на поликарбонатных мембранах (мембрана № 7 в Таблице 1). На фиг.5A показано закрепление клеток в контрольной лунке. На фиг.5B показано закрепление клеток, обработанных 10 мкМ Y-26732. На фиг.5C показано закрепление клеток, обработанных 20 мкМ Y-26732.
На фиг.6 показано влияние ингибитора Rho-киназы H-1152 на закрепление эмбриональных стволовых клеток человека линии H1 на поликарбонатных мембранах (мембрана № 7 в Таблице 1). На фиг.6A показано закрепление клеток в контрольной лунке. На фиг.6B показано закрепление клеток при добавлении в культуральную среду 0,03 мкМ H-1152. На фиг.6C показано закрепление клеток при добавлении в культуральную среду 0,1 мкМ H-1152. На фиг.6D показано закрепление клеток при добавлении в культуральную среду 0,3 мкМ H-1152. На фиг.6E показано закрепление клеток при добавлении в культуральную среду 1 мкМ H-1152. На фиг.6F показано закрепление клеток при добавлении в культуральную среду 3 мкМ H-1152.
На фиг.7 показано открепление эмбриональных стволовых клеток человека линии H1 от поликарбонатных мембран (мембрана № 9 в Таблице 1) после удаления из культуральной среды ингибитора Rho-киназы H-1152. На фиг.7A показано открепление клеток в случае, когда в культуральной среде поддерживалась концентрация H-11523 мкМ. На фиг.7B показано открепление клеток в случае, когда H-1152 был удален из культуральной среды.
На фиг.8 показано влияние размера пор в мембране и обработки ингибитором Rho-киназы на закрепление эмбриональных стволовых клеток человека линии H1 на плоских носителях, представляющих собой: поликарбонатную мембрану № 10 в Таблице 1 для фиг.8A и 8C; и поликарбонатную мембрану № 11 в Таблице 1 для фиг.8B и 8D. На фиг.8A и 8B показано открепление клеток в случае, когда в культуральной среде поддерживалась концентрация H-1152 3 мкМ. На фиг.8C и 8D показано открепление клеток в случае, когда H-1152 был удален из культуральной среды.
На фиг.9 показано сохранение экспрессии ассоциируемых с плюрипотентностью маркеров для эмбриональных стволовых клеток человека линии H1, культивировавшихся в течение трех пассажей на поликарбонатных мембранах (мембрана № 8 в Таблице 1). Уровень экспрессии указанных на фигуре генов определяли с использованием ПЦР в режиме реального времени. Сплошными столбиками показаны данные, полученные для недифференцированных эмбриональных стволовых клеток человека линии H1. Заштрихованными столбиками показаны данные, полученные для клеток, культивировавшихся на поликарбонатных мембранах.
На фиг.10 показана способность эмбриональных стволовых клеток человека линии H1 образовывать эмбриоидные тельца после культивирования в течение 12 пассажей на поликарбонатных мембранах (мембрана № 8 в Таблице 1). На фигуре приведены представительные данные из одного эксперимента.
На фиг.11 показаны полученные на сканирующем электронном микроскопе микрофотографии плоских носителей, составляющих предмет настоящего изобретения.
На фиг.12 показаны полученные на сканирующем электронном микроскопе микрофотографии плоского носителя ULTRAWEBTM.
На фиг.13 показано влияние среды определенного состава mTESRTM на связывание эмбриональных стволовых клеток человека линии H1 с различными плоскими носителями.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для ясности описания, а не в ограничение изобретения, подробное описание изобретения разделено на следующие подразделы, описывающие или иллюстрирующие определенные особенности, варианты осуществления или области применения настоящего изобретения.
Определения
Используемый в настоящей заявке термин «адсорбированный слой» относится к слою на поверхности твердого носителя, формируемому путем прикрепления молекул к поверхности либо ковалентными (так называемая пересадка), либо нековалентными (так называемая адсорбция) связями. Используемые для получения адсорбированного слоя молекулы могут быть, например, белковыми и родственными им молекулами, которые могут включать в себя, например, белки внеклеточного матрикса, аминокислоты и т.д., или молекулами небиологической природы, такими как, например, полиэтиленимин.
Используемый в настоящей заявке термин «β-клеточная линия дифференцирования» относится к клеткам, положительным по экспрессии гена транскрипционного фактора PDX-1 и по меньшей мере одного из следующих транскрипционных факторов: NGN3, NKX2.2, NKX6.1, NEUROD, ISL1, HNF-3 бета, MAFA, PAX4 или PAX6. Клетки с экспрессией маркеров, характерных для β-клеточной линии дифференцирования, включают в себя β-клетки.
Используемый в настоящей заявке термин «клетки с экспрессией маркеров, характерных для линии дифференцирования в клетки сформированной эндодермы» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: SOX17, GATA4, HNF3 бета, GSC, CER1, Nodal, FGF8, Brachyury, Mix-подобный гомеобоксный белок, FGF4 CD48, эомезодермин (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 или OTX2. Клетки с экспрессией маркеров, характерных для линии дифференцирования в клетки сформированной эндодермы, включают в себя клетки-предшественники первичной полоски, клетки первичной полоски, клетки мезэндодермы и клетки сформированной эндодермы.
Термин «клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы» в настоящем документе обозначает клетки, экспрессирующие по меньшей мере один из следующих маркеров: PDX1, HNF1 бета, PTF1 альфа, HNF6, NKX6.1 или HB9. Клетки с экспрессией маркеров, характерных для линии дифференцирования в клетки панкреатической эндодермы, включают в себя клетки панкреатической эндодермы, клетки первичной кишечной трубки и клетки поздней передней кишки.
Используемый в настоящей заявке термин «сформированная эндодерма» относится к клеткам, обладающим характерными особенностями клеток, происходящих в ходе гаструляции от эпибласта, и формирующим желудочно-кишечный тракт и его производные. Клетки сформированной эндодермы экспрессируют следующие маркеры: HNF3 бета, GATA4, SOX17, церберус, OTX2, гузекоид, C-Kit, CD99 или MIXL1.
Используемый в настоящей заявке термин «панкреатическая эндокринная клетка» или «клетка, экспрессирующая панкреатические гормоны» относится к клеткам, способным к экспрессии по меньшей мере одного из следующих гормонов: инсулина, глюкагона, соматостатина и панкреатического полипептида.
Используемый в настоящей заявке термин «внеэмбриональная эндодерма» относится к популяции клеток, экспрессирующих по меньшей мере один из следующих маркеров: SOX7, AFP или SPARC.
Используемый в настоящей заявке термин «белки внеклеточного матрикса» относится к белковым и родственным им молекулам, обычно находящимся между клетками в теле или в плаценте. Белки внеклеточного матрикса могут быть получены из ткани, биологических жидкостей, например крови, или из среды, кондиционированной нерекомбинантными клетками, рекомбинантными клетками или бактериями.
Используемый в настоящей заявке термин «маркеры» обозначает молекулы нуклеиновых кислот или полипептидов с дифференциальной экспрессией в интересующих клетках. В данном контексте под дифференциальной экспрессией подразумевается повышение уровня экспрессии для положительного маркера и понижение уровня экспрессии для отрицательного маркера. Определяемый уровень маркерной аминокислоты или полипептида в интересующих клетках оказывается значительно выше или ниже по сравнению с другими клетками, что позволяет идентифицировать интересующую клетку и отличить ее от других клеток с помощью любого из множества известных в данной области способов.
Используемый в настоящей заявке термин «клетка мезэндодермы» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: CD48, эомезодермин (EOMES), SOX-17, DKK4, HNF3 бета, GSC, FGF17 или GATA6.
Используемый в настоящей заявке термин «панкреатическая секретирующая гормоны клетка» относится к клеткам, способным к секреции по меньшей мере одного из следующих гормонов: инсулина, глюкагона, соматостатина и панкреатического полипептида.
Используемый в настоящей заявке термин «клетка-предшественник клетки первичной полоски» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: Nodal или FGF8.
Используемый в настоящей заявке термин «клетка первичной полоски» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: Brachyury, Mix-подобный гомеобоксный белок или FGF4.
Стволовые клетки представляют собой недифференцированные клетки, определяемые по их способности на уровне единичной клетки как самообновляться, так и дифференцироваться с образованием клеток-потомков, таких как самообновляющиеся клетки-предшественники, необновляющиеся клетки-предшественники и окончательно дифференцированные клетки. Стволовые клетки также характеризуются способностью дифференцироваться in vitro в функциональные клетки различных клеточных линий дифференцирования из нескольких зародышевых листков (эндодермы, мезодермы и эктодермы), а также после трансплантации давать начало тканям, происходящим от нескольких зародышевых листков, и вносить существенный вклад в формирование большинства, если не всех, тканей после инъекции в бластоцисты.
По потенциалу развития стволовые клетки классифицируют следующим образом: (1) тотипотентные, т.е. способные давать начало всем эмбриональным и внеэмбриональным типам клеток; (2) плюрипотентные, т.е. способные давать начало всем эмбриональным типам клеток; (3) мультипотентные, т.е. способные давать начало группе клеточных линий в пределах конкретной ткани, органа или физиологической системы (например, гематопоэтические стволовые клетки (ГСК) могут давать таких потомков, как ГСК (самообновление), олигопотентные предшественники, ограниченные клетками крови, и все типы клеток и клеточных элементов (таких как тромбоциты), являющиеся нормальными компонентами крови); (4) олигопотентные, т.е. способные давать начало более ограниченному набору клеточных линий, чем мультипотентные стволовые клетки; и (5) унипотентные, т.е. способные давать начало единственной клеточной линии (например, сперматогенные стволовые клетки).
Дифференцирование представляет собой процесс, при помощи которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает свойства специализированной клетки, например нервной или мышечной клетки. Дифференцированная клетка или клетка с индуцированным дифференцированием представляет собой клетку, занявшую более специализированное («коммитированное») положение в линии дифференцирования клетки. Термин «коммитированная» применительно к процессу дифференцирования обозначает клетку, дошедшую в ходе процесса дифференцирования до стадии, от которой в нормальных условиях она продолжит дифференцироваться до определенного типа клеток или набора типов клеток и не сможет в нормальных условиях дифференцироваться в иной тип клеток или вернуться обратно к менее дифференцированному типу. Дедифференцированием называется процесс, в ходе которого клетка возвращается к менее специализированному (или коммитированному) положению в линии дифференцирования. Используемый в настоящей заявке термин «линия дифференцирования» определяет наследственность клетки, то есть определяет, из какой клетки произошла данная клетка и каким клеткам она может дать начало. В линии дифференцирования клетка помещается в наследственную схему развития и дифференцирования. Маркером, специфичным для линии дифференцирования, называется характерная особенность, специфически ассоциированная с фенотипом клеток конкретной линии дифференцирования, которая может использоваться для оценки дифференцирования некоммитированных клеток в клетки данной линии дифференцирования.
Используемый в настоящей заявке термин «поверхность» относится к внешнему слою молекул твердого носителя - сосуда или матрицы, предназначенных для культивирования или анализа клеток. Элементный состав, степень гладкости и смачиваемость поверхности могут быть проанализированы способами рентгеновской фотоэлектронной спектроскопии (РФЭС), атомно-силовой микроскопии (АСМ) и измерения угла смачивания, соответственно.
Для описания клеток в процессе культивирования используются различные термины. Термин «поддержание» относится в целом к клеткам, помещенным в ростовую среду в условиях, которые способствуют росту и/или делению клеток, в результате чего популяция клеток может увеличиваться или не увеличиваться. Термин «пассирование» означает процесс изъятия клеток из одного культурального сосуда и переноса их в другой культуральный сосуд в условиях, которые способствуют росту и/или делению клеток.
Конкретная популяция клеток или клеточная линия иногда описывается или характеризуется числом выполненных с ней пассирований. Например, пассированная 10 раз культивируемая популяция клеток может описываться как культура десятого пассажа, или культура P10. Первичная культура, т.е. первая культура после выделения клеток из ткани, получает обозначение P0. После первого пересева клетки описываются как вторичная культура (P1, или культура первого пассажа). После второго пересева клетки превращаются в третичную культуру (P2, или культура второго пассажа) и т.д. Специалист в данной области определит, что за промежуток времени между последовательными пассированиями популяция клеток может удваиваться многократно; поэтому число удвоений популяций в культуре превышает номер пассажа. Степень размножения клеток (то есть число удваиваний популяции) за промежуток времени между последовательными пассированиями зависит от многих факторов, включая без ограничений плотность посева, тип носителя, тип среды, условия роста и продолжительность времени между пересевами.
Плоские носители настоящего изобретения
Соответствующие целям настоящего изобретения плоские носители могут быть изготовлены из любого материала, способного образовать основу, на которой смогут закрепиться плюрипотентные клетки. Например, плоский носитель может быть изготовлен из поликарбоната. Альтернативно, плоский носитель может быть изготовлен из полиэтилентерефталата (ПЭТФ). Альтернативно, плоский носитель может быть изготовлен из нейлона. Альтернативно, плоский носитель может быть изготовлен из ацетата целлюлозы. Альтернативно, плоский носитель может быть изготовлен из смешанных эфиров целлюлозы. Примеры плоских носителей, соответствующих целям настоящего изобретения, приведены в Таблице 1.
В одном варианте осуществления настоящего изобретения описаны способы закрепления, культивирования и дифференцирования плюрипотентных стволовых клеток на плоском носителе, содержащем до приблизительно 12% N, от по меньшей мере приблизительно 12% O до по меньшей мере приблизительно 55% O, с углом смачивания от приблизительно 18 градусов до приблизительно 32 градусов, не имеющем адсорбированного слоя и слоя питающих клеток. Плоский носитель, содержащий от по меньшей мере приблизительно 8% N до по меньшей мере приблизительно 12% N и от по меньшей мере приблизительно 12% O до по меньшей мере приблизительно 55% O, может представлять собой груботекстурированную волоконную поверхность или, альтернативно, гладкую поверхность.
В одном варианте осуществления настоящего изобретения описан способ закрепления плюрипотентных стволов