Новые октапептидные соединения, представляющие собой производные соматостатина
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и медицины. Предложено новое октапептидное соединение общей формулы (I): H-2-Nal1-цикло(Cys2-Tyr3-AA4-Lys5-Val6-Cys7)-Thr8-NH2. Соединение (I) имеет сродство к некоторым подтипам рецепторов соматостатина, поэтому может быть использовано в качестве терапевтически активного пептида при разработке составов лекарственных средств для лечения патологических состояний или заболеваний, в которых задействованы один или несколько рецепторов соматостатина. Также соединение (I) может быть использовано в качестве пептида, служащего носителем в рецептурных составах. 19 з.п. ф-лы, 3 табл., 25 пр.
Реферат
Настоящее изобретение относится к новым октапептидным соединениям. Эти продукты обладают хорошим сродством к некоторым подтипам рецепторов соматостатина, они особенно интересны для лечения патологических состояний или заболеваний, в которых задействован(ы) один (или несколько) рецептор(ов) соматостатина. Кроме того, эти соединения имеют физико-химические свойства, позволяющие их использовать в различных решениях при разработке составов лекарственных средств, например, в качестве фармацевтически приемлемого носителя. Изобретение относится также к фармацевтическим композициям, содержащим указанные продукты и к их применению для получения лекарственного средства.
Соматостатин (SST) является циклическим тетрадекапептидом, который был впервые выделен из гипоталамуса как вещество, ингибирующее гормон роста (Brazeau P. и др., Science 1973, 179, 77-79). Он выполняет также функцию нейротрансмиттера в головном мозге (Resine T. и др., Neuroscience 1995, 67, 777-790; Resine и др., Endocrinology 1995, 16, 427-442). Гетерогенность биологических функций соматостатина и связь между структурой и активностью его пептидных аналогов привели к открытию 5 подтипов мембранных рецепторов (Yamada и др., Proc. Natl. Acad. Sci. U.S.A. 89, 251-255, 1992; Raynor, K. и др., Mol. Pharmacol., 44, 385-392, 1993). Молекулярное клонирование позволило доказать, что биологическая активность соматостатина зависит напрямую от этих пяти подтипов рецепторов.
В настоящее время активно изучается функциональная роль этих рецепторов. Преимущественная активация 2-го и 5-го подтипов этих рецепторов связана с супрессией гормона роста GH (акромегалия), гормона TSH и пролактина в аденомах, экспрессирующих эти гормоны; однако точную роль каждого такого подтипа еще предстоит определить.
Среди патологических нарушений, связанных с соматостатином (Moreau J.P. и др., Life Sciences, 1987, 40, 419; Harris A.G. и др., The European Journal of Medicine, 1993, 2, 97-105), можно назвать в качестве примера: акромегалию, гипофизарные аденомы, болезнь Кушинга, гонадотропиномы и пролактиномы, побочные катаболические эффекты глюкокортикоидов, диабет, диабетическую ретинопатию, диабетическую нефропатию, гипертиреоз, гигантизм, гастроэнтеропанкреатические эндокринные опухоли, такие как карциноидный синдром, ВИПома, инсулинома, незидиобластоз, гиперинсулинемия, глюкагонома, гастринома и синдром Золлингера-Эллисона, GRF-ома, а также острые кровотечения из варикозно расширенных вен пищевода, гастроэзофагитный рефлюкс, гастродуоденальный рефлюкс, панкреатит, свищи желудка и поджелудочной железы, а также диареи, стойкие диареи при приобретенном иммунодепрессивном синдроме, хроническую секреторную диарею, диарею, ассоциированную с синдромом раздраженного кишечника, нарушения, связанные с гастрин-высвобождающим пептидом, вторичные патологии кишечных трансплататов, портальную гипертензию и кровотечения из варикозно расширенных вен у пациентов с циррозом, желудочно-кишечное кровотечение, кровотечение при язве двенадцатиперстной кишки, болезнь Крона, системный склероз, демпинг-синдром, синдром короткой кишки, гипотензию, склеродермию и медулярную карциному щитовидной железы, болезни, связанные с гиперпролиферацией клеток, такие как рак, в частности рак грудной железы, рак простаты, рак щитовидной железы, а также рак поджелудочной железы и рак прямой кишки, фиброзы, в частности, фиброз почек, фиброз печени, фиброз легких, фиброз кожи и фиброз центральной нервной системы, а также полипы носа и фиброз, вызванный химиотерапией, а также другие области терапии, такие как цефалии, в том числе, цефалии, связанные с гипофизарными опухолями, боли, приступы паники, химиотерапия, рубцевание ран, почечная недостаточность, вызванная задержкой роста, ожирение и задержка роста, связанная с ожирением, задержка внутриутробного развития, дисплазия скелета, синдром Нунан, синдром апное во сне, болезнь Грейвса, поликистоз яичников, псевдокистоз поджелудочной железы и асциты, лейкоз, менингиома, раковая кахексия, ингибирование Н. pylori, псориаз, а также болезнь Альцгеймера. Можно также назвать остеопороз.
В настоящее время большое внимание уделяется пептидам, обладающим сродством к рецепторам соматостатина. Так, был изучен препарат ланреотид для лечения заболеваний, связанных с гормоном роста (Cendros JM, Peraire C, Trocóniz IF, Obach R. Pharmacokinetics and population pharmacodynamic analysis of lanreotide Autogel. Metabolism. 2005 Oct, 54(10), 1276-81).
Следовательно, главная цель заключается в поисках альтернативных путей существующим решениям. Настоящее изобретение служит достижению этой цели.
Таким образом, предлагаются новые октапептидные соединения, обладающие хорошим сродством с рецепторами соматостатина и/или физикохимическими свойствами, позволяющими их использовать в различных решениях при разработке составов лекарственных средств.
Соединения согласно изобретению имеют многочисленные преимущества, в частности, они имеют по меньшей мере одну из следующих характеристик:
- обладают сродством к рецепторам соматостатина,
- имеют реологические свойства, обеспечивающие диапазон вязкостей, совместимый с инъецированием,
- возможность использования в качестве носителя в составе лекарственного средства,
- обладают способностью к самосборке в форме монодисперсных нанотрубок разного диаметра,
- обладают способностью к самосборке в форме волокон,
- обладают различной степенью растворимости в воде.
Таким образом, изобретение относится к октапептидному соединению общей формулы (I):
H-2-Nal1-цикло(Cys2-Tyr3-AA4-Lys5-Val6-Cys7)-Thr8-NH2 (I)
в которой АА4 обозначает аминокислотный остаток, связанный с аминокислотами Tyr3 и Lys5 согласно формуле:
в которой n4 означает целое число от 0 до 3 и R4 обозначает атом водорода, алкильный, циклоалкильный, арильный или гетероарильный радикал, причем арильный и гетероарильный радикалы необязательно замещены одним или несколькими радикалами, одинаковыми или различными, выбираемыми из арилазо, галогена, нитро, гидроксила, арила, OR41;
R41 обозначает радикал , в котором R42 обозначает алкильный радикал или атом водорода, n обозначает целое число от 2 до 4, m обозначает целое число от 1 до 4;
при условии, что все аминокислоты могут иметь конфигурацию D или L,
за исключением соединений H-D-2-Nal1-цикло(Cys2-Tyr3-β-(3-пиридил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2, H-D-2-Nal1-цикло(Cys2-Tyr3-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2, H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Lys5-Val6-Cys7)-Thr8-NH2 и их солей,
или к фармацевтически приемлемой соли этого соединения.
Согласно настоящему изобретению под аминокислотным остатком подразумевают остаток, который образует аминокислота, у которой амино- и кислотные группы включены в образование пептидных связей. Таким образом, аминокислотный остаток, содержащий R в качестве боковой цепи, будет остатком формулы -NH-CH(R)-C(O)-.
Согласно настоящему изобретению аминокислоты, представленные в общей формуле трехбуквенным кодом, либо в качестве кислоты как таковой, либо в качестве остатка, могут относиться к конфигурации D или, если указание на нее отсутствует, к конфигурации L.
Кроме того, согласно изобретению и в соответствии с конвенцией, название пептидов, представленных в примерах последовательностью аминокислот, входящих в их состав и обозначаемых трехбуквенным кодом, подразумевает как аминокислоты конфигурации L, если указание на конфигурацию отсутствует, так и аминокислоты конфигурации D, когда конкретно указывается буква D перед трехбуквенным кодом, обозначающим данную аминокислоту.
В рамках настоящего изобретения под алкильным радикалом, если не указано иное, понимают алкильный радикал, линейный или разветвленный, содержащий 1-6 атомов углерода, такой как метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, трет-бутильный, пентильный или гексильный, предпочтительно содержащий 1-4 атома углерода.
Под циклоалкильным радикалом понимают циклический радикал, содержащий 3-7 атомов углерода, соединенных между собой простыми связями, такой как циклопропильный, циклобутильный, циклопентильный, циклогексильный или циклогептильный. Этот радикал необязательно замещен алкильным радикалом, который определен выше. Предпочтительно, циклоалкильный радикал содержит от 4 до 6 метиленовых звеньев, такой как циклобутильный, циклопентильный или циклогексильный радикал. Особенно предпочтительно, когда циклоалкильный радикал означает циклогексильный радикал.
Под арильным радикалом понимают карбоциклическую ненасыщенную систему, включающую по меньшей мере один ароматический цикл, предпочтительно, радикал, выбранный из фенила, нафтила, антрила (или антраценила) и флуоренила.
Под арилазо радикалом понимают в рамках настоящего изобретения радикал формулы арил-N=N-, в котором арильный радикал определен выше. Предпочтительно, радикал арилазо означает радикал фенилазо.
Под гетероарильным радикалом в рамках настоящего изобретения понимают ароматический ненасыщенный цикл, содержащий один или несколько гетероатомов, одинаковых или различных, выбранных из N, O и S, такой как пиридинил, пиримидинил, фурил, тиенил, бензотиенил, оксазолил, бензоксазолил, изоксазолил, тиазолил, пиролил, пиразолил, имидазолил, триазолил, тетразолил, особенно, тиенил, бензотиенил и имидазолил.
Согласно настоящему изобретению термин «фармацевтически приемлемая соль» означает аддитивные соли с неорганическими кислотами, такие как гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат, дифосфат и нитрат, или с органическими кислотами, такие как ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, п-толуолсульфонат, памоат и стеарат. Другие примеры фармацевтически приемлемых солей можно найти в документе «Salt selection for basic drugs», Int. J. Pharm. (1986), 33, 201-217.
Согласно настоящему изобретению аминокислоты представляют собой аминокислоты, известные специалисту с конфигурацией D или L, и обозначаемые в данном описании в соответствии с общепринятой номенклатурой, а также синтетические аналоги, модифицированные в боковых цепях указанных аминокислот, среди которых:
- β-(3-бензотиенил)-Ala, β-(2-тиенил)-Ala, β-(1-нафтил)-Ala, β-(2-нафтил)-Ala или 2-Nal, β-(9-антрил)-Ala, β-(2-флуоренил)-Ala означают аланин, замещенный в β положении соответственно бензотиенилом по положению 3 этого цикла, тиенилом по положению 2 этого цикла, нафтилом по положению 1 этого цикла, нафтилом по положению 2 этого цикла, антрилом по положению 9 этого цикла и флуоренилом по положению 2 этого цикла;
- Ph-Gly или Phg означает глицин, замещенный фенильным радикалом;
- Гомо-Phe или Гомо-phe означает фенилаланин, боковая цепь которого удлинена на метиленовое звено; и
- p-Br-Phe, p-F-Phe, p-Нитро-Phe, p-Ph-Phe; p-O-2-(2-метоксиэтокси)этокси-Phe, m-Br-Phe, m-F-Phe, o-Br-Phe, o-F-Phe, 3,5-диF-Phe означают фенилаланин, у которого фенильное кольцо замещено соответственно в пара положении атомом брома, фтора, радикалом нитро, фенилом и О-2-(2-метоксиэтокси)этокси, в мета-положении атомом брома и фтора, в орто-положении атомом брома и фтора, и в положении 3 и 5 двумя атомами фтора.
Предпочтительно, изобретение относится более конкретно к соединению, которое указано выше, в котором n4 означает целое число от 0 до 2, и R4 означает алкильный, циклоалкильный, арильный или гетероарильный радикалы, причем арильный и гетероарильный радикалы необязательно замещены одним или несколькими радикалами, одинаковыми или различными, выбранными из арилазо, галогена, нитро, гидроксила, арила, OR41
R41 означает радикал , в котором R42 означает алкильный радикал, n или m означают 2.
Особенно предпочтительно, изобретение относится к соединению, описанному выше, в котором n4 означает 0 или 1, а R4 означает атом водорода или алкильный радикал.
Также особенно предпочтительно, изобретение относится к соединению, описанному выше, в котором n4 означает 0, а R4 означает алкильный радикал.
Еще более предпочтительно, изобретение относится к соединению, описанному выше, в котором алкильный радикал означает метильный радикал.
Настоящее изобретение относится также к октапептидному соединению общей формулы (I):
H-2-Nal1-цикло(Cys2-Tyr3-AA4-Lys5-Val6-Cys7)-Thr8-NH2 (I)
в которой АА4 означает аминокислоту формулы:
в которой n4 означает целое число от 0 до 3, а R4 означает атом водорода, алкильный, арильный или гетероарильный радикал, причем арильный и гетероарильный радикалы необязательно замещены одним или несколькими радикалами, одинаковыми или различными, выбранными из галогена, нитро, гидроксила, арила, OR41;
R41 означает радикал , в котором R42 означает алкильный радикал или атом водорода, n означает целое число от 2 до 4, а m означает целое число от 1 до 4;
при условии, что все аминокислоты могут иметь конфигурацию D или L,
за исключением соединений H-D-2-Nal1-цикло(Cys2-Tyr3-β-(3-пиридил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2, H-D-2-Nal1-цикло(Cys2-Tyr3-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2, H-D-2-Nal1-цикло(Cys2-Tyr3-D-Trp4-Lys5-Val6-Cys7)-Thr8-NH2 и их солей,
или к фармацевтически приемлемой соли этого соединения.
Предпочтительно, более конкретно изобретение относится к соединению, описанному выше, в котором n4 означает целое число от 0 до 2, а R4 означает алкильный, арильный или гетероарильный радикал, причем арильный и гетероарильный радикалы необязательно замещены одним или несколькими радикалами, одинаковыми или разными, выбранными из галогена, нитро, гидроксила, арила, OR41; и R41 означает радикал , в котором R42 означает алкильный радикал, n и m означают 2.
Изобретение предпочтительно относится к соединению, описанному выше, в котором термин арильный означает радикал, выбранный из фенила, нафтила, антрила и флуоренила.
Изобретение предпочтительно относится также к соединению, описанному выше, в котором термин гетероарильный означает радикал, выбранный из пиридинила, пиримидинила, фурила, тиенила, бензотиенила, оксазолила, бензоксазолила, изоксазолила, тиазолила, пирролила, пиразолила, имидазолила, тиазолила, тетразолила, более конкретно, выбраны из тиенила, бензотиенила и имидазолила.
Изобретение предпочтительно относится также к соединению, описанному выше, в котором термин алкильный означает радикал, выбранный из метила, этила, пропила, изопропила, бутила, изобутила, трет-бутила.
Изобретение предпочтительно относится также к соединению, описанному выше, в котором термин алкильный означает радикал, выбранный из метила, этила, пропила, изопропила, бутила, изобутила, трет-бутила; а термин «циклоалкильный» означает циклогексильный радикал.
Более предпочтительно, изобретение относится к октапептидному соединению общей формулы (I), в которой АА4 означает радикал аминокислоты, выбранной из Trp, Ala, β-(3-бензотиенил)-Ala, β-(2-тиенил)-Ala, β-(9-антрил)-Ala, β-(2-флуоренил)-Ala, His, Val, 1-Nal, 2-Nal, фенил-Gly, Гомо-Phe, p-Br-Phe, p-F-Phe, m-F-Phe, o-F-Phe, m-Br-Phe, o-Br-Phe, p-NO2-Phe, 3,5-дифтор-Phe, 4-фенил-Phe, Tyr, p-(2-(2-метоксиэтокси)этокси)-Phe; β-(циклогексил)-Ala, p-фенилазо-Phe.
Также более предпочтительно, изобретение относится к октапептидному соединению общей формулы (I), в которой АА4 означает аминокислоту, выбранную из Trp, Ala, β-(3-бензотиенил)-Ala, β-(2-тиенил)-Ala, β-(9-антрил)-Ala, β-(2-флуоренил)-Ala, His, Val, 1-Nal, 2-Nal, фенил-Gly, Гомо-Phe, p-Br-Phe, p-F-Phe, m-F-Phe, o-F-Phe, m-Br-Phe, o-Br-Phe, p-NO2-Phe, 3,5-дифтор-Phe, 4-фенил-Phe, Tyr, p-(2-(2-метоксиэтокси)этокси)-Phe.
Еще более предпочтительно изобретение относится к октапептидному соединению общей формулы (I), в которой радикал аминокислоты АА4 имеет конфигурацию D, и еще более предпочтительно, аминокислоты 2-Nal1 и АА4 имеют конфигурацию D, при этом другие аминокислоты имеют конфигурацию L.
Также особенно предпочтительно изобретение относится к октапептидному соединению общей формулы (I), в которой радикал аминокислоты АА4 имеет конфигурацию L, еще более предпочтительно, аминокислоты 2-Nal1 и АА4 имеют конфигурацию L, при этом другие аминокислоты имеют конфигурацию D.
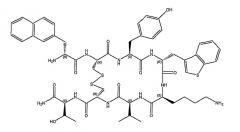
Согласно также более предпочтительному варианту изобретение относится к октапептидному соединению общей формулы (I), в которой AA4 означает остаток аминокислоты Ala.
Предпочтительно, соединение согласно изобретению выбирают из:
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(3-бензотиенил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(2-тиенил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
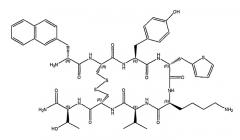
H-D-2-Nal1-цикло(Cys2-Tyr3-D-His4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Val4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(1-нафтил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(2-нафтил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(9-антрил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(2-флуоренил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-Ph-D-Gly4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-гомо-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-p-Br-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-p-F-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Tyr4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-m-F-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-o-F-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-3,5-диF-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-m-Br-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-o-Br-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-p-Нитро-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-p-Ph-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-p-(2-(2-метоксиэтокси)этокси)-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(D-Cys2-D-Tyr3-Trp4-D-Lys5-D-Val6-D-Cys7)-D-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(циклогексил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-p-фенилазо-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
или фармацевтически приемлемой соли этого соединения.
Более предпочтительно, соединение согласно описанному выше изобретению выбирают из:
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(3-бензотиенил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(2-тиенил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-D-His4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(1-нафтил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(2-флуоренил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-p-Br-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-p-F-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Tyr4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-m-F-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-o-F-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-3,5-диF-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-m-Br-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-p-Нитро-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-p-(2-(2-метоксиэтокси)этокси)-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-p-фенилазо-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2.
Также более предпочтительно, соединение согласно описанному выше изобретению выбирают из:
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-Ph-D-Gly4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(циклогексил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2.
Также более предпочтительно, соединение согласно описанному выше изобретению выбирают из:
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Val4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(2-нафтил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-β-(9-антрил)-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-Гомо-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
H-D-2-Nal1-цикло(Cys2-Tyr3-p-Ph-D-Phe4-Lys5-Val6-Cys7)-Thr8-NH2
Очень предпочтительное соединение согласно описанному выше изобретению представляет собой:
H-D-2-Nal1-цикло(Cys2-Tyr3-D-Ala4-Lys5-Val6-Cys7)-Thr8-NH2.
Изобретение относится также к лекарственному средству, содержащему соединение согласно изобретению, которое определено выше.
Изобретение относится также к фармацевтической композиции, содержащей соединение согласно изобретению, которое определено выше, в более конкретном случае, когда соединение использовано в качестве действующего начала.
Изобретение относится также к терапевтической композиции, содержащей соединение общей формулы (I), которое определено выше, в качестве действующего начала в комбинации по меньшей мере с одним фармацевтически приемлемым вспомогательным веществом.
Изобретение относится также к терапевтической композиции, содержащей соединение общей формулы (I), которое определено выше, в качестве фармацевтически приемлемого вспомогательного вещества в комбинации по меньшей мере с одним действующим началом.
Изобретение относится также к терапевтической композиции с быстрым, контролируемым, пролонгированным или замедленным высвобождением, содержащей соединение общей формулы (I), которое определено выше, в качестве фармацевтически приемлемого вспомогательного вещества в комбинации по меньшей мере с одним действующим началом.
Изобретение относится также к применению октапептидного соединения общей формулы (I), которое определено выше, для получения лекарственного средства.
Изобретение относится также к применению, описанному выше, в котором лекарственное средство предназначено для лечения патологии, выбираемой из заболеваний, связанных с гормоном роста.
И, наконец, изобретение относится к применению соединения, которое определено выше, для получения лекарственного средства; предпочтительно, лекарственное средство предназначено для лечения патологий, в которых задействован(ы) один (или несколько) рецептор(ов) соматостатина, таких как акромегалия, для лечения нейроэндокринных опухолей, диабетической ретинопатии, лечения сосудов, суставов и кожи; предпочтительно, для лечения акромегалии или нейроэндокринных опухолей.
Терапевтическая композиция согласно изобретению может находиться в твердой форме, например в форме порошков, гранул, таблеток, желатиновых капсул, липосом или свечей. Подходящими твердыми носителями могут быть, например, фосфат кальция, стеарат магния, тальк, сахара, лактоза, декстрин, крахмал, желатин, целлюлоза, метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, поливинилпирролидин и воск.
Терапевтическая композиция согласно изобретению может находиться также в жидкой форме, например в форме растворов, эмульсий, суспензий или сиропов. Подходящими жидкими носителями могут быть, например, вода, органические растворители, такие как глицерин или гликоли, а также их смеси, находящиеся в различных соотношениях с водой.
Введение композиции согласно изобретению может осуществляться топическим, пероральным, парентеральным путем, путем внутримышечной инъекции, подкожно и т.д.
Если не указано иное, то технические и научные термины, используемые в настоящей заявке, имеют такое же значение, которым широко пользуется средний специалист данной области, к которой относится изобретение.
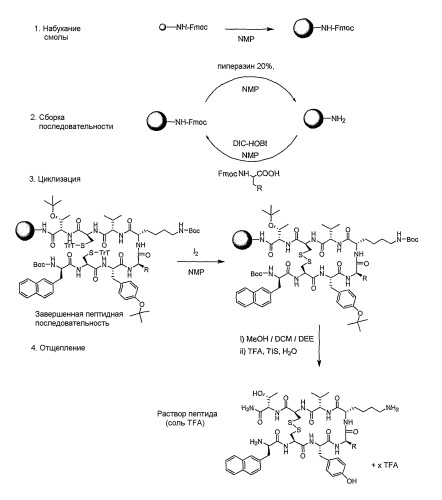
Следующая ниже экспериментальная часть представлена для иллюстрации описанных выше способов и не должна рассматриваться для ограничения объема изобретения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1. Описание синтезов
1.1 Используемое оборудование
ВЭЖХ-МС:
Система марки Waters (2525) c линейным дегазатором и системой автоматической инжекции (2767). Элюирование проводят градиентом воды и ацетонитрила, содержащего 0,1% муравьиной кислоты. Детекцию элюируемых веществ осуществляют с использованием диодной матрицы (2996), испарительного детектора светорассеяния (DEDL) и масс-спектрометра (см. ниже). Колонка обращенно-фазного типа с привитыми фазами С18, модель Х-Bridge, 100×4,6 мм с размером частиц 3,5 мкм и размером пор 13,5 нм. Устанавливают скорость элюирования 1 мл/мин с объемом инжекции 20 мкл.
Масс-спектрометром является прибор компании Micromass ZQ, марки Waters. Ионизацию осуществляют электроспреем с температурой источника ионизации 120°С и напряжением на конусе 20 В. Образец вводят непрерывно со скоростью 0,3 мл/мин. Используют масс-анализатор квадрупольного типа (модель ZQ2000). Спектры регистрируют с помощью программного обеспечения Mass Lynx 4.0 в диапазоне масс m/z 100-1000 в случае органических молекул и 100-2000 в случае пептидов.
Препаративная ВЭЖХ:
Используют две системы для очистки пептидов. Систему, описанную выше, снабженную колонкой обращенно-фазного типа с привитыми фазами С18, модель Х-Bridge, 150×19 мм с размером частиц 5 мкм и размером пор 13,5 нм. Скорость элюирования 17 мл/мин. Вторая система компании Waters 2545 аналогична предыдущей системе, но без масс-спектрометра. Колонка Thermo Hypurity обращено-фазного типа (привитая фаза С18) 21,2 х 250 мм. Колонку элюируют смесью воды и ацетонитрила, содержащего 0,1% ТФУ кислоты, со скоростью 20 мл/мин. Две препаративные ВЭЖХ системы используют в изократическом режиме после определения оптимальных условий.
ЯМР-анализы:
Анализы с помощью ядерного магнитного резонанса осуществляют на спектрометре Bruker Advance 400 Ultrashield. Рабочие частоты составляют 400 МГц в случае ЯМР протона, 376,4 МГц в случае ЯМР фтора 19 и 100 МГц в случае ЯМР углерода 13. Спектры ЯМР фтора регистрируют с последовательностью одного 90°-го импульса длительностью 19,5 мкс. Ширина спектрального окна 7,5 кГц, время релаксации 2 сек и время накопления 0,87 сек. Осуществляют шестнадцать сканирований при каждом анализе. Спектры регистрируют при комнатной температуре, химические смещения выражают в м.д., а константы взаимодействия в Гц. Множество сигналов представлены следующим образом: с = синглет, с шир.= синглет широкий, д = дублет, д шир.= дублет широкий, дд = дублет дублетов, ддд = дублет расщепленных дублетов, т = триплет, т шир.= триплет широкий, к = квадруплет, кд = квадруплет расщепленный, м = мультиплет.
Анализы МСВР (МС высокого разрешения):
Определение точной массы осуществляют на время-пролетном масс-спектрометре (LCT фирмы Micromass®, Великобритания), снабженном источником для электроспрея (источник излучения Z-спрей) в режиме положительно заряженных ионов. Внешний стандарт для измерения точной массы вводят непрерывно и параллельно с образцом (конфигурация LocksprayTM). В качестве внешнего стандарта используют лейцин-энкефалин, который дает ион [M+Na]+ с массой m/z = 578,2591. Прибор имеет разрешение 6500 и дает точность результатов с отклонением менее 5 мДа от теоретической массы иона. Система контролируется программным обеспечением Masslynx 4.0®. Образец, солюбилизированный в воде, инжектируют в поток, состоящий из 50% воды и 50% метанола, системы ВЭЖХ, снабженной автоматическим устройством для подачи образца (Alliance 2795 компании WATERS®, Великобритания) с расходом 200 мкл/мин. Инжектируемый объем составляет 10 мкл. Напряжение на капилляре 2800 В. Напряжение на конусе 40 В. Температура источника ионизации 120°С. Температура десольвации 250°С. Расход газа для десольвации (азот) 500 л/час. Расход газа на конус (азот) 20 л/час. TDC стоп-сигнала: 100 мВ.
ИК-спектрометрия:
Инфракрасные спектры пептидов регистрируют методом ослабленного полного внутреннего отражения и Фурье-преобразования. Используют прибор Bruker IFS 66, оснащенный модулем 45°N Znse ATR, непрерывно продуваемым азотом. Наносят 10 мкл раствора на кристалл и выполняют 30 сканирований с разрешением 4 см-1. Сигнал от воды вычитали из спектра с фоновым шумом с помощью устройства с программным обеспечением OPUS 4.2.
Лиофилизатор:
Используют лиофилизатор Christ Alpha 2-4 LD Plus, соединенный с лопастным насосом для создания вакуума 15 мкбар. Водные образцы отверждают жидким азотом перед введением их в этот прибор.
Микроскопия:
ТЭМ (трансмиссионный электронный микроскоп) типа Microscope Phillips CM-20, рабочее напряжение 200 кВ, и СЭМ (сканирующий электронный микроскоп) типа Léo-Gémini (пушка с полевой эмиссией).
1.2. Используемые реактивы
Смола для пептидного синтеза получена от Novabiochem, отделение Merk Bioscience (Schwalbach, Германия). Ионообменная смола приобретена у компании Laboratoires Bio-Rad (Hercules, США).
Используемая вода была дважды деионизована с использованием ионообменной системы Milli-Q Plus от компании Millipore (Billerica, США). Растворители для синтезов и очистки приобретены у фирмы Aldrich и VWR (West Chester, США) и, если не сказано обратного, использовались без очистки.
Аминокислоты приобретены у фирмы Bachem (Well am Rhein, Германия), Fluka (Buchs, Швейцария), Acros Organics (Geel, Бельгия) и NeoMPS (Strasbourg, Франция).
Коммерчески доступные аминокислотные предшественники:
Fmoc-L-Cys(Trt)-OH, Fmoc-L-Tyr(tBu)-OH, Fmoc-L-Lys(Boc)-OH, Fmoc-L-Val-OH, Fmoc-L-Thr(tBu)-OH, Boc-β-(2-нафтил)-D-Ala-OH;
Fmoc-β-(3-бензотиенил)-D-Ala-OH, Fmoc-β-(2-тиенил)-D-Ala-OH, Fmoc-D-His(Boc)-OH, Fmoc-D-Ala-OH, Fmoc-D-Val-OH, Fmoc-β-(1-нафтил)-D-Ala-OH, Fmoc-β-(2-нафтил)-D-Ala-OH, Fmoc-β-(9-антрил)-D-Ala-OH, Fmoc-Ph-D-Gly-OH, Fmoc-гомо-D-Phe-OH, Fmoc-p-Br-D-Phe-OH, Fmoc-p-F-D-Phe-OH, Fmoc-D-Tyr(tBu)-OH, Fmoc-m-F-D-Phe-OH, Fmoc-o-F-D-Phe-OH, Fmoc-3,5-диF-D-Phe-OH, Fmoc-m-Br-D-Phe-OH, Fmoc-o-Br-D-Phe-OH, Fmoc-p-нитро-D-Phe-OH, Fmoc-β-(циклогексил)-D-Ala-OH;
Fmoc-β-(2-нафтил)-L-Ala-OH, Fmoc-D-Cys(Trt)-OH, Fmoc-L-Trp(Boc)-OH, Fmoc-D-Lys(Boc)-OH, Fmoc-D-Thr(tBu)-OH.
Синтез аминокислоты Fmoc-β-(2-флуоренил)-D-Ala-OH
а) метил-2-(бензилоксикарбониламино)-3-(9Н-флуорен-2-ил)-акрилат
К раствору, находящемуся при 0°С, метил-2-(бензилоксикарбониламино)-2-(диметоксифосфорил)ацетата (2 г, 6,04 ммол, 1 экв.) в дихлорметане (60 мл) прибавляют 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU, 1,35 мл, 1,5 экв.). После перемешивания в течение 5 минут прибавляют 9Н-флуорен-2-карбальдегид (1,17 мг, 6,04 ммол, 1 экв.). Смесь оставляют на 2 часа при 0°С для перемешивания, затем ледяную баню убирают и дают температуре подняться до температуры в диапазоне от 20 до 30°С. Реакцию оставляют на 2 часа для перемешивания. К реакционной среде добавляют 40 мл дихлорметана и, после промывки 0,5М HCl, органический слой сушат над сульфатом натрия и затем выпаривают. Остаток растирают с холодным диэтиловым эфиром. Супернатант рекуперируют и операцию повторяют несколько раз. Полученный твердый продукт очищают на силикагеле (элюент: гексан-AcOEt 75:25) и получают 1,75 г чистого продукта (неустановленной конфигурации) с выходом = 74%. Выделяют также другой изомер. Соотношение двух изомеров 95/5.
1Н-ЯМР (CDCl3): δ 3,84 (м, 2Н, флуорен + 3Н метила); 5,13 (с, 2Н, бензил); 7,25-7,40 (м, 7Н); 7,45 (с, 1Н); 7,55 (д, J=7,6, 2Н); 7,72 (м, 2Н); 7,79 (д, J=7,6, 1Н).
13С-ЯМР (CDCl3): δ 36,95; 52,76; 67,63; 120,04; 120,44; 123,36; 125,22; 127,04; 127,52; 128,38; 128,59; 129,17; 132,16; 132,73; 136,07; 141,04; 143,31; 143,52; 144,0; 166,02.
МС(ESI): m/z 400,0 [M+H]+
ИК: λ (см-1): 3262, 3034, 2951(СН алкила), 1725(СО), 1699, 1509, 1234, 730.
Точка плавления: 109°С
b) (R)-метил-2-(бензилоксикарбониламино)-3-(9Н-флуорен-2-ил)пропаноат
В металлическом закрытом реакторе прибавляют асимметрический родиевый катализатор (35 мг, 2% мол) к раствору метил-2-(бензилоксикарбониламино)-3-(9Н-флуорен-2-ил)акрилата (1 г, 2,51 ммол) в МеОН (150 мл). Среду очищают от содержащегося в реакторе воздуха и устанавливают давление водорода (50 бар). Спустя 24 часа среду концентрируют с количественным получением продукта реакции.
1H-ЯМР (CDCl3): δ 3,15 (дд, J=14,0, J=6,4, 1H); 3,22 (дд, J=14,0, J=6,0, 1H); 3,73 (с, 3H метила); 3,85 (с, 2H флуорена); 4,70 (м, 1H); 5,07 (д, J=12,4, 1H бензила); 5,12 (д, J=12,4, 1H, бензила); 5,25 (1H, NH); 7,11 (д, J=7,6, 1H); 7,27-7,38 (м, 8H); 7,53 (д, J=7,6, 2H); 7,58 (д, J=7,8, 1H); 7,75 (д, J=7,6, 1H).
13C-ЯМР (CDCl3): δ 36,74; 38,38; 52,27; 54,95; 66,91; 119,76; 119,85; 124,96; 125,87; 126,64, 126,70, 127,79, 128,04; 128,11, 128,45, 134,14; 136,17; 140,74; 141,27; 143,12; 143,64; 155,58, 172,01.
МС (ESI) m/z: 402,0 [M+H]+
ИК: λ, (см-1): 3347, 3025, 2949 (CH алкила), 1741 (CO), 1689, 1523, 1256, 1024, 740
Точка плавления: 125°С
Избыток энантиомера определен с помощью хиральной ВЭЖХ: 93,4%
с) (R)-2-(бензилоксикарбониламино)-3-(9Н-флуорен-2-ил)пропановая кислота
К раствору (R)-метил-2-(бензилоксикарбониламино)-3-(9Н-флуорен-2-ил)пропаноата (800 мг, 1,99 ммол) в диоксане (35 мл) при 0°С прибавляют раствор LiOH (96 мг) в воде (15 мл). Реакцию контролируют с помощью ТСХ (гексан-AcOEt 1:1) (полученная кислота не мигрирует). Реакция заканчивается в течение часа. Среду подкисляют с помощью 2М HCl и продукт экстрагируют этилацетатом. После сушки продукта над сульфатом натрия, выпаривания в вакууме и кристаллизации в эфире продукт получают с количественным выходом (735 мг).
1H-ЯМР ((CD3)2SO): δ 2,90 (дд, J=14,0, J=9,6, 1H); 3,20 (дд, J=13,6, J=4,8, 1H); 3,71 (с, 2H, флуорена); 4,40 (дд, J=9,6, J=4,8, 1H); 4,87 (д, J=12,6, 1H бензила); 4,96 (д, J=12,6, 1H, бензила); 7,12 (м, 6H); 7,18 (т, J=7,6, 1H); 7,26 (т, J=7,6, 1H); 7,32 (с, 1H); 7,43 (д, J=7,6, 1H); 7,60 (д, J=7,6, 1H); 7,68 (д, J=7,8, 1H).
13C-ЯМР ((CD3)2SO): δ 36,17; 36,60; 55,68; 65,14; 119,59; 119,71; 125,01 ; 125,77; 126,43; 126,63; 127,40; 127,59; 127,70; 128,45; 128,15; 136,57; 136,89; 139,39; 140,90; 142,82; 142,88; 155,92; 173,27.
МС (ESI) m/z: 388 [M+H]+
ИК: λ, (см-1): 3333; 3035; 2902 (CH алкила); 1724 (CO); 1705; 1689; 1531 ; 1245; 1062; 734.
Точка плавления: 141°С
d) (R)-2-амино-3-(9Н-флуорен-2-ил)пропановая кислота
К раствору (R)-2-(бензилоксикарбониламино)-3-(9Н-флуорен-2-ил)пропановой кислоты (650 мг, 1,68 ммол) в метаноле (80 мл) прибавляют Pd/C (65 мг). Среду продувают азотом, затем водородом. Реакцию оставляют на 6 часов при интенсивном перемешивании: происходит выделение осадка. Среду отфильтровывают: смесь целевого продукта и Pd/C выделяют, затем солюбилизируют в смеси диоксана и воды (1:1), затем подкисляют 2М HCl до растворения аминокислоты. Полученный раствор фильтруют, диоксан выпаривают в вакууме, затем водный слой нейтрализуют добавлением 2М NaOH. После выпаривания полученный белый порошок промывают водой до удаления избытка солей. Получают 500 мг аминокислоты. Выход составляет 85%.
МС(ESI) m/z: 254 [M+H]+
ИК: λ (см-1): 3425; 3019; 2960 (CH алкила); 1567; 1402; 1316; 737.
Точка плавления: 225°С
УФ: λ (нм): 206 (abs=0,868), 267 (abs=0,446), 303 (abs=0,203)
Флуоресценция: (возбуждение при 267 нм) максимум при 312 нм.
Избыток энантиомеров определяют с помощью хиральной ВЭЖХ: 93,4%
е) (R)-2-(((9Н-флуорен-9-ил)метокси)карбониламино)-амино)-3-(9Н-флуорен-2-ил)пропановая кислота или Fmoc-β-(2-флуоренил)-D-Ala-OH
К раствору аминокислоты, т.е. (R)-2-амино-3-(9Н-флуорен-2-ил)пропановой кислоты (560 мг, 221 ммол, 1 экв.), в смеси диоксана (50 мл) и 10%-го карбоната натрия в воде (30 мл) прибавляют по каплям раствор FmocOSu (820 мг, 2,43 ммол, 1,1 экв.) в 20 мл диоксана. За исчезновением FmocOSu наблюдают с помощью ТСХ при элюировании гексаном-AcOEt (1:1). Реакцию перемешивают в течение 3 часов. Реакционную смесь экстрагируют этилацетатом и органический слой рекуперируют и выпаривают. Полученный твердый продукт кристаллизуют в AcOEt, затем