Система и способ для связанной со временем микроскопии биологических организмов
Иллюстрации
Показать всеИзобретение относится к микроскопии отдельных биологических организмов в жидком образце. Изображения, на которых могут быть идентифицированы отдельные биологические организмы, объединяют для создания наборов оптических срезов биологических организмов, и наборы оптических срезов анализируют для определения значения по меньшей мере одного параметра, описывающего микробную активность указанного отдельного биологического организма в каждом контейнере для образца. Техническим результатом является уменьшение времени исследования, повышение надежности и экономической эффективности результата. 2 н. и 23 з.п. ф-лы, 23 ил.
Реферат
Тестирование чувствительности к антибиотикам является очень важной дисциплиной, которая используется повсеместно в больницах, клиниках, медицинских производственных предприятиях, производстве пищи и напитков и т.д. Большое количество различных химических веществ и стандартных процедур и огромное количество тестов, выполняемых каждый год, дают простор для огромной промышленной выгоды от микроорганизмов, растущих повсеместно.
Некоторые из этих тестов являются косвенными тестами, т.е. измеряют или наблюдают наличие производных деятельности микроорганизмов, например, продуктов жизнедеятельности или окислительно-восстановительного индикатора, вместо наблюдения деятельности микроорганизмов напрямую.
Расходы, связанные с выполнением тестов чувствительности к антибиотикам, например, в больницах, огромны и постоянно растут. Кроме того, длительные инкубационные периоды тестирования до 6 дней представляют собой большую проблему, так как лечение не может ждать такого продолжительного времени реакции. Пациент может умереть к моменту, когда будет готов результат. Врачи, таким образом, прописывают антибиотики широкого спектра для начала лечения немедленно, до того как поступят результаты. Более быстрое получение результатов (в течение нескольких часов) может сделать возможным использование антибиотиков узкого спектра, нацеленных непосредственно на причину болезни, тем самым минимизируя риск создания устойчивости к антибиотикам в целом.
Одним из наиболее распространенных применяемых тестов чувствительности является анализ мочи на инфекции мочевыводящих путей (ИМП). Моча сама по себе является очень хорошей средой для роста, и необходимо принять наиболее тщательные меры предосторожности, чтобы не загрязнить мочу бактериями во время обработки образцов мочи. Кроме того, чтобы надежность результатов осталась в силе, необходимо, чтобы анализ в лаборатории начался в течение 1-2 часов. В целях сокращения расходов в системе здравоохранения многие небольшие лаборатории были закрыты, оставив только несколько крупных лабораторий, зачастую расположенных в больницах. Образец мочи должен, таким образом, поступить в центральную лабораторию в течение 1-2 часов, что не является проблемой в больших больницах, но когда образец получен семейным врачом (GP), расстояние и время транспортировки в лабораторию могут быть проблемой. В этих случаях может потребоваться заморозка образцов мочи и хранение их в специальных контейнерах до прибытия в лабораторию. Даже в больницах, где лаборатория может находиться в непосредственно близости, выгодно начинать тестирование чувствительности сразу после забора образца, так как это минимизирует время доставки результатов анализа. Таким образом, желательно иметь небольшое и простое в использовании устройство для проведения тестирования чувствительности локально по месту оказания медицинской помощи.
Тестирование чувствительности микроорганизмов включает в себя несколько уровней тестирования. Одним уровнем может быть определение типов микроорганизмов, присутствующих в образце, например бактерии, грибки, простейшие, водоросли или вирусы. Другим уровнем тестирования является установление того, какой тип антибиотика будет использоваться для устранения микроорганизмов. Типы антибиотиков могут включать в себя антибиотики узкого или широкого спектра, а также более специализированные типы. Аналогично, тесты могут определить лучший из препаратов одного типа, но разных производителей.
Кроме того, может оказаться важным протестировать чувствительность микроорганизмов к различным средам, например аэробным и анаэробным, и в некоторых случаях даже к фосфорным средам. В некоторых ситуациях может потребоваться тестирование влияния различных уровней и комбинаций питательных веществ, особенно при поиске специфичных типов микроорганизмов.
После того как определен лучший антибиотик для уничтожения микроорганизмов, важно определить концентрацию антибиотика для назначения. Как правило, тестируют по меньшей мере 5 различных концентраций, и могут использовать до 15 или более различных концентраций для определения оптимальной концентрации. Результатом тестирования концентрации может быть MIT - минимальная ингибирующая концентрация (Minimum Ingibitory Concentration), которая показывает концентрацию антибиотика, необходимую для предотвращения роста микроорганизмов. Если используют концентрации ниже MIT, то антибиотик будет устранять лишь часть микроорганизмов, с последующим риском развития устойчивости или чувствительности к антибиотикам у оставшихся микроорганизмов.
Как правило, результаты тестирования формулируют путем разделения антибиотиков-кандидатов на группы Устойчивые, Промежуточные или Чувствительные.
Современные способы тестирования требуют использования большого количества различных химических веществ и стандартизированных процедур. В США стандарты курируются CLSI (Clinical and Laboratory Standards Institute, Институт клинических и лабораторных стандартов). Стандарты описывают подробности тестов, например, как проводить тесты, включая инокуляцию (концентрации), расстояния изоляции, температуры, проверку результатов роста, инкубационные периоды. Инкубационные периоды тестов могут варьироваться от нескольких часов (например, 16-24 часов) до нескольких дней (например, 3-6 дней).
Часто используют трехэтапный способ во время инкубирования микроорганизмов. Первый этап заключается в инкубировании первичной культуры. Когда получено достаточно высокое качество культуры, одну или несколько монокультур выбирают и изолируют. Монокультуры затем инкубируют снова для получения достаточно большого количества микроорганизмов для последнего этапа - для инкубирования микроорганизмов в чашках Петри или аналогичных, содержащих различные типы и концентрации антибиотиков. Три этапа, как правило, выполняются вручную и, таким образом, являются затратными по человеческим ресурсам, и время от получения первичной культуры до того, когда можно начинать тестирования чувствительности, часто составляет много часов или несколько дней.
Описанная сложность тестирования чувствительности говорит о преимуществах устройства, которое снижает время тестирования от многих часов в лучшем случае до всего лишь нескольких часов или даже минут. Кроме того, было бы полезно использовать более автоматические процедуры тестирования, чем мы видим сегодня, минимизируя ручную обработку в лабораториях. Наконец, снижение затрат на тест, очевидно, станет весьма полезным для всех частей системы здравоохранения.
Были представлены различные решения для преодоления по меньшей мере частично некоторых из описанных выше проблем.
Одним из таких решений является патент США 6153400 "Устройство и способ для тестирования микробной чувствительности к антибиотикам", Matsumara et al. Matsumara предоставляет способ и устройство для осуществления тестирования чувствительности микробов к антибиотикам, включающие одноразовые многокамерные планшеты и автоматический держатель планшет и инструмент получения и обработки изображений. Планшеты чувствительности инокулируют микроорганизмом и применяют антимикробный(е) агент(ы) таким образом, что микроорганизмы подвергаются воздействию ряда концентраций или градиента каждого антимикробного агента. Планшеты затем помещают в устройство, которое контролирует и измеряет рост микроорганизмов. Эти данные используют для определения чувствительности микроорганизмов к антибиотикам. Такая система автоматизирует тестирование антимикробной чувствительности с использованием твердых сред и стандартизированное предоставление результатов Кирби-Бауэра. Система частично автоматическая, но имеет дело с агаровыми дисками для дискодиффузионного метода.
Другой подход показан в патенте США № 4448534 "Тестирование чувствительности к антибиотикам", Wertz et al. Устройство предназначено для автоматического электронного сканирования каждой лунки многолуночной кюветы, содержащей множество жидких образцов. Источник света, предпочтительно одиночный источник, проходит через лунки к матрице фоточувствительных ячеек, по одной на каждую лунку. Также имеется калибровочная или сравнительная ячейка, принимающая свет. Электронное устройство считывает последовательно каждую ячейку, быстро завершая сканирование без физического перемещения каких-либо частей. Полученные сигналы сравнивают с сигналом от сравнительной ячейки и с другими сигналами, или с сохраненными данными и производят вычисление, которое отображается или распечатывается. Тем самым могут быть решены такие вопросы, как определение минимальных ингибирующих концентраций (MIC) лекарственных средств и идентификация микроорганизмов. Устройство в соответствии с патентом США № 4448534 не получает наборов оптических срезов указанных биологических организмов.
Еще одна система подана в качестве заявки на патент США №US 2005/0068614. Микроскопическая система имеет предметный столик, на котором должен быть расположен наблюдаемый образец, включающий наблюдаемый объект и прозрачный элемент, линзу объектива, которую помещают лицом к наблюдаемому образцу, расположенному на предметном столике, блок фокусировки, который перемещает по меньшей мере один элемент из предметного столика и объектива для выполнения фокусировочного действия, и блок автоматической фокусировки, который управляет приводом фокусировки посредством так называемой TTL системы. После того как для прозрачного элемента блоком автоматической фокусировки проведена автоматическая фокусировка, привод фокусировки выполняет перемещение по меньшей мере одного из предметного столика и объектива на предопределенное постоянное расстояние. Устройство в соответствии с заявкой на патент США №2005/0068614 не получат наборов оптических срезов указанных биологических организмов.
Задачей настоящего изобретения является обеспечение системы и способа для осуществления тестирования микробной чувствительности, которые преодолевают некоторые из указанных выше недостатков и дают быстрый, надежный и экономически эффективный результат по сравнению с известными системами и способами.
Способ можно использовать непосредственно на клиническом материале или на клиническом материале после простой подготовки, например, посредством разведения подходящим субстратом, смешивания, центрифугирования или фильтрации.
Система позволяет быстро определять резистентность бактерий к антимикробным веществам непосредственно на материале первичного клинического образца без предварительной изоляции отдельных агентов, присутствующих в клиническом образце.
Таким образом, система способна определять оптимальное антимикробное вещество, которое должно быть выбрано для лечения инфекции всего за один инкубационный этап, без обычных этапов инкубирования первичной культуры, выбора колоний для монокультуры и воспроизводства и повторного инкубирования, применяя полученный материал для общепринятого тестирования резистентности для еще одной инкубации.
В одном из вариантов осуществления систему и способ можно использовать для быстрого и надежного тестирования образцов мочи, инфицированных бактериями, для определения чувствительности к различным антибиотикам. Было установлено, что система и способ по настоящему изобретению обладают преимуществом по сравнению с другими системами, широко используемыми в учреждениях здравоохранения, поскольку она является более быстрой и экономически более эффективной, и в то же время сокращает потребность в человеческих ресурсах и ручной обработке образцов.
В одном из вариантов осуществления настоящего изобретения систему и способ можно использовать для исследования различных типов микроскопических биологических организмов посредством наблюдения отдельных экземпляров в течение периода времени в окружении, похожем на естественную среду обитания для организмов. При наблюдении за микроскопическими биологическими организмами с использованием традиционных микроскопов организмы должны быть помещены на предметное стекло микроскопа очень тонким слоем. Тонкий слой не оставляет места организмам для естественного поведения, и, как правило, невозможно контролировать среду с точки зрения питания, уровня кислорода, значения pH и т.д. Настоящее изобретение преодолевает по меньшей мере часть этих недостатков.
Микроскопические биологические организмы могут присутствовать в клиническом материале, таком как кал, образцы мазков с кожи, поражения, поверхностей серозных или слизистых оболочек, моча, лимфа, гной, мокрота, транссудат, экссудат, железистые выделения, например молоко, пот, слюна, слезная жидкость, сальные выделения, носовые или другие слизистые выделения, кровь, спинномозговая жидкость, опухолевая ткань, материал биопсии из любой ткани, внеклеточная жидкость, сыворотка, плазма.
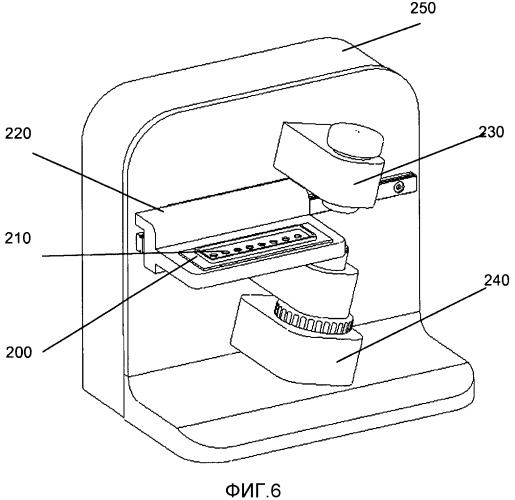
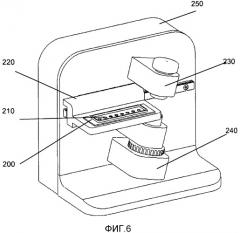
Таким образом, в соответствии с одним из вариантом осуществления настоящего изобретения предлагается система для определения значения по меньшей мере одного параметра, описывающего микробную активность отдельных биологических организмов в жидком образце. Система содержит блок оптической регистрации, включающий по меньшей мере одно устройство получения изображения, адаптированное для получения изображений, на которых могут быть идентифицированы отдельные биологические организмы. Кроме того, система содержит по меньшей мере одно устройство для образцов, включающее в себя по меньшей мере один контейнер для образца для удерживания образца в жидком состоянии и по меньшей мере один перемещающий блок, организованный для перемещения устройства для образцов и блока оптической регистрации относительно друг друга. Система дополнительно содержит блок управления для управления указанным блоком оптической регистрации и указанным перемещающим блоком для получения изображений для формирования по меньшей мере первого набора оптических срезов в указанном жидком образце. Устройство анализа изображений предназначено для анализа указанного первого набора оптических срезов, указанное устройство анализа изображений содержит алгоритмы, адаптированные для определения указанного значения указанного по меньшей мере одного параметра, описывающего микробную активность указанных отдельных биологических организмов в каждом контейнере для образца.
В одном из вариантов осуществления блок управления выполнен с возможностью последовательно получать наборы оптических срезов указанного образца, например первый набор оптических срезов и по меньшей мере второй набор оптических срезов.
Одна из задач настоящего изобретения обеспечивается способом для микробной активности в жидком образце. Способ включает в себя последовательное получение множества наборов оптических срезов указанного жидкого образца и выбор первого и второго набора оптических срезов из указанного множества наборов срезов. Значение по меньшей мере одного параметра для каждого набора оптических срезов вычисляют и определяют, возникло ли изменение значения по меньшей мере одного параметра между получениями двух наборов оптических срезов. Способ дополнительно включает в себя определение микробной активности в жидком образце на основе изменений значения по меньшей мере одного параметра
Одна из задач настоящего изобретения обеспечивается способом определения микробной активности в жидком образце, указанный способ включает получение по меньшей мере одного набора оптических срезов указанного жидкого образца и выбор первого набора оптических срезов из указанного по меньшей мере одного набора оптических срезов. Способ дополнительно содержит вычисление значения по меньшей мере одного параметра указанного первого набора оптических срезов и определение указанной микробной активности в указанном жидком образце на основании указанного значения по меньшей мере одного указанного параметра.
В контексте настоящего изобретения параметром, в принципе, могут быть любые измеряемые параметры, в качестве неограничивающих примеров, такие как скорость клеточного деления, жизнеспособность клетки, отношение количества живых/мертвых, броуновское движение, уровень метаболизма, морфология, фактор роста, кинетика или фокусное поведение. Под параметром может пониматься одно значение, комбинация нескольких значений или даже комбинация нескольких параметров.
В контексте настоящего изобретения фраза "биологические организмы" может относиться и к одному биологическому организму, и к ансамблю биологических организмов, например малым или большим группам биологических организмов. Способ и систему по настоящему изобретению, таким образом, можно использовать для определения значения по меньшей мере одного параметра, описывающего микробную активность одного биологического организма в жидком образце, и для определения значения по меньшей мере одного параметра, описывающего микробную активность множества отдельных биологических организмов в жидком образце.
Под микробной активностью можно понимать активность, создаваемую клеточным делением, клеточным движением, изменениями среды, метаболически индуцированными изменениями среды, гибелью клеток и т.д., вызывающую изменения в популяции микроскопических организмов, изменения в размере отдельных организмов или кластеров организмов или изменения положений или перемещений организмов. Микробную активность, таким образом, можно понимать в очень широком смысле как любое изменение, которое можно обнаружить для одного микроскопического организма, или в малой группе или в популяции микроскопических организмов.
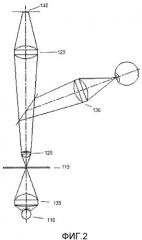
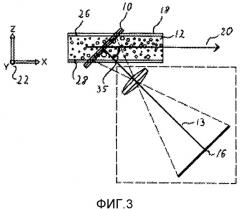
Система по настоящему изобретению содержит блок оптической регистрации. Блок оптической регистрации содержит по меньшей мере одно устройство получения изображений, включающее CCD-камеру или CMOS-камеру. Блок оптической регистрации дополнительно может состоять из линз, призм, перегородок, отверстий и других широко распространенных оптических компонентов, используемых в микроскопии. Блок оптической регистрации может быть адаптирован для получения изображений, где могут быть идентифицированы отдельные биологические организмы. Один из вариантов осуществления блока оптической регистрации описан в предварительной заявке на патент США №61/146850, где представлено устройство для получения множества изображений образца, расположенных относительно устройства для образцов. Устройство содержит по меньшей мере первый блок оптической регистрации, включающий по меньшей мере первое устройство получения изображений. Первый блок оптической регистрации имеет оптическую ось и предметную плоскость. Предметная плоскость содержит область получения изображений, из которой первым устройством получения изображения в виде изображения могут быть зарегистрированы электромагнитные волны. Устройство дополнительно содержит по меньшей мере один перемещающий блок, расположенный для перемещения устройства для образцов и первого блока оптической регистрации относительно друг друга, и корпус, расположенный для удерживания указанного первого блока оптической регистрации и указанного перемещающего блока, где указанный первый блок оптической регистрации и указанный перемещающий блок расположены таким образом, что по меньшей мере часть указанного устройства для образцов проходит через указанную область захвата изображения. Движение устройства для образцов и первого блока оптической регистрации относительно друг друга осуществляется вдоль траектории сканирования, что определяет угол тета относительно оптической оси, где тета больше нуля. Патент США №61/146850 также описывает способ получения множества изображений образца. Этот способ включает в себя расположение указанного образца относительно устройства для образцов и расположение указанного устройства для образцов относительно устройства для получения множества изображений. Устройство содержит по меньшей мере первый блок оптической регистрации, имеющий по меньшей мере первое устройство получения изображений. Первый блок оптической регистрации имеет оптическую ось и предметную плоскость, где предметная плоскость имеет область получения изображений, электромагнитные волны из которой могут быть зарегистрированы первым блоком получения изображений в виде изображения. Область получения изображений пересекает по меньшей мере часть указанного образца. Устройство для образцов и указанный первый блок регистрации перемещаются относительно друг друга по длине сканирования вдоль первой траектории сканирования. Траектория сканирования и оптическая ось вместе определяют угол тета, который больше нуля. Способ дополнительно включает получение указанного множества изображений. В патенте США №61/146850 также описана система для получения множества изображений образца. Система включает в себя устройство для образцов и устройство, имеющее по меньшей мере первый блок оптической регистрации, содержащий по меньшей мере первое устройство получения изображений. Первый блок оптической регистрации устройства имеет оптическую ось и предметную плоскость. Эта предметная плоскость содержит область получения изображений, из которой первым устройством получения изображения в виде изображения могут быть зарегистрированы электромагнитные волны. Устройство этой системы дополнительно содержит по меньшей мере один перемещающий блок, расположенный для перемещения устройства для образцов и первого блока оптической регистрации относительно друг друга, и корпус, расположенный для того, чтобы удерживать указанный первого блок оптической регистрации и указанный перемещающий блок, где указанный первый блок оптической регистрации и указанный перемещающий блок расположены таким образом, что по меньшей мере часть указанного устройства для образца проходит через указанную область получения изображений. Движение устройства для образцов и первого блока оптической регистрации относительно друг друга осуществляется вдоль траектории сканирования, что определяет угол тета относительно оптической оси, где тета больше нуля. В принципе, траектория сканирования в патенте США № 61/146850 может включать в себя любое перемещение предметной плоскости и образца относительно друг друга. В частности, траектория сканирования может включать в себя практически прямую линию сканирования, расположенную вдоль оси сканирования. Траектория сканирования также может определяться по существу вращательным движением, в таком случае тета - это угол между указанной оптической осью и локальной касательной к указанному вращательному движению. В одном из вариантов осуществления траектория сканирования ограничивается плоскостью, например прямая линия, круговое движение, движение по спирали или любая другая подходящая траектория.
В одном из вариантов осуществления биологические организмы являются неподвижными во время получения изображения. В контексте настоящего приложения фраза "по существу неподвижны" относится к ситуации, когда движения организмов в неоднородном жидком образце не влияют на определение параметров образца, например, параметров организмов в образце. В одном из вариантов осуществления "по существу неподвижны" относится к ситуации, когда перемещение организмов в период времени, проходящий между получением двух последовательных изображений в последовательности пространственно разделенных изображений, должно быть значительно меньше, чем расстояние меду этими двумя последовательными изображениями, например, одна десятая расстояния. В одном из вариантов осуществления "по существу неподвижны" еще относится к ситуации, где отсутствует поток массы указанного образца во время получения по меньшей мере части указанных изображений. В одном из вариантов осуществления для визуализации клеток и их содержимого движение клетки может быть ограничено до такой степени, в которой могут быть получены достаточно резкие изображения клеток, так что можно будет определить детали, относящиеся, например, к ядру. В вариантах осуществления, приспособленных для определения параметров, относящихся к клеткам, термин "по существу неподвижны", таким образом, может означать, что движение указанных клеток на протяжении получения изображения может быть ограничено глубиной резкости изображаемого пространства (ГРИП), или частью ГРИП, например одной тысячной ГРИП, например одной сотой ГРИП, например одной десятой ГРИП, например одной пятой ГРИП, например одной третей ГРИП. ГРИП может быть в диапазоне от 0,1 микрометра до 200 микрометров. Движение организмов в жидком образце в неподвижных условиях может, таким образом, быть менее чем 0,001 микрометра в секунду, например менее чем 0,01 микрометра в секунду, например менее чем 0,1 микрометра в секунду, например менее чем 1 микрометр в секунду. Параметром организма в этом варианте осуществления может быть количество и размер ядер или расстояние между ядрами в клетке. В одном из вариантов осуществления, где детали организмов представляют меньший интерес, например для подсчета организмов, ограничение на движение организма является таким, чтобы движение не влияло на подсчет организмов.
Движение организмов, которые должны быть подсчитаны, должно быть, таким образом, менее чем 1 миллиметр в секунду, например менее чем 100 микрометров в секунду, например, менее чем 10 микрометров в секунду, например менее 1 микрометра в секунду, например, менее чем 0,1 микрометра в секунду.
Глубина резкости здесь определена как диапазон расстояний от оптической системы визуализации, в котором изображение объектов по существу не подвержено влиянию смещений от фокальной плоскости. Фокальная плоскость определяется как плоскость, в которой достигается наилучшее разрешение визуализации. Термин "по существу не подвержено влиянию" означает, что оцениваемые параметры, которые характеризуют признаки объекта, по существу не зависят от перемещения. В одном из вариантов осуществления "по существу не подвержены влиянию" означает, что отношение между FWHM (Full Width Half Max, полная ширина на половине высоты) распределения интенсивностей точечного источника в заданном положении в пределах глубины резкости к FWHM распределения интенсивностей точечного источника в фокальной плоскости менее чем 5, например менее чем 2, например менее чем 1,5, например менее чем 1,25, например менее чем 1,1, например менее чем 1,05.
Система по настоящему изобретению содержит по меньшей мере одно устройство для образцов, включающее по меньшей мере один контейнер для образца для удержания образца в жидком виде. Устройство для образцов может состоять из стеклянного материала и/или из пластикового материала. В одном из вариантов осуществления материал по существу прозрачный на длине (длинах) волны электромагнитного излучения, используемой для получения набора оптических срезов. Устройство для образцов может быть одноразовым элементом для использования только один раз, хотя оно может состоять из повторно используемых материалов, таких как стекло. Количество жидкого образца в контейнере для образца может быть в диапазоне от 0,1 микролитра до 100 микролитров. Количество контейнеров для образцов в устройстве для образцов может варьироваться в зависимости от приложения. Устройство для образцов, которое содержит только один контейнер для образца, можно, например, использовать в варианте осуществления для мониторинга всего одного биологического организма. Устройство для образцов, содержащее несколько контейнеров для образцов, например 20 контейнеров, можно использовать для тестирования чувствительности. Количество Ncont контейнеров для образцов на указанном устройстве для образцов, может быть равным 2, 3, 4, 5, 6, 8, 9, 10, 12, 14,15, 16, 18, 20, 21, 22, 24, 25, 26, 27, 28, 30, или более 30. В одном из вариантов осуществления Ncont контейнеров для образцов расположены в один или несколько рядов, например с одинаковым числом контейнеров для образцов в каждом ряду. Контейнер для образца может содержать входное отверстие, которое будет использовано для ввода жидкости в контейнер для образца, и может содержать выходное отверстие, которое будет использовано для выпуска лишней жидкости или воздуха во время ввода жидкости. Выходное отверстие также можно использовать для извлечения образца, если устройство для образцов должно быть использовано повторно с новым образцом жидкого образца. Контейнер для образца может быть открытым, т.е. может быть открытым по меньшей мере в одном направлении, в таком случае контейнер можно рассматривать как контейнер луночного типа, или образец может быть по существу закрытым, т.е. быть по существу закрытым во всех направлениях, кроме необязательных входного и выходного отверстий, в таком случае его можно рассматривать как контейнер кюветного типа.
Образец может быть в жидком виде во время получения наборов оптических срезов. В контексте настоящего изобретения образец рассматривается как находящийся в жидком состоянии, если образец может перетекать под действием гравитационных сил в контейнер для образца или быть втянутым в контейнер для образца с использованием капиллярных сил. Жидкий образец может вести себя как гель. В контексте настоящего изобретения гель является твердым, желеобразным материалом, который обладает свойствами, варьирующимися от мягкого и жидкого то твердого и вязкого. Гель проявляет отсутствие текучести в стационарном состоянии. По весу гели в основном являются жидкостями, но они ведут себя как твердые тела.
Набор оптических срезов образца в контейнере для образца содержит по меньшей мере одно изображение. Набор оптических срезов может также содержать несколько изображений, например 10 изображений или даже больше, например 25, 40, 60 или даже больше.
Система по настоящему изобретению содержит перемещающий блок для перемещения устройства для образцов и блока оптической регистрации относительно друг друга. Это может достигаться посредством расположения указанного устройства для образцов относительно опоры, которая затем перемещается относительно остальной системы, удерживая блок оптической регистрации неподвижным, или наоборот, смещая блок оптической регистрации относительно остальной системы, удерживая опору устройства для образцов неподвижной. Устройство для образцов и блок оптической регистрации могут перемещаться одновременно относительно остальной системы.
В одном из вариантов осуществления, где измерения должны проводиться только в одном контейнере для образца, перемещающий блок может быть отрегулирован для движения устройства для образцов относительно блока оптической регистрации небольшими шагами только при получении изображений для наборов оптических срезов. Размер шага может быть менее около 1000 микрометров, например менее около 100 микрометров, например менее около 10 микрометров, например менее около 1 микрометра, например менее около 0,1 микрометра.
Малые шаги могут изменяться от шага к шагу. Длина шагов может быть определена равной ГРИП или ее части или может быть равна k, умноженному на ГРИП, где k больше 1,0.
В другом варианте осуществления, где измерения должны проводиться в нескольких контейнерах для образцов в последовательности, перемещающий блок может быть отрегулирован для перемещения устройства для образцов относительно блока оптической регистрации большими шагами при движении от одного контейнера к следующему в последовательности, в то время как при получении изображений для набора оптических срезов в контейнере для образца шаги остаются маленькими.
В одном из вариантов осуществления изобретения устройство анализа изображений анализирует изображения и наборы оптических срезов, полученные от контейнеров для образцов.
При наличии набора оптических срезов образца соответствующие объекты, будь то клетки, бактерии или другие объекты, предоставляющие интерес, могут быть извлечены для дальнейшего анализа посредством применения первого алгоритма, включающего:
Применение функции решения к каждой точке набора оптических срезов, классифицируя каждую точку либо как объект, либо как фон. Функция решения может быть, например, основана на локальном контрасте вокруг точки в задаче.
Объединение точек объектов из каждого изображения набора оптических срезов для формирования фокусных стопок отдельных объектов. Фокусная стопка объекта состоит из одного или нескольких изображений объекта, снятых в разных плоскостях фокусировки. При построении фокусных стопок объекта необходимо проявлять осторожность, если набор оптических срезов получен с использованием наклонной оптической системы, как описано в предварительной заявке США № US 61/146850.
Для каждой фокусной стопки объекта можно определить точку оптимальной фокусировки, используя функцию фокусирования, применяемую к каждому изображению в фокусной стопке объекта В одном из вариантов осуществления, когда объектами в задаче являются амплитудные объекты, в качестве функции фокусирования можно использовать дисперсию интенсивностей точек. Считается, что объект в фокусе в изображении с максимальной дисперсией. Это изображение можно извлечь для дальнейшего анализа.
В одном из вариантов осуществления изобретения устройство анализа изображений включает в себя алгоритмы, приспособленные для определения скорости клеточного деления. При наличии набора наборов оптических срезов образца на равноудаленных или неравноудаленных временных интервалах скорость клеточного деления рассчитывается путем извлечения соответствующих клеток с использованием первого алгоритма. Для каждого извлеченного объекта можно рассчитать параметр, относящийся к клетке. Им может быть, например, количество субкомпонентов, площадь объекта, периметр объекта, размер веретена деления и т.д. Можно рассчитать среднее значение параметра для всех объектов в наборе оптических срезов. Это повторяют для всех наборов оптических срезов образца в задаче. Наблюдая как изменяются во времени средние значения, можно установить скорость клеточного деления. Другие, отличающиеся от среднего значения параметра, статистические показатели также можно рассматривать, например, медиану, дисперсию или другие более высокого порядка и/или нелинейные показатели.
В одном из вариантов осуществления изобретения устройство анализа изображений включает в себя алгоритмы, приспособленные для определения жизнеспособности клеток. При наличии одного набора оптических срезов образца степень жизнеспособности клеток можно установить посредством первого применения указанного выше способа для извлечения фокусных стопок соответствующих объектов. Для каждого объекта можно рассчитать жизнеспособность путем рассмотрения таких параметров, как поведение функции фокусирования, профиль интенсивности объекта в фокусе, общий контраст объекта, отклик некоторых биологических окрашиваний и т.д. Применяя это для всех зарегистрированных объектов в стопке, можно использовать статистические показатели, такие как среднее арифметическое, для оценки общей жизнеспособности клеток в образце.
В одном из вариантов осуществления устройство анализа изображений включает алгоритмы, приспособленные для определения отношения количества живых/мертвых. Имея набор наборов оптических срезов образца на равноудаленных или неравноудаленных временных интервалах, отношение живых/мертвых рассчитывают путем извлечения соответствующих клеток с использованием первого алгоритма. Для каждого извлеченного объекта можно рассчитать параметр, относящийся к свойствам живые/мертвые.
Это может быть, например, поведение функции фокусирования, профиль интенсивности объекта в фокусе, общий контраст объекта, реакция на некоторые биологические окрашивания и т.д. Можно рассчитать среднее значение параметра для всех объектов в наборе оптических срезов. Это повторяют для всех наборов оптических срезов образца в задаче. Наблюдая, как изменяются во времени средние значения, можно установить отношение количества живых/мертвых. Другие статистические показатели, отличающиеся от среднего значения па