Усиление иммунного ответа и направленности на мишень с помощью антигенов и/или лекарства
Иллюстрации
Показать всеИзобретение относится к соединениям, направленно доставляющим лекарство к клеткам с рецепторами CD1d и индуцирующим усиленный иммунный ответ в сравнении с антигеном, композициям на их основе и способу с их использованием, применимым в медицине, формулы
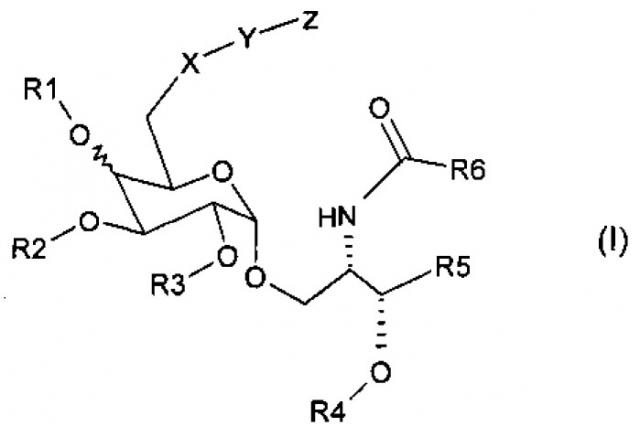
где R1, R2, R3, и R4 представляют собой водород; R6 представляет собой -(CH2)xCH3, x представляет собой целое число, выбираемое от 20 до 25, или -(CH2)xCH=CH(CH2)yCH3, x, y и z представляют собой независимо числа от 1 до 14, R5 характеризуется формулой (II)
где R8 представляет собой водород, R7 представляет собой C3-C15 алкил; X представляет собой N; Υ представляет собой -(CH2)t, где t - число 3-10; Ζ представляет собой пептидный антиген. Получены новые биологически активные соединения, эффективные для стимулирования иммунного ответа. 4 н. и 8 з.п. ф-лы, 6 ил., 5 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение касается гликолипидов, активирующих клетки NKT, ковалентно связанных с антигенами и/или лекарством.
Уровень техники
Настоящее изобретение касается соединений, состоящих из гликолипидов, ковалентно связанных с антигеном или лекарством через линкер. Названные соединения способны индуцировать более сильный иммунный ответ, чем композиция, включающая по отдельности гликолипиды и антиген. Названные соединения также способны направлять лекарство к клеткам, несущим молекулы CD1d.
Натуральные (природные) киллерные T-клетки («NKT-клетки») представляют собой популяцию клеток, подобных природным клеткам памяти/эффекторным клеткам, которые экспрессируют как рецепторы натуральных киллеров (natural killer, NK), так и консервативные семи-инвариантные рецепторы T-клеток (TCR). Клетки NKT участвуют в подавлении аутоиммунных реакций и отторжении имплантатов, стимулировании устойчивости к патогенам и стимулировании иммунного ответа в отношении опухолей.
Клетки NKT отвечают массированной продукцией цитокинов в течение нескольких часов после активации TCR, высвобождая цитокины TH1-типа, включая IFN-γ и TNF, а также цитокины TH2-типа, включая IL-4 и IL-13. Модуляция этих лимфокиновых ответов и является главным предназначением адьювантов, которые применяются в иммуногенных композициях.
Клетки NKT распознают чужеродные и собственные липидные антигены, представленные у молекул - членов семейства CD1d, ассоциированного с β2-микроглобулинами. Было установлено, что большое число липидов с разной структурой связывает молекулы CD1d специфическим способом, который сопровождается локализацией жирнокислотных цепей в каждом из двух гидрофобных связывающих карманах (A′ и F) молекулы CD1d. Виды липидов, способные связываться с молекулами CD1d, включают миколовые кислоты, диацилглицеролы, сфинголипиды, полиизопреноиды, липопептиды, фосфомикокетиды и небольшие гидрофобные соединения.
Большое число молекул природных и синтетических липидов преобразуется антиген-презентирующими клетками и презентируется молекулами CD1 для клеток NKT. Прототипным соединением, применяемым для изучения активации клеток NKT in vitro и in vivo, является KRN7000, а также α-галактозилцерамид ("αGalCer"), вьщеляемый из морской губки Agelas mauritianus. Другие недавно идентифицированные соединения включают изоглоботригексозилцерамид ("iGB3"), который представляет собой эндогенный гликолипид, описанный в заявке на Патент РСТ WO 2006/029010, и PBS-57, модифицированный 6″амино-6″дезоксигалактозилцерамид, который был описан в PCT-заявке на Патент PCT/US 2007/066250, которая включается в настоящее изобретение путем отсылки. Эти соединения активируют NKT-клетки и усиливают цитокиновые ответы in vitro и in vivo. В соответствии с этим было высказано предположение, что применение таких соединений в качестве адъювантов будет улучшать эффективность вакцины при их совместном введении с антигеном (PCT заявка на Патент WO 2006/083671).
В контексте вакцинации антиген должен быть представлен антиген-презентирующей клеткой (antigen-presenting cell, APC), в частности дендритными клетками (dendritic cells, DCs), обычным CD8+ и CD4+ T-клеткам посредством молекул MHC класса I или класса II соответственно для того, чтобы индуцировать специфический иммунный ответ против данного антигена. Для этой цели инициируется реципрокная активация NKT-клеток и дендритных клеток путем презентации α-галактозилцерамидов покоящимися дендритными клетками клеткам NKT, что индуцирует NKT-клетки к повышенной регуляции цитокинов CD40L и Th1 и Th2 и хемокинов. После этого «сшивание» CD40 стимулирует дендритные клетки к повышенной регуляции CD40, В7.1 и В7.2 и IL-12, что в свою очередь усиливает активацию клеток NKT и продукцию цитокинов. Распространение этой реакции включает активацию цитолиза клеток NKT и продукцию IFN-γ и, что самое главное, повышенную регуляцию ко-стимулирующих свойств дендритных клеток и презентирование антигенов, опосредованное MHC класса I и MHC класса II
Было высказано предложение применять гликолипиды, непосредственно связанные с репортерной группой, такой как флуорофор или другая маленькая молекула (например, биотин), для того, чтобы используя их в качестве зондов, наблюдать связывание гликолипидов с CD1d и клетками NKT (PCT заявка на Патент WO 2004/094444). В частности, связанные с 6″амино-6″дезокси-галактозилцерамидом флуорофор и биотин применялись для выяснения роли структуры гликолипида в связывании с рецепторами CD1d и NKT-клеток. Такое окрашивание позволяло наблюдать за перемещением гликолипидов и количественно определять их связывание с рецепторами CD1d и клеток NKT (Zhou et al, Org. Lett. 2000 4: 1267-1270). Было установлено, что дансилированные и продановые производные 6″-амино-6″-дезокси-галактозилцерамидов, а также связанные с биотином 6″-амино-6″-дезокси-галактозилцерамиды стимулируют клетки NKT так же, как и исходный гликолипид, что позволило предположить, что эти соединения поглощаются в процессе эндоцитоза, связываются с CD1d, презентируются на клеточной поверхности и обеспечивают связывание с рецепторами T-клеток, вызывая стимуляцию T-клеток. Однако Zhou et al. присоединяли маленькие молекулы к гликолипиду для мечения NKT-клеток и/или только клеток, имеющих рецептор CD1d. Остается неизвестным, будет ли влиять присоединение более крупных молекул к липидной цепи на связывание с CD1d. Кроме того, до настоящего времени не было сообщений о гликолипидах, связанных с антигенами или лекарствами.
Раскрытие изобретения
Авторы настоящего изобретения неожиданно обнаружили, что соединение, состоящее из гликолипида, ковалентно связанного с антигеном посредством линкера, способно вызывать специфический иммунный ответ к данному антигену, причем более сильный, чем ответ, наблюдаемый в случае, когда гликолипид и антиген по отдельности вводились в виде композиции.
Не будучи связанными рамками теории, авторы предположили, что при совместной доставке антигена и агониста клеток NKT к одной и той же клетке APC, предпочтительно к одному и тому же B-лимфоциту или одной и той же клетке DC, B-клетка и/или DC-клетка активируются NKT-клеткой, и антиген, таким образом, будет презентирован обычным T-клеткам полностью активированной B-клеткой и/или клеткой DC. Близкое расположение активированной T-клетки может быть полезно, когда клетка APC презентирует антиген T-клетке, поскольку это будет вносить свой вклад в ее цитокиновое окружение.
Кроме того, когда гликолипид ковалентно связан с лекарством, гликолипид способен обеспечить специфическую доставку лекарства к клеткам NKT.
Таким образом, настоящее изобретение касается соединений, состоящих из гликолипидов, ковалентно связанных посредством линкера с антигеном или лекарством, и их применения.
Соединение, состоящее из гликолипида, ковалентно связанного посредством линкера с антигеном или лекарством
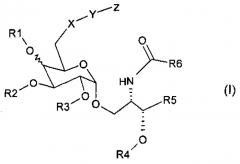
Соединение настоящего изобретения имеет Формулу (I):
где,
R1, R2, R3, и R4 представляют собой каждое независимо друг от друга водород, C1-С6 алкил, С6-С12 аралкил, или C1-С6 ацил; и R1 находится либо выше, либо ниже сахарного кольца.
R6 представляет собой
a) -(СН2)xCH3, где x представляет собой целое число, выбираемое от 1 до 100; или
b) -(СН2)xCH=СН(СН2)уСН3 или -(CH2)xCH=CH(CH2)yCH=CH(CH2)zCH3
где x, у и z представляют собой независимо выбираемые целые числа от 1 до 14.
R5 представляет собой одну из следующих формул (II), (III) или (IV)
где
R8 представляет собой водород, C1-С6 алкил, C6-C12 аралкил, или C1-С6 ацил, и
R7 представляет собой линейный или разветвленный С3-С100 алкил;
Х представляет собой О, N или S;
Y представляет собой расщепляемую или не расщепляемую линкерную группу; и
Z представляет собой антиген или лекарство или их фармацевтически приемлемую соль.
В используемом здесь значении термин «алкил» обозначает углеводородную цепь, которая может быть прямой цепью или разветвленной цепью, содержащей указанное число атомов углерода. Например, C1-C12 алкил указывает, что группа может содержать в себе от 1 до 12 (включительно) атомов углерода. Термин «арилалкил» или «аралкил» обозначает алкильный остаток, в котором алкильный атом водорода замещен на арильную группу. Примеры «арилалкила» или «аралкила» включают бензильную и 9-фторфенильную группы.
Термин «ацил» относится к алкилкарбонильному, циклоалкилкарбонильному, арилкарбонильному, гетероциклилкарбонильному или гетероарилкарбонильному заместителю, любой из которых может быть дополнительно замещен заместителями.
Термин «циклоалкил» в используемом здесь значении включает насыщенные циклические, бициклические, трициклические или полициклические углеводородные группы, содержащие от 3 до 12 углеродных атомов, в которых любой атом кольца, доступный для замещения, может быть замещен заместителем. Примеры циклоалкильных остатков включают, но ими не ограничиваются, циклогексил и адамантил.
Термин «арил» относится к ароматической моноциклической, бициклической или трициклической углеводородной кольцевой системе, в которой любой атом кольца, доступный для замещения, может быть замещен заместителем. Примеры арильных остатков включают, но ими не ограничиваются, фенил, нафтил и антраценил.
Термин «гетероциклил» относится к не-ароматической 3-10-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, содержащей 1-3 гетероатома в случае моноциклической, 1-6 гетероатомов в случае бициклической или 1-9 гетероатомов в случае трициклической системы, где названные гетероатомы выбираются из О, N или S (например, атомы углерода и 1-3, 1-6 или 1-9 гетероатомов, выбираемых из N, О или S, в случае моноциклической, бициклической или трициклической системы соответственно), где любой атом кольца, доступный для замещения, может быть замещен заместителем.
Термин «гетероарил» относится к ароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, содержащей 1-3 гетероатома в случае моноциклической, 1-6 гетероатомов в случае бициклической или 1-9 гетероатомов в случае трициклической системы, где названные гетероатомы выбираются из О, N или S (например, атомы углерода и 1-3, 1-6 или 1-9 гетероатомов, выбираемых из N, О или S, в случае моноциклической, бициклической или трициклической системы соответственно), где любой атом кольца, доступный для замещения, может быть замещен заместителем.
Термин «оксо» относится к атому кислорода, который формирует карбонил при присоединении к углероду, N-оксид при присоединении к азоту и сульфоксид или сульфон при присоединении к сере.
Термин «заместители» относится к группе, «замещающей» алкильную, циклоалкильную, гетероциклильную, арильную или гетероарильную группу по любому из атомов этой группы. Подходящие заместители включают, но ими не ограничиваются, алкил, алкенил, алкинил, алкокси, гало, гидрокси, циано, нитро, амино, SO3H, сульфат, фосфат, перфторалкил, перфторалкокси, метилендиокси, этилендиокси, карбоксил, оксо, тиоксо, имино (алкил, арил, аралкил), S(O)n алкил (где n составляет 0-2), S(O)n арил (где n составляет 0-2), S(O)n гетероарил (где n составляет 0-2), S(O)n гетероциклил (где n составляет 0-2), амин (моно-, ди-, алкил, циклоалкил, аралкил, гетероаралкил и их комбинации), сложный эфир (алкил, аралкил, гетероаралкил), амид (моно-, ди-, алкил, аралкил, гетероаралкил и их комбинации), сульфонамид (моно-, ди-, алкил, аралкил, гетероаралкил и их комбинации), незамещенный арил, незамещенный гетероарил, незамещенный гетероциклил и незамещенный циклоалкил.
R6 может содержать от 1 до 100 метиленовых (CH2) групп (например, R6 представляет собой (CH2)xCH3 и x=1-100). В частности, R6 может содержать 1-75 СН2 групп, 1-50 СН2 групп, 1-25 CH2 групп, 1-20 СН2 групп, 1-15 СН2 групп, 1-10 СН2 групп или 1-5 СН2 групп. Предпочтительно, R6 содержит 15-25 СН2 групп. Более предпочтительно, R6 содержит 20-25 CH2 групп.
В определенных воплощениях R6 содержит 22 или 24 СН2 группы (х=22 или х=24).
R7 может представлять собой, в частности, линейный или разветвленный С3-С75 алкил, С3-С50 алкил, С3-С25 алкил, С3-С20 алкил, С3-С15 алкил, C10-C15 алкил или С3-С10 алкил.
В определенных воплощениях R7 представляет собой неразветвленную алкильную группу из 14 атомов углерода.
Предпочтительно, R6 представляет собой C25H51 и R7 представляет собой С14Н29. Более предпочтительно, R6 представляет собой С23Н45 и R7 представляет собой С14Н29. В другом предпочтительном воплощении R6 представляет собой С23Н47 и R7 представляет собой C14H29.
Когда R1-R3 не являются водородом, предпочтительно, чтобы каждый из них независимо представлял собой метил, бензил или ацетил.
Согласно определенному воплощению (далее обозначается как PBS-6), R1, R2, R3, R4 и R8 представляют собой водород, R5 представляет собой (II), R6 представляет собой C25H51, R7 представляет собой С14Н29 и Х представляет собой N.
Согласно другому воплощению (далее обозначается как PBS-57), R1, R2, R3, R4 и R8 представляют собой водород, R5 представляет собой (II), R6 представляет собой С23Н45, R7 представляет собой C14H29 и Х представляет собой N.
Согласно еще одному воплощению (далее обозначается как PBS-14), R1, R2, R3, R4 и R8 представляют собой водород, R5 представляет собой (II), R6 представляет собой С25Н51, R7 представляет собой С14Н29 и Х представляет собой N.
В другом воплощении (далее обозначается как PBS-96), R1, R2, R3, R4 и R8 представляют собой водород, R5 представляет собой (II), R6 представляет собой С23Н47, R7 представляет собой С14Н29 и Х представляет собой N.
Фармацевтически приемлемые соли соединений настоящего изобретения включают соли, происходящие из фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры пригодных солей кислот включают ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, диглюконат, додецилсульфат, этансульфонат, форм(и)ат, фумарат, глюкогептаноат, гликолат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, пальмоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, салицилат, сукцинат, сульфат, тартрат, тиоцианат, тозилат и андеканоат. Другие кислоты, такие как щавелевая кислота, хотя сами по себе и не являются фармацевтически приемлемыми, могут использоваться для получении солей, применимых в качестве промежуточных компонентов при получении соединений настоящего изобретения и их фармацевтически приемлемых кислотно-аддитивных солей (солей присоединения кислоты). Соли, полученные из приемлемых оснований, включают соли щелочных металлов (например, натрия), щелочноземельных металлов (например, магния), аммония и N-(алкил)4 +. Настоящее изобретение также предполагает кватернизацию любых щелочных азотсодержащих групп раскрываемых здесь соединений. С помощью такой кватернизации могут быть получены продукты, растворимые или диспергируемые в воде или масле. Солевые формы соединений, имеющих указанную здесь Формулу, могут быть солями аминокислот по карбоксильным группам (например, солями L-аргинина, -лизина, -гистидина).
Гликолипидный компонент соединений согласно настоящему изобретению, описанный выше, может быть синтезирован таким образом, как это раскрывается в Международной заявке на патент WO 2004/094444, которая включается в настоящее изобретение путем отсылки.
Присоединение компонента линкер-антиген или лекарство (Y-Z) к гликолипидному компоненту может быть проведено согласно методу, описанному в работе Zhou et al. (Org. Lett. 2000 4:1267-1270).
Пример конъюгации пептидного антигена показан на приведенной ниже схеме I:
Для получения такой конъюгации пептидного антигена пептид может быть растворен в концентрации 50-100 мкМ в приемлемом буфере при pH 7,0-7,5 при комнатной температуре. Восстановление дисульфидных связей в пептиде может быть проведено путем добавления в 10-кратном молярном избытке восстанавливающего агента, такого как DTT или ТСЕР. Гликолипид, содержащий реактивную группу, может быть добавлен по каплям к раствору пептида при перемешивании до конечного соотношения 10-20 молей гликолипида на каждый моль пептида. Реакционную смесь можно оставить для протекания реакции на 2 часа при комнатной температуре или на ночь при температуре 4°С. Конъюгат может окончательно быть выделен с помощью гель-хроматографии на колонке.
Линкерной группой Y может быть любая углеродсодержащая цепь или кольцо. Например, линкером может быть -(CH2)t-, в которой цепь необязательно содержит один или более терминальных гетероатомов (например, N, О, S), и/или один или более гетероатомов, колец, двойных связей, тройных связей, которые вставлены в данную цепь. Значение «t» может быть 1-20, предпочтительно 3-10.
В предпочтительном воплощении настоящего изобретения линкер состоит из 6 атомов углерода.
Предпочтительно, линкер содержит протеолитически расщепляемый участок, в частности, участок расщепления эндо-лизосомальными протеазами. Альтернативно этому, линкерная группа содержит участок расщепления липазами. В частности, линкерная группа может содержать участок расщепления протеазами и/или участок расщепления липазами.
Предпочтительно, соединение согласно настоящему изобретению является способным связываться с мономером или тетрамером CD1d. Более предпочтительно, это соединение способно активировать клетки NKT.
В используемом здесь значении термин «антиген» относится к любому веществу или материалу, который специфически распознается связывающим компонентом иммунной системы, таким как антитело или фрагмент антитела, включающий паратоп или рецептор Т-клеток (TCR).
Соответственно, антигены соединения формулы (I) происходят из ослабленных или убитых инфекционных агентов. Могут применяться целые микроорганизмы или их части (например, «тени» мембран, грубые мембранные препараты, лизаты и другие препараты микроорганизмов). Подходящие инфекционные агенты, из которых может быть получен антиген, включают, но ими не ограничиваются, патогены и микроорганизмы, такие как бактерии, паразиты и вирусы. В определенных случаях подходящие антигены получают или выделяют из вирусного патогена, который связан с заболеванием человека, включая, но ими не ограничиваясь, HIV/AIDS (Retroviridae, например, молекулы gp120 для HIV-1 и HIV-2 изолятов, HTLV-I, HTLV-11), вирусы гриппа (Orthomyxoviridae, например, типы А, В и С), герпеса (например, симплексные вирусы герпеса, HSV-1 и HSV-2 гликопротеины gB, gD и gH), ротавирусных инфекций (Reoviridae), респираторных инфекций (парагрипп и респираторные синцитиальные вирусы), полиомиелитов (Picornaviridae, например, полиовирусы, риновирусы), кори и свинки (Paramyxoviridae), краснухи (Togaviridae, например, вирус краснухи), гепатитов (например, вирусы гепатитов типа А, В, С, D, Е и/или G), цитомегаловирусы (например, gB и gH), гастроэнтерита (Caliciviridae), Желтой лихорадки и лихорадки Западного Нила (Flaviviridae), бешенства {Rhabdoviridae), Корейской геморрагической лихорадки (Bunyaviridae), Венесуэльской лихорадки (Arenaviridae), бородавок (Papillomavirus), вирус иммунодефицита обезьян, вирус энцефалита, вирус ветряной оспы и опоясывающего лишая, вирус Эпштейна-Барра и другие семейства вирусов, включая Coronaviridae, Birnaviridae и Filoviridae.
Подходящие бактериальные и паразитические антигены также могут быть получены или выделены из известных агентов, вызывающих заболевания, включая, но ими не ограничиваясь, дифтерию, коклюш, столбняк, туберкулез, бактериальную или грибковую пневмонию, отит среднего уха, гонорею, холеру, брюшной тиф, менингит, мононуклеоз, чуму, шигеллез (бактериальную дизентерию) или сальмонеллез, болезнь Легионеров, болезнь Лайма, проказу, малярию, анкилостоматоз, Онхоцеркоз, Шистосомоз (бильгарциоз), Трипаносомоз, Лейшманиоз, гирдазиоз (жирдазиаз), амебиаз (амебную дизентерию), филяриоз, Боррелии и трихинеллез. Другие антигены могут быть получены или выделены из необычных патогенов, таких как возбудители болезни куру, болезни Крейтцфельда-Якоба (CJD), скрепи (почесухи), трансмиссивной энцефалопатии норок и хронических изнуряющих заболеваний, или из белковых инфекционных частиц, таких как прионы, которые связаны с коровьим бешенством (губчатой энцефалопатией).
Дополнительные специфические патогены, из которых могут быть выделены антигены, включают Mycobacterium tuberculosis, Chlamydia, Neisseria gonorrhoeae, Shigella, Salmonella, Vibrio cholerae, Treponema pallidum, Pseudomonas, Bordetella pertussis, Brucella, Francisella tularensis, Helicobacter pylori, Leptospira interrogans, Legionella pneumophila, Yersinia pestis, Streptococcus (типы А и В), pneumococcus, meningococcus, Haemophilus influenza (тип b), Toxoplasma gondii, Moraxella catarrhalis, donovanosis и actinomycosis, патогены грибов, включая кандидоз и аспергиллоз, патогены паразитов, включая Taenia, трематод, круглых червей, амебиаз (амебную дизентерию), гирдазиоз (жирдазиаз), Cryptosporidium, Schistosoma, Pneumocystis carinii, trichomoniasis и trichinosis. Настоящее изобретение также может применяться для обеспечения соответствующего иммунного ответа против разнообразных ветеринарных заболеваний, таких как ящур, коронавирусная инфекция, Pasteurella multocida, Helicobacter, Strongylus vulgaris, Actinobacillus pleuropneumonia, вирус диареи крупного рогатого скота (BVDV), Klebsiella pneumoniae, Escherichia coli, и Bordetella pertussis, parapertussis и brochiseptica.
В других воплощениях антигены для связывания с гликолипидами, которые могут применяться, представляют собой антигены, получаемые из опухолей, или аутологические или аллогенные целые опухолевые клетки. Соответственно, опухолевый антиген представляет собой антиген, специфический для опухоли (tumor specific antigen, TSA) или антиген, ассоциированный с опухолью (tumor associated antigen, TAA). Некоторые опухолевые антигены и особенности их экспрессии известны в данной области техники и могут быть выбраны, исходя из типа опухоли, которая будет подвеграться лечению. Нелимитирующие примеры опухолевых антигенов включают cdk4 (меланома), р-катенин (меланома), каспазу-8 (плоскоклеточная карцинома), MAGE-1 и MAGE-3 (меланома, рак молочной железы, глиома), тирозиназу (меланома), поверхностный идиотип Ig (например, BCR) (лимфома), Her-2/neu (рак молочной железы, рак яичников), MUC-1 (рак молочной железы, рак поджелудочной железы) и HPV Е6 и Е7 (карцинома шейки матки). Дополнительные подходящие опухолевые антигены включают простата-специфичный антиген (PSA), сиалил Tn (STn), белки теплового шока и ассоциированные опухолевые пептиды (например, gp96), молекулы ганглиозидов (например, GM2, GD2, и GD3), карциноэмбриональный антиген (СЕА) и MART-1.
Согласно другому воплощению к гликолипиду присоединяется лекарство. Примеры подходящих лекарств включают циклоспорин, FK 506 и рапамицин.
Композиции для вакцинации и фармацевтические композиции Другой аспект настоящего изобретения касается композиции для вакцинации, которая включает соединение описанной выше формулы (I), где Z представляет собой антиген.
Термин «вакцина» обозначает композицию, которая при введении субъекту индуцирует клеточные и/или гуморальные иммунные ответы, как здесь описано.
В контексте настоящего изобретения термин «субъект» относится к животному, предпочтительно млекопитающему, являющемуся не человеком или человеком. Примеры млекопитающих, не являющихся человеком, включают грызунов и приматов. Наиболее предпочтительно субъект представляет собой человека.
Настоящее изобретение также предоставляет способ индукции, особенно стимуляции иммунного ответа у субъекта, который включает введение субъекту названного соединения или композиции для вакцинации согласно настоящему изобретению.
В контексте настоящего изобретения термин «стимуляция иммунного ответа» означает усиление иммунного ответа, который индуцируется присутствием антигена.
В предпочтительном воплощении иммунный ответ представляет собой гуморальный иммунный ответ. В используемом здесь значении, термин «гуморальый иммунный ответ» представляет собой продукцию антител В клетками и вспомогательные процессы, которые сопровождают эту продукцию, включая, но ими не ограничиваясь, например активацию Th2 и продукцию цитокинов, формирование герминативного центра (центра размножения) и переключение изотипа, процесс «созревания аффинности» и образование клеток памяти (Т лимфоцитов). Для определения того, стимулируется ли гуморальный иммунный ответ, может быть проведено количественное сравнение сигнала в образце, полученном из субъекта, который вакцинировался соединением или композицией для вакцинации, как определено выше, с сигналом в образце, полученном из субъекта, который вакцинировался только антигеном самим по себе. Гуморальный иммунный ответ может оцениваться путем измерения эффекторных функций антител, включая нейтрализацию патогена или токсина, классическую активацию комплемента и стимулирование опсонинов при фагоцитозе и элиминацию патогена. Антитела, продуцируемые в ответ на введение соединения или композиции для вакцинации, как определено выше, и антигена могут принадлежать к любому типу, например IgM, IgA или IgG. Гуморальный иммунный ответ может быть измерен любым количественным методом, известным в данной области техники, например, ELISA, методом простой радиальной иммунодиффузии (SRID), иммуноферментным анализом (EIA) или в тесте ингибирования гемагглютинации (HAI).
В другом предпочтительном воплощении стимуляция иммунного ответа соответствует активации CD4+ Т-лимфоцитов. Как должно быть известно специалистам в данной области техники, CD4+ Т-клетки или «клетки Т-хелперы» представляют собой клетки, которые распознают антигены, представленные маркером главного комплекса гистосовместимости класса II на поверхности антиген-презентирующих клеток, и секретируют лимфокины для стимуляции как опосредуемой клетками, так и опосредуемой антителами ветвей иммунной системы. Активация CD4+ Т-клеток стимулирует секрецию лимфокинов, переключение изотипа иммуноглобулинов, созревание аффинности ответа антител, активацию макрофагов и усиление активности натуральных киллеров (NK) и цитотоксичных Т-клеток (CTL). Лимфокины представляют собой белки, секретируемые лимфоцитами, которые оказывают влияние на их собственную активность и/или на активность других клеток. Лимфокины включают, но ими не ограничиваются, интерлейкины и цитокины, например, IL-2, IL-4, IL-5, IL-6, IL-10, IL-12 или INFγ. Для того, чтобы выяснить, активируются ли CD4+ Т-лимфоциты, может быть проведено количественное сравнение сигнала в образце, взятом у субъекта, который вакцинировался соединением или композицией вакцины, как определено выше, и сигнала в образце, взятом у субъекта, который вакцинировался только антигеном. Методы определения активации CD4+ Т-клеток известны в данной области техники.
В другом предпочтительном воплощении стимуляция иммунного ответа соответствует активации CD8+ Т-лимфоцитов. CD8+ Т-лимфоциты распознают антигены, представленные молекулами Класса I MHC (присутствуют на всех содержащих ядра клетках). Вовлечение пептидного комплекса MHC класса I обеспечивает доставку литических гранул к клетке-мишени, вызывая лизис клетки-мишени. Методы, используемые для определения активации CD8+ Т клеток, известны в данной области техники и включают, но ими не ограничиваются ELISPOT, ELISA и анализ цитотоксичности. Альтернативно этому для мониторинга активации CD8+ Т-клеток может применяться модель на мышах с использованием определения флуоресценции для измерения опосредованной клетками цитотоксичности, как это описано в работе Hermans et al. (2004) J. Immunol. Meth. 285:25-40.
Подходящие эффективные дозировки соединения формулы (I) в композициях для вакцинирования могут быть определены специалистом в данной области техники, но обычно они находятся в диапазоне от примерно 1 микрограмма до примерно 10000 микрограммов на килограмм массы тела, хотя, как правило, они составляют примерно 1000 микрограммов или меньше на килограмм массы тела. В некоторых воплощениях эффективные дозировки находятся в диапазоне от, примерно 10 до, примерно 5000 микрограммов на килограмм массы тела. В другом воплощении эффективные дозировки находятся в диапазоне от, примерно 50 до, примерно 1000 микрограммов на килограмм массы тела. В другом воплощении, эффективные дозировки находятся в диапазоне от, примерно 75 до, примерно 500 микрограммов на килограмм массы тела. Композиция может вводиться в виде однократной дозировки или может быть разделена на многократные дозировки, которые водятся в течение недель или месяцев. Необходимо понимать, что дозировка антигена будет зависеть от специфического антигена и от возраста и иммунного статуса субъекта, а также от других важных факторов, которые может определить специалист в данной области техники.
Введение вакцины настоящего изобретения может обеспечивать терапевтическое или профилактическое лечение инфекционного заболевания или заболевания, связанного с инфекционным агентом. Термин «лечить» или «лечение» инфекционного заболевания включает одно или более из следующих значений: (1) подавление инфекции, то есть предотвращение развития инфекции под действием инфекционного агента, (2) предотвращение распространения инфекционного агента, то есть распространения в другие области (органы) субъекта или от одного субъекта к другому, (3) снижение тяжести заболевания, (4) предотвращение рецидивов инфекций, то есть, предотвращение повторной активации латентных или хронических инфекций и (5) смягчение симптомов инфекционного заболевания.
Другой аспект настоящего изобретения касается фармацевтической композиции, которая содержит соединение формулы (I), в которой Z представляет собой лекарство.
Настоящее изобретение также предоставляет способ лечения субъекта, который нуждается в лечении, который включает введение названному субъекту названного соединения или фармацевтической композиции.
Термин «эффективное количество» обозначает количество соединения, которое обеспечивает терапевтический эффект у получающего лечение субъекта. Терапевтический эффект может быть объективным (то есть, измеряемым с помощью какого-либо теста или маркера) или субъективным (то есть, субъект демонстрирует признаки эффекта или чувствует данный эффект). Эффективное количество описанного выше соединения может варьировать в диапазоне от примерно 0,01 мкг/кг до примерно 500 мкг/кг, альтернативно этому от примерно 0,1 мкг/кг до примерно 100 мкг/кг, альтернативно этому от примерно 1 мкг/кг до примерно 50 мкг/кг. Эффективные дозировки также будут варьировать в зависимости от способа введения, а также от возможности совместного применения с другими агентами.
Как должны понимать специалисты в данной области техники, вакцины готовятся в соответствии с тем, какой способ введения предполагается. Примеры подходящих способов введения включают парентеральное, например, внутривенное, внутрикожное, подкожное, внутримышечное, пероральное (например, путем ингаляции), трансдермальное (топическое), трансмукозальное и ректальное введение.
Предпочтительно, чтобы вакцины согласно настоящему изобретению могли вводиться внутримышечно, внутривенно, подкожно, внутрикожно, внутрибрюшинно, назально, парентерально или с помощью ингаляции. Наиболее предпочтительно, вакцины согласно настоящему изобретению вводятся внутримышечно или подкожно.
Вакцина также может включать физиологически приемлемый наполнитель. «Физиологически приемлемый» наполнитель представляет собой любой наполнитель, который является подходящим для введения in vivo (например, путем перорального, трансдермального или парентерального введения) или применения in vitro, то есть, в культуре клеток. Подходящие физиологически приемлемые наполнители для введения in vivo включают, среди прочих, воду, буферные растворы и растворы глюкозы. Дополнительные компоненты композиций в дополнение к физиологически приемлемому наполнителю могут соответственно включать эксципиенты, такие как стабилизаторы, консерванты, растворители, эмульгаторы или любриканты. В частности, подходящие эксципиенты включают, но ими не ограничиваются, Твин 20, ДМСО, сахарозу, L-гистидин, полисорбат 20 и сыворотку.
Соединения описанной здесь формулы, могут, например, вводиться путем инъекции, внутривенно, внутриартериально, подкожно, внутрибрюшинно, внутримышечно или подкожно, или перорально, буккально, назально, трансмукозально, топически, в виде офтальмологических препаратов или путем ингаляции, в дозировках в диапазоне от примерно 0,5 до примерно 100 мкг/кг массы тела, альтернативно этому в дозировках в диапазоне от примерно 1 мг до примерно 100 мг/дозировку, каждые 4-120 часов, или в соответствии с требованиями для конкретного лекарства. Описанные здесь способы предполагают введение эффективного количества соединения или композиции соединения для достижения желаемого или необходимого эффекта. Как правило, фармацевтические композиции настоящего изобретения должны вводиться от примерно 1 до примерно 6 раз в день или, альтернативно этому, в виде непрерывного вливания. Такое введение может применяться в качестве хронической или острой терапии. Количество активного ингредиента, которое может комбинироваться с материалами носителя для получения одной дозировочной формы, будет варьировать в зависимости от получающего лечение объекта и от конкретного способа введения. Типичный препарат будет содержать от примерно 5% до примерно 95% активного соединения (по массе). Альтернативно этому, такие препараты содержат от примерно 20% до примерно 80% активного соединения.
Могут потребоваться более низкие или более высокие дозы, чем те, которые указаны выше. Специфическая дозировка и схема лечения для любого конкретного пациента будут зависеть от множества факторов, включая активность применяемого специфического соединения, возраст, массу тела, общее состояние здоровья, пол, диету, время введения, скорость выведения, комбинацию лекарств, тяжесть и характер протекания заболевания, состояние или симптомы, отношение пациента к болезни, состоянию или симптомам, и решение лечащего врача.
При улучшении состояния пациента, если это необходимо, может вводиться поддерживающая доза соединения, композиции или комбинации настоящего изобретения. После этого дозировка или частота введения, или и дозировка, и частота, могут быть снижены в зависимости от симптомов до уровня, на котором улучшение состояния сохраняется, когда симптомы облегчаются до желаемого уровня. Однако пациенты могут требовать периодического лечения на долговременной основе по мере появления рецидивов симптомов заболевания.
Описанные здесь композиции включают соединения описанной здесь формулы, а также дополнительные терапевтические агенты, если они присутствуют, в количествах, эффективных для достижения модулирования заболевания или симптомов заболевания, включая те, которые здесь описаны.
Термин «фармацевтически приемлемый носитель» обозначает носитель, который может вводиться пациенту вместе с соединением настоящего изобретения и который не нарушает фармакологической активности этого соединения и не является токсичным при введении в дозах, достаточных для доставки терапевтического количества соединения.
Фармацевтически приемлемые носители и наполнители, которые могут применяться в фармацевтических композициях настоящего изобретения, включают, но ими не ограничиваются, ионообменники, окись алюминия, стеарат алюминия, лецитин, самоэму