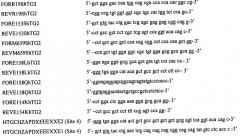Диагностика индуцируемых глютеном аутоиммунных заболеваний
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно диагностике глютен-чувствительной энтеропатии у генетически предрасположенных пациентов, и может быть использована для уточнения диагноза аутоиммунного заболевания. Для этого измеряют уровень связывания аутоантител в образцах сыворотки крови пациента с неизменным целиакальным эпитопом белков семейства трансглутаминаз по сравнению с уровнем связывания тестового соединения (ТС). ТС представляет собой тестовое антитело либо его фрагмент, вариант или аналог. ТС способно связываться с основным целиакальным эпитопом белков семейства трансглутаминаз. Превышение уровня связывания аутоантител в отсутствие ТС или снижение уровня связывания аутоантител на 50% в присутствие ТС указывают на индуцируемое глютеном аутоиммунное заболевание у указанного индивидуума. Группа изобретений обеспечивает корректировку диагностики индуцируемых глютеном аутоиммунных заболеваний и назначение сопутствующей диеты с устранением источников глютена. 4 н. и 4 з.п. ф-лы, 15 ил., 2 табл. 10 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к селективной диагностике индуцируемых глютеном аутоиммунных заболеваний с помощью анализов связывания с использованием основного целикального эпитопа, присутствующего на белках семейства трансглутаминазы.
УРОВЕНЬ ТЕХНИКИ
Глютеновая болезнь (также известная как целиакальная болезнь, нетропические афты или глютен-чувствительная энтеропатия) представляет собой уникальное аутоиммунное нарушение, для которого известен пусковой фактор из окружающей среды. Это нарушение развивается у генетически предрасположенных индивидуумов с генетическим фоном лейкоцитарного антигена человека (HLA) DQ2 или DQ8, и оно характеризуется хроническим воспалением кишечника, мальабсорбцией и продукцией аутоантител в результате употребления глютена. В дополнение к энтеропатии, глютен также может вызывать зудящую и образующую волдыри кожную сыпь, и в этом случае заболевание называют герпетиформным дерматитом. Заболевание можно успешно лечить путем устранения глютена из диеты пациентов, однако для постоянного ответа это лечение необходимо соблюдать на протяжении всей жизни.
Глютеновая болезнь вызывается употреблением глютеновой фракции пшеницы, ржи и ячменя. Глиадин представляет собой растворимую в спирте часть глютена и он содержит смесь пептидов, которые, как было показано, являются токсичными для пациентов. 33-мерный происходящий из α-глиадина пептид был идентифицирован в качестве наиболее иммуногенной части глиадина, которая устойчива к расщеплению протеазами желудка, поджелудочной железы и мембраной щеточной каемки, и может проникать через эпителий кишечника, стимулируя иммунный ответ в собственной пластинке [Shan L et al, Science. 2002; 297:2275-9]. Характерными признаками заболевания являются инфильтрация воспалительных клеток, атрофия ворсинок и гиперплазия крипт в верхнем отделе тонкого кишечника, в то время как также оно может вызывать внекишечные симптомы, такие как анемия, неврологические нарушения или заболевание кожи, называемое герпетиформным дерматитом. Заболевание, главным образом, встречается в западных популяциях, где пшеница является основным продуктом питания (Европа, США, Австралия), однако недавно оно также появилось на Среднем Востоке, в Южной Америке, Северной Африке и Азии. Это заболевание было выявлено у 1,0% финских детей школьного возраста [Maki M et al, N Engl J Med. 2003; 348(25):2517-24], у 0,75% "не имеющих риска" групп в США [Fasano A et al, Arch Intern Med. 2003; 163(3):286-92] и у 1,4% детей в возрасте 6 лет при скрининге в Венгрии [Korponay-Szabo IR et al, BMJ. 2007; 335(7632):1244-7]. Это заболевание имеет широкий диапазон различных клинических проявлений, таких как диарея, вздутие живота, анемия, снижение массы, задержка роста, кожные или неврологические симптомы, и оно может быть диагностировано в любом возрасте. В результате отсутствия надлежащего всасывания могут возникать дефициты витаминов и минералов: витамина B12, витамина K, фолиевой кислоты, железа и кальция. Многие пациенты могут иметь только мягкие симптомы и в таких случаях надлежащая диагностика часто затягивается. Глютеновая болезнь без лечения имеет тяжелые осложнения, такие как аденокарцинома (практически с двукратным риском по сравнению с общей популяцией), T-клеточная лимфома (приблизительно с пятидесятикратным риском) и остеопороз.
Современные диагностические критерии для глютеновой болезни были установлены European Society for Pediatric Gastroenterology and Nutrition и требуют гистологического обследования биоптата из верхней части тонкого кишечника (дуоденальная биопсия), указывающего на внутриэпителиальный лимфоцитоз, гиперплазию крипт и атрофию ворсинок, вместе с тем, также должен наблюдаться благоприятный ответ на диету без глютена. Также в поддержку диагноза глютеновой болезни служит, если пациент обладает определенными аутоантителами в крови, которые могут связываться с нормальными срезами тканей вдоль слоев соединительной ткани, окружающих гладкомышечные клетки (эндомизиальное антитело) или вдоль волокон ретикулина (паттерн связывания антител с R1-ретикулином) [Green PH, Cellier C, N Engl J Med. 2007; 357(17):1731-43].
Диагностика этого заболевания является в высокой степени недостаточной и только у двух из десяти пациентов это заболевание устанавливают клинически. Основным объяснением является то, что не у всех пациентов развиваются клинические проявления (молчащее заболевание) и некоторые из них могут даже иметь нормальную морфологию слизистой оболочки в течение длительного периода времени [Maki M, Collin P, Lancet. 1997; 349(9067):1755-9]. Однако они часто являются положительными по аутоантителам против ретикулина и эндомизиальной ткани с высокой плотностью внутриэпителиальных лимфоцитов или с положительным паттерном антител кишечника, подобных целиакальным. Эта подгруппа заболевания, называемая латентной или потенциальной глютеновой болезнью, является диагностической проблемой и у этих пациентов может появиться атрофия ворсинок и гиперплазия крипт в последующие годы или может развиться тяжелое - иногда необратимое - повреждение других органов (глютеновая атаксия, кардиомиопатия, сахарный диабет, гипотиреоз). Диагностика у пациентов с латентной фазой является трудной, поскольку они часто не удовлетворяют общепринятым диагностическим критериям, и требуется длительный период их наблюдения. Уровни антител могут колебаться с течением времени, и в настоящее время отсутствуют хорошие инструменты для точного предсказания того, у каких индивидуумов произойдет ухудшение в ближайшем будущем [Simell S et al, Scand J Gastroenterol. 2005; 40(10):1182-91].
Современные диагностические критерии на основе доказанного повреждения ворсинок в тонком кишечнике, таким образом, являются недостаточными и требуют переформулирования [Kaukinen K et al, Dig Dis Sci. 2001; 46:879-87]. Кроме того, биопсия тонкого кишечника является неприятной и инвазивной диагностической процедурой, и замена диагностических критериев на основе биопсии на положительность по антителам имела бы несколько практических преимуществ, а также возможность включать в диагностику индивидуумов с ранним заболеванием и своевременно формулировать показание к лечению. Потребность в менее сложных и лучше переносимых начальных диагностических инструментах давно признана. Все в большей степени применяют серологические тесты на основе детекции циркулирующих антител в крови пациентов против глиадина, ретикулина, эндомизия и трансглутаминазы 2 типа (TG2). Также они пригодны для нахождения пациентов с мягкими симптомами или атипичными клиническими проявлениями и для скрининга ближайших родственников или групп риска. Основные группы риска состоят из пациентов с сахарным диабетом, синдромом Дауна, селективным дефицитом IgA и различными аутоиммунными нарушениями, такими как аутоиммунное заболевание щитовидной железы, синдром Шегрена, красная волчанка, аутоиммунное заболевание печени, алопеция, гломерулярное заболевание и заболевание сердца, которые часто сосуществуют с глютеновой болезнью [Green PH, Cellier C, N Engl J Med. 2007; 357(17):1731-43].
Антитела против глиадина не демонстрируют достаточной чувствительности или специфичности в отношении глютеновой болезни, несмотря на это, тест на основе дезамидированных пептидов глиадина, которые структурно сходны с TG2, является относительно эффективным [Volta U et al, Dig Dis Sci. 2008; 53(6): 1582-8.; Korponay-Szabo IR et al, J Pediatr Gastroenterol Nutr. 2008; 46(3):253-61]. Мониторинг эндомизиальных IgA-антител с использованием непрямых иммунофлоресцентных анализов может обеспечить высокую точность, поскольку эти антитела являются высокоспецифическими маркерами этого заболевания. Однако оценка теста эндомизиальных антител в большой степени зависит от исследователя и требует высококвалифицированных и обученных специалистов и, таким образом, он не является широко доступным в любых медицинских условиях. Селективный дефицит IgA является распространенным признаком у пациентов с глютеновой болезнью (1 из 40 случаев), что делает очень трудным распознавание пациентов общепринятым тестом эндомизиальных антител. В этих случаях необходимо проводить детекцию IgG-класса аутоантител против TG2 [Korponay-Szabo I et al, Gut. 2003; 52(11):1567-71]. Кроме того, эндомизиальный тест не может отличать явную и латентную формы заболевания [Green PH, Cellier C, N Engl J Med. 2007; 357(17):1731-43]. Таким образом, в данной области существовала потребность в надежных и более простых для применения тестах.
Было выявлено, что TG2 (также известный как тканевая, эритроцитарная или клеточная трансглутаминаза) является главным собственным аутоантигеном и мишенью для антител против эндомизия и ретикулина при глютеновой болезни. Этот фермент является представителем суперсемейства трансглутаминаз, которые катализируют реакцию переноса ацила между γ-карбоксамидной группой глутамина и ε-аминогруппой остатка лизина - ковалентное сшивание белков - зависимым от Ca2+ образом (EC 2.3.2.13). Помимо этого, TG2 может катализировать включение аминов в белки, сайт-специфическую дезамидацию, он обладает изопептидазной активностью и участвует в трансмембранной передаче сигнала через его GTP-азную активность. TG2 может экстернализоваться из клеток, где она образует комплексы с инегринами и фибронектином, стимулирует ремоделирование и сборку внеклеточного матрикса и опосредует взаимодействия клетка-матрикс. Таким образом, TG2 участвует в заживлении ран и ангиогенезе. Этот фермент может транслоцироваться в ядро и, путем сшивания гистонов и ретинобластомных белков, он также может регулировать экспрессию генов. TG2 индуцируется и активируется в процессе апоптоза; более того, нехватка этого фермента нарушает поглощение апоптотических клеток макрофагами [Fesus L, Piacentini M, Trends Biochem Sci. 2002; 27(10):534-9].
TG2 является повсеместно распространенным ферментом, он может быть найден по всему организму внутриклеточно, а также внеклеточно. После идентификации основного аутоантигена TG2, были разработаны многочисленные твердофазные иммуноферментные анализы (ELISA) с TG2 печени морских свинок или рекомбинантной TG2 человека в качестве антигена [Schuppan D et al, 1998; WO 98/03872.; Powell M et al, 2002; WO 02/068616 A2]. Кроме того, внеклеточный матрикс, богатый TG2, продуцируемой клеточными линиями, также можно использовать в качестве антигена в диагностических тестах. Эти анализы являются менее дорогостоящими, чем тесты эндомизиальных антител, и их чувствительность и специфичность превышает 90% в случае антигена TG2 человека. Более того, была описана эффективная быстрая детекция антител с использованием природной собственной TG2 в эритроцитах образцов крови пациента [Maki M et al, 2002; WO 02/086509].
У некоторых пациентов, и, в частности, у пациентов с герпетиформным дерматитом, также были описаны антитела против гомологичного белка трансглутаминазы кожи (TG3), который также можно использовать для диагностических целей (Paulsson M. et al., 2001, WO 01/001133).
Hadjivassiliou et al. [Hadjivassiliou et al, Ann Neurol. 2008; 64:332-43] предположили, что антитела против трансглутаминазы 6 (TG6) могут служить в качестве маркера, индуцируемого глютеном аутоиммунного заболевания, в дополнение к типу лейкоцитарного антигена человека и детекции антител против глиадина и против трансглутаминазы 2, для идентификации подгруппы пациентов с чувствительностью к глютену, которые могут иметь риск развития неврологического заболевания. Они выявили, что ответ IgG и IgA на TG6 преобладает при глютеновой атаксии независимо от вовлечения кишечника.
В действительности в нескольких исследованиях на основе тестов уровня техники, основанных на TG2, описаны ложноотрицательные результаты в отношении IgA против TG2 с положительностью по IgA-антителам против эндомизия и ложноположительные результаты в отношении IgA против TG2 в отсутствие положительности по IgA против эндомизия [Wong RC et al, J Clin Pathol. 2002; 55(7):488-94]. Ложноположительные результаты по антителам против TG2 являются относительно частыми в клинических условиях [Lock RJ et al, Eur J Gastroenterol Hepatol. 2004; 16(5):467-70.; Green PH, Cellier C, N Engl J Med. 2007; 357(17):1731-43] и это значительно ограничивает применение положительности по антителам против TG2 в качестве единственного диагностического теста. В частности, пациенты с другими аутоиммунными заболеваниями, опухолями, сердечной недостаточностью, неврологическими нарушениями, псориазом и заболеваниями печени, могут обладать низкими уровнями антител, реагирующих с TG2. Это неудивительно, поскольку эти ткани содержат относительно высокие количества TG2, которая может высвобождаться при любом типе повреждения ткани, которое может индуцировать неспецифические аутоантитела против TG2, и эта положительность по антителам может не иметь отношения к глютеновой болезни.
Напротив, специфические для глютеновой болезни антитела индуцируются в ответ на глютен, возможно с помощью механизма гаптена-носителя [Sollid LM et al, Gut. 1997; 41(6):851-2], и они распознают TG2 в той форме, в какой она связана с поверхностью фибронектина в подслоях срезов мышечной ткани, используемых для детекции эндомизиальных антител с помощью иммунофлуоресценции. Однако даже тест на эндомизиальные антитела не может отличить антитела против TG2 у пациентов с глютеновой болезнью и другие антитела против TG2, экспериментально индуцированные у мышей [Korponay-Szabo IR et al, J Pediatr Gastroenterol Nutr. 2008; 46(3):253-61]. Кроме того, в попытках получить более специфические к глютеновой болезни диагностические тесты, также в качестве антигена использовали TG2 в комплексе с пептидами глиадина, но это дало менее надежные результаты, чем в случае TG2 отдельно [Rajadhyaksha M et al, WO 01/29090 A1]. Таким образом, подтверждающий иммуноанализ, по-разному распознающий антитела, направленные против целиакальных эпитопов и других TG2-эпитопов, мог бы быть исключительно важен для упрощения процесса диагностики в будущем.
Таким образом, все еще существует потребность в разработке надежного и относительно удобного диагностического способа, который является специфичным для индуцируемого глютеном аутоиммунного заболевания или предпочтительно глютеновой болезни. В частности, в данной области остается потребность в разработке диагностического анализа, который мог бы идентифицировать латентную форму заболевания, и/или который применим у детей или в случаях, когда симптомы не дают окончательного ответа. Более того, замена диагностики на основе биопсии тощей кишки также была бы желательна с точки зрения стоимости и комфорта для пациентов.
В действительности в данной области было предпринято несколько попыток идентифицировать основные эпитопы, связываемые целиакальными аутоантителами. Однако до настоящего времени такой эпитоп не был выявлен, и также неясно, существует ли только один или несколько таких эпитопов. В предшествующих исследованиях [Seissler J et al, Clin Exp Immunol. 2001; 125(2):216-21.; Sblattero D et al, Eur J Biochem. 2002; 269(21):5175-81; Nakachi K et al, J Autoimmun. 2004; 22(1):53-63], в которых использовали фрагменты TG2, было показано, что C-концевой домен может нести важные участки связывания. Однако в некоторых образцах пациентов также распознавался N-концевой или центральный домен, так что было сделано заключение, что антительный ответ может быть рассредоточенным и варьирующим, в зависимости от индивидуумов. Кроме того, было отмечено различие между молодыми пациентками с глютеновой болезнью и с другими клиническими проявлениями [Tiberti C et al, Clin Immunol. 2003; 109(3):318-24]. В другом исследовании [Byrne G et al, Gut. 2007; 56(3):336-41] в качестве основного участка связывания была предложена каталитическая триада, поскольку мутация этих трех аминокислот приводила к белку, с которым антитела пациента связывались плохо. Вновь в этом исследовании специфичность целиакальных антител классов IgA и IgG оказалась различной. Однако в этих исследованиях не учитывали трехмерную структуру белка, которая может значительно нарушаться крупными делециями, в частности делециями, влияющими на центральный домен или каталитическую триаду. Следующие исследования, проведенные с помощью фрагментов TG2, экспонированных на поверхности фагов, также показали, что конформация белка может иметь высокое значение для образования функционального участка связывания для целиакальных антител, поскольку с помощью этих способов также не было возможно идентифицировать эпитопы моноклональных антител, образовавшихся у пациентов с глютеновой болезнью [Di Niro R et al, Biochem J. 2005; 388(3):889-94].
TG2 не только является основным аутоантигеном при глютеновой болезни и, таким образом, важной молекулой-мишенью для диагностики, но также она вовлечена в патогенез заболевания. Увеличенная экспрессия и активность TG2 были выявлены в биоптатах двенадцатиперстной кишки у пациентов с глютеновой болезнью по сравнению со здоровыми донорами, и было выявлено, что пептиды глиадина являются хорошими субстратами для TG2. Согласно современной гипотизе комплексы глиадин-TG2 могут связываться со специфичными к TG2 B-клетками, где фрагменты как глиадина, так и TG2, могут быть презентированы на DQ2. Презентированные комплексы глиадин-DQ2 могут активировать глиадин-специфические T-клетки, которые могут помочь TG2-специфическим B-клеткам продуцировать антитела против TG2 посредством механизма гаптен-носитель [Sollid LM et al, Gut. 1997; 41(6):851-2]. Глютеновая болезнь традиционно считается, главным образом, опосредуемым T-клетками нарушением, при котором роль целиакальных антител является спорной.
Интересно, целиакальные антитела не блокируют сшивающую активность TG2 [Dieterich W et al, Gut. 2003; 52(11):1562-6; Roth EB et al, Clin Exp Rheumatol. 2006; 24(1): 12-8], вместо этого они могут даже усиливать процессы трансамидации и дезамидации, предположительно путем стабилизации конформации фермента [Kiraly R et al, J Autoimmun. 2006; 26(4):278-87]. Таким образом, TG2 может процессировать больше глиадина, что может усилить иммунный ответ, заканчивающийся продукцией одного или нескольких антител и далее направляющий процесс заболевания.
Предположения, существующие в данной области, что эпитоп является конформационным и в него вовлечено множество доменов, по-видимому, противоречат этим данным. Несколько направлений новых данных указывают на то, что аутоантитела против TG2 также обладают патогенной ролью при развитии заболевания. Присутствие этих антител является постоянным признаком у всех пациентов и, если они не поддаются детекции в кровотоке, эти антитела могут быть найдены депонированными в различных тканях. Была показана связь повреждения тканей со связыванием антител in vivo и было выявлено, что антитела связывались с внеклеточной TG2 in situ в поражаемых заболеванием органах, таких как тонкий кишечник, печень, мышцы, почка, головной мозг и т.д. также в отсутствие положительности по антителам в образцах сыворотки [Korponay-Szabo IR et al, Gut. 2004; 53(5):641-8]. Эти антитела являются функциональными, поскольку они могут связывать добавленную извне рекомбинантную TG2 и они появляются в тканях уже до развития атрофии ворсинок [Salmi TT et al, Gut. 2006; 55(12): 1746-53; Salmi TT et al, Aliment Pharmacol Ther. 2006; 24(3):541-52].
Кроме того, было показано, что целиакальные антитела нарушают дифференцировку эпителиальных клеток и ангиогенез в клеточных моделях [Myrsky E et al, Clin Exp Immunol. 2008; 152(1): 111-9], а также индуцируемый апоптоз через митохондриальные каскады [Cervio E et al, Gastroenterology. 2007; 133(1): 195-206]. Антитела, очищенные с помощью пептида-гомолога TG2 увеличивали проницаемость эпителиальных клеток и индуцировали активацию моноцитов [Zanoni G et al, PLoS Med. 2006; 3(9):e358].
Авторы настоящего изобретения неожиданно открыли, что можно определить локализацию основного целиакального эпитопа на трансглутаминазах, которые функционируют в качестве аутоантигенов в индуцируемых глютеном аутоиммунных заболеваниях. Неожиданно могут быть предоставлены улучшенные диагностические способы на основе сконструированных трансглутаминаз, имеющих свернутые бета-сэндвич и центральный домены, с использованием паттерна связывания целиакальных аутоантител и тем самым устраняющие ложноположительные результаты. Более того, следующий усовершенствованный диагностический способ может быть предоставлен с использованием соединений, специфично связывающихся с основным целиакальным эпитопом и способных вытеснять аутоантитела пациентов с глютеновой болезнью или быть вытесненными ими.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно первому аспекту изобретение относится к диагностическому способу для диагностики индуцируемого глютеном аутоиммунного заболевания у индивидуума, включающему стадии:
i) взятие биологического образца от индивидуума или предоставление биологического образца, взятого от индивидуума, где указанный образец содержит аутоантитела указанного индивидуума, и необязательно выделение аутоантител из указанного образца,
ii) контактирование аутоантител указанного образца с
- эталонным белком, принадлежащим семейству трансглутаминаз (белок семейства TG) и имеющим целостный основной целиакальный эпитоп,
- по меньшей мере одним тестовым белком, относящимся к семейству трансглутаминаз, в котором положение боковой цепи и/или пространственное положение по меньшей мере одного поверхностного аминокислотного остатка, являющегося частью основного целиакального эпитопа, изменены по сравнению с эталонным белком, в котором основной целиакальный эпитоп является целостным, так чтобы уровень связывания антитела, известного тем, что оно способно связываться с указанным основным целиакальным эпитопом, снижался в отношении указанного тестового белка,
где указанный по меньшей мере один поверхностный аминокислотный остаток основного целиакального эпитопа содержит или выбран из
одного или нескольких поверхностных аминокислотных остатков первой альфа-спирали центрального домена, предпочтительно поверхностный аминокислотный остаток выбран из первых четырех, трех или двух аминокислотных остатков указанной альфа-спирали, более предпочтительно первого аминокислотного остатка указанной альфа-спирали, и/или
одного или нескольких поверхностных аминокислотных остатков первой альфа-спирали бета-сэндвич-домена и одного или нескольких поверхностных аминокислотных остатков консервативного мотива HisHisThr бета-сэндвич-домена, предпочтительно поверхностного аминокислотного остатка, выбранного из последних шести, пяти, четырех или трех аминокислотных остатков указанной первой альфа-спирали бета-сэндвич-домена и аминокислотных остатков мотива HisHisThr, более предпочтительно шестого аминокислотного остатка указанной спирали и/или первой аминокислоты указанного мотива HisHisThr,
и где центральный домен имеет свернутую трехмерную структуру, предпочтительно нативную свернутую трехмерную структуру, и бета-сэндвич-домен имеет свернутую трехмерную структуру, предпочтительно нативную свернутую трехмерную структуру, предпочтительно укладка этих доменов является по существу целостной или сохранена,
iii) оценка связывающих свойств аутоантител в отношении эталонного белка и по меньшей мере одного тестового белка,
где, если связывание аутоантител с тестовым белком ухудшено по сравнению с эталонным белком, этот факт считается указывающим на индуцируемое глютеном аутоиммунное заболевание у указанного индивидуума.
Предпочтительно, когда боковая цепь изменена, изменяется геометрия боковой цепи, размер боковой цепи, функциональная группа боковой цепи или ее заряд.
Предпочтительно свойство связывания оценивают путем оценки уровня связывания или путем оценки кинетических величин или параметров связывания, например параметров ассоциации и/или диссоциации.
В предпочтительном варианте осуществления на стадии iii) диагностического способа связывание оценивают путем измерения уровня связывания аутоантител с тестовым белком и с эталонным белком, где, если уровень связывания аутоантител с эталонным белком превышает заданную пороговую величину и если уровень связывания аутоантител с тестовым белком значительно ниже, чем с эталонным белком или предпочтительно снижен по меньшей мере на заданную величину, предпочтительно по меньшей мере на 30%, более предпочтительно по меньшей мере на 40%, еще более предпочтительно по меньшей мере на 50% по сравнению с эталонным белком, этот факт считается указывающим на индуцируемое глютеном аутоиммунное заболевание у указанного индивидуума. Установка заданного порога (или предела) является стандартным процессом оптимизации и лежит в пределах квалификации специалиста в области установки условий анализа. Пригодный предел для утверждения, что связывающие молекулы, например антитела, являются реакционно-способными в отношении белка семейства TG, например эталонного белка семейства TG, может быть установлен, например, посредством рабочей характеристической кривой (ROC), полученной с помощью известных образцов от индивидуумов с глютеновой болезнью и без глютеновой болезни, как известно в данной области.
В одном варианте осуществления заданный порог установлен на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 15%, 16%, 17%, 18%, 19% или 20% от максимальной эталонной величины, например от уровня связывания 100%.
Предпочтительно, первая альфа-спираль бета-сэндвич-домена располагается от аминокислотного остатка, который находится на расстоянии восьми аминокислот в N-концевом направлении от первого His мотива HisHisThr бета-сэндвич-домена до указанного первого His мотива HisHisThr бета-сэндвич-домена. Предпочтительно, последние пять аминокислот первой альфа-спирали бета-сэндвич-домена располагаются от консервативного Asn первой альфа-спирали бета-сэндвич-домена до первого His консервативного мотива HisHisThr бета-сэндвич-домена и предпочтительно остальные шесть, пять, четыре или три аминокислотных остатков указанной спирали вычисляют соответствующим образом.
Таким образом, предпочтительно шестой аминокислотный остаток указанной спирали представляет собой вторую аминокислоту в N-концевом направлении от консервативного мотива HisHisThr бета-сэндвич-домена, или вторую аминокислоту в C-концевом направлении от консервативного Asn первой альфа-спирали b-сэндвич-домена.
Предпочтительно, шестая аминокислота первой альфа-спирали бета-сэндвич-домена представляет собой Arg19 в TG2 человека или соответствующую аминокислоту в последовательности белка семейства трансглутаминаз, имеющего свернутый бета-сэндвич-домен и свернутый центральный домен; и первый His в мотиве HisHisThr представляет собой His22 в TG2 человека или соответствующую аминокислоту в последовательности белка семейства трансглутаминаз, имеющего свернутый бета-сэндвич-домен и свернутый центральный домен.
Предпочтительно первая альфа-спираль центрального домена располагается:
- от пятой аминокислоты в N-концевом направлении от консервативного мотива GluTyrXxx (где Xxx представляет собой неполярный аминокислотный остаток, предпочтительно Val или Ile или Leu) первой альфа-спирали центрального домена, или
- от третьей аминокислоты в N-концевом направлении от консервативного Arg первой альфа-спирали центрального домена трансглутаминаз человека
- до по меньшей мере Glu или Tyr указанного мотива GluTyrXxx.
Таким образом, первый или первые два, три или четыре аминокислотных остатка первой альфа-спирали центрального домена вычисляют соответствующим образом.
Более предпочтительно, первый аминокислотный остаток указанной альфа-спирали представляет собой пятую аминокислоту в N-концевом направлении от консервативного мотива GluTyrXxx первой альфа-спирали центрального домена или третью аминокислоту в N-концевом направлении от консервативного Arg первой альфа-спирали центрального домена большинства трансглутаминаз человека.
В предпочтительном варианте осуществления пространственное положение или геометрия боковой цепи
a) по меньшей мере поверхностного аминокислотного остатка первой альфа-спирали центрального домена, предпочтительно поверхностного аминокислотного остатка, выбранного из первых четырех, трех или двух аминокислотных остатков указанной альфа-спирали, более предпочтительно первого аминокислотного остатка указанной альфа-спирали, и
b) по меньшей мере поверхностного аминокислотного остатка первой альфа-спирали бета-сэндвич-домена и консервативного мотива HisHisThr бета-сэндвич-домена, предпочтительно поверхностного аминокислотного остатка, выбранного из последних шести, пяти, четырех или трех аминокислотных остатков и мотива HisHisThr, более предпочтительно шестого аминокислотного остатка в указанной спирали,
изменены друг относительно друга.
В следующем варианте осуществления в часть белка семейства трансглутаминаз вносят мутацию, которая приводит к вытеснению или измененному пространственному положению любой из аминокислот, определенных в настоящем документе в качестве аминокислоты, являющейся частью основного целиакального эпитопа или SSE, несущего указанный белок. В определенных вариантах осуществления более крупные части альфа-спиралей вытесняются, например альфа-спирали прерываются или поворачиваются.
В диагностическом способе по настоящему изобретению предпочтительно
первый аминокислотный остаток указанной первой альфа-спирали центрального домена представляет собой аминокислотный остаток, соответствующий или эквивалентный Glu153, пронумерованному в соответствии с нумерацией аминокислот полноразмерной TG2 человека на основе выравнивания аминокислотных последовательностей, и/или
шестой аминокислотный остаток(остатки) указанной первой альфа-спирали бета-сэндвич-домена представляет собой аминокислотный остаток, соответствующий или эквивалентный Arg19, пронумерованному согласно нумерации аминокислот полноразмерной TG2 человека на основе выравнивания аминокислотных последовательностей, и/или
первую аминокислоту мотива HisHisThr, причем указанная первая альфа-спираль бета-сэндвич-домена представляет собой аминокислотный остаток, соответствующий или эквивалентный His22, пронумерованному согласно нумерации аминокислот в полноразмерной TG2 человека на основе выравнивания аминокислотных последовательностей.
В предпочтительном варианте осуществления диагностического способа в соответствии с настоящим изобретением в указанном тестовом белке семейства TG изменены боковая цепь или пространственное положение по меньшей мере одной дополнительной аминокислоты, например одна или несколько дополнительных аминокислот подвергнуты мутации, по сравнению с эталонным белком, в которым основной целиакальный эпитоп является целостным, где предпочтительно указанная дополнительная аминокислота выбрана из группы из аминокислотных остатков, соответствующих или эквивалентных Arg151, Glu153, Glu154, Arg156, Arg19, His22, Val431, Arg433, Glu435, Met659, Leu661, пронумерованным согласно нумерации аминокислот полноразмерной TG2 человека на основе множественного выравнивания последовательностей, и где предпочтительно указанное изменение влияет на связывание целиакального антитела.
В следующем предпочтительном варианте осуществления пространственное положение любого из следующих аминокислотных остатков изменено вследствие изменения одной или нескольких дополнительных аминокислот по сравнению с эталонным белком: поверхностный аминокислотный остаток, выбранный из первых четырех, трех или двух аминокислотных остатков указанной альфа-спирали, более предпочтительно первый аминокислотный остаток указанной альфа-спирали, и/или поверхностный аминокислотный остаток, выбранный из последних шести, пяти, четырех или трех аминокислотных остатков указанной первой альфа-спирали бета-сэндвич-домена и аминокислотных остатков мотива HisHisThr, более предпочтительно шестого аминокислотного остатка указанной спирали и/или первой аминокислоты указанного мотива HisHisThr.
В предпочтительном варианте этого варианта осуществления указанное дополнительное изменение представляет собой мутацию по сравнению с эталонным белком в одном или нескольких аминокислотных остатках, выбранных из группы аминокислотных остатков, соответствующих или эквивалентных следующим аминокислотам полноразмерной TG2 человека на основе множественного выравнивания последовательностей: Glu158, Tyr160, Val161, His23, Thr24, или изменение N-концевой части бета-сэндвич-домена, например делецию или замену по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, аминокислотных остатков, вычисленных от шестого остатка первой альфа-спирали бета-сэндвич-домена.
Предпочтительно, тестовый белок представляет собой мутантную TG2 и изменение указанных одной или нескольких аминокислот представляет собой мутацию, выбранную из следующей группы:
мутация Glu153, например E153S, E153T, E153Y, E153K, E153R, E153Q, E153N;
Arg19, например R19S, R19K, R19Q;
Glu154, например E154S, E154T, E154Y, E154K, E154R, E154Q, E154N;
Glu158, например E158S, E158Q, E158L;
His22, например H22S;
и в качестве дополнительных мутаций: Ala24, Arg151, Arg156, Val431, Val432, Arg433, Glu435, Met659, Leu661.
Квалифицированному специалисту понятно, что если эффект мутации или изменения в боковой цепи является небольшим, например если вносят консервативную замену, может быть целесообразным наличие более одного мутантного аминокислотного остатка.
В следующем варианте осуществления настоящего изобретения аутоантитела или панель аутоантител выделяют перед контактированием их с тестовым белком и, если желательно, с эталонным белком.
В следующем аспекте изобретение относится к диагностическому набору для диагностики индуцируемого глютеном аутоиммунного заболевания у индивидуума, включающему
a) тестовый белок, принадлежащий к семейству трансглутаминаз, в котором боковая цепь и/или пространственное положение по меньшей мере одного поверхностного аминокислотного остатка, являющегося частью основного целиакального эпитопа, изменены по сравнению с эталонным белком, в котором основной целиакальный эпитоп является целостным,
где указанный по меньшей мере один поверхностный аминокислотный остаток основного целиакального эпитопа содержит или выбран из
поверхностного аминокислотного остатка первой альфа-спирали центрального домена, предпочтительно поверхностного аминокислотного остатка, выбранного из первых четырех, трех или двух аминокислотных остатков указанной альфа-спирали, более предпочтительно первого аминокислотного остатка указанной альфа-спирали, и/или
поверхностного аминокислотного остатка первой альфа-спирали бета-сэндвич-домена и поверхностного аминокислотного остатка консервативного мотива HisHisThr бета-сэндвич-домена, предпочтительно поверхностного аминокислотного остатка, выбранного из последних шести, пяти, четырех или трех аминокислотных остатков указанной первой альфа-спирали бета-сэндвич-домена и аминокислотных остатков мотива HisHisThr, более предпочтительно шестого аминокислотного остатка указанной спирали и/или первой аминокислоты указанного мотива HisHisThr,
и где центральный домен имеет свернутую трехмерную структуру, предпочтительно нативную свернутую трехмерную структуру, и
b) эталонный белок, принадлежащий семейству трансглутаминаз, причем указанный белок имеет целостный основной целиакальный эпитоп, или по меньшей мере носитель, содержащий инструкции по предоставлению и применению указанного эталонного белка, относящегося к семейству трансглутаминаз;
и необязательно
средства для взятия биологического образца от индивидуума, где указанный образец содержит аутоантитела указанного индивидуума, и/или
средства для выделения аутоантител из указанного образца, и/или
средства для оценки уровня связывания и/или кинетики аутоантител в отношении белков белки.
В диагностическом наборе по изобретению можно использовать любой тестовый белок и/или эталонный белок, как определено в настоящем документе.
В предпочтительном варианте осуществления
a) тестовый белок представляет собой мутантную трансглутаминазу (TG), предпочтительно мутантную TG2, TG3 или TG6, и
b) эталонный белок представляет собой TG дикого типа, предпочтительно TG2, TG3 или TG6 дикого типа.
В предпочтительном варианте осуществления средства для оценки уровня связывания включают планшет, например микропланшет для титрования, имеющий лунки, в которых первая часть лунок покрыта эталонным белком, а вторая часть лунок покрыта по меньшей мере одним тестовым белком.
В одном варианте осуществления лунки планшета также покрыты фибронектином.
В следующем аспекте изобретение относится к диагностическому способу для диагностики индуцируемого глютеном аутоиммунного заболевания у индивидуума, включающему стадии:
i) взятие биологического образца или предоставление биологического образца, взятого от указанного индив