Фармацевтические композиции лигандов рецепторов меланокортинов
Иллюстрации
Показать всеНастоящее изобретение относится к фармацевтической композиции, содержащей памоатную соль Ac-Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2, которая является лигандом рецептора меланокортина подтипа 4 (MC4-R) и в которой, после подкожного или внутримышечного введения субъекту, пептид образует депо с физиологическим значением pH, которое медленно растворяется и высвобождается в жидкость организма и кровоток. Также настоящее изобретение содержит полиэтиленгликоль (PEG) со средней молекулярной массой от приблизительно 200 до приблизительно 400. Настоящее изобретение обладает высокой эффективностью, ассоциированной с ровным профилем высвобождения. 23 з.п. ф-лы, 12 ил., 6 табл., 1 пр.
Реферат
ОПИСАНИЕ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Настоящее изобретение относится к улучшениям в композициях, содержащих пептиды, которые являются лигандами одного или более рецепторов меланокортинов (MC-R), или их фармацевтически приемлемые соли, способам получения таких композиций и способу применения таких композиций для лечения млекопитающих. В частном случае настоящее изобретение относится к фармацевтической композиции, содержащей памоатную соль Ac-Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2, которая является лигандом рецептора меланокортина подтипа 4 (MC4-R) и в которой, после подкожного или внутримышечного введения субъекту, пептид образует депо с физиологическим значением pH, которое медленно растворяется и высвобождается в жидкость организма и кровоток. Кроме того, настоящее изобретение может содержать органический компонент, такой как диметилацетамид (DMA) или полиэтиленгликоль (PEG), со средней молекулярной массой ниже чем 1000.
Меланокортины представляют собой семейство регуляторных пептидов, которые образуются путем посттрансляционной обработки про-гормона про-опиомеланокортина (РОМС; длиной 131 аминокислота). РОМС обрабатывается в 3 класса гормонов: меланокортины, адренокортикотропный гормон и различные эндорфины (например, липотропин) (Cone, et al., Recent Prog. Horm. Res., 51:287-317, (1996); Cone et al., Ann. N.Y. Acad. Sci., 31:342-363, (1993)).
Меланокортины были обнаружены в широком разнообразии нормальных человеческих тканей, включая мозг, надпочечники, кожу, семенники, селезенку, почки, яичники, легкие, щитовидную железу, печень, толстую кишку, тонкую кишку и поджелудочную железу (Tatro, J. B. et al., Endocrinol. 121:1900-1907 (1987); Mountjoy, K. G. et al., Science 257:1248-1251 (1992); Chhajlani, V. et al., FEBS Lett. 309:417-420 (1992); Gantz, I. et al. J. Biol. Chem. 268:8246-8250 (1993) и Gantz, I. et al., J. Biol. Chem. 268:15174-15179 (1993)).
Было показано, что пептиды меланокортинов проявляют широкое разнообразие видов физиологической активности, включая регуляцию поведения и памяти, с воздействием на нейротропные и антипиретические свойства, а также с воздействием на модуляцию иммунной системы. Было также показано, что меланокортины, кроме их хорошо известных воздействий на функции коры надпочечников (адернокортикотропный гормон или “АКТГ”) и на меланоциты (меланоцит-стимулирующий гормон или “МСГ”), регулируют сердечно-сосудистую систему, анальгезию, терморегуляцию и высвобождение других нейрогуморальных агентов, включая пролактин, лютеинизирующий гормон и биогенные амины (De Wied, D. et al., Methods Achiev. Exp. Pathol. 15:167-199 (1991); De Wied, D. et al., Physiol. Rev. 62:977-1059 (1982); Guber, K.A. et al., Am. J. Physiol. 257:R681-R694 (1989); Walker J.M. et al., Science 210:1247-1249 (1980); Murphy, M. T. et al., Science 221:192-193 (1983); Ellerkmann, E. et al., Endocrinol. 130:133-138 (1992) и Versteeg, D. H. G. et al., Life Sci. 38:835-840 (1986)).
Было также показано, что участки связывания меланокортинов распределены во многих различных типах тканей, включая слезные и подчелюстные железы, поджелудочную железу, жировую ткань, мочевой пузырь, двенадцатиперстную кишку, селезенку, мозг и ткани половых желез, а также в злокачественных меланомных опухолях. К настоящему времени охарактеризованы 5 рецепторов меланокортинов (MC-R). Они включают меланоцит-специфический рецептор (MC1-R), специфичный для коры надпочечников рецептор АКТГ (MC2-R), рецептор меланокортина-3 (MC3-R), меланокортина-4 (MC4-R) и меланокортина-5 (MC5-R). Все рецепторы меланокортина реагируют на класс пептидных гормонов, стимулирующих мелоноциты (MSH) (Cone, R. D. et al., Ann. N.Y. Acad. Sci., 680:342-363 (1993); Cone, R. D. et al., Recent Prog. Horm. Res., 51:287-318 (1996)). MC1-R, известный в данной области как рецептор гормона, стимулирующего меланоциты (MSH-R), рецептор меланотропина или рецептор меланокортина-1, представляет собой трансмембранный белок из 315 аминокислот, относящийся к семейству рецепторов, связанных с G-белком. MC1-R представляет собой рецептор и для MSH, и для АКТГ. Активность MC1-R опосредована G-белками, которые активируют аденилатциклазу. Рецепторы MC1-R обнаруживаются в меланоцитах и ткани коры надпочечников, а также в различных других тканях, таких как надпочечники, лейкоциты, легкие, лимфоузлы, яичники, семенники, гипофиз, плацента, селезенка и матка. MC2-R, также называемый рецептором адренокортикотропного гормона (ACTH-R), представляет собой трансмембранный белок из 297 аминокислот, обнаруживаемый в меланоцитах и ткани коры надпочечников. MC2-R опосредует кортикотропный эффект АКТГ. У людей MC3-R представляет собой белок из 360 аминокислот, обнаруживаемый в мозговой ткани; у мышей и крыс MC3-R представляет собой белок из 323 аминокислот. MC4-R представляет собой трансмембранный белок из 332 аминокислот, который также экспрессирован в мозге, а также в тканях плаценты и кишечника. MC5-R представляет собой трансмембранный белок из 325 аминокислот, экспрессированный в надпочечниках, желудке, легких и селезенке и на очень низких уровнях в мозге. MC5-R также экспрессирован в трех слоях коры надпочечников, преимущественно в клетках гломерулезной зоны, продуцирующих альдостерон.
Однако пять известных рецепторов меланокортина различаются по своим функциям. Например, MC1-R представляет собой G-белок, который регулирует пигментацию в ответ на α-MSH, мощный агонист MC1-R. Агонизм рецептора MC1-R приводит к стимуляции меланоцитов, что вызывает образование эумеланина и увеличивает риск рака кожи. Агонизм MC1-R может также оказывать неврологические эффекты. Стимуляция активности MC2-R может привести к карциноме ткани надпочечников. Недавнее фармакологическое подтверждение установило, что центральные рецепторы MC4-R представляют собой первичные медиаторы анорексических и орексигенических воздействий, о которых сообщалось в отношении соответственно агонистов и антагонистов меланокортина. Эффекты агонизма MC3-R и MC5-R еще не известны.
Проявлялся большой интерес к рецепторам меланокортина (MC-R) как мишеням для разработки новых терапевтических средств для лечения расстройств массы тела, таких как ожирение и кахексия. И генетические, и фармакологические доказательства указывают на центральные рецепторы MC4-R как основную мишень (Giraudo, S. Q. et al., Brain Res., 809:302-306 (1998); Farooqi, I. S. et al., NE J Med., 348:1085-1095 (2003); MacNeil, D. J. et al., Eu. J. Pharm., 44:141-157 (2002); MacNeil, D. J. et al., Eu. J. Pharm., 450:93-109 (2002); Kask, A. et al., NeuroReport, 10:707-711 (1999)). Современные достижения в разработке селективных в отношении рецепторов агонистов и антагонистов свидетельствуют о терапевтическом потенциале активации рецепторов меланокортина, в частности MC4-R.
Агонистические, антагонистические или другие лигандные соединения, активирующие один или более рецептор меланокортина, могли бы использоваться для лечения широкого разнообразия показаний у субъекта, нуждающегося в них, или с риском их развития, включая острые и хронические воспалительные заболевания, такие как общее воспаление (U.S. Patent No.6613874; Catania, A. et al., Pharm. Rev., 56:1-29 (2004)), воспалительное заболевание кишечника (U.S. Patent No.6713487; Catania, A. et al., Pharm. Rev., 56:1-29 (2004)), воспаление мозга (Catania, A. et al., Pharm. Rev., 56:1-29 (2004)), сепсис (U.S. Patent No.6613874; U.S. Patent No.6713487; Catania, A. et al., Pharm. Rev., 56:1-29 (2004)) и септический шок (U.S. Patent No.6613874; Catania, A. et al., Pharm. Rev., 56:1-29 (2004)); заболевания с аутоиммунным компонентом, такие как ревматоидный артрит (U.S. Patent No.6713487; Catania, A. et al., Pharm. Rev., 56:1-29 (2004)), подагрический артрит (Catania, A. et al., Pharm. Rev., 56:1-29 (2004), Getting, S. J. et al., Curr. Opin. Investig. Drugs, 2:1064-1069 (2001)) и рассеянный склероз (U.S.Patent No.6713487); метаболические заболевания и медицинские состояния, сопровождающиеся прибавкой массы тела, такие как ожирение (U.S. Patent No.6613874; U.S. Patent No.6600015; Fehm, H. L. et al., J. Clin. Endo. & Metab., 86:1144-1148 (2001); Hansen, M. J. et al., Brain Res., 1039:137-145 (2005); Ye, Z. et al., Peptides, 26:2017-2025 (2005); Farooqi, I. S. et al., NE J Med., 348:1085-1095 (2003); MacNeil, D. J. et al., Eu. J. Pharm., 44:141-157 (2002); MacNeil, D. J. et al., Eu. J. Pharm., 450:93-109 (2002); Kask, A. et al., NeuroReport, 10:707-711 (1999); Schwartz, A. W., J. Clin. Invest., 108:963-964 (2001), Gura, Т., Science, 287:1738-1740 (2000), Raffin-Sanson, M. L., Eu. J. Endo., 144:207-208 (2001), Hamilton, В. S. et al., Obesity Res. 10:182-187 (2002)), расстройства питания (U.S. Patent No.6720324; Fehm, H. L. et al., J. Clin. Endo. & Metab., 86:1144-1148 (2001); Pontillo, J. et al., Bioorganic & Med. Chem. Ltrs., 15:2541-2546 (2005)) и синдром Prader-Willi (GE, Y. et al., Brain Research, 957:42-45 (2002)); метаболические заболевания и медицинские состояния, сопровождающиеся потерей массы тела, такие как анорексия (U.S. Patent No.6613874; Wisse, B.R. et al., Endo., 142:3292-3301 (2001)), булимия (U.S. Patent No.6720324), истощение при СПИДе (Marsilje, Т. H. et al., Bioorg. Med. Chem. Lett., 14:3721-3725 (2004); Markison, S. et al., Endocrinology, 146:2766-2773 (2005)), кахексия (U.S. Patent No.6613874; Lechan, R. M. et al., Endo., 142:3288-3291 (2001); Pontillo, J. et al., Bioorganic & Med. Chem. Ltrs., 15:2541-2546 (2005)), раковая кахексия (U.S. Patent No.6639123) и алиментарная дистрофия у истощенных пожилых лиц (U.S. Patent No.6639123); диабет (U.S. Patent No.6713487) и связанные с диабетом состояния и осложнения диабета, такие как ретинопатия (U.S. Patent No.6525019); неопластическая пролиферация (U.S. Patent No.6713487), такая как рак кожи (Sturm, R.A., Melanoma Res., 12:405-416 (2002); Bastiens, M. T. et al., Am. J. Hum. Genet., 68:884-894 (2001)) и рак предстательной железы (Luscombe, C.J. et al., British J. Cancer, 85:1504-1509 (2001); репродуктивные или половые медицинские состояния, такие как эндометриоз (U.S. Patent No.6713487) и маточное кровотечение у женщин (U.S. Patent No.6613874), половая дисфункция (U.S. Patent No.6720324; Van der Ploeg, L. H. T. et al., PNAS, 99:11381-11386 (2002), Molinoff, P. B. et al., Ann. N.Y. Acad. Sci., 994:96-102 (2003), Hopps, С. V. et al., BJU International, 92:534-538 (2003)), эректильная дисфункция (U.S. Patent No.6613874; Diamond, L. E. et al., Urology, 5:755-759 (2005), Wessells, H. et al., Int. J. Impotence Res., 12:S74-S79 (2000), Andersson, K-E. et al., Int. J. Impotence Res., 14:S82-S92 (2002), Bertolini, A. et. al., Sexual Behavior: Pharmacology and Biochemistry, Raven Press, NY, p 247-257 (1975); Wessells, H. et al, Neuroscience, 118:755-762 (2003), Wessells, H. et al., Urology, 56:641-646 (2000), Shadiack, A. M. et al., Society for Neuroscience Abstract, (2003); Wessells, H. et al., J. Urology, 160:389-393 (1998), Rosen, R. С et al., Int. J. Impotence Res., 16:135-142 (2004), Wessells, H. et al., Peptides, 26:1972-1977 (2005)) и сниженная сексуальная реакция у женщин (U.S. Patent No.6713487; Fourcroy, J.L., Drugs, 63:1445-1457 (2003)); заболевания или состояния, возникающие в результате лечения или повреждающего воздействия на организм, такого как отторжение органного трансплантата (U.S. Patent No.6713487; Catania, A. et al., Pharm. Rev., 56:1-29 (2004)), ишемическое и реперфузионное повреждение (Mioni, C. et al., Eu. J. Pharm. 477:227-234 (2003); Catania, A. et al., Pharm. Rev., 56:1-29 (2004)), лечение травм спинного мозга и для ускорения заживления ран (Sharma H. S. et al., Acta. Nerochir. Suppl., 86:399-405 (2003); Sharma H. S., Ann. N.Y. Acad. Sci. 1053: 407-421 (2005); U.S. Patent No.6525019), а также потеря массы тела, вызванная химиотерапией, лучевой терапией, временной или постоянной иммобилизацией (Harris, R. B. et al., Physiol. Behav., 73:599-608 (2001)) или диализом; сердечно-сосудистые заболевания или состояния, такие как геморрагической шок (Catania, A. et al., Pharm. Rev., 56:1-29 (2004)), кардиогенный шок (U.S. Patent No.6613874), гиповолемический шок (U.S. Patent No.6613874), сердечно-сосудистые расстройства (U.S. Patent No.6613874) и сердечная кахексия (Markison, S. et al., Endocrinology, 146:2766-2773 (2005); легочные заболевания или состояния, такие как острый респираторный дистресс-синдром (U.S. Patent No.6350430; Catania, A. et al., Pharm. Rev., 56:1-29 (2004)), хроническое обструктивное легочное заболевание (U.S. Patent No.6713487), астма (U.S. Patent No.6713487) и пневмофиброз; для усиления иммунной толерантности (Luger, T. A. et al., Pathobiology, 67:319-321 (1999)) и для борьбы с атаками на иммунную систему, такими как воздействия, связанные с определенными видами аллергии (U.S. Patent No.6713487) или отторжением органных трансплантатов (U.S. Patent No.6713487; Catania, A. et al., Pharm. Rev., 56:1-29 (2004)), лечение дерматологических заболеваний и состояний, таких как псориаз (U.S. Patent No.6713487), истощение пигментации кожи (U.S. Patent No.6713487; Ye, Z. et al., Peptides, 26:2017-2025 (2005), угри (Hatta, N. et al., J. Invest. Dermatol., 116:564-570 (2001); Bohm, M. et al., J. Invest. Dermatol., 118:533-539 (2002)), образование келоидов (U.S. Patent No.6525019) и рак кожи (Sturm, R.A., Melanoma Res., 12:405-416 (2002); Bastiens, M. T. et al., Am. J. Hum. Genet., 68:884-894 (2001)); поведенческие расстройства и состояния и расстройства центральной нервной системы, такие как тревога (U.S. Patent No.6720324; Pontillo, J. et al., Bioorganic & Med. Chem. Ltrs., 15:2541-2546 (2005)), депрессия (Chaki, S. et al., Peptides, 26:1952-1964 (2005), Bednarek, M. A. et al., Expert Opinion Ther. Patents, 14:327-336 (2004); U.S. Patent No.6720324), расстройства и дисфункция памяти (U.S. Patent No.6613874; Voisey, J. et al., Curr. Drug Targets, 4:586-597 (2003)), модуляция восприятия боли (U.S. Patent No.6613874; Bertolini, A. et al., J. Endocrinol. Invest, 4:241-251 (1981); Vrinten, D. et al., J. Neuroscience, 20:8131-8137 (2000)) и лечение нейропатической боли (Pontillo, J. Et al., Bioorganic & Med. Chem. Ltrs., 15:2541-2546 (2005)); состояния и заболевания, связанные с употреблением алкоголя, злоупотреблением алкоголем и/или алкоголизмом (WO 05/060985; Navarro, M. et al., Alcohol Clin. Exp. Res., 29:949-957 (2005)); и почечные состояния или заболевания, такие как лечение почечной кахексии (Markison, S. Et al., Endocrinology, 146:2766-2773 (2005) или натриурез (U.S. Patent No.6613874).
Лигандные соединения, активирующие один или более рецептор меланокортина, были бы полезны для модулирования широкого разнообразия нормализующей или гомеостатической активности у нуждающегося в них субъекта, что включает высвобождение тироксина (U.S. Patent No.6613874), синтез и высвобождение альдостерона (U.S. Patent No.6613874), температуру тела (U.S. Patent No.6613874), артериальное давление (U.S. Patent No.6613874), частоту сердечных сокращений (U.S. Patent No.6613874), сосудистый тонус (U.S. Patent No.6613874), мозговой кровоток (U.S. Patent No.6613874), уровни глюкозы в крови (U.S. Patent No.6613874), костный метаболизм, образование или развитие костной ткани (Dumont, L. M. et al., Peptides, 26:1929-1935 (2005), массу яичников (U.S. Patent No.6613874), развитие плаценты (U.S. Patent No.6613874), секрецию пролактина и фолликулостимулирующего гормона (ФСГ) (U.S. Patent No.6613874), внутриматочный рост плода (U.S. Patent No.6613874), роды (U.S. Patent No.6613874), сперматогенез (U.S. Patent No.6613874), секрецию сала и феромонов (U.S. Patent No.6613874), нейропротекцию (U.S. Patent No.6639123) и рост нервов (U.S. Patent No.6613874), а также модуляцию мотивации (U.S. Patent No.6613874), обучение (U.S. Patent No.6613874) и другие виды поведения (U.S. Patent No.6613874).
Существует потребность в улучшенных составах композиций, содержащих пептиды, которые представляют собой лиганды одного или более рецепторов меланокортина, в частном случае, лиганды, которые выборочно связаны с MC4-R и которые обеспечивают приемлемый профиль замедленного высвобождения с улучшенными фармококинетическими параметрами после однократной подкожной инъекции. Идеально, такие улучшенные препараты с замедленным высвобождением, включают новые пептиды, которые действуют как лиганды одного или более рецепторов меланокортинов, как раскрыто в предшествующих международных публикациях заявителя WO2007/008704, WO2008/147556 и WO2008/156677. Более того, среди других терапевтических эффектов препаратов настоящего изобретения присутствуют ослабленные побочные эффекты и улучшенная эффективность, ассоциированная с более ровным профилем высвобождения. Кроме того, в настоящем изобретении предложен раствор, который может быть или не быть прозрачным раствором, лишенным вспомогательных веществ, упрощающим, таким образом, производственный процесс.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Заявители настоящего изобретения сделали удивительное открытие, что препарат фармацевтической композиции, содержащий памоатную соль пептида, который действует как лиганд одного или более рецепторов меланокортина, демонстрирует идеальную растворимость для медленного высвобождения in vivo. Особенно предпочтительным является то, что следующий пептид, на который ссылаются далее в тексте патентной заявки, как на «Пример 1»: Ac-Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2, лиганд рецептора меланокортина подтипа 4, в котором после подкожного или внутримышечного введения субъекту пептид образует депо с физиологическим значением pH, которое медленно растворяется и высвобождается в жидкость организма и кровоток, тем самым приводит к ослабленным побочным эффектам и улучшенной эффективности.
Изобретение можно кратко изложить в следующих параграфах, а также в формуле изобретения.
(1) В одном аспекте, настоящее изобретение указывает на фармацевтическую композицию раствора, геля или полутвердого вещества, или суспензии, содержащую пептид, который действует как лиганд одного или более рецепторов меланокортина, или его фармацевтически приемлемую соль, в которой пептид образует депо после подкожного или внутримышечного введения субъекту.
(2) Фармацевтическая композиция, соответствующая параграфу 1, в которой вышеуказанный пептид в вышеуказанном растворе образует депо на месте инъекции после введения, которое медленно растворяется и высвобождается в жидкость организма и кровоток, и в которой вышеуказанный раствор представляет собой полностью водный раствор, полностью органический раствор, водный раствор, имеющий органический компонент, водный раствор, имеющий неорганический компонент, или водный раствор, имеющий как органический, так и неорганический компоненты.
(3) Фармацевтическая композиция, соответствующая параграфу 1 или параграфу 2, в которой вышеуказанный пептид представляет собой Пример 1, то есть Ac-Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2.
(4) Фармацевтическая композиция, соответствующая любому из предыдущих параграфов, в которой вышеуказанный пептид представлен в форме памоатной соли.
(5) Фармацевтическая композиция, соответствующая любому из предыдущих параграфов, дополнительно включающая в себя органический компонент, который увеличивает растворимость вышеуказанного пептида в водном растворе или уменьшает плотность геля или полутвердого вещества.
(6) Фармацевтическая композиция, соответствующая параграфу 5, в которой вышеуказанный органический компонент представляет собой органический полимер, спирт, ДМСО, ДМФ или ДМА.
(7) Фармацевтическая композиция, соответствующая параграфу 6, в которой вышеуказанный органический полимер представляет собой PEG.
(8) Фармацевтическая композиция, соответствующая параграфу 7, в которой вышеуказанный PEG имеет среднемолекулярную массу приблизительно от 200 до 10000.
(9) Фармацевтическая композиция, соответствующая параграфу 8, в которой вышеуказанный пептид растворяли в водном растворе PEG200 или PEG400, в котором соотношение объемов PEG и воды составляет приблизительно от 1:99 до 99:1.
(10) Фармацевтическая композиция, соответствующая параграфу 9, в которой вышеуказанный пептид растворяли в водном растворе PEG200 или PEG400, в котором соотношение объемов PEG и воды составляет приблизительно от 1:9 до 9:1.
(11) Фармацевтическая композиция, соответствующая параграфу 6, в которой вышеуказанный спирт представляет собой этанол или изопропиловый спирт.
(12) Фармацевтическая композиция, соответствующая любому из предыдущих параграфов, в которой концентрация (масса/объем) вышеуказанного пептида составляет приблизительно 0,1 мг/мл - 600 мг/мл.
(13) Фармацевтическая композиция, соответствующая любому из предыдущих параграфов, в которой pH вышеуказанной композиции имеет значение приблизительно от 3,0 до 8,0.
(14) Фармацевтическая композиция, соответствующая параграфу 13, в которой вышеуказанную памоатную соль Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2 растворяли в PEG400/водном растворе, в котором соотношение объемов PEG400 и воды было приблизительно 1:1 и в котором концентрация (масса/объем) пептида составляет приблизительно 200 мг/мл.
(15) Фармацевтическая композиция, соответствующая параграфу 13, в которой вышеуказанную памоатную соль Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2 растворяли в PEG200/водном растворе, в котором соотношение объемов PEG200 и воды было приблизительно 1:1 и в котором концентрация (масса/объем) пептида составляет приблизительно 200 мг/мл.
(16) Фармацевтическая композиция, соответствующая параграфу 13, в которой вышеуказанную памоатную соль Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2 растворяли в PEG400/PBS растворе, в котором соотношение объемов PEG400 и PBS было приблизительно 1:1 и в котором концентрация (масса/объем) пептида составляет приблизительно 300 мг/мл.
(17) Фармацевтическая композиция, соответствующая параграфу 13, в которой вышеуказанную памоатную соль Ac-Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2 растворяли в PEG400/солевом растворе, в котором соотношение объемов PEG400 и солевого раствора было приблизительно 1:1 и в котором концентрация (масса/объем) пептида составляет приблизительно 300 мг/мл.
(18) Фармацевтическая композиция, соответствующая любому из предыдущих параграфов, дополнительно включающая в себя консервирующее вещество.
(19) Фармацевтическая композиция, соответствующая параграфу 18, в которой вышеуказанное консервирующее вещество выбирали из группы, состоящей из m-крезола, фенола, бензилового спирта и метилпарабена.
(20) Фармацевтическая композиция, соответствующая параграфу 19, в которой вышеуказанное консервирующее вещество присутствует в концентрации приблизительно от 0,01 мг/мл до 100 мг/мл.
(21) Фармацевтическая композиция, соответствующая любому из предыдущих параграфов, дополнительно включающая в себя изотонический агент.
(22) Фармацевтическая композиция, соответствующая параграфу 21, в которой вышеуказанный изотонический агент присутствует в концентрации приблизительно от 0,01 мг/мл до 100 мг/мл.
(23) Фармацевтическая композиция, соответствующая любому из предыдущих параграфов, дополнительно включающая в себя стабилизатор.
(24) Фармацевтическая композиция, соответствующая параграфу 23, в которой вышеуказанный стабилизатор выбирали из группы, состоящей из имидазола, аргинина и гистидина.
(25) Фармацевтическая композиция, соответствующая любому из предыдущих параграфов, дополнительно включающая в себя поверхностно-активное вещество.
(26) Фармацевтическая композиция, соответствующая любому из предыдущих параграфов, дополнительно включающая в себя хелатообразующий агент.
(27) Фармацевтическая композиция, соответствующая любому из предыдущих параграфов, дополнительно включающая в себя буфер.
(28) Фармацевтическая композиция, соответствующая параграфу 27, в которой вышеуказанный буфер выбирали из группы, состоящей из Tris, ацетата аммония, ацетата натрия, глицина, аспарагиновой кислоты и Bis-Tris.
(29) Фармацевтическая композиция, соответствующая любому из предыдущих параграфов, дополнительно включающая в себя двухвалентный металл.
(30) Фармацевтическая композиция, соответствующая параграфу 29, в которой вышеуказанный двухвалентный металл представляет собой цинк.
(31) Фармацевтическая композиция, соответствующая любому из предыдущих параграфов, в которой вышеуказанный раствор представляет собой прозрачный раствор.
Хотя предпочтительный вариант осуществления настоящего изобретения приводится в Примере 1, то есть Ac-Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2, который представляет собой лиганд MCR-R, настоящее изобретение никаким образом не ограничено Примером 1. Пептиды настоящего изобретения включают, например, все те пептиды, которые действуют как лиганды для одного или более рецепторов меланокортина, как раскрыто в ряде предшествующих международных публикаций заявителей, опубликованных как WO2007/008704, WO2008/147556 и WO2008/156677. Эти публикации введены в данную патентную заявку путем ссылки в том же объеме, как если бы раскрытие каждой независимой публикации было подробно представлено в данной патентной заявке.
Следующие соединения из этих публикаций можно также успешно использовать для образования фармацевтических композиций настоящего изобретения:
Пример 2: Ac-D-Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2;
Пример 3: Ac-Tyr-Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2;
Пример 4: Ac-Tyr-D-Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2; и
Пример 5: гидантоин(Arg-Gly)-цикло(Cys-Glu-His-D-Phe-Arg-Trp-Cys)-NH2.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
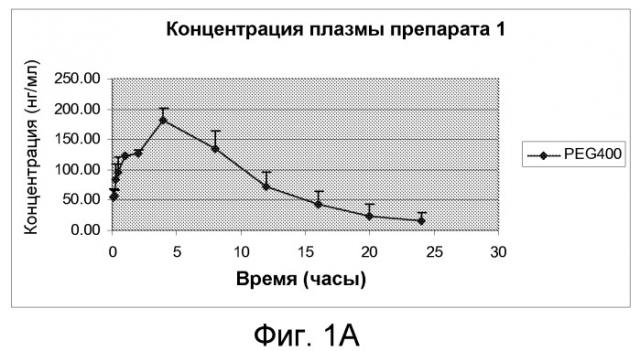
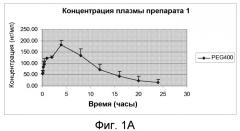
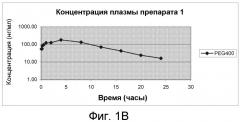
На Фиг.1А и Фиг.1В изображены графики фармакокинетических профилей полного курса (срединные значения), полученные после однократного подкожного введения крысам линии Спраг-Доули, состава, содержащего 200 мг/мл (20% м/об.) памоатной соли из примера 1, растворенной в растворителе из 50% PEG400 и 50% воды (об./об.), дозируемого в количестве 2,5 мг/кг массы тела, по нормальной шкале и по логарифмической шкале, соответственно.
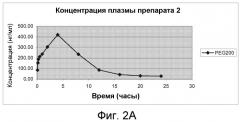
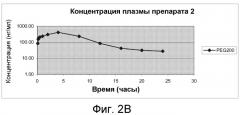
На Фиг.2А и фиг.2В изображены графики фармакокинетических профилей полного курса (срединные значения), полученные после однократного подкожного введения крысам линии Спраг-Доули, состава, содержащего 200 мг/мл (20% м/об.) памоатной соли из примера 1, растворенной в растворителе из 50% PEG200 и 50% воды (об./об.), дозируемого в количестве 2,5 мг/кг массы тела, по нормальной шкале и по логарифмической шкале, соответственно.
На Фиг.3А и фиг.3В изображены графики фармакокинетических профилей полного курса (срединные значения), полученные после однократного подкожного введения крысам линии Спраг-Доули, состава, содержащего 300 мг/мл (30% м/об.) памоатной соли из примера 1, растворенной в растворителе из 50% PEG400 и 50% PBS (об./об.), дозируемого в количестве 3,75 мг/кг массы тела, по нормальной шкале и по логарифмической шкале, соответственно.
На Фиг.4А и фиг.4В изображены графики фармакокинетических профилей полного курса (срединные значения), полученные после однократного подкожного введения крысам линии Спраг-Доули, состава, содержащего 300 мг/мл (30% м/об.) памоатной соли из примера 1, растворенной в растворителе из 50% PEG400 и 50% солевого раствора (об./об.), дозируемого в количестве 3,75 мг/кг массы тела, по нормальной шкале и по логарифмической шкале, соответственно.
На Фиг.5А и фиг.5В изображены графики фармакокинетических профилей полного курса (срединные значения), полученные после однократного подкожного введения крысам линии Спраг-Доули, состава, содержащего ацетатную соль из примера 1, растворенную в растворителе из солевого раствора/2% нагретой неактивированной мышиной сыворотке/5% ДМА/2% твин-80, дозируемого в количестве 0,5 мг/кг массы тела, по нормальной шкале и по логарифмической шкале, соответственно.
На Фиг.6А и фиг.6В изображены графики фармакокинетических профилей полного курса (срединные значения), как показано на фиг.1А посредством фиг.5А по нормальной шкале, а также на фиг.1В посредством фиг.5В по логарифмической шкале, как параллельное сравнение разных препаратов, использованных в экспериментах, как описано в данной патентной заявке.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Номенклатура, используемая для определения пептидов в настоящей патентной заявке, представляет собой ту, которая обычно используется в данной области, где аминогруппа N-конца появляется слева, а карбоксильная группа на С-конце появляется справа. Когда аминокислота имеет изомерные формы, то, пока нет других ясных указаний, она представлена L-формой. Пока нет других определений, все использованные в настоящем описании технические и научные термины имеют такое же значение, которое обычно понимает средний специалист в области, к которой относится настоящее изобретение.
Аббревиатуры, использованные в настоящей патентной заявке, определяются следующим образом:
Ac: ацетил
Ala или A: аланин
Arg или R: аргинин
Cys или C: цистеин
Glu или E: глутаминовая кислота
Gly или G: глицин
His или H: гистидин
Phe или F: фенилаланин
Trip или W: триптофан
Tyr или Y: тирозин
Пока нет других указаний, все аббревиатуры (например, Ala) аминокислот в этом описании означают структуру -NH-C(R)(R')-C0-, где R и R' каждый независимо обозначает водород или боковую цепь аминокислоты (например, R=CH3 и R'=H для Ala) или R и R' могут быть соединены для образования кольцевой системы.
Обозначение NH2, например, в Ac-Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2 указывает на то, что С-конец пептида амидирован.
“-цикло(Cys-Cys)- обозначает структуру:
Термин “приблизительно” в том виде, как использован в настоящей патентной заявке, в сочетаниях с параметрами и количествами, означает, что параметр или количество находится в пределе ±5% установленного параметра или количества.
Некоторые другие аббревиатуры, использованные в настоящей патентной заявке, определяются следующим образом:
Boc: трет-бутилоксикарбонил
BSA: альбумин бычьей сыворотки
DCM: дихлорметан
DIPEA: диизопропилэтиламин
DMF: диметилформамид
DTT: дитиотриетол
Fmoc: 9-фторенилметилоксикарбонил
HBTU: гексафторфосфат 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония
HOBt: 1-гидроксибензотриазол
HPLC: жидкостная хроматография высокого разрешения
IBMX: изобутилметилксантин
Sodium pamoate (памоат натрия): динатриевая соль памоевая кислота, имеющая структуру
LC-MC: жидкостная хроматография масс-спектрометрия
LOQ: предел количественной оценки
MRM: мониторинг мультиплетной реакции
NMP: N-метилпирролидон
PBS: фосфат буферного солевого раствора
PEG: поли(этиленгликоль), который имеет структуру , где n целое число от 1 до 2000
PEG200: поли(этиленгликоль) со средней молекулярной массой приблизительно 200 Да
PEG400: поли(этиленгликоль) со средней молекулярной массой приблизительно 400 Да
TFA: трифторуксусная кислота
TIS: триизопропилсилан
Tris-HCl: гидрохлорид трис(гидроксиметил)аминометана
Trt: тритил
СИНТЕЗ
Пептиды настоящего изобретения можно получить путем стандартного пептидного синтеза в твердой фазе. Смотри, например, Stewart, J.M., et ah, Solid Phase Synthesis (Pierce Chemical Co., 2d ed. 1984). Следующие примеры описывают синтетические способы получения пептидов настоящего изобретения, способы, которые хорошо известны специалистам в данной области. Другие способы также хорошо известны специалистам в данной области. Примеры представлены в качестве иллюстрации и не подразумевают какого-либо ограничения сущности настоящего изобретения каким бы то ни было образом.
Синтез Примера 1, то есть Ac-Arg-цикло(Cys-D-Ala-His-D-Phe-Arg-Trp-Cys)-NH2
Указанный в заголовке пептид, имеющий вышеуказанную структуру, был собран с использованием Fmoc химии на Apex пептидном синтезаторе (Aapptec; Louisville, KY, USA). 220 мг 0,91 ммоль/г (0,20 ммоль) смолы МВНА амида Rink (Polymer Laboratories; Amherst, MA, USA) помещали в реакционную ячейку и, предварительно приведя в набухшее состояние в 3,0 мл ДМФ перед синтезом. Для цикла 1, смолу обработали двумя порциями по 3 мл 25% пиперидина в ДМФ в течение 5 и 10 минут, соответственно, с последующим 4-разовым промыванием 3 мл ДМФ - каждая промывка, состояла из добавления 3 мл растворителя, перемешивания в течение 1 минуты и сливания в течение 1 минуты. Реакционную массу аминокислот получали в NMP, в виде 0,45М растворов, содержащих 0,45M HOBT. HBTU получали в виде 0,45М раствора в NMP, и DIPEA получали в виде 2,73М раствора в NMP. К смоле добавляли 2 мл первой аминокислоты (0,9 ммоль, Fmoc-Cys(Trt)-OH) (Novabiochem, San Diego, CA, USA) вместе с 2 мл (0,9 ммоль) HBTU и 1,5 мл (4,1 ммоль) DIPEA. Через час постоянного перемешивания связывающие реагенты сливали, и стадию связывания повторяли. Последующее аминокислотное ацилирование, смолу промывали двумя аликвотами ДМФ по 3 мл в течение 1 минуты. Процесс сборки пептида (деблокирование/промывание/ацилирование/промывание) повторяли для циклов 2-9 идентично тому, как описан цикл 1. Использовали следующие аминокислоты: цикл 2) Fmoc-Trp(Boc)-OH (Genzyme; Cambridge, MA, USA); цикл 3) Fmoc-Arg(Pbf)-OH (Novabiochem); цикл 4) Fmoc-D-Phe-OH (Genzyme); цикл 5) Fmoc-His(Trt)-OH (Novabiochem); цикл 6) Fmoc-D-Ala-OH (Genzyme); цикл 7) Fmoc-Cys(Trt)-OH (Novabiochem); и цикл 8) Fmoc-Arg(Pbf)-OH (Genzyme). N-конец Fmoc удаляли 25% пиперидином в ДМФ, как описано выше в тексте патентной заявки, с последующими четырьмя промывками ДМФ по 3 мл в течение 1 минуты. Ацилирование N-конца выполняли добавлением 0,5 мл 3М DIPEA в NMP к смоле вместе с 1,45 мл 0,45М уксусного ангидрида в NMP. Смолу перемешивали в течение 30 минут и ацилирование повторяли. Смолу промывали ДМФ в целом 5 раз по 3 мл с последующими 5 промывками DCM по 5 мл каждая.
Для того чтобы расщепить и снять защиту пептида, к смоле добавляли 5 мл следующего реагента: 2% TIS/5% воды/5% (м/об) DTT/88% TFA. Раствор перемешивали в течение 3,5 часов. Фильтрат собирали в 40 мл холодного безводного этилового эфира. Осадок осаждали центрифугированием в течение 10 минут при 3500 об/мин в охлажденной центрифуге. Эфир декантировали и пептид повторно суспендировали в свежем эфире. Обработку эфиром проводили три раза. После последней промывки эфиром пептиду дали высохнуть на воздухе, чтобы ушли остатки эфира.
Пептид растворяли в 10% ацетонитриле и анализировали с помощью масс-спектроскопии и обращенно-фазовой ВЭЖХ, используя 30х4,6 см С18 колонку (Vydac; Hesperia, CA, USA) с градиентом 2-60% ацетонитрила (0,1% TFA) в течение 30 минут. Этот анализ идентифицировал продукт с ~53% чистотой. Масс-анализ, использующий электрораспыляющую ионизацию, идентифицировал основной продукт, содержащий массу 1118,4, соответствующую желаемому неразветвленному продукту. Неочищенный продукт (~100 г) разводили до концентрации 2 мг/мл в 5% уксусной кислоте. К этому раствору при интенсивном перемешивании по каплям добавляли 0,5М иодин/метанол до тех пор, пока раствор не окрашивался в бледно-желтый цвет. Раствор интенсивно перемешивали еще 10 минут. Затем избыток иодина гасили добавлением 1,0М тиосульфата натрия при постоянном перемешивании до тех пор, пока смесь не обесцвечивалась. Пептид перепроверяли с помощью масс-спектрометрического анализа и ВЭЖХ. Масс-спектрометрический анализ идентифицировал основные образцы с массой 1116,4, что указало на проведение успешного окисления с образованием циклического пептида. Раствор пептида очищали на препаративной ВЭЖХ, оборудованной С18 колонкой, использующей схожий градиент элюирования. Очищенный продукт повторно анализировали с помощью ВЭЖХ для чистоты (>95%) и масс-спектрометрией (1116,9, что согласуется с ожидаемой массой 1117,3) и следующим шагом лиофилизировали. После лиофилизирования получили 28 мг очищенного продукта, представляющего собой 24% выход.
Другие приведенные в качестве примеров пептиды синтезировали, главным образом, в соответствии с методикой, описанной в вышерассмотренном синтетическом способе. Физические данные выбранных в качестве примера пептидов представлены в Таблице 1.
| Таблица 1 | |||
| Пример № | Мол. масса (рассчитанная) | Мол. масса (ES-MS) | Чистота (ВЭЖХ) |
| 1 | 1117,3 | 1116,9 | 95,1% |
| 2 | 1117,3 | 1116,8 | 99,2% |
| 3 | 1280,5 | 1280,6 | 98,0% |
| 5 | 1216,37 | 1216,20 | 99,9% |
Получение памоатной соли из Примера 1.
Ацетатную соль из Примера 1 (200 мг, 0,18 ммоль) растворяли в 10 мл воды. Памоат натрия (115 мг, 0,36 ммоль) растворяли в 10 мл воды. Два раствора объединяли и хорошо перемешивали. Осадки собирали с помощью центрифугирования при 3000 об/мин в течение 20 минут, три раза промывали водой и сушили путем лиофилизации.
In Vitro исследования
Соединения настоящего изобретения могут быть и были протестированы на активность в качестве лигандов одного или более рецепторов меланокортина, в соответствии со следующими методиками. Специалисту в данной области должно быть известно, что методики, похожие на те, что описаны в настоящей патентной заявке, могут использоваться для анализа активностей связывания соединений настоящего изобретения с молекулами рецепторов меланокортина.
Радиолигандный анализ связывания
Клеточные мембраны, использованные для анализов связывания рецепторов in vitro, получали из трансгенных CHO-K1 клеток, устойчиво экспрессирующих подтип 1, 3, 4 или 5 рецептора hMC-R. CHO-K1 клетки, экспрессирующие желаемый тип рецептора hMC-R, обрабатывали ультразвуком (Branson®, CT, USA; setting 7, приблизительно 30 с) в ледяной 50 мМ Tris-HCl при pH 7,4 и затем центрифугировали при 39000 г в течение 10 минут при температуре приблизительно 4°С. Гранулы повторно суспендировали в том же буфере и центрифугировали при 50000 г в течение 10 минут при температуре приблизительно 4°С. Промытые гранулы, содержащие клеточные мембраны, хранили приблизительно при - 80°С.
Конкурентное ингибирование [125](Tyr2)-(Nle4-D-Phe7)-α-MSH ([125]-NDP-α-MSH; Amersham Biosciences®, Piscataway, NJ, USA) связывания проводили в полипропиленовых 96-луночных планшетах. Клеточные мембраны (1-10 мкг белок/лунка), полученные, как описано выше в тексте настоящей патентной заявки, инкубировали в 50 мМ Tris-HCl при pH 7,4, содержащем 0,2% BSA, 5 мМ MgCl2, 1 мМ CaCl2 и 0,1 мг/мл бацитрацин, с увеличивающимися концентрациями испытуемого соединения и 0,1-0,3 нМ [125]-NDP-α-MSH в течение приблизительно 90-120 минут при приблизительно 37°C. Связанный [125]-NDP-α-MSH лиганд отделяли от свободного [125]-NDP-α-MSH фильтрацией через GF/C стекловолоконные фильтровальные пластины (Unifilter®, Meriden, CT, USA) предварительно пропитанные 0,1% (м/об) полиэтиленимином (PEI), используя сборщик клеток Packard Filtermate® (Millipore, Danvers, MA, USA). Фильтры промывали три раза 50 мМ Tris-HCl при pH 7,4 при температуре приблизительно 0-4°C и затем анализировали на радиоактивность, используя Packard Topcount® сцинтилляционный счетчик (GMI, Inc., Ramsey, MN, USA). Данные связывания анализировали нелинейным регрессионным анализом с помощью компьютера (XL fit; IDBS, Burlington, MA, USA).
Выбор предпочтительных вариантов осуществления испытывали с использованием обсужденного выше анализа и констант связывания (Ki в нМ), представленных в Таблице 2.
| Таблица 2 | ||||
| Пример № | Ki (нМ)hMC1-R | Ki (нМ)hMC3-R | Ki (нМ)hMC4-R | Ki (нМ)hMC5-R |
| 1 | 3,87 | 10,1 | 2,09 | 430 |
| 2 | 4,01 | 12,1 | 1,76 | 352 |
| 3 | 8,53 | 21,2 | 3,72 | 714 |
| 5 | 8,59 | 94,1 | 2,44 | 7760 |
Биологический анализ циклического AMP
Уровни внутриклеточного циклического AMP (cAMP) определяли анализом электрохемилюминисценции (ECL) (Meso Scale Discovery, Gaithersburg