Ингибирование организмов биопленки
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики и медицины и касается применения цистеамина в лечении микробной инфекции, вызванной микробной биопленкой, а также к продукту, содержащему по меньшей мере два агента против биопленки, где по меньшей мере один агент против биопленки представляет собой антимикробный пептид, а второй агент против биопленки представляет собой цистеамин. Также предложено применение этого продукта в лечении микробной инфекции и способ предотвращения образования микробной биопленки в среде. Группа изобретений обеспечивает повышенную антибактериальную активность в сравнении с активностью любого соединения по отдельности. 8 н. и 5 з.п. ф-лы, 33 ил., 2 табл.
Реферат
Область изобретения
Изобретение относится к продуктам, композициям, способам и применениям, которые являются полезными для предотвращения образования биопленок и воздействия на них.
Предпосылки изобретения
Микробная биопленка представляет собой сообщество микробных клеток, погруженных во внеклеточный матрикс полимерных веществ и прикрепленных к биологической или небиотической поверхности. В этих биопленках можно найти целый ряд микроорганизмов (бактерии, грибы и/или простейшие и ассоциированные с ними бактериофаги и другие вирусы). Биопленки повсеместно распространены в природе и могут быть обнаружены в широком диапазоне сред. Научные и медицинские организации все в большей мере признают участие биопленок во многих инфекциях, особенно их вклад в устойчивость инфекций к лечению.
Биопленки являются этиологическими факторами множества заболеваний у млекопитающих и вовлечены в 80% инфекций у людей. Примеры включают кожные и раневые инфекции, инфекции среднего уха, инфекции желудочно-кишечного тракта, инфекции перитонеальной мембраны, инфекции мочеполовых путей, инфекции мягких тканей ротовой полости, образование зубного налета, глазные инфекции (в том числе контаминацию контактных линз), эндокардит, инфекции при муковисцидозе и инфекции имплантированных медицинских устройств, таких как суставные протезы, зубные имплантаты, катетеры и сердечные имплантаты.
В типичных случаях в качестве моделей для исследования чувствительности к антимикробным воздействиям используют планктонные микробы (то есть микроорганизмы, суспендированные или растущие в жидкой среде), как указано Институтом клинических и лабораторных стандартов (Clinical and Laboratory Standard Institute, CLSI) и Европейским комитетом по тестированию чувствительности к антимикробным воздействиям (European Committee on Antimicrobial Succeptibility Testing, EUCAST). Микробы в биопленках значительно более устойчивы к антимикробным воздействиям, чем их планктонные аналоги. Однако нет стандартизованного способа исследования чувствительности микробов биопленки к антибиотикам.
Образование биопленки не ограничено только способностью микробов прикрепляться к поверхности. Микробы, растущие в биопленке, способны взаимодействовать больше между собой, чем с реальным физическим субстратом, на котором биопленка развилась исходно. Например, этот феномен способствует переносу генов при конъюгации, который происходит с большей скоростью между клетками в биопленках, чем между планктонными клетками. Это создает повышенную возможность для горизонтального переноса генов между бактериями и важно потому, что может облегчать перенос устойчивости к антибиотикам или генов, определяющих вирулентность, от устойчивых к чувствительным микробам. Бактерии могут общаться между собой по системе, известной как «quorum sensing» («чувство кворума»), когда сигнальные молекулы высвобождаются в среду, и их концентрацию могут детектировать окружающие микробы. Quorum sensing делает возможной для бактерии координацию их поведения, что повышает их способность выживать. Реакции на quorum sensing включают адаптацию к доступности питательных веществ, защиту от других микроорганизмов, которые могут конкурировать за те же питательные вещества, и избегание токсичных соединений, потенциально опасных для бактерии. Это очень важно для патогенных бактерий во время инфицирования хозяина (например, людей, других животных или растений) для координации их вирулентности с тем, чтобы избегать иммунного ответа хозяина, чтобы быть способными к успешному заражению.
Образование биопленки играет ключевую роль во многих инфекционных заболеваниях, таких как муковисцидоз и периодонтит, в инфекциях кровотока и мочевых путей и в последствиях присутствия имплантированных медицинских устройств. Предполагаемые механизмы, посредством которых ассоциированные с биопленкой микроорганизмы вызывают заболевания у своего хозяина, включают следующее: (1) замедленное проникновение антимикробного агента через матрикс биопленки, (2) открепление клеток или клеточных агрегатов от биопленок на имплантированном медицинском устройстве, (3) продуцирование эндотоксинов, (4) устойчивость к иммунной системе хозяина, (5) предоставление ниши для генерации устойчивых организмов посредством горизонтального переноса генов устойчивости к антимикробным воздействиям и/или генов детерминантов вирулентности (6) измененную скорость роста (то есть, метаболическая спячка) (Donlan and Costerton, Clin Microbiol Rev 15: 167-193, 2002; Parsek and Singh, Annu Rev Microbiol 57: 677-701, 2003; Costerton JW, Resistance of biofilms to stress. In The Biofilm Primer'. (Springer Berlin Heidelberg), pp.56-64, 2007).
Недавние экспериментальные данные свидетельствуют о том, что в пределах биопленок существуют мелкие субпопуляции специализированных не метаболизирующих устойчивых клеток (покоящихся клеток). Считается, что эти клетки могут быть ответственными за высокую устойчивость/толерантность биопленки к антимикробным агентам. Толерантные ко многим лекарственным средствам устойчивые клетки присутствуют как в планктонных, так и в биопленочных популяциях, и оказывается, что дрожжи и бактерии выработали аналогичные стратегии, которые придают этим субпопуляциям функцию выживания. Защита, обеспечиваемая полимерным матриксом, позволяет устойчивым клеткам избегать выведения и служить в качестве источника для репопуляции. Есть свидетельства того, что устойчивые клетки в значительной степени являются ответственными за устойчивость микробных биопленок ко множеству лекарственных средств (LaFleur et al., Antimicrob Agents Chemother. 50: 3839-46, 2006; Lewis, Nature Reviews Microbiology 5, 48-56 2007).
Сохраняется необходимость в улучшенных способах терапии для предупреждения образования биопленки и лечения заболеваний, ассоциированных с микробными биопленками.
Изложение сущности изобретения
В соответствии с первым аспектом настоящего изобретения, предложен продукт, содержащий по меньшей мере два агента против биопленки, где по меньшей мере один агент против биопленки представляет собой антимикробный пептид. Другой агент против биопленки представляет собой диспергирующий агент или антиадгезивный агент.
Термин "агент против биопленки" использован здесь для описания агента, который способен разрушать микробную биопленку или ингибировать ее рост. Агент против биопленки может нарушать структуру биопленки, например внеклеточного слизистого матрикса, или может разрушать микробные клетки или ингибировать их рост в пределах биопленки.
В этом изобретении дополнительно предложен способ предотвращения образования биопленки в среде, включающий стадию введения антимикробного пептида в эту среду. Преимущественно, этот способ включает стадию введения в эту среду продукта в соответствии с этим изобретением.
В этом изобретении дополнительно предложен способ профилактического или терапевтического лечения микробной инфекции, особенно микробной биопленки, включающий введение терапевтически эффективного количества антимикробного пептида, например катионного пептида. В типичных случаях этот способ включает последовательное или комбинированное введение в терапевтически эффективном количестве:
первого агента против биопленки и
второго агента против биопленки, отличного от первого;
причем по меньшей мере один из первого и второго агентов против биопленки представляет собой антимикробный пептид, например, катионный пептид.
Указанные активные агенты можно вводить в виде свободных или фиксированных комбинаций. Свободные комбинации можно предоставлять в виде упаковок комбинаций, содержащих все активные агенты в свободных комбинациях. Фиксированные комбинации часто представляют собой таблетки или капсулы.
Настоящее изобретение также включает применение антимикробных пептидов или комбинаций активных агентов, указанных выше, в изготовлении лекарственного средства для лечения микробной инфекции, особенно инфекции, вызванной микробной биопленкой.
Эти продукты обладают преимуществом в том, что они демонстрируют антибактериальную активность против, среди прочего, устойчивых клеток, присутствующих в биопленках, что является существенной стадией на пути к уничтожению биопленок.
Агенты по этому изобретению можно вводить в форме фармацевтически приемлемых солей. Фармацевтически приемлемые соли по настоящему изобретению можно синтезировать из исходного соединения, которое содержит основную или кислотную группировку, общепринятыми химическими способами. Обычно такие соли можно получать взаимодействием форм этих соединений, представляющих собой свободную кислоту или основание, со стехиометрическим количеством надлежащего основания или кислоты в воде или в органическом растворителе или в их смеси; обычно неводные среды, такие как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил, являются предпочтительными. Перечни подходящих солей можно найти в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., US, 1985, p.1418, описание которого включено сюда посредством ссылки; см. также Stahl et al, Eds, "Handbook of Pharmaceutical Salts Properties Selection and Use", Verlag Helvetica Chimica Acta and Wiley-YCH, 2002. Фраза "фармацевтически приемлемый" использована здесь по отношению к тем соединениям, веществам, композициям и/или лекарственным формам, которые являются, в пределах обоснованного медицинского суждения, подходящими для применения в контакте с тканями человека или, возможно, животного без избыточной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, в соответствии с разумным соотношением польза/риск.
Это изобретение, таким образом, включает фармацевтически приемлемые соли раскрытых соединений, где исходное соединение модифицировано путем получения его солей с кислотой или основанием, например общепринятых нетоксичных солей или солей четвертичного аммония, которые образованы, например, из неорганических или органических кислот или оснований. Примеры таких солей присоединения кислоты включают ацетат, адипат, альгинат, аспартат, бензоат, бензосульфонат, бисульфат, бутират, цитрат, камфорат, камфоросульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат и ундеканоат. Соли основания включают соли аммония, соли щелочного металла, такие как соли натрия и калия, соли щелочноземельного металла, такие как соли кальция и магния, соли с органическими основаниями, такие как соли дициклогексиламина, N-метил-О-глюкамина, и соли с аминокислотами, такими как аргинин, лизин и так далее. Также, основные азотсодержащие группы можно переводить в четвертичные такими агентами, как низшие алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, -бромиды и -йодиды; диалкилсульфаты, такие диметил-, диэтил-, дибутил- и диамилсульфаты, длинноцепочечные галогениды, такие как децил-, лаурил-, миристил- и стеарилхлориды, -бромиды и -йодиды, аралкилгалогениды, такие как бензил- и фенэтилбромиды, и другие.
Следовательно, это изобретение включает фармацевтические продукты, обычно содержащие по меньшей мере:
первый агент против биопленки и
второй агент против биопленки, отличный от первого,
причем по меньшей мере один из первого и второго агентов против биопленки представляет собой антимикробный пептид, например, катионный пептид.
Первый агент против биопленки
Первый агент против биопленки может быть антимикробным пептидом, например антибактериальным пептидом. Предпочтительно, первый агент против биопленки представляет собой антимикробный пептид, здесь ниже обозначаемый как "первый антимикробный агент". Первый антимикробный агент может содержать аминокислоты в соответствии с формулой I:
,
где l и m представляют собой целые числа от 1 до 10, например от 1 до 5; n представляет собой целое число от 1 до 10; X и Y, которые могут быть одинаковыми или разными, независимо представляют собой гидрофобную или катионную аминокислоту.
Предпочтительно, первый антимикробный агент содержит аминокислоты в соответствии с формулой (I), где X и Y представляют собой катионные аминокислоты.
Антимикробный пептид может содержать от 2 до 200 аминокислот, например, от 3, 4, 5, 6 или 7 до 100 аминокислот, включая от 3, 4, 5, 6 или 7 до 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот. В соответствии с одним из воплощений, антимикробный пептид содержит от 3 или 4 до 50 аминокислот. Альтернативно, пептид может содержать более чем 27 аминокислот, в типичных случаях от 27 до 300 аминокислот, подходящим образом от 27 до 200 аминокислот.
Этот пептид может содержать от 100 до 200 аминокислот, от 20 до 100, 20 и 45 аминокислот, например 20, 25, 30, 35, 40, 42 или 45 аминокислот. Этот пептид может содержать от 3 до 15 аминокислот, например от 5 до 15 аминокислот.
При использовании здесь термин "гидрофобный" относится к аминокислоте, имеющей боковую цепь, которая является незаряженной при физиологических pH, которая является неполярной и которая обычно отталкивается водным раствором.
При использовании здесь термин "катионный" относится к аминокислотам, имеющим суммарный заряд, который больше чем 0 или равен 0. Обычно термин "катионный" относится к аминокислотам, имеющим суммарный заряд, который больше чем ноль.
Обычно гидрофобный аминокислотный остаток имеет гидрофобность большую чем -1,10 или равную -1,10, и заряд больший чем 0 или равный 0.
Гидрофобные аминокислоты могут включать лейцин, фенилаланин, пролин, аланин, триптофан, валин, изолейцин и метионин.
Предпочтительно, X и/или Y представляют собой катионные аминокислоты, например выбранные из группы, состоящей из гистидина, аргинина и лизина. Еще предпочтительнее, X и/или Y представляют собой аргинин или лизин. X и/или Y можно выбрать из не встречающихся в природе аминокислот, например, катионной аминокислоты орнитина.
X и/или Y могут представлять собой оптические изомеры катионной аминокислоты, какая определена здесь, например, D- или L-аминокислоты. Более того, X и/или Y могут быть чередующимися аминокислотами.
Аминокислоты могут быть встречающимися в природе или синтетическими. Это изобретение также включает известные изомеры (структурные, стерео-, конформационные и конфигурационные) и структурные аналоги указанных аминокислот и их модификации, либо природные (например, посттрансляционная модификация), либо химические, что включает, без ограничения, фосфорилирование, гликозилирование, сульфонилирование и/или гидроксилирование.
В соответствии с одним из воплощений пептид может включать одну или более чем одну замену катионных или гидрофобных аминокислот X и Y. Однако этот пептид должен преимущественно содержать катионные или гидрофобные аминокислоты X и Y. В типичных случаях пептид может содержать от 1 до 5 замен, подходящим образом от 1 до 3 замен, обычно одну замену. Замены могут быть концевыми или неконцевыми.
Эти замены могут состоять из аминокислот или отличаться от аминокислот. Замены могут быть заряженными или незаряженными. В типичных случаях одна или более чем одна замена представляет собой незаряженную аминокислоту. Альтернативно или дополнительно одна или более чем одна замена может не представлять собой аминокислоту, например, цистеамин.
Предпочтительно, X и Y являются одинаковыми и представляют собой лизин или аргинин.
В соответствии с одним воплощением, пептид содержит преимущественно аминокислоты, представляющие собой аргинин, которые можно заменить одной или более чем одной аминокислотой, которая не представляет собой аргинин.
Обычно пептид содержит от 7 до 20 аминокислот, представляющих собой аргинин, возможно замененных 1-5 аминокислотами, не представляющими собой аргинин, в типичных случаях, 3-5 заменами, не представляющими собой аргинин.
Альтернативно, пептид может содержать от 7 до 20 аминокислот, представляющих собой лизин, возможно замененные 1-5 аминокислотами, не представляющими собой лизин, в типичных случаях, 3-5 заменами, не представляющими собой лизин.
В соответствии с дополнительным воплощением пептид может содержать от 27 до 300 аминокислот, представляющих собой лизин, обычно от 27 до 200 аминокислот, представляющих собой лизин. В типичных случаях пептид не содержит неконцевых замен аминокислотами, не представляющими собой лизин.
В пептиде формулы (I) l и m могут представлять собой 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, и n может представлять собой 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10.
В пептиде формулы (I) l может представлять собой 1, n может представлять собой 1, и m может быть между 4 и 9, например, m может представлять собой 3, 4, 5, 6, 7, 8 или 9.
В пептиде формулы (I) l, n и/или m могут быть между 1 и 5, например 1, 2, 3, 4 или 5.
В пептиде формулы (I) l и m могут представлять собой целое число между 0 и 7, и n может представлять собой целое число между 1 и 10.
В пептиде формулы (I) l и m может представлять собой 0, 1 или 2, и n может представлять собой целое число между 1 и 10.
В пептиде формулы (I) X и Y могут быть одинаковыми, l может представлять собой 0, m может представлять собой 1, и n может представлять собой 3, 4, 5, 6, 7, 8, 9 или 10.
В пептиде формулы (I) X и Y могут быть одинаковыми, l и m могут представлять собой 1, и n может представлять собой 2, 3, 4 или 5.
В пептиде формулы (I) X и Y могут быть одинаковыми, l может представлять собой 1, m может представлять собой 2, и n может представлять собой 1, 2, 3 или 4.
В пептиде формулы (I) X и Y могут быть одинаковыми, l и m могут представлять собой 2, и n может представлять собой 1, 2, 3 или 4.
Предпочтительно, первый антимикробный агент содержит пептидную последовательность, выбранную из группы, состоящей из полилизина и полиаргинина.
В одном из воплощений первый антимикробный агент содержит полилизин.
В альтернативном воплощении первый антимикробный агент содержит полиаргинин.
В соответствии с дополнительным аспектом настоящего изобретения предложено применение первого антимикробного агента в лечении для предотвращения образования биопленки.
В типичных случаях первый антимикробный агент находится в форме продукта по этому изобретению, как описано ниже.
Второй агент против биопленки
Второй агент против биопленки может представлять собой любой агент, который ингибирует образование биопленки. Например, второй агент против биопленки может ингибировать бактериальную адгезию, гидрофобность или продукцию слизи. Второй агент против биопленки можно выбрать из диспергирующего агента и антиадгезивного агента.
В соответствии с одним из воплощений настоящего изобретения, второй агент против биопленки не представляет собой пептид.
Термин "диспергирующий агент" включает любой агент, способный диспергировать частицы биопленки. В частности, диспергирующий агент может способствовать дисперсии слизи, продуцируемой микробами, такими как бактерии, слизи, которая формирует часть биопленки, например слизи, продуцируемой клетками, к которым прилипают микробы биопленки, и микробов биопленки, таких как бактерии.
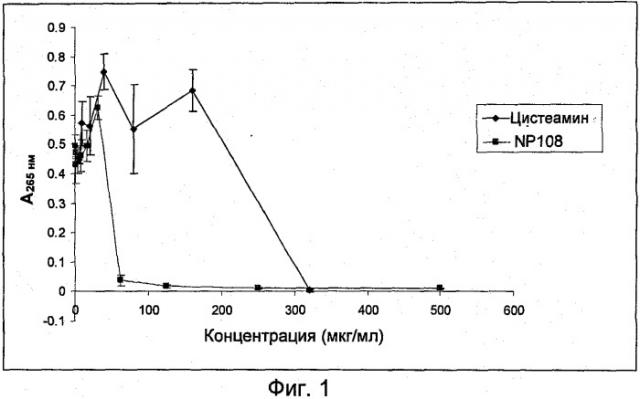
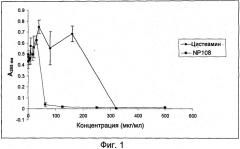
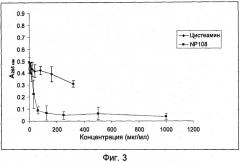
Диспергирующий агент может представлять собой муколитический агент. Муколитический агент может представлять собой фермент, например ДНКазу, альгиназу, протеазу или карбогидразу. Альтернативно муколитический агент может представлять собой малую молекулу, например амин, такой как аминотиол, или кислоту, такую как этилендиаминтетрауксусная кислота (ЭДТА). Амин можно выбрать из ацетилцистеина и цистеамина (cysteamine).
Термин "антиадгезивный агент" включает любой агент, способный ингибировать адгезию между клетками, белками и организмами, например микробами, предотвращая тем самым образование биопленки или способствуя саморазрушению биопленки. В частности, антиадгезивный агент может предотвращать адгезию к поверхности или субстрату всех типов клеток, встречающихся в микробных биопленках, в частности, свободноживущих микробов, т.е., планктонных клеток. Антиадгезивные агенты могут включать, без ограничения, гиалуронан, гепарин или Карбопол 934.
Вторым агентом против биопленки может быть антибактериальный агент. Антибактериальный агент может представлять собой муколитический агент, например, муколитический агент, имеющий как муколитическую, так и антибактериальную активность. Предпочтительно, антибактериальный агент представляет собой цистеамин.
Продукты по изобретению
Продукт по настоящему изобретению может содержать антимикробный пептид.
Предпочтительный продукт содержит антимикробный пептид и муколитический агент.
Соотношение первого агента против биопленки и второго агента против биопленки в продуктах по этому изобретению может составлять от 1:10 до 10:1; обычно по меньшей мере 2:1, например, по меньшей мере 3:1 или 4:1. В соответствии с одним из воплощений, соотношение первого агента против биопленки и второго агента против биопленки представляет собой приблизительно 1:1. Предпочтительно, первый агент против биопленки представляет собой катионный пептид, а второй агент против биопленки представляет собой муколитический агент, и соотношение катионный пептид: муколитический агент находится в диапазоне от 2:1 до 4:1. В соответствии с дополнительным воплощением, это соотношение может быть приблизительно 1:1.
Активные агенты можно вводить одновременно, последовательно или раздельно. Активные агенты можно предоставлять в виде комбинированной упаковки. Комбинированная упаковка может содержать продукт по этому изобретению вместе с инструкциями для одновременного, раздельного или последовательного введения каждого активного агента. Для последовательного введения активные агенты можно вводить в любом порядке.
Активные агенты продукта по этому изобретению можно предоставлять в виде фармацевтических композиций, дополнительно содержащих один или более чем один фармацевтически приемлемый разбавитель, эксципиент и/или носитель. Это относится как к фиксированным, так и к свободным комбинациям.
Активные агенты по настоящему изобретению можно вводить любым подходящим путем, известным специалистам, предпочтительно в форме фармацевтической композиции, адаптированной к такому пути, и в дозе, эффективной для назначенного лечения. Активные соединения и композицию можно, например, вводить парентерально, перорально, интраназально, внутрибронхиально, энтерально, через кожу, сублингвально, ректально, вагинально, в глаз или местно. Предусмотрено как локальное, так и системное введение.
В целях парентерального введения ("парентеральный" при использовании здесь относится к способам введения, которые включают внутривенную, внутримышечную, энтеральную, внутрибрюшинную, внутригрудинную, подкожную и внутрисуставную инъекцию и инфузию, причем внутривенное введение (включая непрерывное внутривенное введение) является наиболее предпочтительным) можно использовать растворы в водном пропиленгликоле, а также стерильные водные растворы соответствующих водорастворимых солей. Такие водные растворы могут быть подходящим образом забуференными, если необходимо, и жидкий разбавитель сначала делают изотоническим с использованием достаточного количества физиологического раствора или глюкозы. Эти водные растворы являются особенно подходящими для целей внутривенной, внутримышечной, подкожной и внутрибрюшинной инъекции. В этой связи все используемые стерильные водные среды легко получать стандартными методиками, хорошо известными специалистам.
Продукты по этому изобретению можно также вводить интраназальным путем или ингаляцией, и их удобно доставлять в форме сухой порошковой ингаляции или аэрозольного спрея из контейнера под давлением, насоса, спрея, пульверизатора, распылителя с применением или без применения подходящего пропеллента.
Альтернативно, продукты по этому изобретению можно вводить в форме суппозитория или пессария, или их можно наносить местно в форме геля, гидрогеля, лосьона, раствора, крема, мази или порошка. Продукты по этому изобретению можно вводить в кожу или через кожу, например, с использованием кожного пластыря, депо или подкожной инъекции. Их можно также вводить легочным или ректальным путями.
Для перорального введения фармацевтическая композиция может быть в форме, например, таблетки, капсулы, суспензии или жидкости. Фармацевтическую композицию предпочтительно получают в стандартной лекарственной форме, содержащей конкретное количество активного ингредиента. Примерами таких стандартных форм являются капсулы, таблетки, порошки, гранулы или суспензии с общепринятыми добавками, такими как лактоза, маннит, кукурузный крахмал или картофельный крахмал; со связующими агентами, такими как кристаллическая целлюлоза, производные целлюлозы, гуммиарабик, кукурузный крахмал или желатины; с разрыхлителями, такими как кукурузный крахмал, картофельный крахмал или карбоксиметилцеллюлоза в натриевой форме; и со смазывающими агентами, такими как тальк или стеарат магния. Активный ингредиент можно также вводить инъекцией в виде композиции, где в качестве подходящего носителя можно использовать, например, физиологический раствор, декстрозу или воду.
Продукты по этому изобретению могут также находить применение в виде или в составе перорального препарата, где продукт приготовлен в виде препарата с носителем, например, выбранном из пленок, лент, гелей, микросфер, лепешек, жевательных резинок, зубных паст или порошков и ополаскивателей рта.
Количество терапевтически активного соединения, которое вводят, и режим дозировки для лечения заболевания соединениями и/или композициями по этому изобретению зависят от множества разных факторов, включая возраст, массу, пол и медицинское состояние субъекта, тяжесть заболевания, путь и частоту введения и конкретное используемое соединение, а также фармакокинетические свойства индивида, которого лечат, и таким образом могут широко варьировать. Дозировка должна обычно быть снижена, если соединения вводят местно, а не системно, и для профилактики, а не для лечения. Такие средства лечения можно вводить так часто, как это необходимо, и в течение времени, определенного врачом как необходимое для лечения. Специалист в данной области должен понимать, что режим дозировки или терапевтически эффективное количество ингибитора для введения могут быть оптимизированы для каждого индивида. Фармацевтические композиции могут содержать активный ингредиент в диапазоне от примерно 0,1 до 2000 мг, предпочтительно в диапазоне от примерно 0,5 до 500 мг и, наиболее предпочтительно, между примерно 1 и 200 мг. Может быть подходящей суточная доза от примерно 0,01 до 100 мг/кг массы тела, предпочтительно между примерно 0,1 и примерно 50 мг/кг массы тела и, наиболее предпочтительно, от примерно 1 до 20 мг/кг массы тела. Суточную дозу можно вводить в виде от одной четырех доз в сутки.
Продукты по этому изобретению предпочтительно вводят в дыхательные пути. Таким образом, настоящее изобретение также предлагает аэрозольные фармацевтические препараты, содержащие продукт по этому изобретению. Также предложен распылитель или ингалятор, содержащий продукт по этому изобретению.
Дополнительно, продукты по этому изобретению можно вводить в виде лекарственных форм для постоянного высвобождения и тому подобных. Препараты можно составлять так, что они высвобождают активные агенты, например, в конкретной части кишечного или респираторного тракта, возможно, в течение некоторого периода времени. Покрытия, оболочки и защитные матрицы можно получать, например, из полимерных веществ, таких как полилактид-гликоляты, липосомы, микроэмульсии, микрочастицы, наночастицы или воски. Эти покрытия, оболочки и защитные матрицы являются полезными для покрытия имплантированных устройств, например, стентов, катетеров, трубок для перитонеального диализа, дренирующих устройств и тому подобного.
Продукты по этому изобретению могут включать синергетически эффективные количества каждого определенного здесь активного агента. Это изобретение, таким образом, включает продукты, содержащие синергетически эффективное количество (1) первого агента против биопленки, (2) второго агента против биопленки, который отличается от первого агента против биопленки и представляет собой в типичных случаях антимикробный пептид. Этот продукт можно применять в изготовлении лекарственного средства для одновременного, раздельного или последовательного введения указанных агентов в лечении микробной инфекции, например биопленочной инфекции. "Синергетически" при использовании здесь описывает действие двух или более чем двух агентов продукта по этому изобретению, совместное действие которых может дать больший эффект, чем предполагаемый суммарный эффект агентов, используемых по отдельности.
В дополнительном аспекте этого изобретения предложен субстрат, на который наносят или к которому присоединяют продукт по этому изобретению. Предпочтительно, этот субстрат является подходящим для нанесения на раны или доставки к месту раны. Предпочтительно, субстрат позволяет переносить активные агенты продукта по этому изобретению от субстрата к ткани раны для реализации их антибиопленочного эффекта. Этот субстрат может представлять собой повязку, например, повязку на рану. Эта повязка может содержать тканое вещество, или она может представлять собой вещество, подобное коллагену. Субстрат может быть в любой подходящей форме для нанесения на рану, в типичных случаях субстрат может быть в форме гидрогеля, коллоида, мази, крема, геля, пены или спрея.
Продукты по этому изобретению могут также находить применение в качестве или в составе дезинфектанта или биоцида. В этом контексте, пептид или фармацевтические композиции по этому изобретению можно наносить, либо по отдельности, либо в комбинации с другими дезинфицирующими агентами, на поверхность, подлежащую обработке. При использовании здесь "поверхность, подлежащая обработке" может представлять собой субстрат, как определено здесь, и может включать медицинские устройства и имплантированные устройства, например, стенты, катетеры, трубки для перитонеального диализа, дренирующие устройства, протезы суставов, зубные имплантаты и тому подобное.
Способы и применение
В этом изобретении предложен способ предотвращения образования биопленки в среде, включающий стадию введения продукта в соответствии с этим изобретением в среду. Этот способ может представлять собой способ in vivo или ex vivo.
В соответствии с одним из воплощений этот способ включает стадию введения антимикробного пептида.
Преимуществом является то, что этот способ включает стадию введения
первого агента против биопленки и
второго агента против биопленки, отличного от первого, причем по меньшей мере один из первого и второго агента против биопленки представляет собой антимикробный пептид, например, катионный пептид.
Среда может содержать любой образующий биопленку микроорганизм, выбранный из бактерий, грибов, дрожжей, вирусов и простейших.
В типичных случаях микроорганизм представляет собой бактерию, например, грамположительную или грамотрицательную бактерию. Бактериальный патоген может происходить из бактериальных видов, выбранных из группы, состоящей из следующего: Staphylococcus spp., например Staphylococcus aureus, Staphylococcus epidermidis; Enterococcus spp., например Enterococcus faecalis; Streptococcus pyogenes; Listeria spp.; Pseudomonas spp.; Mycobacteria spp., например Mycobacteria tuberculosis; Enterobacter spp.; Campylobacter spp.; Salmonella spp.; Streptococcus spp., например Streptococcus Группы A или B, Streptococcus pneumoniae; Helicobacter spp., например Helicobacter pylori; Neisseria spp., например Neisseria gonorrhea, Neisseria meningitidis; Borrelia burgdorferi; Shigella spp., например Shigella flexneri; Escherichia coli; Haemophilus spp., например Haemophilus influenzae; Chlamydia spp., например Chlamydia trachomatis, Chlamydia pneumoniae, Chlamydia psittaci; Francisella tularensis; Bacillus spp., например Bacillus anthracis; Clostridia spp., например Clostridium botulinum; Yersinia spp., например Yersinia pestis; Treponema spp.; Burkholderia spp.; например Burkholderia mallei и В pseudomallei.
В частности, бактерия может включать Pseudomonas spp., например Pseudomonas aeruginosa; Staphylococcus spp., например Staphylococcus aureus и Staphylococcus epidermidis; Haemophilus spp., например Haemophilus influenzae; Burkholderia spp., например Burkholderia cepacia; Streptococcus spp., Propionibacterium spp., например Propionibacterium acnes. Предпочтительно бактерия выбрана из Pseudomonas spp., например Pseudomonas aeruginosa и Staphylococcus spp., например Staphylococcus aureus и Staphylococcus epidermidis.
Вирусный патоген может происходить из вируса, выбранного из группы, состоящей из: вируса иммунодефицита человека (ВИЧ 1 и 2); вируса T-клеточного лейкоза человека (HTLV 1 и 2); вируса Эбола; вируса папилломы человека (например, ВПЧ-2, ВПЧ-5, ВПЧ-8 ВПЧ-16, ВПЧ-18, ВПЧ-31, ВПЧ-33, ВПЧ-52, ВПЧ-54 и ВПЧ-56); паповавируса; риновируса; полиовируса; герпесвируса; аденовируса; вируса Эпштейна-Барр; вируса гриппа, вирусов гепатита B и C, вирусов осповакцины, ротавируса или коронавиуса, вызывающего тяжелый острый респираторный синдром (SARS).
Паразитарный патоген может происходить из паразитарных патогенов, выбранных из группы, состоящей из Trypanosoma spp.(Trypanosoma cruzi, Trypanosoma brucei), Leishmania spp., Giardia spp., Trichomonas spp., Entamoeba spp., Naegleria spp., Acanthamoeba spp., Schistosoma spp., Plasmodium spp., Cryptosporidium spp., Isospora spp., Balantidium spp., Loa Loa, Ascaris lumbricoides, Dirofilaria immitis, Toxoplasma ssp., например Toxoplasma gondii. Грибной патоген может происходить из грибного патогена из рода Candida spp., (например С.albicans), Epidermophyton spp., Exophiala spp., Microsporum spp., Trichophyton spp., (например T.rubrum и T.interdigitale), Tinea spp., Aspergillus spp., Blastomyces spp., Blastoschizomyces spp., Coccidioides spp., Cryptococcus spp., Histoplasma spp., Paracoccidiomyces spp., Sporotrix spp., Absidia spp., Cladophialophora spp., Fonsecaea spp., Phialophora spp., Lacazia spp., Arthrographis spp., Acremonium spp., Actinomadura spp., Apophysomyces spp., Emmonsia spp., Basidiobolus spp., Beauveria spp., Chrysosporium spp., Conidiobolus spp., Cunninghamella spp., Fusarium spp., Geotrichum spp., Graphium spp., Leptosphaeria spp., Malassezia spp., Mucor spp., Neotestudina spp., Nocardia spp., Nocardiopsis spp., Paecilomyces spp., Phoma spp., Piedraia spp., Pneumocystis spp., Pseudallescheria spp., Pyrenochaeta spp., Rhizomucor spp., Rhizopus spp., Rhodotorula spp., Saccharomyces spp., Scedosporium spp., Scopulariopsis spp., Sporobolomyces spp., Syncephalastrum spp., Trichoderma spp., Trichosporon spp., Ulocladium spp., Ustilago spp., Verticillium spp., Wangiella spp.
В соответствии с дополнительным воплощением, микроорганизм может представлять собой гриб, в частности Candida.
Способ по этому изобретению можно использовать для минимизации и, предпочтительно, предотвращения образования биопленок во многих различных средах, включая, без ограничения, домашнее хозяйство, рабочее место, лабораторию, промышленную среду, водную среду (например, трубопроводные системы), медицинские устройства, в том числе имплантированные устройства, такие как определено здесь, зубоврачебные устройства или зубные имплантаты, организм животного, например организм человека.
Способ по этому изобретению можно, таким образом, использовать для предупреждения образования налета и кариеса на зубе или на зубном имплантате человека, например, зубном протезе, в ротовой полости.
Способ по этому изобретению можно использовать для предотвращения или ограничения образования биопленки в человеческом организме, особенно при лечении микробных инфекций. Заболевания, ассоциированные с биопленочными инфекциями, могут включать местные инфекции, инфекции ротовой полости и системные инфекции. Местные инфекции могут включать раны, язвы и патологические изменения, например кожные ранения, такие как порезы или ожоги, и заболевания, ассоциированные с ними.
Инфекции ротовой полости могут включать гингивит, периодонтит и мукозит.
Системные инфекции могут включать муковисцидоз и другие заболевания, ассоциированные с инфекциями слизистых, например, желудочно-кишечные, мочеполовые или респираторные инфекции.
Другой аспект этого изобретения относится к способам лечения, предупреждения или замедления прогрессии заболевания или состояния, ассоциированного с присутствием микробной биопленочной инфекции у млекопитающего, особенно человека, путем введения терапевтически эффективного количества продукта по этому изобретению млекопитающему.
"Эффективное" количество или "терапевтически эффективное количество" означает количество одной или более чем одной активной субстанции, которое, в пределах обоснованного медицинского суждения, является достаточным для достижения желаемого эффекта без избыточной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, в соответствии с разумным соотношением польза/риск.
В соответствии с одним из аспектов настоящего изобретения способ включает стадию