Способ одновременной амплификации и флуоресцентного маркирования нескольких сегментов генома микобактерий туберкулезного комплекса
Иллюстрации
Показать всеИзобретение относится к биохимии. Изобретение обеспечивает способ одновременной (мультиплексной) амплификации и флуоресцентного маркирования ДНК нескольких сегментов генома микобактерий туберкулезного комплекса (Mycobacterium tuberculosis, M. bovis, M. bovis BCG, M. africanum и M. microti). Далее проводится гибридизационный или электрофоретический анализ последовательностей данных сегментов. Мультиплексная ПЦР осуществляется в едином реакционном объеме с использованием специфичных и адаптерных праймеров, флуоресцентного субстрата, встраиваемого в растущую цепь ДНК в ходе ПЦР и геномной ДНК в качестве матрицы. Мультиплексная ПЦР включает два последовательных профиля амплификации, различающихся температурами отжига специфичных и адаптерных праймеров не менее чем на 10°С. Изобретение позволяет проводить анализ последовательностей данных генов на выявления мутаций, ассоциированных с устойчивостью к противотуберкулезным препаратам. Способ по изобретению сокращает число стадий амплификаций для получения одноцепочечных флуресцентно-меченных ПЦР-продуктов, исключает перенос ДНК-матрицы из одного реакционного объема в другой, что повышает устойчивость процедуры к контаминации ПЦР-продуктами и существенно снижает время и трудоемкость анализа. 4 ил., 1 табл., 1 пр.
Реферат
Изобретение относится к молекулярной биологии, микробиологии и медицине и обеспечивает способ одновременной амплификации и флуоресцентного маркирования ДНК нескольких сегментов генома Mycobacterium tuberculosis, M. bovis, M. bovis BCG, M. africanum и M. microti с целью последующего гибридизационного или электрофоретического анализа последовательностей данных сегментов.
Уровень техники
В настоящее время Всемирная организация здравоохранения (ВОЗ) выделяет возбудителей туберкулеза с множественной лекарственной устойчивостью (МЛУ ТБ, MDR TB), с широкой лекарственной устойчивостью (ШЛУ ТБ, XDR TB) и возбудителей с тотальной (полной) устойчивостью к противотуберкулезным препаратам (суперустойчивый ТБ, XXDR TB). МЛУ ТБ вызывается микобактериями, устойчивыми, по крайней мере, к двум наиболее эффективным препаратам первого ряда - изониазиду и рифампицину. ШЛУ ТБ - это форма туберкулеза, возбудитель которого устойчив к изониазиду и рифампицину, одному из препаратов фторхинолонового ряда, и, как минимум, к одному из трех инъекционных противотуберкулезных препаратов второй линии терапии: амикацину, канамицину или капреомицину (WHO, Global tuberculosis control : WHO report 2012., in WHO/HTM/TB/2012.62012, WHO: Geneva. p. 1-98).
Молекулярный анализ генома возбудителя туберкулеза успешно внедряется в практику учреждений противотуберкулезной службы Российской Федерации и за рубежом. Разработаны диагностические тесты для обнаружения ДНК возбудителя туберкулеза с одновременной идентификацией мутаций, ассоциированных с лекарственной устойчивостью возбудителя к различным противотуберкулезным препаратам (Pai M, Minion J, Sohn H, Zwerling A, Perkins MD. Novel and improved technologies for tuberculosis diagnosis: progress and challenges. Clin Chest Med, 30(4), 701-716, viii (2009)).
Методы идентификации точечных мутаций, основанные на ПЦР с детекцией в режиме реального времени, такие как рекомендованная Всемирной организацией здравоохранения автоматизированная система Xpert MTB/RIF (компания «Cepheid», США), определяют только ограниченное количество мутаций в гене rpoB, приводящих к устойчивости к рифампицину и не могут быть использованы для обнаружения штаммов с МЛУ и, тем более, ШЛУ (Список публикаций по данной системе доступен на веб-сайте ВОЗ по следующей ссылке: Published evidence and commentary on the Xpert MTB/RIF assay).
Гибридизационные технологии в формате «один пациент - одна пробирка - один детектирующий носитель (нитроцеллюлозная мембрана или биологический микрочип)» позволяют идентифицировать существенно большее количество мутаций в различных сегментах микобактериального генома, тем самым выявляют штаммы с МЛУ и, частично, с ШЛУ. Процедура анализа обязательно включает одну или двухстадийную мультиплексную ПЦР при использовании микобактериальной ДНК в качестве матрицы с последующей гибридизацией полученных ПЦР-продуктов на детектирующем носителе.
Тест-система «GenoType MTBDRplus» (компания «Hain LifeSciences», Германия) основана на одностадийной мультиплексной ПЦР с последующей гибридизацией ПЦР-продуктов с ДНК-зондами на мембранах (стрипах), что дает возможность выявлять ДНК МБТ в мокроте и определять четыре наиболее часто встречаемые мутации в гене rpoB (устойчивость к рифампицину) и генах katG и inhA (устойчивость к изониазиду). Основным недостатком данного теста является его невысокая аналитическая чувствительность (от 10000 клеток в 1 мл образца), что позволяет применять методику для быстрого выявления МЛУ-штаммов в мокроте с положительным результатом микроскопии (БК+) или в культурах, выделенных на жидкой и/или плотных питательных средах (Paolo Miotto, Federica Piana, Daniela Maria Cirillo, Giovanni Battista Migliori. Genotype MTBDRplus: a further step toward rapid identification of drug-resistant Mycobacterium tuberculosis. https://www.researchgate.net/journal/1098-660X_Journal_of_clinical_microbiology 2008; 46(1):393-4).
Наборы реагентов серии «ТБ-Биочип» (Институт молекулярной биологии им. В.А. Энгельгардта РАН, Россия) для идентификации возбудителя туберкулеза и определения его чувствительности к рифампицину и изониазиду («ТБ-Биочип-1», Патент РФ 2376387; Gryadunov D., V. Mikhailovich, S. Lapa, N. Roudinskii, M. Donnikov, S. Pan'kov, O. Markova, A. Kuz'min, L. Chernousova, O. Skotnikova, A. Moroz, A. Zasedatelev and A. Mirzabekov. Evaluation of hybridisation on oligonucleotide microarrays for analysis of drug-resistant Mycobacterium tuberculosis. Clinical microbiology and infection 2005. Vol 11:p.531-539), для идентификации возбудителя туберкулеза и определения его чувствительности к фторхинолонам («ТБ-БИОЧИП-2», О.В.Антонова, Д.А. Грядунов, С.А.Лапа, А.В.Кузьмин, Е.Е.Ларионова, Т.Г.Смирнова, Е.Ю.Носова, О.И. Скотникова, Л.Н.Черноусова, А.М.Мороз, А.С. Заседателев, В.М.Михайлович. Выявление мутаций в геноме Mycobacterium tuberculosis, приводящих к устойчивости к фторхинолонам, методом гибридизации на биологических микрочипах. Бюллетень экспериментальной биологии и медицины 2008. №1. стр. 115-120) используют двухстадийную мультиплексную ПЦР с последующей гибридизацией на биологическом микрочипе, содержащем иммобилизованные олигонуклеотиды, специфичные к различным мутациям. Методики отличаются высокой аналитической чувствительностью (от 500 клеток в 1 мл образца), однако двухстадийная мультиплексная ПЦР с обязательным переносом продуктов первой стадии в пробирку, содержащую реакционную смесь второй стадии ПЦР, электрофоретическим контролем каждой стадии существенно усложняют процедуру анализа, требуют наличия специализированного оборудования и высококвалифицированного персонала, увеличивают время и повышают риск контаминации реакционных смесей ПЦР-продуктами, что приводит к ложно-положительным результатам.
Таким образом, в данной области существует острая потребность в разработке способа амплификации нескольких сегментов микобактериального генома, который бы выгодно отличался от известных из уровня техники решений простотой проведения анализа (количество стадий амплификации - не более одной, отсутствие стадии электрофореза), высокой аналитической чувствительностью и устойчивостью к контаминации ПЦР-продуктами.
Раскрытие изобретения
Преимущества способа одновременной амплификации и флуоресцентного маркирования нескольких сегментов генома микобактерий туберкулезного комплекса.
Способ одновременной амплификации и флуоресцентного маркирования нескольких сегментов генома микобактерий туберкулезного комплекса выгодно отличается от известных из уровня техники методов возможностью проведения мультиплексной амплификации в одном реакционном объеме (пробирке или лунке планшета) с одновременным включением флуоресцентной метки в ходе ПЦР и получением на выходе одноцепочечных флуоресцентно-меченных ПЦР-продуктов, которые могут быть далее проанализированы с использованием электрофореза и/или гибридизацией на олигонуклеотидных микроматрицах (микрочипах). Способ не требует нескольких последовательных этапов ПЦР в различных реакционных объемах (пробирках или лунках микропланшета), при которых на первом этапе проводится амплификация фрагментов, специфичных для сегментов микобактериального генома, а на последующих этапах - наработка одноцепочечных продуктов с их одновременным флуоресцентным маркированием. Предлагаемый способ сокращает число стадий амплификации для получения одноцепочечных флуресцентно-меченных ПЦР-продуктов, исключает перенос ДНК-матрицы из одного реакционного объема в другой, что повышает устойчивость процедуры к контаминации ПЦР-продуктами и снижает трудоемкость анализа. Способ предназначен, в первую очередь, в качестве этапа процедуры анализа последовательностей генов антибиотикорезистентости микобактерий туберкулезного комплекса, с целью установления мутаций, ассоциированных с устойчивостью к различным противотуберкулезным препаратам.
В своем первом аспекте данное изобретение обеспечивает способ одновременной амплификации и флуоресцентного маркирования нескольких сегментов генома микобактерий туберкулезного комплекса, проводимых в едином закрытом реакционном объеме, содержащем по меньшей мере две пары специфичных праймеров и пару адаптерных праймеров, и включающий:
а) профиль амплификации, при котором используются:
- по меньшей мере две пары специфичных праймеров, последовательности которых частично комплементарны последовательностям по меньшей мере двух независимых сегментов микобактериального генома;
- геномная ДНК микобактерий в качестве матрицы для ПЦР;
- компоненты реакционной смеси, обеспечивающие наработку и флуоресцентное маркирование ПЦР-продуктов, включающих специфичные сегменты микобактериального генома и фланкированных на 5'-концах последовательностями, комплементарными последовательностям адаптерных праймеров:
б) профиль амплификации, при котором используются:
- пара адаптерных праймеров, последовательности которых комплементарны последовательностям фрагментов, находящихся на 5'-концах ПЦР-продуктов, полученных на стадии (а);
- ПЦР-продукты, полученные на стадии (а), служащие в качестве матрицы для ПЦР;
- компоненты реакционной смеси, обеспечивающие наработку и флуоресцентное маркирование ПЦР-продуктов, включающих специфичные сегменты микобактериального генома.
В одном из своих воплощений способ характеризуется тем, что все компоненты ПЦР-смеси для обоих профилей амплификации, включая геномную ДНК микобактерий, специфичные и адаптерные праймеры, находятся в едином реакционном объеме.
В следующем воплощении способ характеризуется тем, что оба профиля амплификации составляют одну стадию ПЦР, а сами профили проводят последовательно в едином реакционном объеме.
В следующем воплощении способ характеризуется тем, что температура отжига специфичных праймеров первого профиля амплификации превосходит температуру отжига адаптерных праймеров второго профиля не менее чем на 10ºС.
В следующем воплощении способ характеризуется тем, что последовательность каждого из специфичных праймеров состоит из двух фрагментов, при этом последовательность фрагмента, включающего 5'-конец праймера, комплементарна последовательности одного из адаптерных праймеров, а последовательность фрагмента, включающего 3'-конец специфичного праймера, комплементарна последовательности сегмента микобактериального генома.
В следующем воплощении способ характеризуется тем, что концентрация каждого из специфичных праймеров в реакционной смеси меньше концентрации адаптерных праймеров по меньшей мере в 50 раз.
В следующем воплощении способ характеризуется тем, что концентрации прямого и обратного адаптерных праймеров в реакционной смеси могут различаться в 5 и более раз, с целью получения преимущественно одноцепочечных ПЦР-продуктов.
В еще одном из воплощений способ характеризуется тем, что флуоресцентное маркирование ПЦР-продуктов в ходе ПЦР проводят с использованием конъюгата флуоресцентного красителя и дезоксинуклеозидтрифосфата, добавляемого в реакционную смесь.
Наконец в еще одном из воплощений способ характеризуется тем, что полученные ПЦР-продукты могут быть использованы для дальнейшего гибридизационного или электрофоретического анализа.
Другие аспекты настоящего изобретения будут ясны из прилагаемых фигур, подробного описания и формулы изобретения.
Краткий перечень фигур
Для более ясного понимания сущности заявленного изобретения, а также для демонстрации его характерных черт и преимуществ далее приводится подробное описание изобретения со ссылками на фигуры чертежей, на которых:
Фиг. 1. представляет схему проведения мультиплексной ПЦР в заявляемом способе.
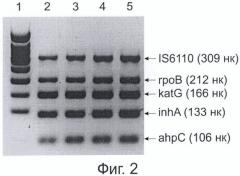
Фиг. 2. представляет электрофоретическую картину ПЦР-продуктов, полученных при проведении мультиплексной ПЦР, заявленной в настоящем способе, и при использовании референс-метода.
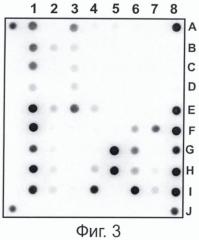
Фиг. 3. представляет пример гибридизации ПЦР-продуктов на специализированном олигонуклеотидном микрочипе, полученных при проведении мультиплексной ПЦР, заявленной в настоящем способе, при использовании в качестве матрицы ДНК M. tuberculosis дикого типа.
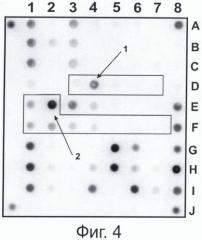
Фиг. 4. представляет пример гибридизации ПЦР-продуктов на специализированном олигонуклеотидном микрочипе, полученных при проведении мультиплексной ПЦР, заявленной в настоящем способе, при использовании в качестве матрицы ДНК M. tuberculosis, содержащей мутации, приводящие к аминокислотным заменам Ser531>Leu в гене rpoB и Ser315>Thr в гене katG.
Осуществление изобретения
Задача настоящего изобретения состоит в создании способа одновременной амплификации и флуоресцентного маркирования нескольких сегментов генома микобактерий туберкулезного комплекса.
Для обеспечения эффективной амплификации с одновременным введением флуоресцентной метки во все фрагменты предложен вариант мультиплексной ПЦР с использованием специально сконструированных праймеров (см. Фиг.1). Последовательность каждого добавляемого в реакционную смесь специфичного праймера (Fis, Ris, i - номер амплифицируемого сегмента) состоит из двух частей - 3'-специфичной, т.е. комплементарной последовательности фрагмента генома микобактерий туберкулезного комплекса, и 5'-универсальной (адаптерной), различавшейся для прямых и обратных праймеров. Помимо таких праймеров, содержащих и специфические, и адаптерные последовательности, в реакционную смесь добавляют два праймера (Fa, Ra), последовательности которых комплементарны последовательностям адаптерной части специфичных праймеров. При этом концентрация специфичных праймеров меньше концентрации адаптерных праймеров по меньшей мере в 50 раз.
Прямой и обратный адаптерные праймеры присутствуют в реакционной смеси в количественном соотношении не менее, чем 1:5, с целью наработки преимущественно одноцепочечных фрагментов. Данное условие необходимо, например, для того чтобы последовательности одноцепочечных фрагментов были которых комплементарны последовательностям олигонуклеотидов, иммобилизованных в ячейках олигонуклеотидного микрочипа.
Последовательности специфичных и адаптерных праймеров выбирают таким образом, чтобы их расчетные температуры плавления Tms и Tma различались не менее чем на 10°С, т.е. (Tms - Tma) ≥10°С. В таком случае профиль амплификации может включать две стадии ПЦР в одном реакционном объеме (микропробирке или лунке микропланшета), различающиеся температурами отжига праймеров не менее чем на 10°С. При этом на первой стадии отжигаются и достраиваются только специфичные праймеры, имеющие высокую температуру плавления и истощающиеся к концу первой стадии, а при понижении температуры отжига на 10°С и более на второй стадии ПЦР начинают работать адаптерные праймеры.
Таким образом, в ходе ПЦР в едином реакционном объеме при первом профиле амплификации за счет гибридизации и элонгации специфичных праймеров при использовании геномной ДНК в качестве матрицы происходит наработка двуцепочечных ПЦР-продуктов, содержащих на концах последовательности, специфичные к адаптерным праймерам, а затем, при смене профиля амплификации, полученные ПЦР-продукты служат матрицей для наработки одноцепочечных фрагментов при использовании адаптерных праймеров с меньшей температурой отжига. Данная схема амплификации проиллюстрирована Фиг. 1.
Флуоресцентное маркирование исследуемых фрагментов микобактериального генома проводят, добавляя в ПЦР-смесь флуоресцентный субстрат, например конъюгат дезоксиуридинтрифосфата и красителя индодикарбоцианинового ряда, с длиной волны возбуждения, равной (640±5) нм, и длиной волны флуоресценции, равной (665±5) нм. В ходе ПЦР данный субстрат встраивается Taq-ДНК-полимеразой в растущую цепь ДНК, обеспечивая на выходе флуоресцентно-меченные ПЦР-продукты, анализируемые далее посредством электрофореза или гибридизации на специализированном олигонуклеотидном микрочипе.
Далее изобретение будет проиллюстрировано примером, который предназначен для обеспечения лучшего понимания сущности заявленного изобретения, но не должны рассматриваться как ограничивающие данное изобретение.
Пример
Одновременная амплификация фрагмента инсерционного элемента IS6110, фрагментов генов rpoB, katG, inhA, ahpC M. tuberculosis. Результаты электрофореза и гибридизации на специализированном олигонуклеотидном микрочипе для идентификации мутаций в геноме микобактерий туберкулезного комплекса, ассоциированных с устойчивостью к рифампицину и изониазиду. Оценка аналитической чувствительности.
С использованием алгоритма, представленного выше, сконструированы праймеры для одновременной амплификации фрагмента инсерционного элемента IS6110, фрагментов генов rpoB, katG, inhA, ahpC. Последовательности специфичных и адаптерных праймеров, участвующие в мультиплексной ПЦР для амплификации вышеуказанных сегментов M. tuberculosis, концентрации праймеров в реакционной смеси приведены в Таблице 1.
Таблица 1. Последовательности специфичных и адаптерных праймеров, их длины и концентрации, используемые для одновременной амплификации фрагмента инсерционного элемента IS6110, фрагментов генов rpoB, katG, inhA, ahpC.
| Праймер | Последовательность (5' - 3') | Длина, нк | Концентрация, нМ |
| rpoB-Fs* | ctctgcgagcataatg-agtgagacgggtgcacgtcgcggacct | 39 | 10 |
| rpoB-Rs | ggctgtacgctgtc-gttgatcaacatccggccggtggtcgc | 34 | 10 |
| katG-Fs | ctctgcgagcataatg-tggaagagctcgtatggcaccggaa | 43 | 10 |
| katG-Rs | ggctgtacgctgtc-cggtgtattgccaagcgccagcag | 41 | 10 |
| inhA-Fs | ctctgcgagcataatg-ccggaaatcgcagccacgttacgc | 40 | 10 |
| inhA-Rs | ggctgtacgctgtc-ggtaaccaggactgaacgggatacgaa | 37 | 10 |
| ahpC-Fs | ctctgcgagcataatg-atggtgtgatatatcacctttgcctgacagc | 44 | 10 |
| ahpC-Rs | ggctgtacgctgtc-tgactctcctcatcatcaaagcggaca | 42 | 10 |
| IS-Fs | ctctgcgagcataatg-aggatggggtcatgtcaggtggttcatcga | 46 | 10 |
| IS-Rs | ggctgtacgctgtc-gcgaagaaagccgacgcggtctttaaaatc | 36 | 10 |
| uni-Fa | ctctgcgagcataatg | 16 | 500 |
| uni-Ra | ggctgtacgctgtc | 14 | 2500 |
*Обозначение. F - прямой праймер, R - обратный праймер, индекс 's' означает специфичный праймер, индекс 'a' - адаптерный
Праймеры выбирали таким образом, чтобы длины получаемых ПЦР-продуктов - фрагментов исследуемых сегментов микобактериального генома имели следующие величины: IS6110 - 309 нуклеотидов (нк), rpoB - 212 нк, katG -166 нк, inhA - 133 нк, ahpC - 106 нк.
Реакционная смесь (30 мкл) включала 3 мкл буфера для HS-Taq полимеразы (ЗАО «Евроген, Россия), 3 мкл 2 мМ смеси дезоксинуклеозидтрифосфатов (ЗАО «Силекс», Россия), 3 мкл смеси праймеров в указанных в Таблице 1 концентрациях, 8 мкМ флуоресцентного субстрата IMD515-дУТФ (ИМБ РАН, Россия), 1 мкл HS-Taq-ДНК-полимеразы (ЗАО «Евроген», Россия) и 3 мкл образца геномной ДНК M. tuberculosis.
Использовался следующий профиль ПЦР: денатурация на 95°С, первый профиль амплификации - 40 циклов (95°С - 30 с, 64°С - 30 с, 72°С - 30 с) , затем второй профиль амплификации - 40 циклов (95°С - 30 с, 50°С - 30 с, 72°С - 30 с) и 72°С - 5 мин.
В качестве метода сравнения использовали методику анализа генома микобактерий туберкулезного комплекса из Набора реагентов для выявления микобактерий туберкулеза и определения их лекарственной чувствительности к рифампицину и изониазиду методом гибридизации на биологическом микрочипе «ТБ-Биочип-1» по ТУ 9398-001-02699501-2010 (Регистрационное удостоверение Федеральной службы по надзору в сфере здравоохранения и социального развития РФ № ФСР 2011/10088), описанной (D. Gryadunov, V. Mikhailovich, S. Lapa, N. Roudinskii, M. Donnikov, S. Pan'kov, O. Markova, A. Kuz'min, L. Chernousova, O. Skotnikova, A. Moroz, A. Zasedatelev and A. Mirzabekov. Evaluation of hybridisation on oligonucleotide microarrays for analysis of drug-resistant Mycobacterium tuberculosis. Clinical microbiology and infection 2005. Vol 11:p.531-539) и запатентованной (Мирзабеков А.Д., Михайлович В. М., Соболев А. Ю. Грядунов Д.А., Лапа С.А., Заседателев А.С. Способ одновременного обнаружения микобактерий туберкулезного комплекса и идентификации мутаций в днк микобактерий, приводящих к устойчивости микроорганизмов к рифампицину и изониазиду, на биологических микрочипах, набор праймеров, биочип и набор олигонуклеотидных зондов, используемые в способе. Патент РФ 2376387. Приоритет от 26.12.2005. Опубликовано 20.12.2009) ранее. Методика основана на двухстадийной ПЦР с целью одновременной амплификации фрагментов генов rpoB, katG, inhA, ahpC и инсерционного элемента IS6110, с последующей гибридизацией на специализированном биологическом микрочипе. Продукты обеих стадий ПЦР подвергаются обязательному электрофоретическому контролю. ПЦР-продукты, полученные на первой стадии ПЦР, являются матрицей для проведения второй стадии ПЦР (1 мкл реакционной смеси, содержащей ПЦР-продукты первой стадии, переносится в отдельную пробирку для проведения второй стадии ПЦР). Длины ПЦР-продуктов, соответствующие фрагментам генов rpoB, katG, inhA, ahpC и инсерционного элемента IS6110, получаемые на первой стадии ПЦР, идентичны указанным выше.
Результаты амплификации микобактериальной ДНК при использовании метода сравнения и заявляемой процедуры мультиплексной ПЦР в виде электрофоретической картины в 4% агарозном геле представлены на Фиг. 2. Дорожки:
1 - молекулярный маркер длин фрагментов;
2 - результат амплификации генов rpoB, katG, inhA, ahpC и инсерционного элемента IS6110 при использовании набора «ТБ-Биочип-1» и ДНК M. tuberculosis дикого типа в качестве матрицы;
3 - результат амплификации генов rpoB, katG, inhA, ahpC и инсерционного элемента IS6110 при использовании набора «ТБ-Биочип-1» и ДНК M. tuberculosis, содержащей мутации, приводящие к аминокислотным заменам Ser531>Leu в гене rpoB и Ser315>Thr в гене katG;
4 - результат амплификации генов rpoB, katG, inhA, ahpC и инсерционного элемента IS6110, полученный при проведении мультиплексной ПЦР, заявленной в настоящем способе, при использовании ДНК M. tuberculosis дикого типа в качестве матрицы;
5 - результат амплификации генов rpoB, katG, inhA, ahpC и инсерционного элемента IS6110 при использовании набора «ТБ-Биочип-1» и ДНК M. tuberculosis, содержащей мутации, приводящие к аминокислотным заменам Ser531>Leu в гене rpoB и Ser315>Thr в гене katG.
Как свидетельствуют результаты, представленные на Фиг. 2, вариант мультиплексной ПЦР, заявляемый в настоящем способе, позволяет проводить одновременную амплификацию пяти сегментов микобактериального генома.
Для оценки эффективности амплификации и флуоресцентного маркирования, ПЦР-продукты, полученные с использованием варианта мультиплексной ПЦР, заявляемой в настоящем способе, гибридизовали на специализированном олигонуклеотидном микрочипе, для идентификации мутаций в генах rpob, katG, inhA, ahpC генома M. tuberculosis, ассоциированных с устойчивостью к рифампицину и изониазиду, и входящего в состав набора реагентов «ТБ-Биочип-1». Гибридизацию проводили, как описано ранее (D. Gryadunov, V. Mikhailovich, S. Lapa, N. Roudinskii, M. Donnikov, S. Pan'kov, O. Markova, A. Kuz'min, L. Chernousova, O. Skotnikova, A. Moroz, A. Zasedatelev and A. Mirzabekov. Evaluation of hybridisation on oligonucleotide microarrays for analysis of drug-resistant Mycobacterium tuberculosis. Clinical microbiology and infection 2005. Vol 11:p.531-539).
Результаты гибридизации ПЦР-продуктов, полученных при использовании варианта мультиплексной ПЦР, заявляемой в настоящем способе и ДНК M. tuberculosis дикого типа, представлены на Фиг. 3.
В соответствии с описанным ранее алгоритмом интерпретации результатов гибридизации (Мирзабеков А.Д., Михайлович В. М., Соболев А. Ю. Грядунов Д.А., Лапа С.А., Заседателев А.С. Патент РФ 2376387. Приоритет от 26.12.2005. Опубликовано 20.12.2009) ячейки с олигонуклеотидами, комплементарными ДНК дикого типа, имеют большую интенсивность флуоресцентного сигнала, чем остальные ячейки внутри каждой группы. Таким образом, ДНК изучаемого объекта образует совершенные гибридизационные дуплексы с олигонуклеотидами, комплементарными последовательности ДНК дикого типа (чувствительного к рифампицину и изониазиду штамма микобактерий туберкулеза). Принадлежность ДНК данного штамма к микобактериям туберкулезного комплекса устанавливается путем наличия флуоресцентного сигнала в ячейках с иммобилизованным олигонуклеотидом на IS6110 (F8, I8). Совершенные гибридизационные дуплексы зафиксированы во всех группах ячеек, содержащих зонды, специфичные к последовательностям генов rpoB, katG, inhA, ahpC, элемента IS6110, что означает равномерную амплификацию и флуоресцентное маркирование с использованием мультиплексной ПЦР, заявляемой в настоящем способе.
Результаты гибридизации ПЦР-продуктов, полученных при использовании варианта мультиплексной ПЦР, заявляемой в настоящем способе и ДНК M. tuberculosis, содержащей мутации, приводящие к аминокислотным заменам Ser531>Leu в гене rpoB и Ser315>Thr в гене katG, представлены на Фиг.4.
В каждой из групп элементов биочипа интенсивность флуоресцентного сигнала в ячейке с олигонуклеотидом, комплементарным ДНК дикого типа, выше интенсивности сигнала остальных ячеек. Исключение составляют группы элементов D3 - D7 (1) и E1,E2, F1- F7 (2) (Фиг. 4).
Максимальной интенсивностью флуоресценции внутри группы D3-D7 обладает элемент D4. Следовательно, ДНК изучаемого объекта имеет точечную нуклеотидную замену A>T в положении 2431 гена rpoB (Genbank Acc. № L27989), что приводит к замене аминокислоты Ser на Leu в позиции № 531 и ведет к возникновению резистентности изучаемого штамма к рифампицину. Максимальной интенсивностью флуоресценции внутри группы E1,E2, F1-F7 обладает элемент E2. Таким образом определяется наличие в исследуемой ДНК нуклеотидной замены G на С в положении 1013 гена katG (Genbank Acc. № U06262), что приводит к замене аминокислоты Ser 315 на Thr в позиции № 315 и ведет к возникновению резистентности изучаемого штамма к изониазиду. Принадлежность ДНК данного штамма к микобактериям туберкулезного комплекса устанавливается путем наличия флуоресцентного сигнала в ячейках с иммобилизованным олигонуклеотидом на IS6110 (F8, I8). Совершенные гибридизационные дуплексы зафиксированы во всех группах ячеек, содержащих зонды, специфичные к последовательностям генов rpoB, katG, inhA, ahpC, элемента IS6110, что означает равномерную амплификацию и флуоресцентное маркирование с использованием мультиплексной ПЦР, заявляемой в настоящем способе.
Аналитическую чувствительность разработанной методики оценивали путем последовательных десятикратных разведений ДНК штамма M.tuberculosis H37Rv и проведением анализа, согласно вышеописанной процедуре. Предложенный способ позволяет воспроизводимо выявлять не менее 300 геном-эквивалентов ДНК микобактерий туберкулезного комплекса (что соответствует концентрации 100 геном-эквивалентов в 1 мкл образца) и идентифицировать в ней наличие мутаций, ответственных за резистентность к противотуберкулезным препаратам. При этом аналитическая чувствительность референс-метода набора «ТБ-Биочип-1» составляет 500 геном-эквивалентов.
Таким образом, предложенный в заявляемом способе вариант мультиплексной ПЦР позволяет эффективно проводить одновременную амплификацию и флуоресцентное маркирование нескольких (в настоящем примере - пяти) сегментов микобактериального генома. Заявляемый способ отличается высокой аналитической чувствительностью, сравнимой с референс-методом, при этом не требуется проведение двухстадийной амплификации в различных реакционных объемах, с обязательным электрофоретическим контролем каждой стадии ПЦР и переносом продуктов амплификации первой стадии в пробирку, содержащую реакционную смесь для второй стадии ПЦР.
Способ данного изобретения выгодно отличается от существующих в настоящее время аналогов сокращенной до одной стадией амплификации для получения одноцепочечных флуресцентно-меченных ПЦР-продуктов, исключает перенос ДНК-матрицы из одного реакционного объема в другой, что повышает устойчивость процедуры к контаминации ПЦР-продуктами и снижает трудоемкость анализа.
Хотя предпочтительные воплощения настоящего изобретения и их преимущества были подробно описаны выше, специалист в данной области сможет внести различные изменения, дополнения или, наоборот, что-то опустить, не выходя при этом за рамки данного изобретения, которые определяются прилагаемой ниже формулой изобретения.
Способ одновременной амплификации и флуоресцентного маркирования нескольких сегментов генома микобактерий туберкулезного комплекса, проводимых в едином закрытом реакционном объеме (микропробирке или лунке планшета), содержащем по меньшей мере две пары специфичных праймеров и пару адаптерных праймеров, а также конъюгат флуоресцентного красителя и дезкосинуклеозидтрифосфата, обеспечивающий флуоресцентное маркирование, и включающий:а) Этап амплификации, в котором происходит наработка и флуоресцентное маркирование ПЦР-продуктов, включающих специфичные сегменты микобактериального генома и фланкированных на 5'-концах последовательностями, комплементарными последовательностям адаптерных праймеров, и в котором используются:- по меньшей мере две пары специфичных праймеров, последовательности каждого из которых состоит из двух фрагментов, при этом последовательность фрагмента, включающего 5′-конец праймера, комплементарна последовательности одного из адаптерных праймеров, а последовательность фрагмента, включающего 3'-конец специфичного праймера, комплементарна последовательности сегмента микобактериального генома, при этом концентрация каждого из специфичных праймеров в реакционной смеси меньше концентрации адаптерных праймеров по меньшей мере в 50 раз;- геномная ДНК микобактерий в качестве матрицы для ПЦР;- компоненты реакционной смеси, обеспечивающие наработку и флуоресцентное маркирование ПЦР-продуктов, включающих специфичные сегменты микобактериального генома и фланкированных на 5′-концах последовательностями, комплементарными последовательностям адаптерных праймеров;б) Этап амплификации, в котором происходит наработка и флуоресцентное маркирование ПЦР-продуктов, включающих специфичные сегменты микобактериального генома, и в котором используются:- пара адаптерных праймеров, последовательности которых комплементарны последовательностям фрагментов, находящихся на 5′-концах ПЦР-продуктов, полученных на стадии (а), при этом разница в температурах отжига адаптерных и специфичных праймеров составляет не менее чем 10°C, а концентрации прямого и обратного адаптерных праймеров в реакционной смеси могут различаться в 5 и более раз, с целью получения преимущественно одноцепочечных ПЦР-продуктов;- ПЦР-продукты, полученные на стадии (а), служащие в качестве матрицы для ПЦР;- компоненты реакционной смеси, обеспечивающие наработку и флуоресцентное маркирование ПЦР-продуктов, включающих специфичные сегменты микобактериального генома.