Иммуноген для лечения и профилактики зависимости от опиатов
Иллюстрации
Показать всеИзобретение относится к биологии и медицине, в частности к наркологии, и может быть использовано для лечения и профилактики зависимости от опиатов. Изобретение раскрывает иммуноген для лечения и профилактики зависимости от опиатов, отличающийся тем, что в качестве иммуногена используют поликлональные антиидиотипические (вторичные) антитела к опиатам, а именно морфину и его производным. Данный иммуноген перспективен для лечения и профилактики зависимости у лиц, употребляющих опиаты, такие как морфин и его производные, в частности героин и кодеин. 6 ил., 2 пр.
Реферат
Изобретение относится к биологии и медицине, в частности к наркологии.
Известен иммуноген, представляющий собой конъюгаты производных морфина (6-гемисукцинильного и 3-O-карбоксиметильного) с белком-носителем (столбнячный анатоксин), способный, по результатам доклинических испытаний на грызунах, запускать синтез поликлональных антител к опиатам - морфину и его структурному аналогу героину - в результате повторного введения этих препаратов при активной иммунизации [EP 1767221 A2, 28.03.2007; US 20080241183 A1, 10.02.2008; US 008,008,457 В2, 30.08.2011]. При введении такого иммуногена в крови появляются в высоких титрах антитела к этим опиатам, способные связать поступающие в организм извне наркотики в кровяном русле и воспрепятствовать тем самым их проникновению в мозг через гематоэнцефалический барьер. В результате снижения положительного подкрепления угасает влечение к опиатам (морфину и его производным, в частности, героину), что было показано на модели внутривенного самовведения этих наркотиков грызунами.
Недостатком этого иммуногена является невозможность его применения в Российской Федерации в соответствии с Федеральным законом «О наркотических средствах и психотропных веществах» №3-Ф3, вступившим в силу 8 января 1998 г. Согласно пункту 6 статьи 31 этого закона «В Российской Федерации запрещается лечение наркомании наркотическими средствами и психотропными веществами, внесенными в Список II» (Постановление Правительства РФ от 30.06.1998 №681, ред. от 26.02.2013), а предложенный иммуноген предполагает введение в организм человека препарата, содержащего в своем составе наркотик. Хотя наркотик в препарате и соединен химическим (ковалентным) способом с белком-носителем, нельзя исключить нестабильность такого соединения, приводящую к самопроизвольному распаду на исходные составляющие, пусть даже в незначительных количествах.
Известен синтетический иммуноген для терапии и профилактики злоупотреблений наркотическими и психоактивными веществами [RU 2236257 C1, 15.09.2003], который представляет собой конъюгат в виде носителя - природного или искусственного белка (яичный альбумин, человеческий гаммаглобулин, микробные токсины) и наркотического или психотропного соединения из следующих групп низкомолекулярных соединений: ароматические пропанамины, или изохинолины, или дифенилметаны, или индоламины, или производные барбитуровой кислоты, или производные замещенных пиперидинов. Конъюгат модифицирован иммунокомпетентным полиэлектролитом - полиоксидонием. К недостаткам этого иммуногена, в котором используются наркотические вещества, относятся приведенные выше сведения о запрете применения в Российской Федерации таких препаратов для лечения наркомании в соответствии с №3-ФЗ «О наркотических средствах и психотропных веществах». Предлагаемый авторами упомянутого патента в качестве иммуногена для введения с целью нейтрализации опиатов в крови наркоманов конъюгат 3-гемисукцинильного производного налтрексона (налоксон и его структурный аналог пролонгированного действия налтрексон являются конкурентными антагонистами опиоидных рецепторов и разрешены к применению в клинической практике) с белком и полиоксидонием также нельзя применять для терапии или профилактики опийной наркомании, поскольку в случае острого отравления опиатами пострадавших трудно будет спасти введением налоксона. Налоксон будет связываться в кровяном русле антителами, выработанными в процессе многократных инъекций этого иммуногена, и не сможет воспрепятствовать действию наркотиков опийной группы на уровне опиоидных рецепторов мозга. Лечение опийной зависимости налтрексоном также будет невозможно из-за запуска образования антител к препарату при каждом его попадании в организм. Утверждение авторов о том, что такие антитела будут вырабатываться пожизненно, также делает этот иммуноген неприемлемым для лечения опийных наркоманов, поскольку в Российской Федерации принято лечение зависимости от опиатов длительным введением налтрексона.
Известно также средство для профилактики и лечения опийной наркомании [RU 2264228, 20.11.2005], представляющее собой иммуноген - первичные моноклональные антитела к опиатам, в частности, к конъюгату морфин-3БСА, при иммунизации которыми в организме животного или человека должны образовываться антиидиотипические (вторичные) антитела. Механизм действия такого средства, по мнению автора, связан с модификацией образуемыми антиидиотипическими антителами периферических опиоидных рецепторов, что отраженным образом может влиять на опиоидную систему мозга. Недостатком этого средства является достаточно сложная и дорогая технология получения моноклональных антител (получение поликлональных антител проще и дешевле), а также тот факт, что эффект от иммунизации будет наблюдаться только в случае присутствия в крови определенного уровня вторичных (антиидиотипических) антител к опиатам (морфину). Употребление опиатов, которое может иметь место, несмотря на иммунизацию, не будет дополнительно стимулировать выработку вторичных (антиидиотипических) антител к опиатам (морфину).
Техническим результатом предлагаемого нами изобретения является устранение вышеуказанных недостатков, расширение арсенала патогенетически обоснованных способов лечения и профилактики зависимости от опиатов, повышение эффективности терапии и предупреждение возможных побочных реакций за счет возможности применения иммуногена у человека, поскольку иммуноген не содержит в своем составе наркотические и психотропные средства, запрещенные к применению в Российской Федерации в соответствии с Федеральным законом «О наркотических средствах и психотропных веществах» №3-Ф3, вступившим в силу 8 января 1998 г.; стимуляция образования антител к наркотику, способных связать наркотик или его метаболиты в крови, при каждом повторном употреблении опиатов, благодаря наличию иммунологической памяти на иммуноген; отсутствию опасности связывания применяемых с лечебной целью конкурентных антагонистов опиоидных рецепторов - налоксона и налтрексона - третичными антителами к опиатам, а именно морфину и его производным, образуемым в результате серии повторных инъекций иммуногена.
Указанный результат достигается тем, что для лечения и профилактики зависимости от опиатов проводят серию инъекций иммуногена, представляющего собой поликлональные антиидиотипические (вторичные) антитела к опиатам, а именно морфину и его производным.
Этот иммуноген получают известным способом в результате иммунизации животных, не родственных человеку по иммуноглобулинам (например, кроликов, лошадей, баранов, крупного рогатого скота) [Клюкина B.C. Промышленные технологии производства тест-систем для диагностики инфекционных болезней свиней. Дисс. докт. биол. наук, Щелково, 2002], поликлональными идиотипическими (первичными) антителами к опиатам, а именно морфину и его производным. Первичные антитела к опиатам, а именно морфину и его производным, получают известным способом из сыворотки крови животных, серологически родственных человеку (к примеру, свиней) [Клюкина B.C. Промышленные технологии производства тест-систем для диагностики инфекционных болезней свиней. Дисс. докт. биол. наук, Щелково, 2002; Lunney J.К. Advances in swine biomedical model genomics. Int. J. Biol. Sci., 2007, 3, 179-184; Dreher F., Kamburov A., Herwig R. Construction of a pig physical interactome using sequence homology and a comprehensive reference human interactome. Evol. Bioinform., 2012, 8, 119-126], после повторных иммунизаций конъюгатами морфина и производных морфина с белком, ковалентно связанным с молекулой морфина через гидроксилы при атомах углерода в 6-ом и 3-ем положениях фенантренового кольца. Определенная часть антиидиотипических (вторичных) антител, согласно теории иммунных сетей Jerne N.K. [Towards a network theory of the immune system. Ann Immunol (Paris) 1974, 125C, 373-389], теоретически будет напоминать по конфигурации первоначальный антиген, т.е. морфин и его производные, конъюгированные с белком, и являться «внутренним образом» первоначального антигена. В результате инъекций предлагаемого нами иммуногена в организме человека может происходить образование третичных антител, напоминающих по своим характеристикам первичные антитела к опиатам.
Кроме того, в организме человека, иммунизированного предлагаемым иммуногеном, также будут вырабатываться вторичные (антиидиотипические) антитела к иммуноглобулинам G исходного животного, взятого для первичной иммунизации. Поэтому при выборе свиньи в качестве животного-продуцента первичных антител в организме человека при введении предлагаемого нами иммуногена будут образовываться вторичные антитела к свиному иммуноглобулину G, имеющие, по той же теории Jerne N.K., пространственное сходство с самим иммуноглобулином свиньи. Здесь важно отметить, что иммуноглобулин G (IgG) свиньи характеризуется высокой степенью гомологии с IgG человека, в результате чего неблагоприятные побочные реакции при введении таких антител будут сведены к минимуму.
Не вытекает явным образом из известного уровня техники, что образование в организме антител в ответ на введение иммуногена, представляющего собой антиидиотипические (вторичные) антитела к опиатам, а именно морфину и его производным, т.е. третичных антител, может реально уменьшить основные проявления опийной зависимости - влечение к опиатам и опийный абстинентный синдром, а также оказывать профилактическое действие.
Сущность изобретения состоит в том, что лечение и профилактику зависимости от опиатов осуществляют путем проведения серии повторных инъекций иммуногена, представляющего собой поликлональные антиидиотипические (вторичные) антитела к опиатам, а именно морфину и его производным, образованные в организме животных, не родственных человеку по иммуноглобулинам (например, кроликов, баранов, крупного рогатого скота, лошадей), в ответ на серию повторных инъекций первичных антител к опиатам, а именно морфину и его производным, при этом первичные антитела получают из сыворотки крови свиней, как серологически родственного человеку вида, после серии повторных инъекций смеси конъюгатов морфина и его производных с белком, ковалентно связанным с молекулой морфина через гидроксилы при атомах углерода в 6-ом и 3-ем положениях фенантренового кольца.
Иммуноген для лечения и профилактики зависимости от опиатов получают следующим образом.
В состав иммуногена входят поликлональные антиидиотипические (вторичные) антитела к опиатам, а именно морфину и его производным. Иммуноген может быть использован в смеси с известными усилителями иммунного ответа (адъювантами). В качестве адъювантов, допущенных для использования у животных, применяют коммерческие адъюванты Фрейнда (Sigma-Aldrich) - полный и неполный, представляющие собой водно-масляную эмульсию, содержащую и не содержащую микобактерии туберкулеза соответственно; биоразлагаемые полимеры [Kohn J., Niemi S.M., Albert E.C. et al. Single-step immunization using a controlled release, biodegradable polymer with sustained adjuvant activity. J. Immunol. Methods, 1986, 95, 31-38], липосомы [Patel G.B., Zhou H, KuoLee R, Chen W.J. Archaeosomes as adjuvants for combination vaccines. Liposome Res., 2004, 14, 191-202] и др. Адъюванты, разрешенные к применению у человека, могут включать, но не ограничиваться, окись алюминия [US 008,008,457 B2, 30.08.2011], различные соли алюминия, водно-масляные эмульсии, липосомы, бактериальные токсины [De Gregorio Е., Caproni Е, Ulmer JB. Vaccine adjuvants: mode of action. Vaccine adjuvants: mode of action. Front. Immunol., 2013, doi: 10.3389/fimmu. 2013.00214, PMID: 23914187 [PubMed], интерлейкин 12 [Portielje J.E., Kruit W.H., Eerenberg A.J., et al. Subcutaneous injection of interleukin 12 induces systemic inflammatory responses in humans: implications for the use of IL-12 as vaccine adjuvant. Cancer Immunol. Immunother, 2005, 54, 37-43] и др.
Количество белка в иммуногене может составлять 1-2 мг/кг массы тела. Количество адъюванта в смеси с иммуногеном может составлять 5-50 объемных процентов в зависимости от свойств применяемого адъюванта.
В состав иммуногена могут входить несущественные компоненты, такие как растворители, буферные растворы и консерванты. Предпочтительным растворителем в составе иммуногена является вода для инъекций. В случае нерастворимости в воде адъюванта иммуноген вводится в виде взвеси или эмульсии.
Все компоненты иммуногена должны быть стерильными, смешиваются в стерильных условиях, помещаются в стерильные флаконы или запаиваются в стерильные ампулы.
Три этапа получения иммуногена.
Этап 1. Синтез конъюгатов морфина и его производных с высокомолекулярным носителем, которым может быть, в частности, бычий сывороточный альбумин (БСА) или другие молекулы (столбнячный анатоксин, стафилококковый анатоксин и др.).
Для получения таких конъюгатов молекула морфина должна быть предварительно активирована введением в состав молекулы различных реакционных групп. Известно, что предпочтительными участками для химической модификации молекулы морфина являются фенольный гидроксил при атоме углерода в положении 3 фенантренового кольца в структурной формуле морфина и спиртовый гидроксил при атоме углерода в положении 6 [Anton В., Salazar A, Flores A, et al. Vaccines against morphine/heroin and its use as effective medication for preventing relapse to opiate addictive behaviors. Hum. Vaccin., 2009, 5, 214-229]. Антигены, образованные в результате химического сшивания модифицированных молекул морфина по гидроксилам при атомах углерода в 6-ом и 3-ем положении с молекулой белка-носителя, вызывают при активной иммунизации появление антител, которые будут в одинаковой степени узнавать морфин, героин, кодеин и продукты их метаболизма в результате ферментативного соединения в организме человека с глюкуроновой кислотой (морфин-3- и морфин-6-глюкурониды, также обладающие агонистической активностью по отношению к опиоидным рецепторам). При этом образуемые антитела не будут обладать специфичностью по отношению к конкурентным антагонистам опиоидных рецепторов (налоксону и налтрексону).
Нами использованы известные методики получения 3-O-карбоксиметильного (3-КММ) и 6-гемисукцинильного (6-ГСМ) производных морфина, а также конъюгатов этих производных морфина с бычьим сывороточным альбумином - БСА [Spector S., Parker C.W. Morphine: radioimmunoassay. Science, 1970, 168, 1347-1348; Wainer B.H., Fitch F.W., Rothberg R.M., Fried J. Morphine-3-succinyl-bovine serum albumin: an immunogenic hapten-proteih conjugate. Science, 1972, 176, 1143-1145; Wainer B.H., Fitch F.W., Rothberg R.M., Fried J. The structure of morphine monohemisuccinate. Science, 1972, 178, 647-648; Simon E.J., Dole W.P., Hiller J.M. Coupling of a new, active morphine derivative to sepharose for affinity chromatography. Proc. Natl. Acad. Sci. USA, 1972, 69, 1835-1837; Wainer B.H., Fitch F.W., Fried J, Rothberg R.M. A measurement of the specificities of antibodies to moiphine-6-succinyl-BSA by competitive inhibition of 14 C-morphine binding. J. Immunol., 1973, 110, 667-673; Hill J.H., Wainer B.H., Fitch F.W., Rothberg R.M. Delayed clearance of morphine from the circulation of rabbits immunized with morphine-6-hemisuccinate bovine serum albumin. J. Immunol., 1975, 114, 1363-1368].
3-O-карбоксиметильное производное морфина получают реакцией морфина гидрохлорида с 2-кратным мольным избытком хлоруксусной кислоты в 3N растворе гидроксида натрия. Реакцию ведут при перемешивании и комнатной температуре в течение 1 часа. Затем доводят pH реакционной смеси до 6,0-7,0 постепенным добавлением концентрированной соляной кислоты. Выпавший осадок отфильтровывают на стеклянном фильтре и промывают хлороформом. 3-КММ очищают перекристаллизацией из абсолютного этанола. При этом немодифицированный морфин остается в растворе, а 3-КММ выпадает в осадок. Продукт мигрирует при тонкослойной хроматографии на силикагеле в системе метанол : ледяная уксусная кислота (1:1) с Rf=0,4.
Сшивание производных морфина с белком (бычьим сывороточным альбумином или другим) проводят с помощью бифункционального реагента 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорида (EDC), реагирующего со свободными карбоксильными группами в эфирных производных 3-КММ и 6-ГСМ и с ε-аминогруппами остатков лизина в боковых цепях БСА, по известной методике [Spector S., Parker C.W. Morphine: radioimmunoassay. Science, 1970, 168, 1347-1348].
Модификацию БСА 3-O-карбоксиметилморфином проводят по следующей методике. К 100 мг БСА в 2,0 мл дистиллированной воды прибавляют при перемешивании 35 мг 3-O-КММ и 25 мг EDC. Перемешивают 24 часа при 20°C, затем диализуют против дистиллированной воды (2 смены по 2 л, затем в 2 л 0,01М калий-фосфатного буфера, pH 7,4). Полученный конъюгат лиофилизируют и хранят при +4°C или хранят в замороженном состоянии при -20°C.
Степень модификации БСА рассчитывают по разнице свободных аминогрупп в исходном белке БСА и в синтезированном конъюгированном препарате 3-O-КММ-БСА с использованием метода определения свободных аминогрупп в белковых препаратах с помощью 2,4,6-тринитробензолсульфокислоты (ТНБС) в соответствии с известной методикой [Goldfarb A.R. Reactivity of amino groups in proteins. Biochim. Biophys. Acta, 1970, 200, 1-3; Полевая О.Ю., Башарова Л.А., Шайдров B.B., Ковалев И.Е. Ковалентное связывание этаперизина с белком для получения антител, нейтрализующих физиологическое действие этаперазина. Хим.-фарм. ж., 1976, №9, 15-19]. Известно, что ТНБС реагирует только со свободными аминогруппами лизина в молекуле БСА с образованием тринитробензолсульфопроизводного лизина, все свободные остатки лизина в котором замещены. Молярное поглощение (экстинкция) такого соединения при 345 нм составляет 1,15·104. Количество свободных аминогрупп в немодифицированной молекуле БСА или в молекуле БСА, модифицированной каким-либо гаптеном (в нашем случае производным морфина) рассчитывают по формуле:
где Eмол - молярное поглощение БСА или конъюгата производного морфина с БСА, обработанных ТНБС, при 345 нм [Полевая О.Ю., Башарова Л.А., Шайдров В.В., Ковалев И.Е. Ковалентное связывание этаперизина с белком для получения антител, нейтрализующих физиологическое действие этаперазина. Хим.-фарм. ж., 1976, №9, 15-19].
Этим способом вначале было определено, что в молекуле БСА присутствуют 60 свободных аминогрупп, поскольку молярная экстинкция немодифицированного БСА при 345 нм составляет 6,9·105. Количество свободных аминогрупп в полученном конъюгированном препарате 3-O-КММ-БСА рассчитывают по той же формуле. В полученном нами конъюгированном препарате на 1 моль БСА приходится 9 молей 3-O-КММ. Таким образом, модификация белка составляет 15%.
6-гемисукцинильное производное морфина получают с помощью янтарного ангидрида. К 50 мг морфина гидрохлорида прибавляют 58 мг янтарного ангидрида в 2,5 мл пиридина, нагревают при 50°C в течение 8 час в колбочке с холодильником. Затем пиридин упаривают при 40°C в вакууме. Осадок промывают хлороформом на фильтре и сушат. При тонкослойной хроматографии на силикагеле в системе метанол : ледяная уксусная кислота (1:1) немодифицированный морфин остается на старте, тогда как М-6-ГС мигрирует с Rf 0,3. В полученном продукте обнаружены лишь следы немодифицированного морфина. Выход продукта не менее 95%.
Модификацию БСА полученным препаратом М-6-ГС проводят по следующей методике. К 50 мг БСА в 2,0 мл дистиллированной воды добавляют 15 мг М-6-ГС и 10 мг EDC, перемешивают на магнитной мешалке 15 час при комнатной температуре, затем проводят диализ в 0,01 М калий-фосфатном буфере с pH 7,4 (3×2 л). Полученный конъюгат лиофилизируют и хранят при +4°C или хранят при -20°C. Степень модификации белка в конъюгате, рассчитанная по методу реагирования свободных аминогрупп лизина с ТНБС, составила 7 молей М-6-ГС на 1 моль БСА, или 11,7%.
Этап 2. Получение первичных поликлональных антител к опиатам, а именно морфину и его производным.
Первичные поликлональные антитела к опиатам - морфину и его производным получают иммунизацией животных, родственных человеку по иммуноглобулинам, к примеру, свиней. Мы использовали для иммунизации мини-свинью Светлогорской породы, самку в возрасте 3 мес., весом 9 кг. Выбор нами этого вида обусловлен тем обстоятельством, что иммуноглобулины свиньи класса G (IgG) имеют большое сродство к IgG человека. По данным Клюкиной B.C. [Клюкина B.C. Промышленные технологии производства тест-систем для диагностики инфекционных болезней свиней. Дисс. докт. биол. наук, Щелково, 2002], перекрестная реактивность полученного автором конъюгата антител к IgG свиньи с пероксидазой хрена, с IgG человека колебалась в пределах 90-95%.
Первую инъекцию проводят внутривенно, вводя животным антиген, представляющий собой равную смесь конъюгированных препаратов 3-O-КММ-БСА и М-6-ГС-БСА, в дозе 1 мг/кг массы тела в 1 мл стерильного физиологического раствора в хвостовую вену. Вторую инъекцию делают через 7 дней внутримышечно в 2 точки задних конечностей в той же дозе в 2 мл физиологического раствора, предварительно смешанного с равным объемом полного адъюванта Фрейнда. Третью инъекцию делают через 14 дней после второй подкожно в 2 точки в области шейных лимфоузлов в той же дозе и в том же объеме физиологического раствора, предварительно смешанного с равным объемом неполного адъюванта Фрейнда. Реиммунизацию проводят через 3-6 мес. после последней инъекции в виде двух подкожных инъекций того же антигена в дозе 1 мг/кг массы тела в 2 мл физиологического раствора, смешанного с равными объемами полного (первая инъекция) или неполного (вторая инъекция) адъюванта Фрейнда в область шейных лимфоузлов с интервалом в 14 дней. Забор крови осуществляют из хвостовой вены на 9-е, 14-е, 21-е сутки.
Титры антител в полученных сыворотках определяют непрямым методом иммуноферментного анализа (ИФА) [Дзантиев Б.Б., Егоров A.M. Современное состояние и перспективы развития иммуноферментного анализа. Журн. Всесоюз. хим. о-ва им. Д. И. Менделеева, 1982. Т. 27, №4. С.442-449; Антитела. Методы. Книга 2 / под ред. Д. Кэтти. М.: «Мир», 1991. - 382 с.]. Для выявления титров первичных антител к морфиновой части конъюгированного антигена на твердой фазе полистирольного планшета (фирмы Nunc) сорбируют конъюгированный антиген 3-КММ или М-6-ГС с белком, отличным от БСА, к примеру, с лизоцимом. Такие конъюгированные антигены получают по методикам, описанным выше для БСА. Реакцию визуализируют, используя конъюгат антител к IgG свиньи с пероксидазой хрена (производства фирмы Sigma или собственного производства), и субстрат-хромогенную смесь (субстрат - перекись водорода, хромоген-ортофенилендиамин, Sigma). Для снижения неспецифического связывания и лучшего выявления специфических антител в буферный раствор для разведения сывороток и пероксидазного конъюгата добавляют 0,4% лошадиной сыворотки. После первого цикла иммунизации титры антител к морфину находились в диапазоне 2,4·10-3-1,3·10-4. После цикла реиммунизаций имеет место повышение титров до 2,6·10-4-1,0·10-5. За титр сыворотки принимают такое ее разведение, при котором величина оптической плотности в ИФА (за вычетом оптической плотности контроля пероксидазного конъюгата) превышает величину оптической плотности в контроле с соответствующим разведением нормальной свиной сыворотки (также за вычетом оптической плотности контроля пероксидазного конъюгата) в 2 раза.
Для последующей работы из сыворотки крови свиньи, содержащей первичные антитела к опиатам - морфину и его производным, выделяют иммуноглобулины класса G (IgG) методом ионообменной хроматографии на ДЭАЭ-сефадексе А-50 по методу Клюкиной B.C. [Промышленные технологии производства тест-систем для диагностики инфекционных болезней свиней. Дисс. докт. биол. наук, Щелково, 2002]. На первом этапе выделяют суммарную фракцию иммуноглобулинов методом осаждения 20% водным раствором полиэтиленгликоля (ПЭГ)-6000. Для этого к 5 мл сыворотки медленно, при помешивании добавляют равный объем раствора ПЭГ-6000, встряхивают в течение 15 мин при комнатной температуре и центрифугируют полученную смесь при 1000 g в течение 20 мин. Преципитат растворяют в 2,5 мл 0,01 М калий-фосфатного буфера, pH 7,4, содержащего 0,1 М натрия хлорида, и диализуют против того же буфера при +4°C в течение 18-20 час. Затем 2 мл полученного раствора IgG с концентрацией 50 мг/мл наносят на колонку с ДЭАЭ-сефадексом A-50 (1,5×30 см), уравновешенную 0,02 М калий-фосфатным буфером, pH 7,0, и элюируют IgG тем же буфером. Скорость элюции составляет 75 мл/час, объем фракций - 3 мл. Отобранные фракции, содержащие IgG, объединяют и концентрируют в 3 раза с помощью концентраторов (Spin-X UF 6 Corning) и центрифугирования при 4000 g в течение 30 мин.
Оптическую плотность измеряют на спектрофотометре при длине волны 280 нм. Для спектрофотометрического определения концентрации IgG в полученном препарате используют коэффициент молярной экстинкции 1,2. Практический выход IgG составляет, как правило, 20%.
Этап 3. Получение антиидиотипических (вторичных) антител к опиатам, а именно морфину и его производным.
Антиидиотипические (вторичные) антитела к опиатам, а именно морфину и его производным, получают путем иммунизации кроликов первичными антителами к опиатам - морфину и его производным - в виде очищенной на ДЭАЭ-сефадексе фракции IgG свиньи. Для иммунизации используют кроликов пород Серый великан, или Советская Шиншилла, или Калифорнийская, или др. в возрасте 7-8 мес., весом 5-6 кг, предпочтительно самок. Первую инъекцию проводят внутривенно, вводя животным антиген в дозе 1 мг/кг массы тела в 1 мл стерильного физиологического раствора в краевую ушную вену. Вторую инъекцию проводят через 7 дней введением того же антигена в той же дозе подкожно в 8 точек спины вдоль хребта (по 0,25 мл в каждую точку). Антиген предварительно разводят в 0,01 М калий-фосфатном буфере (pH 7,4), смешанном с равным объемом полного адъюванта Фрейнда. Третью инъекцию проводят через 14 дней после второй инъекции введением антигена в той же дозировке, смешанного с неполным адъювантом Фрейнда, подкожно в 8 точек спины. Забор крови из краевой ушной вены осуществляют на 9-й, 14-й, 21-й день после последней инъекции. Через 3 мес. после последней инъекции кроликов реиммунизируют теми же антигенами в дозе 1 мг/кг массы тела, смешанными в равных объемах с полным (первая инъекция) и неполным (вторая инъекция) адъювантом Фрейнда с интервалом в 14 дней. Инъекции проводят подкожно в 8 точек спины. Забор крови осуществляют аналогично на 9-й, 14-й, 21-й день после последней инъекции.
Следует подчеркнуть, что в организме кролика, иммунизированного свиными первичными антителами к опиатам, а именно морфину и его производным, вырабатываются как первичные антитела к иммуноглобулинам G свиньи, так и вторичные (антиидиотипические) антитела к опиатам - морфину и его производным, являющиеся лишь пространственным иммуноглобулиновым образом исходного антигена (а не субстанцией морфина). Титр полученных антител определяют непрямым методом ИФА. При этом в лунках полистирольного планшета сначала сорбируют антиген, использованный для иммунизации кролика (первичные антитела к опиатам - морфину и его производным, продуцированные свиньей), затем - полученную сыворотку иммунизированного кролика в раститровке. Реакцию визуализируют добавлением конъюгата антител к IgG кролика с пероксидазой хрена (производства фирмы Sigma или собственного) и описанной выше субстрат-хромогенной смеси. Для снижения неспецифического связывания и лучшего выявления специфических антител в буферный раствор для разведения сывороток и пероксидазного конъюгата добавляют 0,4% лошадиной сыворотки. Полученные титры варьировались от 2,4·10-4 до 1·10-5.
Подтверждением того, что полученные поликлональные антиидиотипические (вторичные) антитела содержат в себе клон, являющийся пространственным иммуноглобулиновым образом морфина, служит постановка непрямого ингибиторного ИФА, где связывание постоянной концентрации антиидиотипических (вторичных) антител кролика с антигеном, сорбированным на твердой фазе (первичные антитела), тормозится дозозависимым образом добавлением различных концентраций субстанции морфина в виде морфина гидрохлорида (от 10-3 М до 10-10 М). В контрольные лунки добавляют сыворотку нормального (не иммунизированного) кролика. При этом на ингибиторной кривой можно было выделить 2 пика торможения связывания морфином: больший пик (24,8%-21,6% торможения) в области концентраций ингибитора 10-6-10-7 М и меньший пик (10,3%) в области концентраций ингибитора 10-10 М.
Из сывороток крови кроликов, содержащих вторичные антитела к опиатам, а именно морфину и его производным, выделяют иммуноглобулины класса G (IgG) методом ионообменной хроматографии на ДЭАЭ-сефадексе А-50 известным способом [Иммунологические методы / под ред. X. Фримеля, Изд-во «Мир», Москва, 1979, стр.267] с небольшой модификацией. На первом этапе к 6 мл сыворотки добавляют равный объем 20% водного раствора полиэтиленгликоля (ПЭГ) с мол. массой 6000 при помешивании в течение 15 мин при комнатной температуре, затем центрифугируют при 1000 g 20 мин. Преципитат растворяют в 3 мл 0,01 М калий-фосфатного буфера (pH 7,4), содержащего 0,1М натрия хлорида, и диализуют против того же буфера при +4°C в течение 18-20 час. Колонку с ДЭАЭ-сефадексом А-50 (1,5×30 см) уравновешивают стартовым калий-фосфатным буфером, pH 7,2. На колонку наносят 4 мл IgG после диализа с концентрацией 30 мг/мл. Первую фракцию IgG элюируют тем же буфером. Вторую фракцию элюируют градиентом 0,01-0,2М калий-фосфатного буфера (pH 8). Скорость элюции составляет 75 мл/час, объем фракций - 3 мл. Оптическую плотность фракций измеряют на спектрофотометре при длине волны 280 нм. Для определения концентрации полученного препарата IgG используют коэффициент молярной экстинкции ε=1,2. Отобранные фракции, содержащие оба пика IgG, объединяют и концентрируют в 3 раза с помощью концентраторов (Spin-X UF 6 Corning) и центрифугирования при 4000 g в течение 30 мин. Практический выход IgG составляет, как правило, 60%.
Иммуноген может быть изготовлен в виде различных дозированных форм, хорошо известных из уровня техники. Примеры таких форм включают растворы для инъекций, накожные аппликации и аэрозоли.
Иммуноген применяют следующим образом. Взвесь или суспензию, содержащую поликлональные антиидиотипические (вторичные) антитела к опиатам, а именно морфину и его производным и усилитель иммунного ответа, например окись алюминия, вводят подкожно, внутримышечно или интраназально. Инъекции иммуногена можно проводить через 1-2 недели, курс может включать 3-6 инъекций.
Изобретение может быть продемонстрировано следующими примерами.
Пример 1.
Купирование проявлений зависимости от опиатов иммунизацией крыс линии Wistar иммуногеном - поликлональными антиидиотипическими антителами кролика к опиатам, а именно морфину и его производным - лечение
Эксперименты проведены на 40 крысах линии Wistar, вес 200 г, самцы. Крысы были произвольно разбиты на 4 группы по 10 животных в каждой. Крысы содержались в индивидуальных клетках со свободным доступом к стандартному сухому лабораторному корму и воде в двух поилках, при естественном освещении.
Оценку лечебного эффекта специфической иммунизации проводили двумя способами: 1) путем исследования предпочтения наркотика зависимыми от опиатов животными в тесте свободного выбора, что можно рассматривать как эквивалент влечения наркомана к наркотику, и 2) путем исследования выраженности зависимости по тяжести опийного абстинентного синдрома.
1. Влияние специфической иммунизации на предпочтение раствора морфина в условиях свободного выбора (влечение)
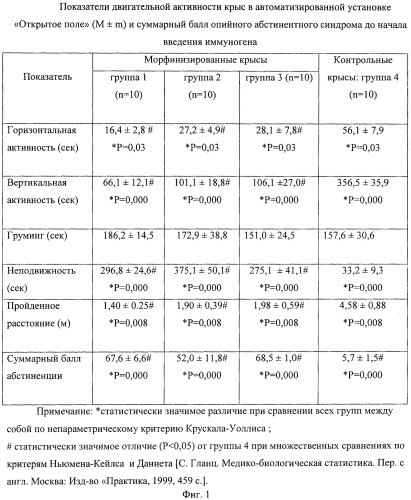
Первоначально крысы первых трех групп были наркотизированы морфином в форме морфина гидрохлорида, который вводили внутрибрюшинно в течение 7 дней два раза в сутки в возрастающих дозах от 5 до 50 мг/кг на одну инъекцию в стерильном физиологическом растворе. Утром 8-го дня крысы получали одну инъекцию морфина в дозе 60 мг/кг. Крысы группы 4 служили контролем (вместо морфина они получали инъекции физиологического раствора). Через 2 часа после последней утренней инъекции всем крысам поочередно вводили внутрибрюшинно раствор налоксона гидрохлорида в дозе 1 мг/кг, вызывая тем самым быстрое развитие абстинентного синдрома у наркотизированных крыс, сразу после чего животных помещали в автоматизированную установку «Открытое поле» (фирма Laboras, Нидерланды). Наблюдение вели в течение 15 мин. Учитывали такие показатели, как горизонтальная и вертикальная двигательная активность, общее время неподвижности, груминг (реакция чистки), диарея, отряхивания «мокрой собаки», встряхивание передними лапами и головой, птоз, скрежет зубами или жевание. По специфическим признакам высчитывали суммарный балл опийного абстинентного синдрома в небольшой модификации [Судаков С.К., Борисова Е.В., Русаков Д.Ю. Метод количественной оценки синдрома отмены у морфин-зависимых крыс. Эксперим. и клинич. фармакол., 1994, т.57, №2, с.60]. Результаты оценки тяжести абстинентного синдрома в трех группах морфинизированных крыс в сравнении с контрольной группой 4 представлены на фиг.1.
Как видно из представленных данных, крысы первых трех групп характеризуются наличием у них признаков опийной зависимости, о чем свидетельствует статистически значимое повышение по сравнению с контрольной (неморфинизированной) группой суммарного балла абстиненции, а также значимое снижение двигательной активности, как горизонтальной, так и вертикальной. Снижение двигательной активности соответствует статистически значимому повышению общей длительности неподвижного состояния, а также снижению пройденного расстояния. Следует отметить, что по критерию Ньюмена-Кейлса все три накротизированные группы (1, 2 и 3) по исследованным параметрам между собой значимо не различаются.
После тестирования крыс всех групп переводят на свободный выбор между раствором 2,5% сахарозы в воде и раствором морфина гидрохлорида в 2,5% растворе сахарозы для исследования предпочтения. Регистрируют потребление каждого раствора и рассчитывают коэффициент предпочтения как отношение объема выпитого раствора морфина гидрохлорида к общему объему выпитой жидкости.
Одновременно начинают введение животным иммуногена (активная иммунизация).
Группа 1 (опытная) получает инъекцию иммуногена (антиидиотипические антитела к опиатам - морфину и его производным - кролика). В первой инъекции крысы этой группы получают раствор очищенных иммуноглобулинов кролика, иммунизированного первичными антителами к опиатам, а именно морфину и его производным, продуцированным свиньей, в дозе 2 мг/кг (0,4 мг на крысу по белку) в 4 точки спины вдоль хребта подкожно. Антитела растворяют в 0,5 мл стерильного физиологического раствора и смешивают с полным адъювантом Фрейнда (ПАФ) в объемном соотношении 1:1.
Группа 2 (группа сравнения) получает инъекцию нормального кроличьего иммуноглобулина в такой же дозе по белку и в таком же адъюванте в аналогичные точки, как и группа 1.
Группа 3 (наркотизированный контроль) получает инъекцию того же объема адъюванта (ПАФ), смешанного с физиологическим раствором в объемном соотношении 1:1 в те же точки.
Группа 4 (контрольная) получает инъекцию физиологического раствора в том же объеме в те же точки.
Вторую инъекцию делают через 14 дней после первой. Крысы группы 1 получают внутрибрюшинно инъекцию иммуногена в дозе 5 мг/кг (1 мг на крысу) в стерильном физиологическом растворе без адъюванта. Крысы группы 2 получают такую же дозу нормального иммуноглобулина G кролика, крысы группы 3 и группы 4 получают внутрибрюшинно инъекцию только физиологического раствора.
Третью инъекцию делают через 7 дней после второй также внутрибрюшинно. При этом крысы группы 1 получают иммуноген в дозе 10,0 мг/кг (2 мг на крысу), крысы группы 2 получают инъекцию нормального кроличьего иммуноглобулина G в той же концентрации. Крысы групп 3 и 4 получают внутрибрюшинно инъекцию физиологического раствора.
Иммунизацию крыс проводят на фоне свободного выбора между двумя поилками с растворами сахарозы и морфина в сахарозе с целью оценки предпочтения по коэффициенту предпочтения.
Результаты анализа динамики предпочтения представлены на фиг.2. Предпочтение оценивают, начиная с 8-го дня пребывания в условиях свободного выбора и заканчивают на 23-й день. За это время крысы получают 3 инъекции иммуногена, причем окончательное тестирование проводят на 7-й день после 3-ей (последней) инъекции иммуногена. Как видно из представленных данных, только в группе 1, получавшей инъекции иммуногена (антиидиотипические - вторичные - антитела кролика к опиатам, а именно морфину и его производным, отмечено снижение коэффициента предпочтения раствора морфина в свободном выборе в среднем на 42% в отличие от всех других групп сравнения, где отмечено даже повышение предпочтения.
Таким образом, снижение предпочтения опиата - морфина в тесте свободного выбора, являющееся экспериментальным аналогом снижения влечения к наркотику у зависимых лиц, свидетельствует о достижении положительного эффекта лечения зависимости от опиатов - морфина и его производных, в частности, таких как героин и кодеин, данным иммуногеном.
Возможность расширения эффективности предлагаемого нами иммуногена для лечения зависимости не только от опиата-морфина, но также и от других опиа