Синтетическая днк, кодирующая эритропоэтин человека, содержащий её вектор, способ получения штамма-продуцента эритропоэтина, штамм-продуцент эритропоэтина
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Предложены синтетическая ДНК, кодирующая эритропоэтин человека, имеющая последовательность Seq ID No. 1, содержащий ее вектор экспрессии, способ получения штамма-продуцента эритропоэтина и штамм клеток яичников китайского хомячка - продуцент рекомбинантного эритропоэтина человека, депонированный под номером РККК(П) 761 Д. Изобретение позволяет повысить уровень экспрессии рекомбинантного эритропоэтина человека. 5 н.п. ф-лы, 1 табл., 8 ил., 4 пр.
Реферат
Область изобретения
Данное изобретение относится к области медицины и биотехнологии.
Уровень техники
Эритропоэз, образование красных кровяных телец, осуществляется непрерывно на протяжении всей жизни человека для компенсации разрушенных клеток. Эритропоэз представляет собой чрезвычайно точно регулируемый физиологический механизм, позволяющий вырабатываться достаточному количеству эритроцитов для правильной оксигенации тканей. Известно, что образование эритроцитов происходит в костном мозге под контролем гормона белковой природы, эритропоэтина.
Эритропоэтин человека представляет собой гликопротеин с молекулярным весом приблизительно 34000 Да, который вырабатывается многими типами тканей, но главным образом почками. Полипептидная цепь эритропоэтина человека содержит 192 аминокислотных остатка и может быть N-гликозилирована по трем сайтам. От степени гликозилирования зависят активность и стабильность молекулы эритропоэтина in vivo. Функцией эритропоэтина является стимулирование конверсии первичных предшествующих клеток в костном мозге в проэритробласты, которые, созревая, превращаются в зрелые эритроциты - переносчики кислорода. В обычных условиях, когда ткани здорового организма получают достаточное количество кислорода, эритропоэтин содержится в плазме крови в очень низких концентрациях (10-15 мМЕ/мл). Эта низкая концентрация достаточна для поддержания воспроизводства красных кровяных телец взамен выбывающих в процессе старения.
Однако концентрация эритропоэтина в крови многократно возрастает в условиях гипоксии, когда снижается перенос кислорода кровяными клетками. Гипоксия может быть вызвана, например, потерей большого количества крови при кровотечениях, разрушением эритроцитов вследствие радиоактивного облучения, снижением потребления кислорода при нахождении в высоких слоях атмосферы, а также при анемиях (Кетлинский С.А., Симбирцев А.С. Цитокины, СПб, 2008). В частности, резкое падение концентрации эритропоэтина в крови наблюдается у больных с хронической почечной недостаточностью, что, в свою очередь, вызывает характерную для данного состояния анемию.
Все вышеперечисленное объясняет широкое клиническое применение эритропоэтина, в частности рекомбинантного эритропоэтина человека, для лечения ряда патологических состояний. Главный результат применения эритропоэтина связан с возможностью восстановить собственное кроветворение и компенсировать анемию без переливания донорской крови. На этом фоне у больных значительно улучшаются показатели функционирования сердечно-сосудистой системы, повышается работоспособность и в целом улучшается качество жизни.
Рекомбинантный эритропоэтин человека получают очисткой из среды культивирования клеток высших эукариот, трансформированных генетическими конструкциями, обеспечивающими синтез эритропоэтина. Процесс получения клеточных линий (штаммов клеток) - продуцентов включает длительный процесс селекции таких штаммов с многократным отбором наиболее продуктивных и стабильных по продукции эритропоэтина клеток, после чего проводят адаптацию отобранных клонов к росту в бессывороточной среде культивирования клеток. Очистка эритропоэтина из среды культивирования клеток включает обычно несколько хроматографических стадий. В связи с постоянным расширением производства данного белка для его использования в медицинской практике и высокой себестоимостью производства постоянно проводится работа по повышению продуктивности клеточных линий - продуцентов эритропоэтина и по оптимизации условий культивирования клеток.
Наиболее близким к настоящему изобретению является клон клеток яичников китайского хомячка 41Н9, продуцирующий эритропоэтин человека (ЕА011619). Клетки данного клона при культивировании в условиях адгезионного роста в бессывороточной среде в течение 7 дней выделяли в среду 91 мг эритропоэтина/л.
Сущность изобретения
Задачей, решаемой авторами, являлось достижение высокого уровня продукции клетками рекомбинантного эритропоэтина человека при их культивировании в бессывороточной среде с химически определенным составом.
Технической задачей являлось конструирование экспрессионных векторов, получение трансфецированных данными векторами клеток яичников китайского хомячка, отбор наиболее продуктивного и стабильного по данному признаку клона клеток с последующим изучением динамики роста клеток и накопления целевого продукта - рекомбинантного эритропоэтина человека, анализ биологической активности полученного рекомбинантного эритропоэтина в сравнении с референтным образцом.
Данная задача решена тем, что предложена синтетическая ДНК, кодирующая эритропоэтин человека, имеющая последовательность Seq ID No. 1. Указанная ДНК предназначена для экспрессии в клетках яичника китайского хомячка.
Также предложен вектор экспрессии, содержащий указанную ДНК.
Предложен способ получения штамма-продуцента эритропоэтина, включающий в себя трансфекцию клеток, дефектных по гену дигидрофолатредуктазы, смесью двух векторов экспрессии, содержащих ДНК по изобретению, один из которых содержит в качестве селективного маркера ген устойчивости к неомицину/G418, а второй содержит в качестве селективного маркера ген устойчивости к метотрексату, с последующей селекцией клонов, одновременно устойчивых к G-418 и метотрексату.
Целесообразно, когда в указанном способе клетки представляют собой клетки яичника китайского хомячка.
Предложен также штамм клеток яичников китайского хомячка - продуцент рекомбинантного эритропоэтина человека, депонированный под номером РККК(П) 761 Д.
Подробное описание изобретения
Технический результат был достигнут использованием высокопроизводительного и стабильного штамма клеток китайского хомячка (СНО) - продуцента рекомбинантного эритропоэтина человека, обеспечивающего накопление в среде культивирования 300 мг/л эритропоэтина за 12 суток культивирования в бессывороточной среде с химически определенным составом.
Данный штамм клеток яичников китайского хомячка СНО-ЕРО/19Е4 - продуцент эритропоэтина человека был помещен в Специализированную коллекцию культур клеток позвоночных Российской коллекции клеточных культур 05.09.2013 под № РККК(П) 761 Д.
Штамм представляет собой первичный продуцент эритропоэтина человека.
Родословная штамма:
Родительская клеточная линия CHOdhfr-. Трансфекция плазмидами pBVneo/hER и pBVdhfr/hER, отбор стабильного высокопродуктивного клона на среде без гипоксантина/тимидина с 500 мкг/мл G-418.
Число пассажей к моменту депонирования - 15.
Стандартные условия выращивания: Среда CD CHO (hivitrogen) без гипоксантина/тимидина с 8 мМ глутамина, 500 мкг/мл G-418, 37°С, 8% СО2.
Культуральные свойства: Суспензионное культивирование в пробирках, колбах или 6-луночных платах на орбитальном шейкере. Посевная доза 0,2-0,3×106/мл, пересев каждые 3-4 суток. Время удвоения 22-24 часа.
Данные по видовой принадлежности: Cricetulus griseus (ПЦР-анализ с видоспецифичными праймерами).
Продуцирует рекомбинантный эроитропоэтин человека (оценка с помощью твердофазного иммуноферментного анализа, вестерн-блота, биологического теста).
Рекомбинантный эритропоэтин человека секретируется в культуральную среду в концентрации не менее 8 пг на клетку в сутки. Стабильность культивирование не менее 25 пассажей. Определение продукции с помощью иммуноферментного анализа.
Способ криоконсервирования: фетальная сыворотка с 10% DMSO, заморозка до -70°С со скоростью 1°С/мин, далее помещение в жидкий азот, жизнеспособность после размораживания и отмывки криоконсерванта 85% (с трипановым синим).
Возможно культивирование клеток в среде DMEM с 10% фетальной сыворотки (адгезионный тип роста) без дополнительной адаптации.
Графические материалы
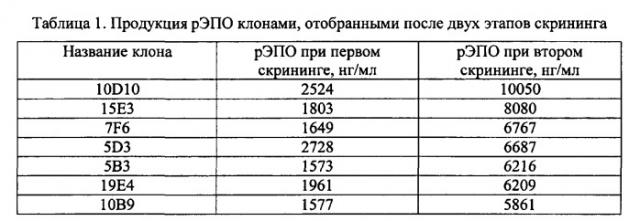
Фиг. 1 - карта плазмидного вектора pBVneo/hER.
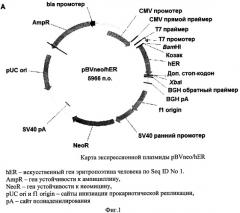
Фиг. 2 - карта плазмидного вектора pBVdhfr/hER.
Фиг. 3 - Динамика VCD клеток семи кандидатных клонов.
Фиг. 4 - Динамика жизнеспособности клеток семи кандидатных клонов.
Фиг. 5 - Динамика продукции рЭПО клетками семи кандидатных клонов.
Фиг. 6 - Динамика VCD, жизнеспособности и уровня рЭПО в культуре клеток клона 19Е4 на первых пассажах пассирования.
Фиг. 7 - Динамика VCD, жизнеспособности и уровня рЭПО в культуре клеток клона 19Е4 через 2 месяца непрерывного пассирования.
Фиг. 8 - Пролиферация клеток TF-1 под действием рЭПО, выделенного из супернатанта клеток штамма 19Е4, и референтного образца ВРЕ.
Seq ID No 1 - последовательность искусственного гена, кодирующего эритропоэтин человека.
Изобретение поясняется следующими примерами:
Пример 1. Создание векторных конструкций для экспрессии эритропоэтина в клетках СНО
Дизайн нуклеотидной последовательности гена, кодирующего эритропоэтин человека, осуществляли с учетом частоты использования кодонов в геноме китайского хомячка. Полученная последовательность, представленная в Seq ID No 1, кодирует последовательность эритропоэтина человека, включая сигнальный пептид, и фланкирована с 5′-конца сайтом рестрикции BamHI и последовательностью Козак, а с 3′-конца - дополнительным стоп-кодоном taa, расположенным непосредственно после «естественного» стоп-кодона tga, и сайтом рестрикции Xbal. Данная последовательность была синтезирована с помощью автоматизированного химического синтеза и вставлена по вышеуказанным сайтам рестрикции в два экспрессионных вектора, первый из которых содержал в качестве селективного маркера ген устойчивости к неомицину/G-418, а второй - ген дигидрофолат-редуктазы. В результате были получены две экспрессионных плазмиды, pBVneo/hER и pBVdhfr/hER, соответственно, карты которых представлены на Фиг. 1 и 2. Правильность синтеза гена и сборки плазмид были подтверждены сиквенированием.
Пример 2. Трансфекция клеток и селекция высокопродуктивного штамма
Для трансфекции была использована клеточная линия CHO-S(Dhfr-), адаптированная к суспензионному росту в бессывороточной среде. Клетки культивировали в среде CD-CHO Medium (Invitrogen) с добавлением 8 тМ Ultraglutamine (Lonza) и HT-media supplement (Invitrogen). Трансфекцию проводили с помощью реагента Lipofectamine™ 2000 (Invitrogen). Для трансфекции использовали смесь плазмид pBVneo/hER и pBVdhfr/hER в соотношении 1:1. Селекцию проводили в среде CD-CHO Medium (Gibco) с 8 mM Ultraglutamine (Lonza) и 500 мкг/мл антибиотика G-418 (Gibco).
Через 48 часов после трансфекции клетки переводили на селективную среду, в которой культивировали в течение 25 суток, а затем клонировали методом лимитирующих разведений. Было проанализировано 240 индивидуальных клонов, демонстрировавших стабильный рост в селективной среде. Индивидуальные клоны идентифицировали визуально, по мере увеличения количества клеток их переносили в 24-луночные платы, откуда отбирали супернатанты для первичного скрининга, который проводился с помощью ИФА (Human Erythropoietin Platinum ELISA, eBiosciences). Всего после первичного скрининга было отобрано для дальнейшей работы 50 клонов, в супернатантах которых уровень рЭПО превысил 2 мкг/мл,
Клетки 50 клонов с максимальной продукцией по результатам первичного скрининга наращивали и высевали в плотности 3×105/мл в 1 мл культуральной среды в лунке 24-луночной платы и культивировали 7 суток. После определяли концентрацию рЭПО в супернатантах с помощью ИФА.
По результатам второго этапа скрининга было отобрано 7 индивидуальных клонов, в супернатантах которых концентрация рЭПО была максимальной. Наименования этих клонов, а также концентрации рЭПО в их супернатантах при первом и втором скрининге приведены в таблице 1. В последующих экспериментах было проведено более детальное изучение культуральных свойств и продуктивности семи кандидатных клонов.
На третьем этапе скрининга проводили культивирование клеток 7 клонов во флаконах Эрленмейера объемом 250 мл, с исходной плотностью клеток 300 тыс/мл, по 100 мл на флакон. Среда для культивирования представляла собой среду CD СНО с 8 мМ Ultraglutamine и 30% питательной добавки СНО CD EfficientFeed™ A (Invitrogen). Культивирование проводили при 37°С, 8% CO2 и скорости встряхивания 125 об/мин. Ежедневно отбирали образец каждой культуры и измеряли плотность жизнеспособных клеток (VCD), жизнеспособность, а также концентрацию рЭПО в среде культивирования с помощью ИФА. Полученные результаты приведены на Фиг. 3-5.
Из Фиг. 3-5 видно, что все семь кандидатных клонов демонстрировали приблизительно схожую динамику роста, достигая пиковой плотности клеток порядка 8-10×106/мл в течение примерно 9 суток, и далее сохраняли жизнеспособность более 80% в течение еще 4-7 суток. При этом различия в уровне продукции рЭПО кандидатными клонами были достаточно выражены: максимальная продукция, достигающая 180 мкг/мл, была зафиксирована в клонах 7F6 и 5В3, тогда как наименьший уровень рЭПО был отмечен в супернатанте клона 10D10 (100 мкг/мл). В культурах пяти из семи кандидатных клонов было отмечено резкое падение уровня рекомбинантного эритропоэтина после 13 суток культивирования, что совпадало со значимым снижением жизнеспособности культур. В двух клонах, 19Е4 и 5D3 падение жизнеспособности имело место на 15-16 сутки и в супернатантах до 15 суток включительно концентрация рЭПО не снижалась. С учетом проанализированных культуральных показателей, а также стабильности рЭПО в супернатантах, в качестве целевого штамма-продуцента был выбран клон 19Е4.
Для увеличения продуктивности клона было проведено два раунда амплификации в восходящих концентрациях метотрексата (20 нМ и 100 нМ). Далее культура была реклонирована в среде без метотрексата и криоконсервирована (создан мастер-банк).
Пример 3. Анализ продукции рЭПО штаммом-продуцентом 19Е4
Для анализа стабильности продукции эритропоэтина криоампулу с клетками клона 19Е4 размораживали и культивировали клетки в среде CD-CHO с добавлением 8 мМ глутамина и 500 мкг/мл G-418. Культивирование проводилось в колбе Эрленмейера на шейкере (рабочий объем 30 мл) с пересевом 2-3 раза в неделю в течение 2 месяцев. Анализ кривой роста и продукции рЭПО проводился в начале эксперимента и после 2 месяцев культивирования.
На Фиг. 6 представлена динамика содержания живых клеток в культуре (VCD), жизнеспособности клеток и концентрации рЭПО в супернатанте клеток 19Е4 на первых пассажах. Культура сохраняла высокую жизнеспособность до 14 суток, при этом концентрация жизнеспособных клеток достигала за 8 суток 8×106 клеток/мл, а уровень рЭПО уже к 10 дню составлял около 300 мкг/мл и сохранялся приблизительно на этом уровне еще 5 суток.
При пассировании клеток клона 19Е4 в течение 2 месяцев динамика увеличения клеточной массы после пересева была достаточно стабильной: за 3 суток клетки с 200 тыс/мл достигали плотности 1,2-1,4 млн/мл. Жизнеспособность при этом колебалась от 88% до 97%. После 2 месяцев пассирования повторно оценивали динамику роста и продукции рЭПО. Результаты представлены на Фиг. 7. Как видно из рисунка, динамика роста клеток была практически такой же, как в начале культивирования - максимальная плотность достигалась на 9 сутки (около 10 млн/мл), высокая жизнеспособность сохранялась в течение 12-13 дней, а плато уровня рЭПО в супернатантах достигалось на 10-11 день. Пиковая концентрация целевого белка составила 320 мкг/мл.
Таким образом, непрерывное культивирование в течение 2 месяцев клеток высокопродуктивного штамма 19Е4 не сопровождалось существенными изменениями в динамике роста и продукции целевого белка. Это обстоятельство указывает на пригодность клеток штамма 19Е4 к промышленному культивированию, в том числе в условиях перфузионного культивирования.
Пример 4. Анализ биологической активности рЕПО, продуцируемого клетками штамма 19Е4
Для изучения биологической активности рекомбинантного белка, секретируемого клетками штамма 19Е4, данные клетки культивировали в колбе Эрленмейера в течение 12 суток, затем супернатанты осветляли центрифугированием при 1000 g с последующей фильтрацией через фильтр с диаметром пор 0,22 мкм. Очистка рекомбинантного эритропоэтина проводилась с помощью иммуноаффинной хроматографии (использовали колонку с иммуносорбентом 6-4А3-сефароза (ООО «Капель») объемом 15 мл). Концентрацию белка в полученном образце определяли спектрофотометрически, после чего анализировали биологическую активность в тесте пролиферации клеток линии TF-1 в сравнении с референтным образцом эритропоэтина Британской фармакопеи (ВРЕ, 32500 Ед во флаконе). Интенсивность пролиферации определяли по включению 3H-тимидина в кислотонерастворимый осадок. Результаты, представленные на Фиг. 8, показывают, что рЭПО, выделенный из супернатанта клеток 19Е4, и контрольный образец ВРЕ обладают идентичной активностью, дозозависимо усиливая пролиферацию клеток TF-1 в диапазоне концентраций от 0,1 до 100 мкг/мл.
1. Синтетическая ДНК, кодирующая эритропоэтин человека, имеющая последовательность Seq ID No. 1.
2. ДНК по п. 1 для экспрессии в клетках яичника китайского хомячка.
3. Вектор экспрессии, содержащий ДНК по п. 1.
4. Способ получения штамма клеток яичника китайского хомячка - продуцента рекомбинантного эритропоэтина, включающий в себя трансфекцию клеток яичника китайского хомячка, дефектных по гену дигидрофолатредуктазы, смесью двух векторов экспрессии, содержащих ДНК по п. 1, один из которых содержит в качестве селективного маркера ген устойчивости к неомицину/G418, а второй содержит в качестве селективного маркера ген устойчивости к метотрексату, с последующей селекцией клонов, одновременно устойчивых к G-418 и метотрексату.
5. Штамм клеток яичников китайского хомячка - продуцент рекомбинантного эритропоэтина человека, полученный способом по п. 4 и депонированный под номером РККК(П) 761 Д.