Плазмида без устойчивости к антибиотику
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии и представляет собой экспрессионную плазмиду без устойчивости к антибиотику, которая содержит полинуклеотид, кодирующий белок-репрессор cI. Экспрессия указанного белка-репрессора регулирует экспрессию токсичного генного продукта, встроенного в несущественный участок генома хозяина. Настоящее изобретение также раскрывает сконструированную клетку-хозяин, относящуюся к грамотрицательным бактериям, содержащую указанную плазмиду. Клетку-хозяин используют для получения плазмиды либо для получения некоего белка или иммуногена, если экспрессионная плазмида дополнительно содержит гены, кодирующие указанные белок или иммуноген. Способ получения экспрессионной плазмиды и способ получения белка или иммуногена проводят в несколько стадий. Сначала создают штамм клеток-хозяев, относящихся к грамотрицательным бактериям, встраиванием путем аллельной замены гена, кодирующего токсичный продукт, в несущественный участок хромосомы хозяина. Затем проводят конструирование ДНК-плазмиды, содержащей ген, кодирующий белок-репрессор cI, и, при необходимости, ген, кодирующий белок или иммуноген. После чего полученные клетки-хозяин трансформируют указанной плазмидой и выращивают в присутствии сахарозы при температуре 30-42 ºC. И, наконец, извлекают экспрессионную плазмиду, белок или иммуноген. Настоящее изобретение позволяет осуществлять контроль токсичного гена, локализованного на хромосоме, с помощью репрессора, локализованного на плазмиде при отсутствии селекционного давления антибиотиком. 4 н. и 29 з.п.ф-лы, 31 ил., 8 табл., 10 пр.
Реферат
Включение ссылкой
Данная заявка притязает на приоритет по предварительной заявке США с порядковым номером No.61/180755 от 22 мая 2009 года.
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу поддержания и продуцирования плазмид в грамотрицательной бактерии без использования селекционного давления антибиотиком. Кроме того, изобретение относится к продуцируемым безлекарственным плазмидам, а также к составам и/или композициям, содержащим безлекарственные плазмиды, и к составам и/или композициям, содержащим белок или иммуноген, полученный с помощью безлекарственной плазмиды, а также к способам введения таких составов и/или композиций организму-хозяину. Изобретение относится к грамотрицательным бактериям, содержащим безлекарственные плазмиды.
Предшествующий уровень техники
В настоящее время нет плазмидных ДНК-векторов, которые бы считались безопасными, мощными и эффективными при применении в медицине. Присутствие генов устойчивости к антибиотикам в доставляемых плазмидах является одним из препятствий для применения современной генной терапии и ДНК-вакцин.
Плазмиды представляют собой внехромосомные молекулы ДНК, которые отделены от хромосомной ДНК и способны к репликации независимо от хромосомной ДНК (Lipps G. (editor). (2008). Plasmids: Current Research and Future Trends. Caister Academic Press. ISBN 978-1-904455-35-6). В естественной среде плазмиды обычно встречаются в бактериях, но иногда их можно обнаружить и в эукариотических организмах. Предполагается, что плазмиды представляют собой переносимые генетические элементы или репликоны, способные к автономной репликации внутри соответствующего организма-хозяина. Плазмиды являются депротеинизированной ДНК и не кодируют генов, необходимых для упаковки генетического материала для переноса к новому организму-хозяину. Таким образом, перенос плазмид от хозяина к хозяину требует прямого, механического переноса путем конъюгации или изменений в экспрессии гена в организме хозяине, что дает возможность намеренного поглощения генетического элемента путем трансформации (Lipps G. 2008).
Использование плазмидной ДНК (пДНК) для генной терапии и вакцинации представляет собой новую технологию со значительным потенциалом в здравоохранении людей и животных (Mairhofer, J. et al., Biotechnol. J., 3, 83-89, 2008). Кроме того, плазмиды служат в качестве важных инструментов в генетических и биотехнологических лабораториях, где они широко используются для умножения количества или экспрессии конкретных генов (Russell, David W.; Sambrook, Joseph (2001), Molecular cloning: a laboratory manual. Cold Spring Harbor, N.Y; Cold Spring Harbor Laboratory).
Плазмиды обеспечивают механизм горизонтального переноса гена внутри популяции микробов и, как правило, обеспечивают селективное преимущество в определенном состоянии окружающей среды. Например, плазмиды могут нести гены, которые обеспечивают устойчивость к природным антибиотикам. Также кроме антибиотиков присутствуют альтернативные маркеры. Например, белки, продуцируемые плазмидой, могут функционировать в качестве токсинов, которые также обеспечивают преимущество в определенном состоянии окружающей среды. Плазмиды также могут обеспечивать бактерии способностью фиксировать элементарный азот или разрушать трудно деградируемые органические соединения, что дает преимущество в условиях дефицита питательных веществ (Lipps G., 2008).
Для отбора с помощью генов устойчивости к антибиотикам, получают плазмиды, в которые вставлен ген, образующий белок, который делает клетки устойчивыми к конкретному антибиотику. Затем с помощью процесса, называемого трансформацией, плазмиды вставляют в бактерии. После этого бактерии подвергают воздействию определенного антибиотика. В присутствии антибиотика выживают только бактерии, которые поглощают копии плазмид, так как плазмида делает их устойчивыми к антибиотику.
Представляющие интерес гены, могут быть доставлены с помощью плазмиды, содержащей маркер устойчивости к антибиотику. Такой ген, как правило, вставляют в сайт множественного клонирования (MCS, или полилинкер). Гены устойчивости к антибиотикам экспрессируются и экспрессируемые белки выводят антибиотик из строя. Таким образом, антибиотики действуют в качестве фильтра для селекции только модифицированных бактерий. Поэтому для выделения представляющей интерес плазмиды эти бактерии могут быть выращены в больших количествах, собраны и лизированы (часто с помощью метода щелочного лизиса).
В настоящее время большой успех антибиотиков в медицине становится проблемой. Многие бактерии, включая патогены инфекционных заболеваний, уже устойчивы к антибиотикам и не могут более контролироваться конкретными антибиотиками. В области медицины людей и животных антибиотики применяли слишком часто. Кроме того, еще более значимым является тот факт, что в течение продолжительного времени антибиотики добавляли в корм животных в качестве вещества, повышающего продуктивность. Эта практика сейчас признана в основном противозаконной, но широко распространенные антибиотики придали преимущество выживания тем бактериям, которые обладали соответствующим геном устойчивости. Кроме того, гены устойчивости в бактериях часто локализованы на мобильных элементах ДНК, которые могут быть передаваться между различными видами.
В отличие от этих данных, существуют данные о том, что бактерии могут поглощать маркерные гены, что в результате приводит к появлению патогенов, против которых прописываемые в настоящее время антибиотики не эффективны. Существует перенос генов в микроорганизмы окружающей среды, например, патогенов (Murphy, D.В., Epstein, S.L., Guidance for Industry: Guidance for human somatic cell therapy and gene therapy, Food and Drug Administration, Rockville 1998). Другим вопросом безопасности является возможная интеграция гена устойчивости к антибиотику в человеческую хромосому (Smith, H.A., Klinman, D.M., Curr. Opin. Biotechnol. 12, 299-203, 2001).
Кроме того, такие гены оказывают значительное влияние на процесс продуцирования плазмиды, поскольку конститутивная экспрессия этих генов накладывает необязательную метаболическую нагрузку на бактериальные клетки-хозяева (Cranenburgh, R.M., et al., Nucleic Acids Res. 2001, 29, e26; Rozkov, A., et al., Enzyme Microb. Technol. 2006, 39, 47-50). Уменьшение размера плазмид путем исключения этих генов приведет к повышению стабильности и увеличению выхода пДНК, получаемой в процессе ферментации (Smith, M.A., et al., Can. J. Microbiol. 1998, 44, 351-355).
Таким образом, исходя из существующего уровня техники, существует безусловная потребность избегать применения генов устойчивости к антибиотикам в конечном (коммерческом) продукте (вакцине в виде депротеинизированной ДНК), поскольку согласно текущим рекомендациям надзорных органов существует потенциальный риск их получения населением/потребителями. Управление по контролю за продуктами и лекарствами (FDA) и Всемирная Организация Здравоохранения (ВОЗ) регулируют применение маркеров устойчивости к антибиотикам для гарантии качества ДНК-вакцин и для профилактики инфекционных заболеваний. Аналогично, директива Европейского союза об осмотрительном введении в окружающую среду генетически измененных организмов, которая действует с 2002 года, требует «постепенной отмены использования маркеров устойчивости к антибиотикам в генетически модифицированных организмах, которые могут нанести вред здоровью человека или окружающей среде». Недостатки традиционных маркеров стали очевидны даже в исследовательской практике. Например, существует потребность в получении систем доставки без антибиотиков для коммерческих применений технологии бактофекции. Технология бактофекции представляет собой доставку плазмидной ДНК в эукариотические клетки с помощью инвазивных бактерий. Кроме того, существует техническая потребность в уменьшении необязательных метаболических затрат во время выращивания, что позволит достигать более высоких значений OD и более высокого выхода плазмидной ДНК.
Для того чтобы решить проблемы, касающиеся распространения генов устойчивости к антибиотикам в кишечных бактериях человека, были разработаны альтернативные стратегии селекции, включая ауксотрофную комплементацию, титрацию репрессора, схемы селекции противоядия/яда на белковой основе и использование маркеров селекции на основе РНК (см. Williams J.A. et al., Plasmid DNA vaccine vector design: Impact on efficacy, safety and upstream production, Biotechnol Adv (2009), doi:10.1016/j.biotechadv.l009.02.003).
Cranenburgh, R.M. et al. сообщили о создании двух новых штаммов Escherichia coli (Dt1lacdapD и DH1lacP2dapD), которые облегчают селекцию без антибиотика и стабильное поддержание рекомбинантных плазмид в комплексной среде. Они содержат жизненно-важный хромосомный ген, dapD, под контролем оператора/промотора lac (Cranenburgh, R. M., et al., 2001). Если не добавлять IPTG (который индуцирует экспрессию dapD) или DAP, эти клетки лизируются, однако при трансформации штаммов мультикопийной плазмидой, содержащей оператор lac, последний конкурентно титрует репрессор LacI и делает возможной экспрессию dapD с промотора lac. Таким образом, с помощью селекции титрацией репрессора трансформанты могут быть просто выделены и размножены на любой среде по их способности к росту. Для плазмиды не требуются гены устойчивости к антибиотикам или другие последовательности, экспрессирующие белки, и антибиотики не являются обязательными для селекции плазмид.
Mairhofer et al. недавно занимались разработкой штаммов бактериальных клеток-хозяев, которые служат для селекции и поддержания плазмид без применения в плазмиде каких-либо маркеров селекции или любых других дополнительных последовательностей. Несколько бактериальных штаммов модифицировали так, чтобы ингибитор репликации РНК I плазмиды мог подавлять трансляцию значимых для роста генов посредством реакции РНК-антисмысловая РНК (Mairhofer, J. et al, Biotechnol. J., 3, 83-89, 2008). Жизненно-важный ген (murA) модифицировали так, чтобы белок-репрессор (tetR) мог препятствовать его экспрессии (Mairhofer, J. et al., 2008). Только в присутствии плазмиды и, следовательно, РНК I, tetR выключался, а murA экспрессировался. Авторы настоящего изобретения сообщали о том, что различные коммерчески доступные плазмиды можно селектировать с помощью различных модифицированных штаммов Escherichia coli. Кроме того, авторы разработали минимальную плазмиду, лишенную какого-либо маркера селекции.
Цитата или указание любого документа в данной заявке не является признанием того, что такой документ доступен в качестве предшествующего уровня техники по отношению к настоящему изобретению.
Сущность изобретения
Предлагаются плазмиды без устойчивости к антибиотикам, а также грамотрицательные бактерии, содержащие плазмиды без устойчивости к антибиотикам. Также предлагаются композиции, содержащие плазмиды без устойчивости к антибиотикам, содержащие гетерологичный ген, кодирующий иммуноген или белок, или предлагаются композиции, содержащие иммуноген или экспрессирующие белок с помощью плазмид без устойчивости к антибиотикам. Грамотрицательные бактерии конструировали так, чтобы они содержали один или несколько гетерологичных полину клеотидов в несущественном участке бактериальной хромосомы. Плазмиды без устойчивости к антибиотикам содержат полинуклеотид, кодирующий репрессор, который регулирует экспрессию гетерологичного полинуклеотида на бактериальной хромосоме. Плазмиды без устойчивости к антибиотикам могут дополнительно содержать один или несколько полинуклеотидов, кодирующих иммуноген или белок.
Способы по изобретению включают способы получения плазмид без устойчивости к антибиотикам, а также способы переноса чужеродных генов в клетки млекопитающих с помощью плазмид без устойчивости к антибиотикам. Эти и другие воплощения описаны в следующем подробном описании или являются очевидными из него и охвачены им.
Краткое описание чертежей
Следующее подробное описание, данное в качестве примера, но не предназначенное для ограничения изобретения конкретными описанными воплощениями, может быть истолковано в сочетании с следующими чертежами, включенными в настоящий документ ссылкой, в которых:
Фигура 1 описывает первый компонент безлекарственной модели, который заключается в клонировании гена sacB, кодирующего левансахаразу в грамотрицательных бактериях, который приводит к быстрой смерти трансформированных бактерий при посеве на среду, содержащую сахарозу.
Фигура 2 описывает второй и третий компоненты безлекарственной модели или модели без устойчивости к антибиотику, которые представляют собой область иммунитета фага λ, где cI кодирует репрессор cI; его кодирует белок Cro; N кодирует транскрипционный анти-терминатор; cII кодирует активатор cI; cIII кодирует протеазный ингибитор cIII; OL 1, 2 и 3 и OR 1, 2 и 3 являются операторами; PL и PR являются правосторонними и левосторонними промоторами; PRE является промотором для первоначального синтеза репрессора; PRM является промотором для поддержания репрессора.
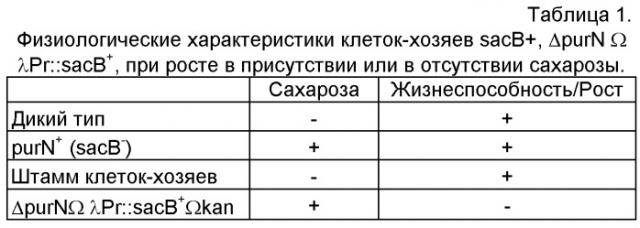
Фигура 3 описывает теоретический обзор «безлекарственной» модели, где активность репрессора cI, экспрессируемого с плазмиды pDL1 (англ. DrugLess Plasmid), ингибирует транскрипцию токсичного продукта гена sacB, управляемую промотором Pr, которые находятся на хромосоме клетки-хозяина, и где выживаемость клеток-хозяев Е. coli в присутствии сахарозы гарантирована достаточным уровнем экспрессии плазмидой белка-репрессора cI из фага λ.
Фигура 4 описывает «чувствительность к сахарозе» инактивированной системы, где температурный переход на 42°С ингибирует активность связывания репрессора cI с промотором Pr из фага λ и делает клетки-хозяева чувствительными к сахарозе.
Фигура 5 демонстрирует комбинацию штамма клеток-хозяев с плазмидой pDL1 без устойчивости к антибиотику, полученную трансформацией pDL1, и роста в среде, содержащей сахарозу, которая приводит к получению безлекарственной плазмиды.
Фигуры 6А-6С иллюстрируют план эксперимента. Фиг.6А дает общий план; ФИГ 6В демонстрирует родительский штамм ΔpurN (или ΔedA), который устойчив к канамицину и конститутивно экспрессирует SacB+, что придает ему чувствительность к сахарозе, при инкубации клеток при 30°С-37°С. Когда родительский штамм ΔpurN (или ΔedA) трансформируют плазмидой рРВ829 или рРВ838, то эти клетки приобретают способность выживать и расти в присутствии сахарозы, при их инкубации при 30-37°С; ФИГ 6С демонстрирует родительский штамм ΔpurN (или ΔedA), трансформированный либо плазмидой рРВ829, либо рРВ838 (плазмиды с cI), который способен расти в среде LB, содержащей либо канамицин, либо сахарозу, либо хлорамфеникол. Переход температуры с 30-37°С на 42°С приводит к смерти клеток при посеве в присутствии сахарозы.
Фигура 7 описывает две плазмиды (рРВ829 и рРВ838), маркированные генами, кодирующими хлорамфениколацетилтрансферазу (CatR и ген λcI. рВ838 представляет собой производное pMCS5, в которой ген хлорамфениколацетилтрансферазы (cat) заменяет ген устойчивости к ампициллину. Эта плазмида содержит ген cI, расположенный под контролем слабого промотора гена устойчивости к канамицину (Р1). рРВ829 представляет собой производное плазмиды pVR1012, содержащей ген cat. Плазмиды содержат ген cI, который расположен под контролем слабого промотора (Р1). При введении в родительский штамм Е. coli ΔpurN (или ΔedA), данные плазмиды сделают возможным рост клеток в присутствии сахарозы. Хлорамфеникол позволяет продемонстрировать достоверность модели.
Фигуры 8А-Е иллюстрируют создание штаммов клеток-хозяев. Фиг.8А и 8В иллюстрируют получение кассеты λPr::sacB Ωkan, вставляемой с помощью аллельной замены гена edA или purN, соответственно, в хромосоме Е. coli. Фигура 8С иллюстрирует создание полной кассеты sacB (ΔpurNΩλPr::sacB cat) с помощью ПЦР и объединяющего ПЦР, используемой для аллельной замены гена edA в клетках-хозяевах ΔpurNΩλPr::sacB Km штамма Е. coli для получения штамма Е. coli с удвоенной кассетой sacB.
На Фигурах 9А, 9В и 9С показано применение ПЦР для демонстрации создания штамма клеток-хозяев, а именно для демонстрации делеции edA и purN в Е. coli. Фиг.9А частично иллюстрирует два продукта ПЦР (соответственно 151 и 729 п.о.), которые очищали и использовали в качестве матрицы во второй стадии ПЦР с праймерами РВ 1186 и РВИ 89 и с ДНК-полимеразой «Phusion». Фиг.9 В иллюстрирует контрольную ПЦР, демонстрирующую введение кассеты λPr::sacB+ΩKan в хромосому Е. coli. Фиг.9С иллюстрирует корректность вставки кассеты λPr::sacB+ΩKan в локус с помощью аллельной замены генов edA и/или purN. Фигура 9D иллюстрирует использование ПЦР для демонстрации создания штамма клеток-хозяев, несущих кассету с дублированным sacB, а именно путем делеции обоих генов, edA и purN в Е. coli с помощью аллельной замены. Контрольный ПЦР демонстрирует, что обе кассеты, λPr::sacB+ΩKan и λPr::sacB+ΩCat, корректно введены в определенный локус на хромосоме Е. coli, что подтверждено секвенированием. На Фигуре 9D показаны: Дорожки 1: BJ5183 дт; 2: BJ5138 ΔpurN; 3: BJ5138 ΔedA; 4: BJ5183 ΔpurN ΔedA, не разведено, 1 мкл; 5: BJ5183 ΔpurN ΔedA, разведено 1/10; 6: Вода, 0 п.о. (контроль); А: BJ5183 дт; В: BJ5138 ΔpurN; С: BJ5138 ΔedA; D: BJ5183 ΔpurN ΔedA, не разведено, 3 мкл; Е: BJ5183 ΔpurN ΔedA, не разведено, 1 мкл; F: BJ5183 ΔpurN ΔedA разведено 1/10; G: BJ5183 ΔpurN ΔedA, разведено, 1/50; Н: Вода, 0 п.о.(контроль).
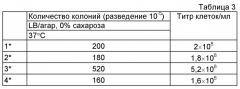
Фигура 10А демонстрирует, что штамм клеток-хозяев (ΔpurN λPr::sacB+Ωkan) является высокочувствительным (отсутствие роста) к сахарозе, что клетки, трансформированные плазмидой рРВ829 или рРВ838 хорошо растут в присутствии сахарозы при 30°С, что экспрессия гена sacB полностью подавлялась продуктом гена cI, синтезированным с каждой из плазмид с cI, и что поддержание плазмиды было на 100% эффективным, что было ясно продемонстрировано с помощью контрольного эксперимента, осуществленного параллельно с помощью аналогичных клеток, которые выращивали в присутствии хлорамфеникола. Повышение температуры до 42°С вызывало инактивацию продукта гена cI и смерть клеток, посеянных на LB-агар, содержащий либо сахарозу, либо хлорамфеникол. Эксперименты по части надежности поддержания данной плазмиды осуществляли после двух последовательных пассажей клеток, растущих в присутствии сахарозы или хлорамфеникола. Фигуры 10 В-С демонстрирует, что штамм Е. coli, несущий кассеты с дублированным sacB (ΔpurN λPr::sacB+Ωkan ΔedA λPr::sacB+ΩCat), является высокочувствительным (отсутствие роста) в присутствии сахарозы при инкубации при 30°С и 42°С, хотя при этом встречаются спонтанные мутанты посеянных на среде с сахарозой штаммов Е. coli, содержащих одну кассету sacB. Фиг.10С также демонстрирует самую низкую концентрацию сахарозы, необходимую для штамма Е. coli, содержащего две кассеты sacB, по сравнению со штаммом Е. coli, содержащим одну кассету sacB (от 10% до 2% конечной концентрации).
Фигура 11 иллюстрирует стабильность плазмид рРВ829 и рРВ838 в растущих клетках.
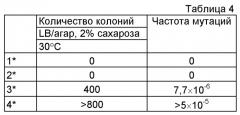
Фигура 12А демонстрирует отсутствие спонтанной мутации в кассете λPr::sacB+, содержащей один sacB, при 30°С. Фигуры 12В-С демонстрируют, что присутствие двух кассет sacB (а не одной) придает большую надежность в отношении чувствительности к сахарозе (оставаясь оптимальной при 2% сахарозы) при температурах в интервале от 30°С до 37°С. Наличие одной кассеты sacB на хромосоме Е. coli было менее стабильным при концентрации сахарозы в интервале от 2% до 4% при аналогичных температурах. В данном анализе с посевом на чашку подтвердили, что частота мутаций под влиянием сахарозы штамма Е. coli с двумя кассетами sacB была не детектируемой при самой низкой концентрации сахарозы (2%) при инкубации при 37°С, в то время как частота мутаций штамма Е. coli с одной кассетой sacB колебалась в интервале от 3,8×10-6 до 5×10-5. Ряд независимых экспериментов показал, что частота мутаций штамма Е. coli с двумя кассетами sacB составила около 5×10-10 при инкубации при 37°С в присутствии 2% сахарозы.
Фигуры 13А-В демонстрирует экспериментальные процедуры, дающие возможность скрининга трансформированных клеток с помощью плазмид cI, маркированных хлорамфениколом (Cat) без использования антибиотика в качестве фактора селекционного давления на чашках с агаром.
Фигуры 14А-С иллюстрируют эффективность экспериментальной процедуры для селекции трансформированных клеток только с плазмидой с cI (рРВ829 и рРВ838) без применения антибиотика в качестве фактора селекционного давления.
Фигуры 15А-В иллюстрируют стабильность и выход плазмид рРВ829 и рРВ838 в растущих клетках E.coli, которые содержат одну копию кассеты sacB. Фигуры 15С-Е иллюстрируют стабильность и выход плазмиды рРВ885 без cat в обоих штаммах Е. coli с одной и с двумя кассетами sacB (ΔpurN λPr::sacB+Ωkan и ΔpurN λPr::sacB+Ωkan ΔedA λPr::sacB+Ωkancat, соответственно). Фигура 15F иллюстрирует эффективность трансфекции плазмид (экспрессия GFP) в клетках СНО, плазмиды без устойчивости к антибиотику (рРВ896/сахароза в качестве фактора селекционного давления) и плазмиды с устойчивостью к антибиотику (pCG105/Cat в качестве фактора селекционного давления). Не наблюдали никакого очевидного различия на примере экспрессии белка GFP между этими двумя селективными давлениями (Сахароза против Cat в качестве антибиотика).
Фигура 16 демонстрирует карту плазмиды pCRblunt + РВ1184-1185.
Фигура 17 демонстрирует рестрикционную карту и характеристики рРВ828.
Фигура 18 демонстрирует рестрикционную карту и характеристики рРВ829.
Фигура 19 демонстрирует рестрикционную карту и характеристики рРВ838.
Фигура 20 демонстрирует плазмидную карту и характеристики рРВ844.
Фигура 21 демонстрирует плазмидную карту и характеристики рРВ845.
Фигура 22 демонстрирует плазмидную карту и характеристики рРВ846.
Фигура 23 демонстрирует плазмидную карту и характеристики рРВ847.
Фигура 24 демонстрирует плазмидную карту и характеристики рРВ885. На карте элементов рРВ885 показаны: две CDS: репрессор cI: 324-1037; AP(R): 2321-2990 (комплементарная цепь), исходное положение (комплементарная цепь 1626..2483); две последовательности с точкой начала репликации: последовательность точки начала репликации из pUC: 1500-2173 (комплементарная цепь), исходное положение (комплементарная цепь 805..1478); последовательность точки начала репликации из f1: 2991-3301 (исходное положение 2615-3053).
Фигура 25 демонстрирует плазмидную карту рРВ896. На карте элементов рРВ896 показаны: три CDS: GFP: 1675-2397 (исходное положение 1676…2398); репресор cI: 4089-4802; Cm(R): 4828-5484 (комплементарная цепь), комплементарная цепь (950-1606); один интрон: интрон А: 805-1625 (исходное положение 805-1625); один эукариотический промотор: промотор CMV: 1-683; одна последовательность точки начала репликации: 3133-3640 (исходное положение 2425..2932); один терминатор: терминатор транскрипции BGH/PolyA: 2405-2951 (исходное положение 1697..2243); один 5' UTR: CMV IE 5' UTR: 684-804 (исходное положение 684..804).
Фигура 26 демонстрирует выравнивание последовательностей белков репрессора cI и процент идентичности последовательности.
Фигура 27 демонстрирует выравнивание последовательностей белков sacB и процент идентичности последовательности.
Фигура 28 представляет собой таблицу, демонстрирующую SEQ ID NO, соответствующие полинуклеотидам и белкам.
Фигура 29 демонстрирует выравнивание последовательностей полинуклеотидов, кодирующих белки репрессора cI, и процент идентичности на уровне нуклеотидов.
Фигура 30 демонстрирует выравнивание последовательностей полинуклеотидов, кодирующих белки sacB, и процент идентичности на уровне нуклеотидов.
Фигура 31 демонстрирует последовательности промотора Р1, нативного промотора cI, промотора λPr, промотора λPr+5' UTR+ген sacB, промотора P1+ген cI, и нативного промотора cI+ген cI.
Подробное описание
Следует отметить, что в данном описании и, особенно, в формуле изобретения термины, такие как «содержит», «содержащий» и т.п. могут иметь значение, которое придается термину в патентном законе США; например, они могут означать «включает», «включенный», «включающий» и т.п.; и что термины, такие как «состоящий в основном» и «состоит в основном» имеют значение приписанное им в патентном законе США, например, они позволяют элементам не явным образом упоминаться, но исключать элементы, которые обнаружены в предшествующем уровне техники или которые влияют на основную или новую характеристику данного изобретения.
Если иное не определено, все технические и научные термины, использованные здесь, имеют тот же смысл, который вкладывает в них обычный специалист в области, к которой принадлежит данное изобретение. Термины в единственном числе включают их значения во множественном числе, если контекстом ясно не указано иное. Аналогичным образом, слово «или» предназначено для включения «и» если контекст с очевидностью не указывает на иное.
Термин «животное» предназначен для обозначения млекопитающих, птиц и тому подобных. Животное или организм-хозяин включает млекопитающих и человека. Животное может быть выбрано из группы, состоящей из лошадиных (пример, лошадь), псовых (пример, собака, волк, лиса, койот, шакал), кошачьих (пример, лев, тигр, домашняя кошка, дикая кошка, другие большие кошки, и другие животные семейства кошачьих, включая гепарда и рысь), овец (пример, овца), крупного рогатого скота (пример, корова), свиней (пример, свинья), птиц (пример, курица, утка, гусь, индейка, перепел, фазан, попугай, зяблик, ястреб, ворона, страус, эму и казуар), приматов (пример, древесный примат, долгопят, обезьяна, гиббон, человекообразные обезьяны), и рыб. Термин «животное» также включает индивидуальное животное во всех стадиях развития, включая стадии эмбриона и плода.
Термины «белок», «пептид», «полипептид» и «полипептидный фрагмент» используются взаимозаменяемо для обозначения полимеров любой длины из аминокислотных остатков. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты или аналоги аминокислот, и он может прерываться химическими компонентами, отличными от аминокислот. Термины также охватывают аминокислотный полимер, который был модифицирован в естественной среде или в результате экспериментального вмешательства; например, путем образования дисульфидной связи, гликозилирования, липидирования, ацетилирования, фосфорилирования или с помощью любой другой манипуляции или модификации, такой как конъюгация с помощью мечения или с помощью биоактивного компонента.
Термин «нуклеиновая кислота» или «полинуклеотид» используются взаимозаменяемо и обозначают РНК или ДНК, линейные или разветвленные, одноцепочечные или двухцепочечные или их гибриды. Термин также охватывает РНК/ДНК гибриды. Далее представлены частные примеры полинуклеотидов: ген или фрагмент гена, экзоны, интроны, мРНК, тРНК, рРНК, рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенная ДНК любой последовательности, выделенная РНК любой последовательности, нуклеотидные зонды и праймеры. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и аналоги нуклеотидов, урацил, другие сахара и группы присоединения, такие как фторрибоза и тиолат, а также ответвления нуклеотидов. Последовательность нуклеотидов может быть дополнительно модифицирована после полимеризации, как, например, путем конъюгации с компонентом мечения. Другие типы модификаций, включенные в данное определение, являются кэпированием, заменой одного или нескольких природных нуклеотидов на аналог и введением посредством прикрепления полинуклеотида к белкам, ионам металлов, компонентам мечения, другим полинуклеотидам и к твердой подложке. Полинуклеотиды могут быть получены путем химического синтеза или могут быть выделены из микроорганизма.
Термины «безлекарственная плазмида» или «плазмида без устойчивости к антибиотику» используются взаимозаменяемо и обозначают ДНК-плазмиду, которая не содержит гена для селекции с помощью антибиотика.
Термин «ген» используется широко для обозначения какого-либо сегмента полинуклеотида, ассоциированного с биологической функцией. Таким образом, гены включают интроны и экзоны, как в геномной последовательности, или только кодирующие последовательности, как в кДНК, и/или регуляторные последовательности, необходимые для экспрессии. Например, ген также относится к фрагменту нуклеиновой кислоты, которая экспрессирует мРНК или функциональную РНК, или кодирует конкретный белок, и которая включает регуляторные последовательности.
Объект изобретения, раскрытый в настоящем документе, относится к новому способу для получения ДНК-векторов на основе бактериальных плазмид путем преодоления применения генов устойчивости к антибиотикам для получения безопасных вакцин и иммуногенных композиций.
Объект изобретения, раскрытый в настоящем документе, демонстрирует новую модель для поддержания высокого количества копий плазмид в грамотрицательной бактерии-хозяине, причем новая модель основана на трех компонентах. Первый компонент представляет собой грамотрицательную бактерию, которая экспрессирует продукт, токсичный для бактерии в определенных условиях культивации, где токсичный ген вставлен в несущественный участок бактериальной хромосомы. Вторым компонентом является ген, присутствующий на хромосоме грамотрицательной бактерии, где ген кодирует токсичный продукт под контролем конститутивного промотора, который может подвергаться сильной регулировке. Третьим компонентом является экспрессия на плазмиде конкретного репрессора, которую регулирует промотор, функционально связанный с токсичным геном на хромосоме.
Грамотрицательные бактерии, рассматриваемые в настоящем изобретении, включают в частности Avibacterium, Brucella, Escherichia coli, Haemophilus (например, Haemophilus suis), Salmonella (например. Salmonella enteridis, Salmonella typhimurium, Salmonella infantis), Shigella, Pasteurella, и Rimeirella.
В одном воплощении, токсичный ген представляет собой структурный ген sacB, который кодирует левансахаразу. В другом воплощении, токсичный ген представляет собой структурный ген sacB из Bacillus subtilis, который кодирует левансахаразу Bacillus subtilis. Экспрессия sacB в его естественном окружении является безопасной для грамположительной бактерии, но при экспрессии в грамотрицательной бактерии приводит к быстрой смерти трансформированной бактерии при посеве на среду с сахарозой.
В одном аспекте в настоящем изобретении предлагается белок sacB (левансахараза). В другом аспекте в настоящем изобретении предлагается белок sacB, содержащий последовательность, представленную в SEQ ID NO:4, 60, 62, 64, 66, 68, 70, 72 или 74, и ее вариант или фрагмент. В другом аспекте в настоящем изобретении предлагается белок sacB, имеющий, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, 96%, 97%, 98% или 99% идентичности последовательности с полипептидом, содержащим последовательность, представленную в SEQ ID NO:4, 60, 62, 64, 66, 68, 70, 72 или 74. Еще в одном аспекте, в настоящем изобретении предлагаются фрагменты и варианты белка sacB, идентифицированные выше (SEQ ID NO:4, 60, 62, 64, 66, 68, 70, 72 или 74), которые легко могут быть получены специалистом в данной области с помощью хорошо известных методов молекулярной биологии. Варианты являются гомологичными полипептидами, содержащими аминокислотную последовательность с идентичностью, составляющей, по меньшей мере, около 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% по отношению к полипептидам по изобретению, конкретно, к аминокислотной последовательности, представленной в SEQ ID NO:4, 60, 62, 64, 66, 68, 70, 72 или 74.
В другом аспекте в настоящем изобретении предлагается полинуклеотид, такой как ген sacB, кодирующий белок sacB (левансахаразу), например, полинуклеотид, кодирующий белок sacB, содержащий последовательность, представленную в SEQ ID NO:4, 60, 62, 64, 66, 68, 70, 72 или 74. Еще в одном аспекте настоящего изобретения предлагается полинуклеотид, кодирующий белок sacB, имеющий, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, 96%, 97%, 98% or 99% идентичности последовательности с полипептидом, содержащим последовательность, представленную в SEQ ID NO:4, 60, 62, 64, 66, 68, 70, 72 или 74, или консервативный вариант, аллельный вариант, гомолог или фрагмент, содержащий, по меньшей мере, восемь или, по меньшей мере, десять последовательно расположенных аминокислот одного из этих полипептидов, или комбинация этих полипептидов. В другом аспекте, в настоящем изобретении предлагается полинуклеотид, содержащий нуклеотидную последовательность, представленную в SEQ ID NO:3, 61, 63, 65, 67, 69, 71, или 73, или ее вариант. В еще одном аспекте, в настоящем изобретении предлагается полинуклеотид, обладающий, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 95%, 96%, 97%, 98% или 99% идентичностью последовательности по отношению к полинуклеотиду, содержащему последовательность, изложенную в SEQ ID NO:3, 61, 63, 65, 67, 69, 71, или 73, или к его варианту.
Другие токсичные гены, которые можно применить в настоящем изобретении, включают в частности гены Listeria или Staphylococcus. Токсичным геном может быть ДНК, которая экспрессирует токсичный продукт гена (токсичный белок или РНК), или может быть токсичной сама по себе. Примеры таких токсичных продуктов генов хорошо известны в данной области и включают, в частности, эндонуклеазы рестрикции (например, Dpnl), CcdA/CcdB (Maki S. et al. J. Mol. Biol. 256: 473-482, 1996) и гены, которые убивают организм-хозяин в отсутствии функции подавления, например, kicB. В ином случае, токсичный ген можно селектировать in vitro, например, с помощью сайта рестрикции.
При использовании в данном документе термин «гомолог» включает ортологи, аналоги и паралоги. Аналоги, ортологи и паралоги полипептида дикого типа могут отличаться от полипептида дикого типа посттрансляционными модификациями, различиями в аминокислотной последовательности, или и тем и другим. В частности, гомологи изобретения будут, как правило, демонстрировать, по меньшей мере, 80-85%, 85-90%, 90-95%, или 95%, 96%, 97%, 98%, 99% идентичности последовательности, со всем или с частью полипептида дикого типа или с полинуклеотидной последовательностью, и будут демонстрировать похожие функции.
«Варианты» предназначены для обозначения по существу похожих последовательностей. Для полинуклеотидов, вариант содержит делецию и/или вставку одного или нескольких нуклеотидов в одном или нескольких участках внутри нативного полинуклеотида и/или замену одного или нескольких нуклеотидов в одном или нескольких участках в нативном полинуклеотиде. При использовании в настоящем документе, «нативный» полинуклеотид или полипептид содержит, соответственно, природную нуклеотидную или аминокислотную последовательность. Варианты конкретного полинуклеотида по изобретению (т.е. эталонного полинуклеотида) также могут оцениваться путем сравнения процента идентичности последовательности между полипептидом, кодируемым вариантным полинуклеотидом, и полипептидом, кодируемым эталонным полинуклеотидом. «Вариантный» белок предназначен для обозначения белка, выделенного из нативного белка путем делеции или вставки одной или нескольких аминокислот по одному или нескольким участкам в нативном белке, и/или путем замены одной или нескольких аминокислот по одному или нескольким участкам в нативном белке. Вариантные белки, охваченные настоящим изобретением, являются биологически активными, то есть они обладают способностью вызывать иммунный ответ.
Варианты включают аллельные варианты. Термин «аллельный вариант» относится к полинуклеотиду или полипептиду, содержащему полиморфизмы, которые приводят к изменениям в аминокислотных последовательностях белка, и которые существуют в естественной популяции (например, вирусные виды или разновидности). Такие естественные аллельные вариации, могут, как правило, приводить к 1-5% дисперсии в полинуклеотиде или полипептиде. Аллельные варианты могут быть идентифицированы секвенированием интересующей последовательности нуклеиновой кислоты во множестве различных видов, что может быть легко осуществлено при использовании гибридизационных зондов для идентификации одинаковых генных локусов в этих видах. Любая и все такие нуклеотидные вариации и обусловленные ими аминокислотные полифорфизмы или вариации, которые являются результатом природных аллельных вариаций, и которые не изменяют функциональную активность интересующего гена, попадают в рамки данного изобретения.
Термин «консервативная вариация» обозначает замену аминокислотного остатка другим похожим остатком, или замену нуклеотида в последовательности нуклеиновой кислоты, так чтобы кодируемый аминокислотный остаток не изменялся или был бы другим биологически похожим остатком. В этом отношении, в особенности предпочтительными заменами будут, как правило, консервативные по своей природе замены, оп