Терапевтические пептиды
Иллюстрации
Показать всеНастоящее изобретение относится к пептиду, пептидомиметику или производному аминокислоты, которые содержат двузамещенную β-аминокислоту, в которой каждая из замещающих групп в β-аминокислоте, которые могут быть одинаковыми или разными, включает по меньшей мере 7 неводородных атомов, является липофильной и включает по меньшей мере одну циклическую группу, причем одна или больше циклических групп в замещающей группе могут быть связаны или конденсированы с одной или большим числом циклических групп в другой замещающей группе, и когда циклические группы слиты таким образом, совокупное общее количество неводородных атомов для таких двух замещающих групп составляет по меньшей мере 12, где указанный пептид, пептидомиметик или производное аминокислоты состоят из 1-4 аминокислот или эквивалентных по длине субъединиц. 3 н. и 14 з.п. ф-лы, 4 ил., 10 табл., 4 пр.
Реферат
Настоящее изобретение касается модифицированных аминокислот, пептидов и пептидомиметиков, а также их использования в качестве цитолитических препаратов, которые особо широко используются в качестве противомикробных и противоопухолевых препаратов.
Инфекции, вызванные мультирезистентными бактериями, стали основной проблемой общества за последние 20-25 лет. В частности, эта проблема встала в больницах, где инфекции, вызванные метициллин-резистентным Staphylococcus aureus (MRSA), ванкомицин-резистентным Staphylococcus aureus (VRSA) и метициллин-резистентным Staphylococcus epidermidis (MRSE), могут привести к серьезным повреждениям, длительной госпитализации и смерти, особенно среди пациентов с ослабленной иммунной системой. Ванкомицин раньше был препаратом для приема в исключительных обстоятельствах, однако отчеты из больниц со всего мира демонстрируют, что ванкомицин используется в настоящее время намного чаще.
Как и для вышеуказанных грамположительных штаммов, врачи-клиницисты также сообщают о проблемах, возникающих вследствие грамотрицательных штаммов, включая Pseudomonas aeruginosa и Eschericha coli. Весьма желательно, чтобы препараты-антибиотики оказывали действие против широкого спектра бактерий, включая грамположительные и грамотрицательные штаммы.
Долгое время между крупнейшими фармацевтическими компаниями велась борьба за разработку новых классов противомикробных соединений, очевидно, вследствие огромных затрат на разработку и сравнительно ограниченную продолжительность лечения пациентов по сравнению с лечением хронических заболеваний. Однако потребность в новых противомикробных препаратах является насущной, поскольку количество смертей в США, вызванных инфекциями, приобретенными в больнице, в настоящее время превышает смертность от ВИЧ.
Многообещающий класс Противомикробных препаратов - это катионные противомикробные пептиды (AMP), также известные как иммунологические защитные пептиды. AMP характеризуются уникальным механизмом действия, фокусируя свое влияние на внутренние и/или внешние оболочки бактерий нерецепторно-специфическим образом. Подробный механизм разрыва оболочки AMP все еще не полностью изучен. Предлагаются различные модели для объяснения наблюдаемых эффектов.
Вследствие относительной схожести между компонентами липидной клеточной оболочки прокариотных и эвкариотных опухолевых клеток, селективная мембранная дестабилизация и вследствие этого литическая активность против опухолевых клеток также наблюдались для этих Противомикробных пептидов. Для обоих видов клеток-мишеней был идентифицирован эффективный класс амфипатических пептидов и пептидообразных молекул, имеющих чистый положительный заряд, и липофильная группа или группы. Хотя для первого поколения настоящих молекул предполагался порообразующий механизм действия, и они, как правило, включали десять или больше аминокислот, недавно было доказано, что намного меньшие молекулы могут поддерживать терапевтически существенные уровни активности и селективности (Strøm M.B. et al., J. Med. Chem. 2003, 46, 1567-1570).
Несмотря на это иногда противоречащие цели терапевтической активности, селективности, токсичности, стабильности in vivo и in vitro, стоимости производства и простоты приема означают, что существует постоянная потребность в разработке новых препаратов в настоящем общем классе молекул.
Настоящие изобретатели установили, что путем применения двузамещенной β-аминокислоты, можно создать новый класс цитолитических препаратов, которые обладают потенциально мощным действием и другими желаемыми характеристиками, включая широкий спектр антибактериальной активности, например, действие против грамположительных и грамотрицательных штаммов. Эти препараты, в основном, предназначаются для перорального приема.
Таким образом, в одном аспекте настоящее изобретение является пептидом, пептидомиметиком или (модифицированной) аминокислотой, имеющей чистый положительный заряд, по меньшей мере, +2, и включающей двузамещенную β-аминокислоту, каждую из замещающих групп в β-аминокислоте, которые могут быть одной и той же или разными, включает, по меньшей мере, 7 неводородных атомов, является липофильной или имеет, по меньшей мере, одну циклическую группу, одна или больше циклических групп в замещающей группе может быть связана или смешана с одной или больше циклических групп в другой замещающей группе, и если циклические группы смешаны таким образом, совокупное общее количество неводородных атомов двух замещающих групп, составляет, по меньшей мере, 12, для использования в качестве цитолитического терапевтического препарата. 2 замещающие группы в β-аминокислоте желательно одни и те же.
Не желая ограничиваться теорией, вероятно, что включение двузамещенный β-аминокислоты повышает стабильность препарата, и хотя принудительные конформационные расходы улучают амфипатичность препарата, а также способствуют мощному разрушающему действию на оболочку вследствие взаимному отталкиванию двух липофильных фрагментов двузамещенного остатка. Это оказывает цитолитическое действие, которое может быть цитотоксичным.
Цитотоксическое действие может быть противомикробным, предпочтительно антибактериальным действием и/или противоопухолевым действием, и такое медицинское применение является предпочитаемыми воплощениями настоящего изобретения. Таким образом, настоящее изобретение обеспечивает пептиды, пептидомиметики и модифицированные аминокислоты, как указано выше (и подробнее описано ниже) для использования в качестве цитолитических противомикробных или противоопухолевых препаратов. Рассматривая с альтернативной точки зрения, настоящее изобретение обеспечивает пептиды, пептидомиметики и модифицированные аминокислоты, как указано выше (и подробнее описано ниже) для использования в лечении микробной (в частности, бактериальной) инфекции или для лечения опухолевых клеток (в частности, солидных опухолей).
Микробы, против которых может быть направлено действие или лечение, включают бактерии (грамположительные и грамотрицательные), грибки, археи и протисты. Бактерии представляют особый интерес ввиду их способности инфицировать людей и животных, нанося вред их здоровью и угрожая жизни.
Предпочтительные бактериальные мишени включают грамположительные бактерии, в частности, Staphylococcus aureus, метициллин-резистентный Staphylococcus aureus (MRSA) и метициллин-резистентный Staphylococcus epidermidis (MRSE). Грамотрицательные штаммы, например, Pseudomonas aeruginosa и Eschericha coli, также могут подвергаться лечению. Хронические раны часто инфицируются грамположительными и грамотрицательными штаммами, а лечение пациента, который имеет или может иметь мультипатогенную инфекцию (например, в области хронической раны), является предпочтительным использованием в соответствии с настоящим изобретением.
Противомикробное действие также может использовать в нетерапевтических целях, например, в качестве дезинфицирующего агента. Еще один аспект настоящего изобретения обеспечивает ex vivo использование пептида, пептидомиметика или модифицированной аминокислоты, как указано и описано в настоящем документе в качестве цитолитического агента.
Липофильность может быть измерена на основе распределения препарата по двухфазной системе, например, «жидкость-жидкость», например, 1-октанол/вода. Широко известно, что полярные заместители, например, гидроксильные, карбоксильные, карбонильные, аминовые группы и эфиры снижают коэффициент разделения по двухфазной систем, например, 1-октанол/вода, поскольку они снижают липофильность; липофильные замещающие группы, таким образом, должны предпочтительно содержать не больше одной или двух, предпочтительно одну или совсем не содержать таких полярных групп.
β-аминокислота содержит аминогруппу, присоединенную β-атому углерода; генетически закодированные аминокислоты, в которых аминогруппы присоединены к атому углерода. Такая организация удлиняется на один атом на β-аминокислоту основу пептида, содержащего одну или более β аминокислот. При такой организации α и/или β атом углерода может быть замещен, α или β атом углерода может быть двузамещенным; если атом углерода - двузамещенный, получается β2,2 аминокислота, а если β атом углерода - двузамещенный, получается создается β3,3 аминокислота. Одна замещающая группа в каждом α или β атоме углерода приводит к формированию β2,3 аминокислоты, β2,2 и β3,3 двузамещенные аминокислоты предпочтительны для использования в соответствии с настоящим изобретением, причем β2,2 двузамещенные аминокислоты особенно предпочтительны.
β аминокислота замещается двумя группам, содержащими, по меньшей мере, 7 неводородных атомов. Предпочтительно одна, более предпочтительно обе из замещающих групп должны содержать, по меньшей мере 8, более предпочтительно, по меньшей мере, 10 неводородных атомов. Эти группы - липофильные по своей природе, и хотя они могут быть разными, предпочтительно они должны быть одинаковыми. Каждая из них содержит, по меньшей мере, одну циклическую группу, как правило, 6-членное кольцо, которое может быть алифатическим или ароматическим, предпочтительно, ароматическим, и может быть замещенным, а замещающие группы могут включать такие атомы, как кислород, азот, серу или галоген, в частности, фтор или хлор. Предпочтительные замещающие группы включают C1-C4 алкильные (в частности, t-бутил), метоксильные, фторовые и фторметиловые группы. Циклические группы могут быть гомо- или гетероциклические, предпочтительно, они являются гомоциклическим кольцом атомов углерода. Предпочтительные липофильные замещающие группы содержат две или три циклические группы, предпочтительно, две циклические группы, которые могут быть связаны или соединены, предпочтительно, соединены. Особо предпочтительно, чтобы замещающие группы включали нафталиновую группу.
Еще одна предпочтительная группа липофильных замещающих групп должна иметь одну замещенную или незамещенную циклическую группу, предпочтительно, фениловую или циклогексильную группу.
Циклическая группа или группы, как правило, отделены от пептидной основы (т.е. от α или β атомов углерода β-аминокислоты) цепью из 1-4, предпочтительно, из 1-3 атомов; эти связывающие атомы могут включать азот и/или кислород, однако, как правило, являются атомами углерода, предпочтительно, связывающие атомы - незамещенные. Эти разделители естественно являются частью замещающих групп, как указано выше.
Каждая замещающая функциональная группа двузамещенной β-аминокислоты, как правило, включает 7-20 неводородных атомов, предпочтительно - 7-13, более предпочтительно - 8-12, но наиболее предпочтительно - 9-11 неводородных атомов.
Молекулы для использования в соответствии с изобретением, предпочтительно, будут пептидами или пептидомиметиками 1 или 2-12 аминокислота или эквивалентных по длине подъединиц. Если контекстом не предусматривается иное, упоминание «аминокислот» в настоящем документе включает эквивалентную подъединицу в пептидомиметике. В Противомикробных целях, предпочтительные молекулы имеют 1-3 или 4 аминокислоты, в противоопухолевых целях, предпочтительные молекулы длиннее, т.е. 3-12 аминокислот, более предпочтительно, 5-12 аминокислот по длине. Как показано в Примерах, молекулы для использования в соответствии с изобретением могут включать только одну аминокислоту, однако это будет «модифицированная» аминокислота с целью выполнения требований заряда.
Отдельные аминокислоты, а также пептиды и пептидомиметики будут предпочтительно инкорпорированы в модифицированный С-терминал, С-терминал модифицирующая группа, как правило, приводит к обращению заряда, т.е. снимает отрицательный заряд карбоксильной группы и добавляет положительный заряд, например, посредством наличия аминогруппы. Такая модификация сама по себе, при условии, что N-терминал не модифицирован, обеспечит общий чистый заряд молекулы, равный +2. Если С-терминал модифицирован для обеспечения обращения заряда или просто для снятия отрицательного заряда карбоксильной группы, молекула, предпочтительно также должна содержать одну или больше катионных аминокислот. Таким образом, общий заряд молекулы может составлять +3, +4 или больше для больших молекул.
Подходящие C-терминальные группы, которые предпочтительно катионные по своей природе, будут, как правило, иметь максимальный размер 15 неводородных атомов. C-терминал предпочтительно амидированный, а амидная группа может быть дополнительно замещена для формирования N-алкильного или N,N-диалкильного амида. Первичные и вторичные амидные группы являются предпочтительными. Соответствующие группы для замещения амидной группы включают аминоалкил, например, аминоэтил или диметиламиноэтил; атом азота амидной группы может формировать часть циклической группы, например пиразолидин, пиперидин, имидазолидин и пиперазин, причем пиперазин является предпочтительным, а эти циклические группы могут сами по себе быть замещены, например, алкильной аминоалкильной группой.
Пептиды для использования в соответствии с изобретением предпочтительно должны включать одну или больше катионных аминокислот, лизин, аргинин, орнитин и гистидин предпочтительны, однако не должны содержать никаких негенетически кодированных или модифицированных аминокислот, несущих положительный заряд при pH 7,0.
Соответствующие негенетически кодированные катионные аминокислоты и модифицированные катионные аминокислоты включают аналоги лизина, аргинина и гистидина, например гомолизин, орнитин, диаминобутановую кислоту, диаминопимелиновую кислоту, диаминопропионовую кислоту и гомоаргинин, а также триметилизин и триметилорнитин, 4-аминопиперидин-4-карбоксильную кислоту, 4-амино-1-карбамимидоилпиперидин-4-карбоксильную кислоту и 4-гуанидинофенилаланил.
Дипептиды, как правило, включают одну катионную аминокислоту, а более длинные пептиды, как правило, будут содержать дополнительные катионные аминокислоты, поэтому пептиды из 4 или 5 аминокислот могут иметь 2 или 3 катионные аминокислоты, а пептиды из 6-9 аминокислот могут включать могут иметь 3-6 катионных аминокислот.
Предпочтительная группа молекул включает β2,2 двузамещенную аминокислоту, присоединенную к остатку C-терминального L-аргининамида, причем дипептиды с такой структурой являются особо предпочтительными.
Пептиды с тремя или больше аминокислотами, как правило, имеют одну или больше дополнительных липофильных аминокислот, т.е. аминокислот с липофильной R-группой. Как правило, липофильная R-группа имеет, по меньшей мере, одну, предпочтительно две циклические группы, которые могут быть слиты или соединены. Липофильная R-группа может содержать такие атомы, как О, N или S, однако, как правило, не больше одного гетероатома, который предпочтительно является азотом. Такая R-группа буте предпочтительно иметь не более 2 полярные группы, более предпочтительно вообще не иметь или иметь одну, наиболее предпочтительно - вообще не иметь.
Триптофан - это предпочтительная липофильная аминокислота, а пептиды предпочтительно включают 1-3 триптофановых остатков. Дополнительные генетически кодированные липофильные аминокислоты, которые могут быть инкорпорированы, - это фенилаланил и тирозин.
Липофильные аминокислоты могут быть негенетически кодированные, включая, генетически кодированные аминокислоты с модифицированной R-группой.
Пептидомиметик, как правило, характеризуется сохранением полярности, трехмерного размера и функциональности (биологического действия) своего пептидного эквивалента, однако если пептидная связь была замещена, как правило, более стабильными соединениями. Под «стабильными» понимается более устойчивые к ферментной деградации гидролитическими ферментами. Как правило, соединение, замещающее амидную связь (суррогат амидной связи), сохраняет множество свойств амидной связи, например, структуру, стерический объем, электростатический характер, возможность связывания с водородом и т.д. В главе 14 "Drug Design and Development", Krogsgaard, Larsen, Liljefors and Madsen (Eds) 1996, Horwood Acad. Pub, предоставляют общее описание способик дизайна и синтеза пептидомиметиком. В данном случае, где молекула вступает в реакцию с оболочкой, а не со специфическим активным участком фермента, некоторые описанные проблемы точного симулирования сродства и эффективности или функции субстрата не являются существенными, а пептидомиметик может быт легко подготовлен на основе данной пептидной структуры или мотива требуемой функциональной группы. Подходящие суррогаты амидной связи включают такие группы: N-алкилация (Schmidt, R. et al., Int. J. Peptide Protein Res., 1995, 46, 47), ретро-инверсный амид (Chorev, M and Goodman, M., Acc. Chem. Res, 1993, 26, 266), тиоамид (Sherman D.B. and Spatola, A.F. J. Am. Chem. Soc., 1990, 112, 433), тиоэфир, фосфанат, кетометилен (X Hoffman, R.V. and Kim, H.O. J. Org. Chem., 1995, 60, 5107), гидроксимтилен, фторвинил (Allmendinger, Т. et al., Tetrahydron Lett., 1990, 31, 7297), винил, метиленамино (Sasaki, Y and Abe, J. Chem. Pharm. Bull. 1997, 45, 13), метилентио (Spatola, A.F., Methods Neurosci, 1993, 13, 19), алкан (Lavielle, S. et al., Int. J. Peptide Protein Res., 1993, 42, 270) и сульфонамидо (Luisi, G. et al. Tetrahedron Lett. 1993, 34, 2391).
Молекулы настоящего изобретения содержат двузамещенную β-аминокислоту, а различные молекулы описаны в примерах, которые содержат только одну дополнительную аминокислоту, т.е. молекулы, имеющие 2 аминокислоты, соединенные амидной связью.
Такие молекулы могут считаться дипептидами ввиду амидной связи; однако амидная связь в этих молекулах фактически является нерасщепляющей ввиду распределения β-аминокислот и как таковые эти молекулы должны считаться пептидомиметиками. В целях настоящего изобретения, такие молекулы (и более крупные молекулы с большими аминокислотами) считаются пептидами (а не пептидомиметиками), ввиду наличия амидной связи. Это позволяет разъяснить номенклатуру без проведения испытаний того, является ли данная амидная связь расщепляющей и в какой степени. Другими словами, если все аминокислоты в молекуле соединены амидными связями, молекула считается пептидом, даже если одна или более амидных связей не являются расщепляющими.
Пептидомиметические соединения в настоящем изобретении, как правило, будут иметь идентифицируемые подъединицы, которые приблизительно эквивалентны по размеру и по функциям аминокислотам. Пептидомиметики, как правило, имеют группы, эквивалентные R-группам аминокислот, и описание подходящих R-групп и N и С-терминал модифицирующих групп применяется, mutatis mutandis, к пептидомиметическим соединениям.
Как описано в пособии, указанном выше, наряду с замещением амидных связей, пептидомиметики могут принимать участие в замещении больших структурных групп диортрипептидомиметическими структурами, и в таком случае, миметические группы, содержащие пептидную связь, например азольные производные миметики, могут использоваться в качестве дипептидных замещений. Пептидомиметик и, поэтому, основы пептидомиметиков, в которых были замещены только амидные связи, как описано выше, являются, однако, предпочтительными.
Подходящие пептидомиметики включают восстановленные пептиды, в которых амидная связь была восстановлена до метиленамина путем обработки таким восстанавливающим веществом, например бораном или гидридным реагентом, таким как алюмогидрид натрия. Такое восстановление обладает дополнительным преимуществом повышения общего содержания катионов молекул.
К другим пептидомиметикам входят сформированные пептиоиды, например, путем поэтапного синтеза амидно-функцианализированных полиглицинов. Некоторые основы пептидомиметиков будут доступными из их пептидных прекурсоров, например пептиды, которые были подвержены перметилированы. Соответствующие способы описаны Ostresh, J.M. et al. in Proc. Natl. Acad. Sci. USA (1994) 91, 11138-11142. Сильноосновные условия будут способствовать преобладанию M-метилации над O-метилацией и приведут к метилации некоторых или всех атомов азота в пептидной связи и N-терминальном азоте.
Предпочтительные заменители пептидной связи включают эфиры, поламины и производные, а также замещенные алканы и алкены, в частности аминометил и кетометилен. Пептидомиметики будут предпочтительно иметь N и C-терминалы, которые могут быть модифицированы, как указано в настоящей работе.
В следующем аспекте настоящего изобретения описан способ лечения или профилактики микробной инфекции, предпочтительно, бактериальной инфекции, который предусматривает введение пациенту пептида, пептидомиметика или модифицированной аминокислоты, как указано выше.
В следующем аспекте настоящего изобретения описан способ лечения опухолевых клеток или профилактики или подавления роста, распространения или метастаз опухоли, который предусматривает введение пациенту пептида, пептидомиметика или модифицированной аминокислоты, как указано выше.
Как и в настоящем изобретении, лечение микробной/бактериальной инфекции будет предпочтительно означать уменьшение количества жизнеспособных микробных/бактериальных клеток, но также может предусматривать бактериостатический механизм действия, при котором клетки удерживаются в тех количествах, которые менее вредны для пациента, чем если бы инфекции протекали без вмешательства. «Профилактика» предусматривает подавление роста микробных/бактериальных клеток таким образом, чтобы измеримая и/или вредная популяция не была установлена у пациента, получившего лечение.
Обработанные опухолевые клетки могут быть циркулирующие, однако, как правило, являются частью солидной опухоли; как и для микробных клеток, лечение будет предпочтительно предусматривать гибель клеток посредством клеточного лизиса. Клеточный лизис может привести к появлению антигенов опухолевых клеток и формированию приобретенного иммунитета, который может помешать или ингибировать развитие вторичных опухолей.
В следующем аспекте настоящего изобретения описан продукт, содержащий (а) пептид, пептидомиметик или модифицированную аминокислоту, как указано выше, и (б) дополнительный Противомикробный агент в виде комбинированного препарата для самостоятельного, одновременного или последовательного использования при лечении или профилактике микробных инфекций.
Еще в одном аспекте настоящего изобретения описан продукт, содержащий (а) пептид, пептидомиметик или модифицированную аминокислоту, как указано выше, и (б) дополнительный противоопухолевый агент в виде комбинированного препарата для самостоятельного, одновременного или последовательного использования при лечении опухолевых клеток.
В следующем аспекте настоящего изобретения описано использование пептида, пептидомиметика или модифицированной аминокислоты, как указано выше, при производстве медикаментов для лечения микробных инфекций, предпочтительно, бактериальных инфекций.
В следующем аспекте настоящего изобретения описано использование пептида, пептидомиметика или модифицированной аминокислоты, как указано выше, при производстве медикаментов для лечения опухолевых клеток или профилактики или замедления роста, распространения или метастаз опухолей.
Из вышеописанного класса молекул существует новая группа высокоэффективных молекул. Эти молекулы подходят для различных применений и способов, указанных в этом документе. Таким образом, в следующем аспекте настоящее изобретение является пептидом, пептидомиметиком или (модифицированной) аминокислотой, имеющей чистый положительный заряд, по меньшей мере, +2, который инкорпорирует группу формулы I
где любые 2 из R1, R2, R3 и R4 являются атомами водорода, а 2 - замещающими группами, которые могут быть одинаковыми или разными, включают, по меньшей мере, 7 неводородных атомов, липофильные и включают циклическую группу, причем вышеуказанная циклическая группа не присоединена непосредственно к α или β атому углерода, а выборочно связана или соединена с циклической группой в другой замещающей группе, где циклические группы соединены с совокупным общим количеством неводородных атомов для двух замещающих групп, по меньшей мере, 12, и где X отображает O, C, N или S,
однако за исключением соединений N-метил-L-фенилаланил-L-лизил-L-пропил-2,2-бис(фенилметил)-β-аланил-D-аргинин и N-метил-L-фенилаланил-L-лизил-L-пропил-D-циклогексилаланил-2,2-бис(фенилметил)-β-аланил-D-аргинин.
Используя номенклатуру Химической реферативной службы, а не систему IUPAC, вышеуказанные две молекулы будут называться D-аргинин, N2-[N-[1-[N2-(N-метил-L-фенилаланил)-L-лизил]-L-пропил]-2,2-бис(фенилметил)-β-аланил] и D-аргинин, N2-[N-[3-циклогексил-N-[1-[N2-(N-метил-L-фенилаланил)-L-лизил]-L-пропил]-D-аланил]-2,2-бис(фенилметил)-β-аланил] и их номера в соответствии с базой данных CAS-145149-42-4 и 145149-43-5, соответственно.
Аннулированные соединения описаны в WO 92/12168 как лиганды анафилатоксинового рецептора, полезные для лечения воспалительных болезненных состояний, и как таковой настоящий документ не описывает проблему, разрешаемую настоящим изобретением.
Желательно, чтобы минимальное количество 12 для комбинированного общего количества неводородных атомов из двух групп R1-4, кода циклические группы из каждого соединенного фрагмента, было достигнуто путем добавления минимального количества несоединенных групп (7+7=14) и вычитания 2, поскольку два неводородных атома эффективно способствуют формированию кольца в каждой группе. Предпочтительно, комбинированное общее количество неводородных атомов в двух группах R1-4, кода циклические группы из каждого фрагмента соединены, составляет 14. Сложные соединенные и связанные группы могут быть проанализированы, если две группы присоединены к Cα или Cβ может содержать более чем одну пару соединенных циклических групп, с или без дополнительного соединения между замещающими группами. Несмотря на это две замещающие группы, предпочтительно не соединенные и не связанные как молекулы, в которых эти группы характеризуются самой высокой гибкостью движения, предпочтительные.
Атом азота в группу из формулы (I) предпочтительно не присоединен к какому-либо атому группы R1-4, кроме, естественно, непрямо через Сβ или Сα. Предпочтительно 5 атомов в вышеуказанной основе (N-Cβ-Cα-C-X) связаны друг с другом только линейным, а не циклическим образом. Желательно, чтобы X и N в формуле (I) имели свои обычные валентности и поэтому были дополнительно замещены, поскольку они связаны с другими частями соединения, например с дополнительными аминокислотами или N- или C-терминал блокирующими группами.
Замещающие группы R1-4, как правило, липофильные по своей природе и предпочтительно не несут никакого заряда и предпочтительно имеют не более двух, более предпочтительно не более одной полярной группы. Одна или обе замещающие группы R1-4 предпочтительно содержат, по меньшей мере, 8, более предпочтительно, по меньшей мере, 9 или 10 неводородных атомов, например 7-13, 7-12, 8-12 или 9-11 неводородных атомов. Эти две замещающие группы предпочтительно одинаковые исключительно в целях простоты синтеза. Предпочтительно, две замещающие группы являются R1 и R2 или R3 и R4, R3 и R4 наиболее предпочтительны.
Как указывалось выше, циклическая группа R1-4 не присоединена непосредственно к α или β атому углерода, поскольку они отделены от нее цепью из 1-4, предпочтительно из 1-3 атомов; эти связывающие атомы могут включать азот и/или кислород, но, как правило, будут атомами углерода, предпочтительно, связывающие атомы - незамещенные. Предпочтительные разделяющие фрагменты показаны на Примерах и формируют часть замещающей группы R1-4, как указано в настоящем документе.
X может быть замещено или незамещено и предпочтительно должно являться N-атомом и предпочтительно замещенным. Если X - это N, X может формировать часть амидной связи в дополнительной аминокислоте, как показано в молекулах в Примере 1. Альтернативно, N-атом может быть замещенным, например аминоалкиловой группой, например, аминоэтилом или аминопропилом или диметиламиноэтилом. Эти молекулы показаны в Примере 2. В дальнейшей альтернативе N-атом может быть частью циклической группы, например, пиперазина, который может быть сам по себе замещен алкиловой или аминоалкиловой группой, что также показано в Примере 2.
Пептиды или пептидомиметики, содержащие группу формулы I, будут предпочтительно иметь модифицированный С-терминал, который предпочтительно амидирован и описан выше в связи с молекулами для использования в качестве цитолитических терапевтических препаратов.
В предыдущих абзацах, определяющих предпочтительные замещающие группы β-аминокислоты применяются, mutatis mutandis, две замещающие группы R1-4. Пептиды и пептидомиметики, содержащие группу формулы I, являются предпочтительным подклассом молекул, описанных ранее в данном применении для использования в качестве цитолитического терапевтического препарата, и поэтому все предыдущие абзацы, описывающие предпочтительные характеристики молекул, например, их длину и другие аминокислоты, которые они содержат, также применяются к этим молекулам, определяемым их инкорпорированием группы формулы I и наоборот. Особо предпочтительные молекулы - это молекулы длинной 1-7 или 8 (например 1-5), более предпочтительно 1, 2, 3 или 4 аминокислоты. Молекулы пептидомиметиков будут включать такое количество подъединиц, однако эти подъединицы будут, как правило, связаны имитаторами амидной связи; предпочтительные связи описаны ранее и включают эфиры и аминометил и кетометилен.
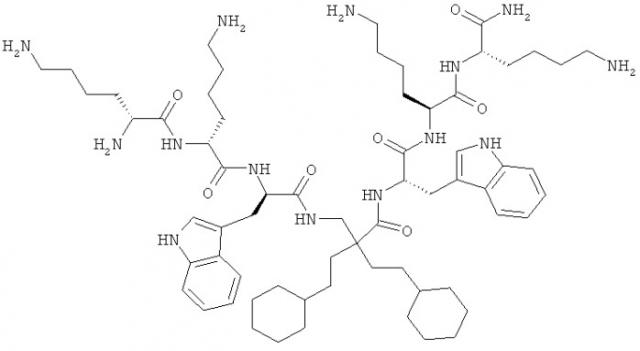
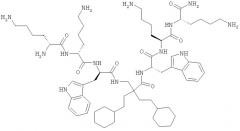
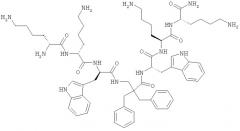
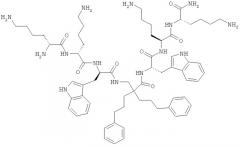
Примеры показывают, что структурный мотив настоящего изобретения в форме ди-пептидов (Пример 1) и отдельных модифицированных аминокислот и гепта-пептидов (Примеры 2 и 4). Молекулы в Примерах отображают предпочтительные молекулы и использование их в настоящем изобретении.
Пептиды, пептидомиметики и аминокислоты изобретения могут быть в форме соли, циклические или эстерифицированые, а предпочтительные амидированные производные описаны выше.
Предпочтительный класс молекул и их использование в настоящем изобретении - это производные β, предпочтительно β2,2-аминокислоты, которые имеют отдельную β2,2-аминокислоту, содержащую две липофильные боковые цепи, как описано выше, двузамещенную β-аминокислоту, окруженные двумя катионными группами. Как описано выше, две замещающие группы предпочтительно одинаковые и включают 6-членную циклическую группу и, по меньшей мере, 8, предпочтительно, по меньшей мере, 10 неводородных атомов. Эти молекулы особо подходят в качестве Противомикробных препаратов и приемлемы для перорального приема.
Молекулы, описанные в настоящем изобретении, могут быть синтезированы каким-либо удобным способом. Как правило, реактивные группы (например, аминовые, тиолевые и/или карбоксильные) будут защищены в течение всего процесса синтеза. Завершающий шаг в синтезе будет, таким образом, снятием защиты с защищенного производного изобретения. Способы синтеза соединений представляют собой еще один аспект настоящего изобретения. Например, в одном способе осуществления изобретения описан способ синтезирования пептида, пептидомиметика или модифицированной аминокислоты, имеющей чистый положительный заряд, по меньшей мере, +2, и которая инкорпорирует группу формулы I, как указано в настоящем документе, причем этом способ включает извлечение защитной группы из указанного пептида, пептидомиметика или модифицированной аминокислоты.
При построении пептида, можно, в принципе, начать с C-терминала или N-терминала, хотя процедура начала C-терминала предпочтительная.
Способы пептидного синтеза широко известны в науке, однако для настоящего изобретения может быть особо целесообразно осуществлять синтез на основе твердой фазы, и такие основы широко известны в науке.
Существует большое количество защитных групп для аминокислот, и соответствующие аминозащитные группы могут включать карбобензилокси (также именуемую Z) t-бутоксикарбонил (также именуемую Boc), 4-метокси-2,3,6-триметилбензол сульфонил (Mtr) и 9-фторэнилметокси-карбонил (также именуемая Fmoc). Желательно, чтобы при построении пептида на основе окончания C-терминала, присутствовала аминозащитная группа в α-аминогруппу каждого добавляемого нового остатка, которую необходимо извлечь выборочно до следующего этапа соединения.
Карбоксильные защитные группы, которые могут использоваться, включают, например, готовые расщепленные эфирные группы, как бензильные (Bzl), p-нитробензильные (ONb), или t-бутиловые (OtBu) группы, а также соединяющие группы на твердых основах, например амид Ринка, связанный с полистиролом.
Тиолевые защитные группы включают p-метоксибензил (Mob), тритил (Trt) и ацетамидометил (Acm).
Предпочтительные пептиды изобретения могут быть легко подготовлены с помощью t-бутилоксикарбонильной (Boc) защитной группы для амидных боковых цепей Lys, Orn, Dab и Dap, а также для защиты остатков триптофана индольного азота. Fmoc можно использовать для защиты альфа-амино групп. Для пептидов, содержащих Arg, 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил можно использовать для защиты гуанидиновой боковой цепи.
Существует множество процедур для извлечения аминовых и карбоксильных защитных групп. Однако они должны соответствовать применяемым синтетическим стратегиям. Боковая цепь защитной группы должны быть стабильной относительно условий, применяемых при извлечении временной α-амино защитной группы до следующего этапа соединения.
Аминовые защитные группы, например, Boc, и карбоксильные защитные группы, например, tBu, следует извлечь одновременно путем кислотной обработки, например с помощью трифторуксусной кислоты. Тиолевые защитный группы, например, Trt, можно извлекать выборочно с помощью окисляющего агента, например йода.
Научная литература и методики синтеза пептидомиметических соединений описаны выше и известны опытным ученым.
Рецептуры, содержащие одно или больше соединений изобретения, смешанные с соответствующим растворителем, носителем или вспомогательным веществом, составляют следующий аспект настоящего изобретения. Такие рецептуры могут использоваться, среди прочего, в фармацевтических (включая ветеринарных) целях и поэтому подходящий растворитель, носитель или вспомогательное вещество будет предпочтительно приемлемое с фармацевтической точки зрения. Соответствующие растворители, вспомогательные вещества и носители известны опытным ученым.
Молекулы, описанные в настоящем документе, являются цитолитическими по своей природе и особо полезны в качестве противомикробного препарата, например антибактериального или противогрибкового препарата, причем использование в антибактериальных целях предпочтительно. Специфичность молекул также обеспечивает их пользу в качестве противоопухолевых препаратов. Таким образом, в следующем аспекте настоящего изобретения описан пептид, пептидомиметик или (модифицированная) аминокислота, имеющая чистый положительный заряд, по меньшей мере, +2, и инкорпорирующей группу формулы I
где любые 2 из R1, R2, R3 и R4 - это атомы водорода, а 2 - замещающие группы, которые могут быть одинаковыми или разными, включают, по меньшей мере, 7 неводородных атомов, липофильные и включают циклическую группу, причем такая циклическая группа не присоединена непосредственно к α или β атому углерода, однако выборочно связана или слита с циклической группой в другой замещающей группе, где циклические группы слиты, а совокупное общее количество неводородных атомов для двух замещающих групп составляет, по меньшей мере, 12, и где X отображает O, C, N или S,
однако за исключением соединения N-метил-L-фенилаланил-L-лизил-L-пропил-2,2-бис(фенилметил)-β-аланил-D-аргинин и N-метил-L-фенилаланил-L-лизил-L-пропил-D-циклогексилаланил-2,2-бис(фенилметил)-β-аланил-D-Аргинин, для использования в терапии.
Изобретение также представляет пептид, пептидомиметик или модифицированную аминокислоту, имеющую чистый положительный заряд, по меньшей мере, +2, которая инкорпорирует группу формулы I
где любые 2 из R1, R2, R3 и R4 - это атомы водорода, а 2 - замещающие группы, которые могут быть одинаковыми или р