Усилитель действия противоопухолевого средства
Иллюстрации
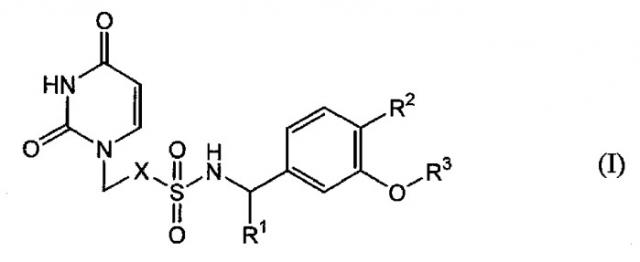
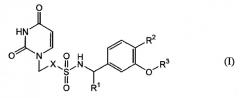
Показать всеИзобретение относится к новому усилителю противоопухолевого действия, представляющего собой производное урацила общей формулы (I) или его фармацевтически приемлемой соли. В общей формуле (I).
X представляет собой C1-5-алкиленовую группу, и где одна из метиленовых групп, составляющих алкиленовую группу, необязательно заменена атомом кислорода; R1 представляет собой атом водорода или C1-6-алкильную группу; R2 представляет собой атом водорода или атом галогена; и R3 представляет собой C1-6-алкильную группу, C2-6-алкенильную группу, C3-6-циклоалкильную группу, (C3-6-циклоалкил)-C1-6-алкильную группу, галоген-C1-6-алкильную группу или 5-6-членную насыщенную гетероциклическую группу с атомом кислорода в качестве гетероатома, производное урацила, представленное следующей формулой (I). Изобретение также относится к способу потенцирования противоопухолевого действия или способу лечения опухолей, включающему введение эффективного количества комбинации указанного производного урацила или его фармацевтически приемлемой соли и антиметаболита в эффективном количестве. При этом антиметаболит представляет средство выбранное из 5-фторурацила (5-FU), тегафур/гимерацил/отерацил калия (TS-1), тегафур/урацила (UFT), капецитабина, 5-фтор-2′-дезоксиуридина (FdUrd) и пеметрекседа. 6 н. и 12 з.п. ф-лы, 10 ил., 10 табл., 67 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к усилителю действия противоопухолевого средства и противоопухолевому лекарственному препарату, содержащему его.
Предпосылки создания изобретения
упоминается как dUTPase (ЕС3.6.1.23)) является ферментом, предотвращающим восстановление ДНК. Указанный фермент специфически Трифосфат дезоксиуридина (далее в данном описании узнает только трифосфат дезоксиуридина, отличая от других трифосфатов природных нуклеиновых кислот, и гидролизует трифосфат дезоксиуридина до монофосфата дезоксиуридина и пирофосфорной кислоты. Известно, что dUTPase является незаменимым ферментом для выживания как прокариотных, так и эукариотных клеток.
Полагают, что в злокачественных опухолях злокачественность ассоциируется с высоким уровнем экспрессии dUTPase (непатентные документы 1 и 2). Также сообщается, что опухоль, в которой экспрессия фермента ускорена, показывает устойчивость к химиотерапии (непатентный документ 3). Более того, наблюдают потенцирование противоопухолевого действия ингибитора тимидилатсинтазы (далее в данном описании упоминается как ингибитор TS), когда уровень экспрессии dUTPase в культивированных раковых клетках снижают с использованием сиРНК (непатентный документ 4). Такие результаты предполагают, что ингибиторы dUTPase человека могут быть применимыми химическими сенсибилизаторами противоопухолевых средств.
Документы известного уровня техники - непатентные документы
Непатентный документ 1: J. Clin. Pathol., 2009, Apr, 62(4): 364-9
Непатентный документ 2: Int. J. Cancer., 1999, Dec 22, 84(6): 614-7
Непатентный документ 3: Cancer Res., 2000, Jul 1, 60(13): 3493-503
Непатентный документ 4: Mol. Pharmacol., 2004, Sep, 66(3): 620-6
Сущность изобретения
Решаемые проблемы
Однако отсутствуют сообщения о том, что низкомолекулярный ингибитор dUTPase человека действительно обнаруживает потенциирующее действие на противоопухолевое действие.
Целью настоящего изобретения является усилитель противоопухолевого действия противоопухолевого средства и содержащее его противоопухолевый лекарственный препарат.
Способы решения проблемы
В результате интенсивных исследований, направленных на достижение вышеуказанной цели, авторы настоящего изобретения обнаружили, что производное урацила с сульфонамидной структурой в положении N-1 урацилового цикла, представленное приведенной ниже формулой (I), или его соль показывают сильное ингибирующее действие в отношении dUTPase человека. Авторы также провели дополнительные исследования и в результате нашли, что вышеуказанное производное урацила или его соль показывают превосходную активность усиления эффективности противоопухолевого средства (в частности, антиметаболита), в связи с этим осуществлено настоящее изобретение.
Настоящее изобретение относится к усилителю противоопухолевого действия противоопухолевого средства, содержащего в качестве активного ингредиента производное урацила, представленное приведенной далее формулой (I)
Формула 1
где Х представляет собой С1-5-алкиленовую группу, и одна из метиленовых групп, составляющих алкиленовую группу, необязательно заменена атомом кислорода;
R1 представляет собой атом водорода или С1-6-алкильную группу; R2 представляет собой атом водорода или атом галогена; и R3 представляет собой С1-6-алкильную группу, С2-6-алкенильную группу, С3-6-циклоалкильную группу, (С3-6-циклоалкил)-С1-6-алкильную группу, галоген-С1-6-алкильную группу или насыщенную гетероциклическую группу,
или его фармацевтически приемлемую соль.
Кроме того, настоящее изобретение относится к противоопухолевому лекарственному препарату включающему комбинацию производного урацила, представленного приведенной выше формулой (I), или его фармацевтически приемлемой соли и противоопухолевого средства.
Кроме того, настоящее изобретение относится к производному урацила, представленному приведенной выше формулой (I), или его фармацевтически приемлемой соли для применения при потенцировании противоопухолевого действия.
Кроме того, настоящее изобретение относится к комбинации соединения, представленного приведенной выше формулой (I), или его фармацевтически приемлемой соли и противоопухолевого средства для применения при лечении опухолей.
Далее, настоящее изобретение относится к способу усиления противоопухолевого действия, который включает введение эффективного количества соединения, представленного приведенной выше формулой (I), или его фармацевтически приемлемой соли.
Далее, настоящее изобретение относится к способу лечения опухолей, который включает введение комбинации соединения, представленного приведенной выше формулой (I), или его фармацевтически приемлемой соли и противоопухолевого средства.
Кроме того, настоящее изобретение относится к применению соединения, представленного приведенной выше формулой (I), или его фармацевтически приемлемой соли для получения усилителя противоопухолевого действия.
Кроме того, настоящее изобретение относится к применению комбинации соединения, представленного приведенной выше формулой (I), или его фармацевтически приемлемой соли и противоопухолевого средства для получения противоопухолевого средства.
Действие изобретения
Новое производное урацила по настоящему изобретению или его фармацевтически приемлемая соль применимы в качестве усилителя противоопухолевого действия противоопухолевого средства (в частности, антиметаболита) и в содержащем его противоопухолевом лекарственном препарате.
Краткое описание чертежей
Фиг.1 представляет собой диаграмму, показывающую усиливающее действие на противоопухолевое действие TS-1.
Фиг.2 представляет собой диаграмму, показывающую усиливающее действие на противоопухолевое действие TS-1.
Фиг.3 представляет собой диаграмму, показывающую усиливающее действие на противоопухолевое действие 5-FU.
Фиг.4 представляет собой диаграмму, показывающую усиливающее действие на противоопухолевое действие капецитабина, FdUrd, пеметрекседа и UFT.
Фиг.5 представляет собой графики, показывающие на голых мышах, которым трансплантирована линия SC-6 клеток рака желудка человека, изменение массы тела и противоопухолевое действие в случае введения комбинации соединения по настоящему изобретению и TS-1.
Фиг.6 представляет собой графики, показывающие на голых мышах, которым трансплантирована линия LS174T клеток рака толстой кишки человека, изменение массы тела и противоопухолевое действие в случае введения комбинации соединения по настоящему изобретению и TS-1.
Фиг.7 представляет собой графики, показывающие на голых мышах, которым трансплантирована линия CFPAC-1 клеток рака поджелудочной железы человека, изменение массы тела и противоопухолевое действие в случае введения комбинации соединения по настоящему изобретению и TS-1.
Фиг.8 представляет собой диаграмму, показывающую на голых мышах, которым трансплантирована линия МХ-1 клеток рака молочной железы человека, противоопухолевое действие в случае введения комбинации соединения по настоящему изобретению и TS-1.
Фиг.9 представляет собой график, показывающий на крысах, которым трансплантирована линия МХ-1 клеток рака молочной железы человека, противоопухолевое действие в случае введения комбинации соединения по настоящему изобретению и TS-1.
Фиг.10 представляет собой графики, показывающие на голых мышах, которым трансплантирована линия CFPAC-1 клеток рака поджелудочной железы человека, противоопухолевое действие в случае введения комбинации соединения по настоящему изобретению и капецитабина.
Подробное описание изобретения
В формуле (I) «С1-5-алкиленовая группа», представленная Х, обозначает линейную или разветвленную алкиленовую группу с 1-5 атомами углерода. Конкретные примеры включают метиленовую группу, этиленовую группу, триметиленовую группу, тетраметиленовую группу, пентаметиленовую группу, пропиленовую группу, бутиленовую группу, диметилтриметиленовую группу и этилтриметиленовую группу. Примером С1-5-алкиленовой группы, в которой одна из метиленовых групп, составляющих алкиленовую группу, заменена атомом кислорода, является -О-С1-4-алкиленовая группа.
Х представляет собой предпочтительно этиленовую группу или -О-СН2СН2СН2-.
В формуле (I) «С1-6-алкильная группа», представленная R1, обозначает линейную или разветвленную углеводородную группу с 1-6 атомами углерода. Конкретные примеры включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу и н-гексильную группу. Предпочтительной является С1-3-алкильная группа, и более предпочтительными являются метильная группа и этильная группа.
В формуле (I) примеры «атома галогена», представленного R2, включают атом фтора, атом хлора, атом брома и атом йода. Из них предпочтительным является атом фтора.
В формуле (I) «С1-6-алкильная группа», представленная R3, включает те же группы, какие описаны выше для R1. Предпочтительными являются изобутильная группа и 2-метибутильная группа.
В формуле (I) «С2-6-алкенильная группа», представленная R3, обозначает углеводородную группу с 2-6 атомами углерода, которая содержит углерод-углеродную двойную связь. Ее примеры включают винильную группу, аллильную группу, метилвинильную группу, пропенильную группу, бутенильную группу, пентенильную группу и гексенильную группу. Из них предпочтительной является аллильная группа.
В формуле (I) примеры «С3-6-циклоалкильной группа», представленной R3, включают циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу. Из них предпочтительной является циклопентильная группа.
В формуле (I) «(С3-6-циклоалкил)С1-6-алкильная группа», представленная R3, обозначает алкильную группу с 1-6 атомами углерода, которая имеет описанную выше циклоалкильную группу. Предпочтительной является циклопропилметильная группа.
В формуле (I) «галоген-С1-6-алкильная группа», представленная R3, обозначает алкильную группу с 1-6 атомами углерода, которая имеет описанный выше атом галогена. Предпочтительными являются 2,2-дифторэтильная группа и 2,2,2-трифторэтильная группа.
В формуле (I) «насыщенная гетероциклическая группа», представленная R3, предпочтительно обозначает моноциклическую или бициклическую насыщенную гетероциклическую группу, предпочтительно, с одним или двумя атомами, выбранными из атомов кислорода, азота и серы. Ее примеры включают пирролидинильную группу, пиперидинильную группу, пиперазинильную группу, гексаметилениминогруппу, морфолиногруппу, тиоморфолиногруппу, гомопиперидинильную группу, тетрагидрофурильную группу и тетрагидропирильную группу. Из них предпочтительными являются тетрагидрофурильная группа и тетрагидропирильная группа.
Группа, представленная R3, предпочтительно представляет собой изобутильную группу, 2-метилбутильную группу, аллильную группу, циклопентильную группу, циклопропилметильную группу, 2,2-дифторэтильную группу, 2,2,2-трифторэтильную группу, тетрагидрофурильную группу или тетрагидропирильную группу.
Наиболее предпочтительно, когда в формуле (I) Х представляет собой этиленовую группу или -О-С1-4-алкиленовую группу; R1 представляет собой атом водорода или С1-3-алкильную группу; R2 представляет собой атом водорода или атом фтора; и R3 представляет собой С1-6-алкильную группу, С2-6-алкенильную группу, С3-6-циклоалкильную группу, (С3-6-циклоалкил)С1-6-алкильную группу, галоген-С1-6-алкильную группу или насыщенную гетероциклическую группу.
Кроме того, также предпочтительно, когда в формуле (I) Х представляет собой этиленовую группу или -О-С1-4-алкиленовую группу; R1 представляет собой атом водорода или С1-3-алкильную группу; R2 представляет собой атом водорода или атом фтора; и R3 представляет собой С1-6-алкильную группу, С2-6-алкенильную группу, С3-6-циклоалкилалкильную группу, (С3-6-циклоалкил)С1-6-алкильную группу, галоген-С1-6-алкильную группу или тетрагидрофурильную группу или тетрагидропирильную группу.
Более того, особенно предпочтительно, когда в формуле (I) Х представляет собой этиленовую группу или -О-СН2СН2СН2-; R1 представляет собой атом водорода, метильную группу или этильную группу; R2 представляет собой атом водорода или атом фтора; и R3 представляет собой изобутильную группу, 2-метилбутильную группу, аллильную группу, циклопентильную группу, циклопропилметильную группу, 2,2-дифторэтильную группу, 2,2,2-трифторэтильную группу, тетрагидрофурильную группу или тетрагидропирильную группу.
Примеры фармацевтически приемлемой соли соединения, представленного формулой (I), включают соли присоединения кислот, таких как хлороводородная кислота, бромоводородная кислота, йодоводородная кислота, серная кислота, азотная кислота или фосфорная кислота, или органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, лимонная кислота, винная кислота, угольная кислота, пикриновая кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота или глутаминовая кислота; соли с неорганическими основаниями, такими как натрий, калий, магний, кальций или алюминий, или с органическими основаниями, такими как метиламин, этиламин, меглумин или этаноламин, или с основными аминокислотами, такими как лизин, аргинин или орнитин; и аммониевые соли. Кроме того, соединение по настоящему изобретению включает оптический изомер и гидрат(ы).
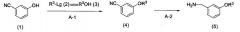
Производное урацила по настоящему изобретению можно получить согласно реакционным стадиям, описанным далее.
Стадия А
Формула 2
где R3 имеет значения, указанные выше; и Lg представляет собой удаляемую группу, такую как атом галогена, метансульфонилоксигруппа, п-толуолсульфонилоксигруппа или трифторметансульфонилоксигруппа.
[A-1]
(а) На данной стадии коммерчески доступный 3-цианофенол (1) в присутствии основания можно ввести во взаимодействие с алкилгалогенидом, алкилмезилатом, алкилтозилатом, алкилтрифторметансульфонатом, представленными общей формулой (2), и получить соединение, представленной общей формулой (4).
Может быть использован без ограничения любой растворитель для реакционной смеси, который не влияет на реакцию. Примеры растворителя включают диэтиловый эфир, тетрагидрофуран (далее в данном описании упоминаемый как ТГФ), диоксан, ацетон, диметоксиэтан, ацетонитрил, N,N-диметилформамид (далее в данном описании упоминаемый как ДМФА), N,N-диметилацет амид (далее в данном описании упоминаемый как DMA) и диметилсульфоксид (далее в данном описании упоминаемый как ДМСО). Из них предпочтительным является ДМФА.
Примеры основания, используемого в данном случае, включают: неорганические основания, такие как бикарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидрид натрия, гидрид калия, гидроксид натрия или гидроксид калия; и органические основания, такие как триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, лутидин или коллидин. Из них предпочтительным является карбонат калия. Его эквивалентное количество составляет 0,8-10 эквивалентов, и предпочтительно, 1,0-5,0 эквивалентов.
Эквивалентное количество соединения общей формулы (2) составляет 0,8-10 эквивалентов, и предпочтительно, 1,0-5,0 эквивалентов. Температура реакции составляет 20-150°С, и предпочтительно, 50-130°С. Время реакции составляет 0,5-24 часа, и предпочтительно, 1,0-12 часов.
(b) На данной стадии коммерчески доступный 3-цианофенол (1) и спирт, представленный общей формулой (3), можно ввести в реакцию конденсации по Мицунобу и получить соединение, представленное общей формулой (4).
Может быть использован без ограничения любой растворитель для реакционной смеси, который не влияет на реакцию. Примеры растворителя включают дихлорметан, 1,2-дихлорэтан (далее в данном описании упоминаемый как DCE), бензол, ксилол, толуол, этилацетат, пропилацетат, бутилацетат, диэтиловый эфир, ТГФ, диоксан, ацетон, диметоксиэтан, ацетонитрил и ДМФА. Их них предпочтительным является ТГФ.
Любой реагент, который обычно можно использовать в реакции Мицунобу, можно использовать в данном взаимодействии без ограничения. Его примеры включают комбинации ди(низший алкил)азодикарбоксилата (например, диэтилазодикарбоксилата (далее в данном описании упоминаемого как DEAD) или диизопропилазодикарбоксилата (далее в данном описании упоминаемого как DIAD)) или азосоединения (например, азодикарбонила, такого как 1,1-(азодикарбонил)дипепиридин) с триарилфосфином (например, трифенилфосфином) или три(низший алкил)фосфином (например, три-н-бутилфосфином). Предпочтительным является комбинация DEAD с трифенилфосфином.
Эквивалентные количества спирта общей формулы (3), ди(низший алкил)азодикарбоксилата и триарилфосфина составляют, соответственно, 0,8-5,0 эквивалентов, и предпочтительно, 1,0-2,0 эквивалента. Температура реакции составляет от -20°С до 120°С, и предпочтительно, 0-60°С. Время реакции составляет 0,1-24 часа, и предпочтительно, 0,2-6,0 часов.
[A-2]
На данной стадии цианосоединение, представленное общей формулой (4), можно ввести во взаимодействие с обычным известным восстановителем и получить соединение, представленное общей формулой (5).
Растворитель для реакции различается в зависимости от типа восстановителя. Его примеры включают метанол, этанол, 1-пропанол, 2-пропанол, трет-бутиловый спирт, диметоксиэтан, диметиловый эфир диэтиленгликоля, диизопропиловый эфир, диэтиловый эфир, ТГФ и диоксан. Из них предпочтительным является ТГФ.
Примеры восстановителя, используемого в данном случае, включают гидриды металлов, такие как алюмогидрид лития (далее в данном описании упоминаемый как LAH), диэтоксиалюмогидрид лития, триэтоксиалюмогидрид лития, трет-бутоксиалюмогидрид лития, алюмогидрид магния, гидрид алюминия с хлоридом магния, алюмогидрид натрия, триэтоксиалюмогидрид натрия или бис(2-метоксиэтокси)алюмогидрид натрия; и катализаторы, используемые для гидрирования, такие как палладий-на-угле, гидроксид палладия или платина. Из них предпочтительным является LAH. Эквивалентное количество восстановителя составляет 0,5-5,0 эквивалентов, и предпочтительно, 0,8-2,0 эквивалента. Температура реакции составляет 0°С-100°С, и предпочтительно, 20-60°С. Время реакции составляет 0,1-24 часа, и предпочтительно, 0,2-6,0 часов.
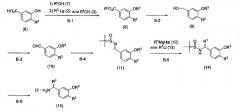
Стадия В
Формула 3
где R1, R2, R3 и Lg имеют значения, указанные выше; Rc представляет собой С1-6-алкильную группу; и Hal представляет собой атом галогена.
[B-1]
На данной стадии карбоксильную группу легко доступного соединения (6) этерифицируют спиртом (7) обычно известным способом, и затем полученное соединение можно ввести во взаимодействие таким же способом, как на стадии [A-1] и получить соединение, представленное общей формулой (8).
[B-2]
На данной стадии соединение, представленное общей формулой (8), можно ввести во взаимодействие с обычно известным восстановителем и получить соединение, представленное общей формулой (9).
Любой растворитель реакционной смеси, который не влияет на реакцию, можно использовать без ограничений. Примеры растворителя включают диэтиловый эфир, диизопропиловый эфир, ТГФ и диоксан. Из них предпочтительным является ТГФ.
Примеры восстановителя, используемого в данном случае, включают LAH, диэтоксиалюмогидрид лития, триэтоксиалюмогидрид лития, три-трет-бутоксиалюмогидрид лития, алюмогидрид магния, алюмогидрид с хлоридом магния, алюмогидрид натрия, триэтоксиалюмогидрид натрия, бис(2-метоксиэтокси)алюмогидрид натрия, диизобутилалюмогидрид (далее в данном описании упоминаемый как DIBAL) и борогидрид лития. Из них предпочтительным является борогидрид лития. Эквивалентное количество восстановителя составляет 0,8-10 эквивалентов, и предпочтительно, 1,0-5,0 эквивалента. Температура реакции составляет от 0°С до температуры кипения растворителя, и предпочтительно, температуру кипения растворителя. Время реакции составляет 0,1-24 часа, и предпочтительно, 0,5-12 часов.
[B-3]
На данной стадии соединение, представленное общей формулой (9), можно ввести во взаимодействие с обычно известным окислителем и получить альдегид, представленный общей формулой (10).
Любой растворитель реакционной смеси, который не влияет на реакцию, можно использовать без ограничений. Примеры растворителя включают дихлорметан, хлороформ, четыреххлористый углерод, DCE, хлорбензол, толуол и ксилол. Из них предпочтительным является дихлорметан.
Примеры окислителя, используемого в данном случае, включают комплес хромового ангидрида, пиридина и уксусного ангидрида; окислители на основе хрома, такие как хлорхромат пиридиния или дихромат пиридиния; гипервалентные йодные окислители, такие как реагент Десс-Мартина; окислители на основе ДМСО, такие как ДМСО, используемый в комбинации с уксусным ангидридом, оксалилхлоридом, дициклогексилкарбодиимидом (далее в данном описании упоминаемым как DCC) или гидрохлоридом 1-этил-3-(3-диметиламинопропил)карбодиимида (далее в данном описании упоминаемым как EDC-HCl); оксид марганца(IV) и радикалы 2,2,6,6-тетраметипиперидинил-1-оксилы. Из них предпочтительным является оксид марганца(IV). Эквивалентное количество окислителя составляет 0,8-30 эквивалентов, и предпочтительно, 1,0-20 эквивалента. Температура реакции составляет от -20 до 150°С, и предпочтительно, 0-100°С. Время реакции составляет 0,1-24 часа, и предпочтительно, 0,5-12 часов.
Когда R2 представляет собой атом водорода, коммерчески доступный 3-гидроксибензальдегид можно ввести во взаимодействие как исходный материал таким же путем, как на стадии [A-1], и получить соединение, представленное общей формулой (10). Кроме того, нитрил, представленный общей формулой (4), также можно восстановить обычной известной реакцией восстановления, например, способом восстановления с DIBAL, и получить соединение, представленное общей формулой (10).
[B-4]
На данной стадии соединение, представленное общей формулой (10), или коммерчески доступный альдегид можно ввести во взаимодействие с коммерчески доступным 2-метил-2-пропансульфинамидом в кислой среде и получить соединение, представленное приведенной выше общей формулой (11).
Любой растворитель реакционной смеси, который не влияет на реакцию, можно использовать без ограничений. Примеры растворителя включают диэтиловый эфир, диизопропиловый эфир, ТГФ, диоксан, дихлорметан, хлороформ, четыреххлористый углерод, толуол и ксилол. Из них предпочтительным является толуол.
Примеры кислоты, используемой в данном случае, включают хлороводородную кислоту, серную кислоту, п-толуолсульфоновую кислоту и кислоту Льюиса (например, тетраизопропоксид титана или тетраэтоксид титана). Из них предпочтительным является тетраизопропоксид титана. Эквивалентные количества 2-метил-2-пропансульфинамида и тетраизопропоксида титана составляют, соответственно, 0,8-10 эквивалентов, и предпочтительно, 1,0-3,0 эквивалента. Температура реакции составляет 20-150°С, и предпочтительно, 50-120°С. Время реакции составляет 0,1-24 часа, и предпочтительно, 0,5-6,0 часов.
[B-5]
На данной стадии соединение, представленное общей формулой (11), можно ввести во взаимодействие с реагентом Гриньяра (12), представленным формулой R1MgHal, или литийорганическим реагентом (13), представленным формулой R1Li, и получить диастереоселективно соединение, представленное общей формулой (14).
Любой растворитель реакционной смеси, который не влияет на реакцию, можно использовать без ограничений. Примеры растворителя включают диэтиловый эфир, диизопропиловый эфир, трет-бутилметиловый эфир, циклопентилметиловый эфир, ТГФ, диметоксиэтан, диоксан, дихлорметан, хлороформ, четыреххлористый углерод, толуол и ксилол. Эквивалентное количество реагента Гриньяра или литийорганического реагента составляет 0,8-20 эквивалентов, и предпочтительно, 1,0-10 эквивалентов. Температура реакции составляет от -100°С до 100°С, и предпочтительно, от -78°С до 50°С. Время реакции составляет 0,1-24 часа, и предпочтительно, 0,5-12 часов.
[B-6]
На данной стадии соединение, представленное общей формулой (14), можно ввести во взаимодействие с кислотой, и получить соединение, представленное общей формулой (15).
Любой растворитель реакционной смеси, который не влияет на реакцию, можно использовать без ограничений. Примеры растворителя включают спирты, такие как метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол или 2-бутанол; диоксан и этилацетат. Из них предпочтительным является метанол.
Примеры кислоты, используемой в данном случае, включают хлороводородную кислоту, серную кислоту и фосфорную кислоту. Из них предпочтительной является хлороводородная кислота. Ее эквивалентное количество составляет 0,1-10 эквивалентов, и предпочтительно, 1,0-2,0 эквивалента. Температура реакции составляет от -20°С до 100°С, и предпочтительно, 0-50°С. Время реакции составляет 0,01-24 часа, и предпочтительно, 0,1-1,0 час.
Кроме того, когда R1 представляет собой атом водорода, и R2 представляет собой атом фтора, соединение, представленное общей формулой (9), можно азидировать обычно известным способом и затем обработать обычно известным восстановителем (например, LAH), и получить соединение, представленное общей формулой (15). Кроме того, в случае, где соединение, представленное общей формулой (15), можно получить в виде рацемата, можно соединение, представленное общей формулой (10), превратить в спирт таким же способом, как на стадии [B-5], затем спирт можно азидировать обычно известным способом, и затем полученный азид можно восстановить обычно известным способом, и получить соединение, представленное общей формулой (15).
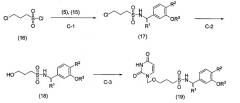
Стадия С
Формула 4
где R1, R2 и R3 имеют значения, указанные выше.
[C-1]
На данной стадии легко доступный 3-хлорпропансульфонилхлорид (16) можно в присутствии основания ввести во взаимодействие с любым амином, представленным общей формулой (5) или (15), и получить соединение, представленное общей формулой (17).
Любой растворитель реакционной смеси, который не влияет на реакцию, можно использовать без ограничений. Примеры растворителя включают ацетон, ТГФ, диэтиловый эфир, диизопропиловый эфир, диоксан, дихлорметан, хлороформ, четыреххлористый углерод, ДМФА, DMA и ацетонитрил. Из них предпочтительным является дихлорметан.
Примеры основания, используемого в данном случае, включают неорганические основания, такие как бикарбонат натрия, карбонат натрия или карбонат калия, и органические амины, такие как триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, лутидин или коллидин. Из них предпочтительным является триэтиламин. Эквивалентные количества основания и амина составляют, соответственно, 0,5-10 эквивалентов, и предпочтительно, 0,7-5,0 эквивалентов. Температура реакции составляет от -20°С до 100°С, и предпочтительно, 0-50°С. Время реакции составляет 0,1-24 часа, и предпочтительно, 0,2-6,0 час.
[C-2]
На данной стадии хлорсодержащее соединение, представленное общей формулой (17), можно ацетоксилировать через взаимодействие с ацетоксилирующим агентом обычным способом и затем дезацетилировать обычным способом, и получить соединение, представленное общей формулой (18).
[C-3]
На данной стадии соединение, представленное общей формулой (18), можно метоксиметилировать (индуцировать МОМ) обычным способом, затем обработать кислотой Льюиса и затем в присутствии йода ввести во взаимодействие с 2,4-бис(триметилсилилокси)пиримидином, полученным согласно способу, описанному в документе (Nucleosides & Nucleotides, 4, 565-585 (1985)), и получить соединение, представленное общей формулой (19).
При обработке кислотой Льюиса можно использовать без ограничений любой растворитель реакционной смеси, который не влияет на реакцию. Примеры растворителя включают дихлорметан, хлороформ, четыреххлористый углерод, DCE, толуол и ксилол. Из них предпочтительным является дихлорметан. Примеры кислоты Льюиса включают трихлорид бора (далее в данном описании упоминаемый как BCl3), трифторид бора и трибромид бора. Из них предпочтительным является BCl3. Его эквивалентное количество составляет 0,01-10 эквивалентов, и предпочтительно, 0,2-0,5 эквивалентов. Температура реакции составляет от -20°С до 100°С, и предпочтительно, 0-50°С. Время реакции составляет 0,1-24 часа, и предпочтительно, 0,5-5,0 часов.
При взаимодействии с 2,4-бис(триметилсилилокси)пиримидином можно использовать без ограничений любой растворитель реакционной смеси, который не влияет на реакцию. Примеры растворителя включают дихлорметан, хлороформ, четыреххлористый углерод, DCE, толуол и ксилол. Из них предпочтительным является DCE или толуол. Эквивалентное количество 2,4-бис(триметилсилилокси)пиримидина составляет 0,8-10 эквивалентов, и предпочтительно, 0,9-5,0 эквивалентов. Эквивалентное количество йода составляет 0,001-1,0 эквивалент, и предпочтительно, 0,05-0,5 эквивалентов. Температура реакции составляет от 20-150°С, и предпочтительно, 50-100°С. Время реакции составляет 0,1-120 часов, и предпочтительно, 0,5-100 часов.
Стадия D
Формула 5
где R1, R2 и R3 имеют значения, указанные выше; Bz представляет собой бензоильную группу; и Pg представляет собой защитную группу для атома азота в сульфонамидной группе.
[D-1]
На данной стадии атом азота в сульфонамидной группе соединения, представленного общей формулой (17), можно обычным способом защитить защитной группой, например, метоксиметильной группой или трет-бутоксикарбонильной группой, и затем полученное соединение можно ввести во взаимодействие со спиртом таким же путем, как на стадии [C-2], и получить соединение, представленное общей формулой (20).
[D-2]
На данной стадии 3-бензоилпиримидин-2,4-(1Н,3Н)-дион (21), полученный согласно способу, описанному в документе (J. Med. Chem., 50, 6032-6038 (2007)), и спирт, представленный общей формулой (20), можно обработать по реакции Мицунобу таким же путем, как на стадии [А-1] (b), и получить соединение, представленное общей формулой (22).
[D-3]
На данной стадии соединение, представленное общей формулой (22), дебензоилируют и удаляют защитную групп Pg обычным способом удаления защитной группы, и получают соединение, представленное общей формулой (23).
Производное урацила, представленное общей формулой (I), обнаруживает сильную активность ингибирования dUTPase человека. Когда производное урацила используют в комбинации с различными противоопухолевыми средствами (далее в данном описании упоминаемых как противоопухолевое средство А), оно показывает активность усиления противоопухолевого действия комбинированного противоопухолевого средства А.
Тип противоопухолевого средства А, эффективность которого усиливается усилителем противоопухолевого действия по настоящему изобретению, особо не ограничивается. Примеры такого противоопухолевого средства А включают алкилирующие агенты, такие как циклофосфамид или нимустин; платинусодержащие средства, такие как цисплатин, карбоплатин или оксалиплатин; антиметаболиты и растительные алкалоиды, такие как паклитаксел, доцетаксел или иринотекан. В качестве противоопухолевого средства А, эффективность которого усиливается усилителем противоопухолевого действия по настоящему изобретению, предпочтителен антиметаболит.
Антиметаболит, используемый в данном случае, обозначает соединение с химической структурой, схожей со структурой природного вещества, используемого для биосинтеза нуклеиновых кислот во время деления клеток и пролиферации раковых клеток, или лекарственное средство, содержащее вышеуказанное соединение в качестве активного фармацевтического ингредиента. Иными словами, антиметаболит обозначает противораковое средство, которое препятствует биосинтезу нуклеиновых кислот или пути биосинтеза нуклеиновых кислот и подавляет пролиферацию раковых клеток. Примеры антиметаболита включают пиримидиновые антиметаболиты, такие как 5-фторурацил (5-FU), тегафур/гимерацил/отерацил калий (TS-1, общее название «смешанное средство тегафур/гимерацил/отерацил калий (известная марка «TS-1»)), тегафур/урацил (UFT; общее название «смешанное средство тегафур/урацил» (известная марка «UFT»)), капецитабин, доксифлуридин, 5-флуоро-2'-дезоксиуридин (FdUrd), гецитабин или цитрабин; пуриновые антиметаболиты, такие как флударабин, кладрибин или неларабин; и антиметаболиты-фолаты, такие как пеметрексед или метотрексат. Из них предпочтительным является ингибитор пути синтеза тимидилата (ТМР). Ингибитор пути синтеза тимидилата обозначает соединение из числа антиметаболитов, которое прямо или косвенно ингибирует фермент, связанный с биосинтезом ТМР, или лекарственное средство, содержащее вышеуказанное соединение в качестве активного фармацевтического ингредиента; при этом ингибитор пути синтеза тимидилата включает, как типичные примеры, ингибитор тимидилатсинтазы и ингибитор дигидрофолатредуктазы. Ингибитор тимидилатсинтазы означает соединение, которое ингибирует тимидилатсинтазу, или лекарственное средство, содержащее вышеуказанное соединение в качестве активного фармацевтического ингредиента. Его примеры включают фторпиримидиновые антиметаболиты, такие как 5-фторурацил (5-FU), тегафур/гимерацил/отерацил калий (TS-1), тегафур/урацил (UFT), капецитабин, доксифлуридин, 5-фтор-2'-дезоксиуридин (FdUrd) или кармофур (ямафул); антиметаболиты-фолаты, такие как пеметрексед, метотрексат или ралтитрексед; и дигидрохлорид нолатрекседа. Кроме того, ингибитор дигидрофолатредуктазы обозначает соединение, которое ингибирует фермент для биосинтеза тетрагидрофолата, существенного для синтеза de novo пуринов, тимидилатов и т.д., или лекарственное средство, содержащее вышеуказанное соединение в качестве активного фармацевтического ингредиента. Его примеры включают антиметаболиты-фолаты, такие как пралатрексат или эдатрексат; пириметамин; бродимоприм и глюкуронат триметатрексата.
Противоопухолевое средство А, действие которого усиливается усилителем противоопухолевого действия по настоящему изобретению, предпочтительнее представляет собой ингибитор тимидилатсинтазы. Среди таких ингибиторов тимидилатсинтазы особенно предпочтительными являются фторурацил (5-FU), тегафур/гимерацил/отерацил калий (TS-1), тегафур/урацил (UFT), капецитабин, 5-фтор-2'-дезоксиуридин (FdUrd) и пеметрексед.
Тип злокачественной опухоли, которую можно лечить комбинацией соединения по настоящему изобретению, как усилителя противоопухолевого действия, и противоопухолевого средства А, эффективность которого усиливается усилителем противоопухолевого действия по настоящему изобретению, особо не ограничивается. Примеры злокачественной опухоли включают рак головы и шеи, эзофагеальный рак, рак желудка, рак толстой кишки, ректальный рак, рак печени, рак желчного пузыря/рак желчных протоков, рак поджелудочной железы, рак легких, рак молочной железы, рак яичников, рак шейки матки, эндометриальный рак, рак почек, рак мочевого пузыря, рак предстательной железы, рак яичка, остеосаркому/саркому мягких тканей, лейкоз, злокачественную лимфому, множественную миелому, рак кожи и опухоль головного мозга.
Противоопухолевый лекарственный препарат с усиленной эффективностью можно получить, объединяя производное урацила формулы (I) или его соль и противоопухолевое средство А. Форма полученного таким образом нового противоопухолевого лекарственного препарата может быть или формой препарата типа единого средства, содержащего производное урацила формулы (I) или его соль и противоопухолевое средство А, или формой отдельных препаратов, котора