Способ профилактики повреждения биологических мембран
Иллюстрации
Показать всеИзобретение относится к области медицины и может быть использовано для профилактики повреждения химическими гемолитическими агентами биологических мембран эритроцитов. Для этого в среду с клетками эритроцитов вводят водный раствор натриевых и калиевых солей гуминовых кислот, полученных из бурого угля леонардита, в дозе 10,0 мг/кг. Затем инкубируют при температуре 37°C в течение 40 минут перед повреждающим воздействием кислотным гемолитиком. Изобретение позволяет нормализовать проницаемость клеточных мембран и уменьшить количество разрушившихся клеток под действием кислотного гемолитика. 1 табл.
Реферат
Изобретение относится к области медицины и фармакологии, а именно к способам профилактики повреждений биологических мембран эритроцитов, и может быть использовано для защиты биологических мембран эритроцитов при воздействии химическими гемолитическими агентами.
Известно, что повреждение биологических мембран клеток является одним из универсальных патогенетических механизмов различных заболеваний (Владимиров Ю.А. Роль нарушений свойств липидного слоя мембран в развитии патологических процессов // Патолог. физиология и эксперим. терапия. - 1989. - №4. - С. 7-19; Геннис Р. Биомембраны. Молекулярная структура и функции: перевод с англ. - 1-е издание. - М.: Мир, 1997. - 624 с.). В связи с этим, разработка способов восстановления функциональных свойств мембран клеток может являться патогенетически обоснованной в стратегии профилактики и лечения различных заболеваний (Молекулярные нарушения мембраны эритроцитов при патологии разного генеза являются типовой реакцией организма: контуры проблемы / Новицкий В.В. [и др.] // Бюллетень сибирской медицины, 2006. - №2. - С. 62-69). Известно применение в составе патогенетической терапии заболеваний лекарственных веществ, обладающих способностью защищать от повреждений компоненты биологических мембран различных клеток. Например, известен способ лечения гнойно-воспалительных заболеваний челюстно-лицевой области, включающий вскрытие гнойно-воспалительного очага, медикаментозное воздействие, отличающийся тем, что интраоперационно или непосредственно после операции и далее - ежедневно, однократно больному внутривенно болюсно в течение 4-5 дней вводят мембранопротектор - препарат рексод в физиологическом растворе, из расчета 0,2 мкг/кг массы тела больного (заявка RU 2006110681; МПК A61K 38/43, А61Р 43/00, 2007). Препарат рексод представляет собой фермент супероксиддисмутаза, который является эндогенным акцептором свободных кислородных радикалов и предупреждает окислительную модификацию белков, а также связанное с активацией перекисного окисления липидов разрушение биомембран клеток (Справочник Видаль, http://www.vidal.ru/poisk_preparatov/rexod.htm).
Известно гепатопротекторное средство для профилактики и коррекции токсических поражений печени, согласно описанию в качестве гепатопротектора используют сукцинат 2-этил-6-метил-3-гидроксипиридина, известный как мексидол. Курсовое применение мексидола оказывает мембранопротекторное действие на клетки печени, токсически пораженной длительным применением туберкулостатиков (Пат. RU 2189817; МПК A61K 31/4412, А61Р 43/00, 2002).
Заявлен способ повышения устойчивости к гемолизу эритроцитов и восстановления их поврежденной формы (патент RU 2162698, МПК A61K 35/18; A61K 38/06, 2001). Согласно описанию способ повышения устойчивости к гемолизу эритроцитов и восстановления их поврежденной формы заключается во введении гидрофильных природных антиоксидантов в кровь, и отличается тем, что в качестве антиоксидантов используют карнозин (β-аланил-L-гистидин) или его N-ацетильное производное в определенном диапазоне концентраций.
Заявлен способ повышения устойчивости эритроцитов к гемолизу, индуцированному этанолом, путем введения во взвесь эритроцитов в этаноле лекарственного препарата галавит, растворенного в физиологическом растворе (патент RU 2315605; МПК A61K 35/18, A61P 25/32, 2008). Галавит (аминодигидрофталазиндион натрия) является иммуномодулирующим препаратом с противовоспалительным действием, механизм действия связан со способностью влиять на функционально-метаболическую активность макрофагов (Справочник Видаль, http://www.vidal.ru/poisk_preparatov/galavit~22901.htm).
Известно, что комбинированное применение низкоинтенсивного лазерного излучения и комплексного соединения 5-окси-6-метилурацила с янтарной кислотой при экспериментальном перитоните повышает кислотную резистентность эритроцитов к гемолитическому действию соляной кислоты, при применении данной комбинации отмечается наиболее мощный мембранопротекторный эффект (Влияние антиоксидантной и лазерной терапии на состояние мембран эритроцитов при экспериментальном перитоните / Срубилин Д.В. [и др.] // Медицинский Вестник Башкортостана, 2009. - Т.4, №2. - С.102-106).
Близким к настоящему изобретению (прототипом) можно считать использование в качестве средства, обладающего гематопротекорным действием аскорбата лития, обладающего гематопротекторной активностью в отношении гемолиза эритроцитов под действием алкоголя и отличающегося меньшей токсичностью по сравнению с другими препаратами лития (патент RU 2351326; МПК A61K 31/375, A61P 43/00, A61P 39/00, 2009). Однако согласно описанию из данного патента и по известным литературным данным аскорбат лития является психотропным средством может быть использован в основном в наркологии и психиатрии при проведении химиотерапии.
Одной из групп соединений, перспективных для разработки медикаментозных способов защиты клеточных биомембран, являются природные соединения - гуминовые вещества и соли гуминовых кислот (гуматы), обладающие разнонаправленной биологической активностью (Сухих А.С. Перспективы применения гуминовых и гуминоподобных кислот в медицине и фармации / А.С. Сухих, П.В. Кузнецов // Медицина в Кузбассе. - 2009. - №1. - С.10-14). Особенности химической структуры гуминовых веществ обуславливают их поверхностно-активные свойства (О механизме антидотного действия гуматов по отношению к нефтепродуктам / А.В. Дагуров [и др.] // Бюлл. ВСНЦ СО РАМН. - 2005. - №6 - С.143-146; Стом Д.И. Комбинированное действие нефтепродуктов и «Гумата» на дафний / Д.И. Стом, А.В. Дагуров // Сибирский экологический журнал. - 2004. - №1. - С.35-40), что приводит к способности солюбилизировать и диспергировать гидрофобные органические вещества, увеличивая их растворимость и повышая гидрофильность поверхностей клеток (Возможные механизмы биологического действия гуминовых веществ / Стом Д.И. [и др.] // Сибирский медицинский журнал. - 2008. - №6. - С.76-79). Данная особенность гуминовых веществ позволяет предположить возможность их влияния на свойства липопротеидов и других компонентов биологических мембран.
Известно применение гуминовых веществ и природных субстратов, их содержащих, в различных отраслях медицины.
В дерматологии известно использование оксидата торфа в качестве средства для лечения больных с хроническими дерматозами (патент RU 2187315; МПК A61K 35/10, A61P 37/04, 20020), использование средства, содержащего гумат натрия из древесно-травяного торфа месторождения «Темное» Томской области в качестве средства, обладающего противомикробным и противогрибковым действием (патент RU 2340328; МПК A61K 9/06; A61K 35/10; A61P 31/10, 2008). Известно использование вытяжки из сапропеля, получаемой как взаимодействия сапропеля и пирофосфата калия при массовом соотношении 25:1, проявляющей обезболивающее, противовоспалительное и рассасывающее действие в качестве биологически активной добавки для косметических и лечебно-профилактических изделий (патент RU 2170094; МПК A61K 35/00, A61K 7/00, A61K 7/48, 2001). Известно использование гуминовых кислот и гуматов в качестве биологически активной добавки в косметической промышленности, обладающей антиоксидантной активностью (патент RU 2094042; МПК A61K 7/00, A61K 7/40, 1997). Известно средство для ухода за волосами и кожей головы на основе гуминового концентрата, представляющего собой продукт обработки торфа раствором гидроокиси натрия или калия при активации кислородом воздуха в процессе барботирования и последующей нейтрализации раствором лимонной или уксусной кислоты, содержащего на абсолютно сухое вещество гуминовых кислот не менее 2,8 мас.% (патент RU 2394556; МПК A61K 8/97, A61Q 5/12, 2010).
Известно применение гуматов в ревматологии, например электрофорез 0,09-0,15%-ного раствора гумата натрия для повышения эффективности восстановительного лечения больных остеоартрозом (патент RU 2196626; МПК A61N 7/00, 2003), способ лечения больных остеоартрозом, осложненным реактивным синовитом, включающий курс грязелечения сапропелем с температурой 35-37°C, магнитотерапию и ЛФК (RU 96117924; МПК A61N 5/06, 1998).
Известно использование грязевых аппликаций в неврологической практике, например способ восстановительного лечения пациентов с умеренным и низким риском развития повторного инсульта в периоде остаточных явлений острого нарушения мозгового кровообращения, включающий бальнеотерапию, ручной массаж сегментарных зон, грязевые аппликации на паретичные конечности (с использованием сапропеля озера Кирек на пораженные конечности температурой 37-38°C в течение 20 мин, через день, количество процедур 10) и лечебную физкультуру (патент RU 2009141660; МПК A61H 1/00, 2011). Известен способ лечения больных со стойкими неврологическими проявлениями поясничного остеохондроза, достигаемый путем наложения грязевых аппликаций на пояснично-крестцовую область и пораженную конечность при 40-42°C в течение 30 мин, после чего дополнительно проводят гипобаротерапию (SU 1711883; МПК A61G 10/02, 1992).
Известно применение различных субстратов, содержащих гуминовые вещества в гастроэнтерологии. Например, известно противоязвенное действие грязевых аппликаций и электрофореза торфяной лечебной грязи (Влияние грязевых аппликаций на состояние ацетатной язвы у белых крыс / Н.Н. Абушинова [и др.] // Вопр. курортологии, физиотерапии и лечебной физической культуры. - 2001. - №3. - С.27-28; Опыт лечения больных язвенной болезнью двенадцатиперстной кишки СМТ-электрофорезом торфяной лечебной грязи в условиях дневного стационара / Корепанов А.М. [и др.] // Вопр. курортологии, физиотерапии и лечебной физкультуры. - 2003. - №5. - С.22-25); использование при язвенной болезни желудка электрофореза лекарственного препарата гумизоль, являющегося биогенным стимулятором и представляющего собой 0,01% раствор фракций гуминовых кислот хаапсалуской морской лечебной грязи Балтийского моря в изотоническом растворе натрия хлорида (снят с производства в 1997 г.) (Лурье Г.В. Эффективность различных методик электрофореза гумизоля из среды димексида при язвенной болезни желудка / Г.В. Лурье // Современные аспекты курортной гастроэнтерологии: сб. науч. тр. - Пятигорск, 1988. - С.46-49). Известно использование путем применения внутрь экстракта из иловой лечебной грязи (лекарственный препарат Пелоидин, содержит комплекс природных биологически активных веществ) для лечения язвенной болезни желудка и двенадцатиперстной кишки, препарат относится к группе биогенных стимуляторов (Машковский М.Д. Лекарственные средства: в 2 т. - Т.1. - 14-е изд., перераб., испр. и доп. - М.: ООО «Издательство Новая волна»: Издатель С.Б. Дивов, 2002. - С.174). Известен способ лечения язвенной болезни желудка и двенадцатиперстной кишки, отличающийся тем, что используют лекарственное средство, полученное путем обработки торфа, содержащее комплекс биологически активных веществ, в том числе гуминовые кислоты. Согласно описанию пероральное введение вышеуказанного препарата торфа один раз в день ежедневно внутрижелудочно в разовой дозе 50-100 мг/кг обеспечивает комплексное воздействие на различные патогенетические звенья развития язвенной болезни желудка, проявляя как местный, так и общий оздоровительный эффект (патент RU 2357741; МПК A61K 35/10; А61Р 1/04, 2009).
Известен способ лечения онкозаболеваний в эксперименте, включающий химиотерапию опухолей циклофосфаном и введение средства из торфа, содержащего гуминовые кислоты, фульвокислоты и др., причем средство из торфа вводят в состав корма или питьевой воды из расчета суточной дозы 100-200 мг/кг (патент RU 2396967; МПК A61K 35/10; А61Р 35/00, 2010). Известно использование суппозиториев для лечения хронического простатита, состоящих из 2,0 мл 1%-ного водного раствора гуминовых кислот (рН 7,4) низкоминерализованных пелоидов и достаточного количества масла какао для получения суппозитория массой 2,0-2,2 г (патент RU 2241471; МПК A61K 35/10, A61K 35/02, A61K 9/02, А61Р 13/08, 2004).
Известно также применение гуматов из торфа и сапропелей в ветеринарии, например способ профилактики заболеваний печени у коров, включающий введение в состав рациона гуминового средства из торфа, применяемого в виде раствора с 1,0% содержанием гуминовых кислот ежедневно один раз в сутки в дозе 0,125-0,25 мл/кг живой массы двумя курсами продолжительностью 25-28 дней (патент RU 2372926; МПК A61K 35/10, 2009).
Однако об известных способах защиты биологических мембран млекопитающих и человека при помощи солей гуминовых кислот, в частности солей гуминовых кислот, получаемых из леонардита, ранее не сообщалось. Задачей настоящего изобретения является расширение арсенала известных способов защиты биологических мембран эритроцитов при повреждающих воздействиях химическими гемолитическими агентами.
Технический результат заключается в использовании для профилактики повреждения биологических мембран эритроцитов препарата на основе малотоксичного, дешевого, доступного природного сырья.
Технический результат достигается тем, что способ профилактики повреждения химическими гемолитическими агентами биологических мембран эритроцитов заключается в использовании водного раствора натриевых и калиевых солей гуминовых кислот, получаемых из бурого угля леонардита, вводимого в дозе 10,0 мг/кг в среду с клетками эритроцитами и последующем инкубировании при температуре 37°С в течение 40 мин перед повреждающим воздействием кислотным гемолитиком. В качестве кислотного гемолитика используют, например, 0,1 Η раствор соляной кислоты. Способ обеспечивает снижение скорости деструкции клеток под действием кислотного гемолитика и уменьшение количества разрушившихся клеток.
Условное название водного раствора натриевых и калиевых солей гуминовых кислот - гумат леонардита. Субстанция-порошок выпускается ООО «Гумат», г. Иркутск, наименование и обозначение продукции: «Гумат» - удобрение на основе гуминовых кислот, для агротехнического применения,
ТУ 2189-004-41764643-98, фармакологические свойства ранее не изучались, мембранопротекторные свойства не известны.
Преимуществами заявляемого способа профилактики повреждения биологических мембран при помощи водного раствора натриевых и калиевых солей гуминовых кислот, получаемых из бурого угля леонардита, являются относительная дешевизна субстанции, широко доступное сырье в больших объемах для экологически безопасного производства субстанции, возможность производства промышленным путем (Перминова И.В. Гуминовые вещества - вызов химикам XXI века / И.В. Перминова // Химия и жизнь, 2008. - №1. - С. 50-55, 10), низкая токсичность (Низкая токсичность и противовоспалительная активность гуматов, выделенных из торфа и сапропеля Томской области / Р.Р. Исматова, А.У. Зиганшин, С.Е. Дмитрук, И.В. Федько // Казанский медицинский журнал. - 2006. - Том 87, №6. - С. 454-455) и отсутствие серьезных побочных эффектов, высокая эффективность.
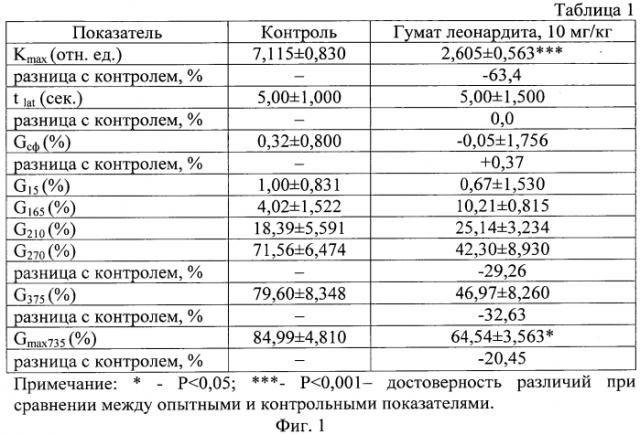
На фиг. 1 представлены результаты влияния раствора гумата леонардита (10 мг/кг, инкубация 40 мин при 37°С) на показатели кислотного гемолиза эритроцитов.
Пример 1.
Для профилактики повреждения биологических мембран эритроцитов при воздействии химическими гемолитическими агентами использовали средство из природного сырья, представляющее собой водный раствор натриевых и калиевых солей гуминовых кислот, полученных из бурого угля леонардита (далее по тексту - гумат леонардита).
Для изучения способности гумата леонардита изменять структурно-функциональные свойства биологических мембран использовали модифицированный метод регистрации химических (кислотных) эритрограмм по Терскову И.А., Гительзону И.И. (1957) (Гительзон И.И. Эритрограммы как метод клинического исследования крови. /И.И. Гительзон, И.А. Терсков. - Красноярск: Изд-во Сибирского отделения Академии наук СССР, 1959. - 247 с.; Терсков И.А. Метод химических (кислотных) эритрограмм // И.А. Терсков, И.И. Гительзон // Биофизика. - 1957. - Т. 11, Вып. 2. - С. 259-266.; Практикум по биофизике / В.Г. Артюхов [и др.] / Под ред. В.Г. Артюхова. - Воронеж: Изд-во ВГУ, 2001. - С. 147-161). Доказано, что эритроциты вовлекаются в патологический процесс не только при гематологических заболеваниях, но и претерпевают серьезные изменения структуры и функции при болезнях разного генеза. Выбор мембраны эритроцитов в качестве объекта для тестирования продиктован тем, что ей присущи общие принципы молекулярной организации плазматических мембран. Поэтому закономерности изменений структуры и функции мембраны эритроцитов с определенной долей коррекции, могут быть экстраполированы на иные мембранные системы. Помимо этого, простота организации эритроцита дает возможность изучать функциональные свойства плазматической мембраны без помех, накладываемых
внутриклеточными мембранными образованиями и органеллами (Молекулярные нарушения мембраны эритроцитов при патологии разного генеза являются типовой реакцией организма: контуры проблемы / Новицкий В.В. [и др.] // Бюллетень сибирской медицины, 2006. - №2. - С.62-69; Постнов Ю.В. Первичная гипертензия как патология клеточных мембран / Ю.В. Постнов, С.Н. Орлов. - М.: Медицина, 1987. - 192 с.).
Оценку способности гумата леонардита обеспечивать защиту биомембран при повреждающих воздействиях проводили по изменению параметров химической резистентности эритроцитарных клеток к индуктору кислотного гемолиза, эксперименты проведены на 3-компонентной модельной системе, включающей: 1 - «модификатор» - раствор солей гуминовых кислот, получаемых из леонардита (гумат леонардита); 2 - «мембрана» - суспензия мембран эритроцитов крыс; 3 - «деструктор» - компонент, вызывающий кислотный гемолиз эритроцитов, т.е. 0,1 H раствор соляной кислоты.
Влияние гумата леонардита на изменение резистентности клеточных мембран оценивали с использованием методики автоматической регистрации кислотных эритрограмм, основанной на фотометрической регистрации процесса гемолиза во времени, методика разработана на кафедре биофизики и биотехнологии Воронежского государственного университета. Принцип использованной методики основан на методе регистрации кислотных эритрограмм, предложенном И.И. Гительзоном и Н.А. Терсковым (Гительзон И.И. Эритрограммы как метод клинического исследования крови. / И.И. Гительзон, И.А. Терсков. - Красноярск: Изд-во Сибирского отделения Академии наук СССР, 1959. - 247 с.; Терсков И.А. Метод химических (кислотных) эритрограмм // И.А. Терсков, И.И. Гительзон // Биофизика. - 1957. - T.11, Вып.2. - С.259-266; Практикум по биофизике / В.Г. Артюхов [и др.]. / Под ред. В.Г. Артюхова. - Воронеж: Изд-во ВГУ, 2001. - С.147-161).
Принцип метода регистрации кислотной резистентности эритроцитов заключается в фотометрической регистрации динамики распада клеток при добавлении к суспензии эритроцитов 100 мкл 0,1 Н раствора соляной кислоты (метод кислотного гемолиза). Мерой стойкости для каждого эритроцита считается время, в течение которого происходит его разрушение. Полученные данные позволяют построить эритрограмму - кинетическую кривую, отражающую во времени последовательное вступление эритроцитов разной стойкости в фазу гемолиза.
Аналитически этот процесс можно представить уравнением вида:
G(%)=f(t),
где G(%) - количество разрушенных эритроцитарных клеток в процентах, t - время, выраженное в секундах.
Эритроциты для проведения исследований получали из крови белых аутбредных крыс самцов общим количеством 30 голов массой тела 210,0±9,5 г. Забор крови осуществляли методом резекции дистальной части хвоста, в каждой серии опытов манипуляцию осуществляли в одно и тоже время суток между 8.30 и 9.30 часами. Кровь самотеком набирали в пробирку со стабилизатором (гепарин). С целью получения суспензии эритроцитов кровь, стабилизированную гепарином, центрифугировали на центрифуге лабораторной медицинской (модель ОПН-8, производства ОАО «ТНК «Дастан», Кыргызская республика) в течение 15 минут при скорости 3000 об/мин с промежуточным отмыванием от стабилизатора и плазмы 0,9% раствором хлорида натрия. Для этого к осадку, содержащему эритроциты, добавляли 0,9% раствор NaCl, осторожно перемешивали и снова центрифугировали при тех же условиях, процедуру повторяли 3 раза.
Гемолиз эритроцитов проводили в кюветах с наружными размерами 20×40×10 мм и рабочим объемом 5,0 мл. Измерение величин светорассеяния проводили при светофильтре (№5) с максимумом пропускания в области 490 нм (при длине волны λ=490 нм), т.к. при данной длине волны тестируется не выход гемоглобина в среду инкубирования, а светорассеяние образцов, интенсивность которого прямо пропорционально зависит от объема, то есть поверхности эритроцита и содержания в среде эритроцитарных клеток. Таким образом:
G=f(Vi×N),
где G(%) - количество разрушенных эритроцитарных клеток в процентах, Vi - объем одного эритроцита, N - количество эритроцитов в среде. Следовательно, выход гемоглобина - явление вторичное и при используемой длине волны (490 нм) практически не влияет на регистрируемый сигнал.
Фотометрическую регистрацию динамики процесса индуцированного гемолиза эритроцитов осуществляли при помощи спектрофотометра (модель ПЭ-5400 ВИ, производства «Группа компаний Экрос», Россия).
Индуцирование кислотного гемолиза осуществляли путем добавления в рабочую кювету к 5 мл суспензии эритроцитов (в изоосмотическом 0,9% растворе NaCl) 100 мкл 0,1 H раствора соляной кислоты. Выбор данного вещества в качестве кислотного гемолитика обусловлен стабильностью раствора при хранении и присутствием обоих ионов (Н+ и Cl-) в плазме крови. Показатели регистрировали через каждые 15 секунд в течение 735 секунд.
Динамику процесса гемолиза эритроцитов фиксировали непосредственно после добавления гемолитика (0,1 M HCl) к эритроцитарной взвеси (0,9% NaCl).
Цифровые данные отображали на графике, в результате регистрировали S-образную интегральную кинетическую кривую (эритрограмму), форма которой отражает суммарное изменение величины светорассеяния (τ) в исследуемом растворе во времени, то есть τ=f(t). В процессе гемолиза скорость распада эритроцитов достигает максимального значения (Vmax) примерно в середине кривой.
Анализ эритрограмм осуществляли графическим и математическим способом, показатели структурного состояния мембран эритроцитов (Геннис Р. Биомембраны. Молекулярная структура и функции: перевод с англ. - 1-е издание. - М.: Мир, 1997. - 624 с.) при гемолизе оценивали по расчетным параметрам в соответствии с методикой (Практикум по биофизике / В.Г. Артюхов [и др.]. / Под ред. В.Г. Артюхова. - Воронеж: Изд-во ВГУ, 2001. - С.147-161).
Рассчитывали константу максимальной скорости гемолиза (Kmax отн. ед.) - параметр, характеризующий долю эритроцитов, одновременно вступивших в стадию гемолиза, определяли по формуле (1):
K m a x = t g α , ( 1 )
где Kmax (отн. ед.) - константа максимальной скорости гемолиза; tg α - тангенс угла α; α- угол наклона линейной части кривой к оси абсцисс, определяли графически.
Вычисляли относительное количество гемолизированных клеток (G, %) в различные моменты времени наблюдения по формуле (2):
G n = K × ( T о п . с р е д н − T 0 с р е д н ) , ( 2 )
где Gn - количество эритроцитов, вовлеченных в процесс гемолиза на n секунду процесса, выраженное в процентах, определяли через каждые 5 сек в течение 735 сек; K - константа скорости гемолиза на т секунду процесса, рассчитывали по формуле (3); Tопр.средн. - среднее значение светорассеяния в опытной пробе на n секунду процесса; T0средн. - среднее значение в опытной пробе исходно, т.е. на 0 сек.
K = 1 0 0 1 0 0 − T 0 с р е д н ., ( 3 )
Определяли относительное количество сфероцитов (Gsf, %) - показатель, отражающий количество эритроцитов (в основном низкостойкой популяции), вовлекаемых в начальную стадию процесса гемолиза - стадию сфероцитоза. Определяли максимальное количество гемолизированных эритроцитов в процентах (Gmax, %).
Определяли время латентного периода гемолиза (tlat, сек) - период времени после добавления гемолитического агента и до начала регистрации фазы гемолиза.
Для оценки способности гумата леонардита обеспечивать защиту биомембран при повреждающем воздействии кислотного гемолитика использовали водный раствор гумата леонардита в дозе 10,0 мг/кг, который добавляли непосредственно в опытную кювету с эритроцитами, затем смесь суспензии эритроцитов и гумата леонардита подвергали предварительной инкубации в термостате при температуре 37°C в течение 40 мин, а затем индуцировали собственно кислотный гемолиз путем добавления в среду с эритроцитами и гуматом леонардита 100 мкл 0,1 H раствора соляной кислоты. Температура инкубации 37°C выбрана как соответствующая температуре тела человека, длительность инкубации 40 мин выбрана как среднее время, необходимое для поступления введенного лекарственного вещества в плазму крови. Доза гумата леонардита 10,0 мг/кг подобрана экспериментальным путем на основании результатов серии предварительно проведенных опытов с дозами 1,0, 5,0, 10,0 и 20,0 мг/кг.
Эксперименты для дозы гумата леонардита 10,0 мг/кг проведены в 3-х сериях опытов, полученные результаты подвергали статистической обработке с вычислением средних значений. В каждой из серий опытов исследования проводили в параллельных пробах, одна из которых являлась контрольной (эритроциты + гемолитик), а вторая опытной (эритроциты + раствор гумата леонардита + гемолитик).
Установлено, что процесс гемолиза в контрольной пробе соответствует параметрам стандартной нормы и кривая гемолиза имеет S-образную форму. Процесс заканчивается в среднем на 7 минуте с общим процентом гемолизированных клеток 84,99±4,810%. При этом в среднем латентный период гемолиза (tlat) составил 5,00±1,000 сек, относительное количество сфероцитов (Gсф,) 0,32±0,800% и константа максимальной скорости гемолиза (Kmax) составила 7,115±0,830 отн. ед. (Фиг.1).
Установлено, что при внесении в среду с клетками эритроцитами гумата леонардита в дозе 10,0 мг/кг с предварительной инкубацией в течение 40 минут при температуре 37,0°C не наблюдалось изменений показателя tlat, выявлено незначительное повышение количества сфероцитов Gсф на 0,37%. Выявлено значительное достоверное снижение Kmax на 63,4%, что свидетельствует о снижении скорости гемолиза и уменьшении интенсивности процесса разрушения клеток. В течение периода наблюдения выявлена способность гумата леонардита значительно снижать процентное количество разрушившихся клеток, так на 270 сек процесса выявлено снижение количества гемолизированных эритроцитов на 29,26%, на 375 сек - соответственно на 32,63% и к моменту окончания процесса гемолиза на 735 сек - снижение общего количества разрушенных клеток на 20,45%, что являлось достоверно меньшим по сравнению с контролем (Фиг.1).
Следовательно, на фоне присутствия в среде гумата леонардита выявлено повышение времени и степени устойчивости эритроцитов к повреждающему действию кислотного гемолитика. Выявленные изменения связаны со способностью гумата леонардита вызывать конформационные структурно-функциональные изменения клеточных мембран, обусловленные взаимодействием с липопротеидными компонентами, что приводит к снижению проницаемости для ионов водорода и обеспечивает повышение осмотической резистентности мембраны клеток.
Таким образом, впервые выявлена способность раствора гумата леонардита в дозе 10,0 мг/кг при предварительной инкубации с суспензией эритроцитов при температуре 37°C в течение 40 мин нормализовать проницаемость клеточных мембран, что проявляется снижением скорости деструкции клеток под действием кислотного гемолитика и уменьшением количества разрушившихся клеток. Установленные изменения свидетельствуют о способности гумата леонардита в дозе 10,0 мг/кг обеспечивать защиту биологических мембран эритроцитов, что может быть использовано для профилактики нарушения целостности биологических мембран эритроцитов при действии химических гемолитических агентов.
Способ профилактики повреждения химическими гемолитическими агентами биологических мембран эритроцитов, заключающийся в использовании водного раствора натриевых и калиевых солей гуминовых кислот, полученных из бурого угля леонардита, вводимого в дозе 10,0 мг/кг в среду с клетками эритроцитов и последующем инкубировании при температуре 37°C в течение 40 мин перед повреждающим воздействием кислотным гемолитиком.