Экстракционно-флуориметрический способ определения фенолов в водных растворах
Иллюстрации
Показать всеИзобретение относится к аналитической химии органических соединений и предназначено для химического контроля питьевых вод, воды объектов, а также может использоваться в очистке сточных вод от фенолов. Способ включает использование расслаивающейся экстракционной системы вода - антипирин-кислота, при этом берут антипирин и нафталин 2-сульфокислоту при молярном соотношении 1:1, нагревают до температуры плавления 97°C, добавляют к 1 мл полученного расплава органической соли нафталин - 2 сульфонат антипириния 10,0 мл анализируемого водного раствора, интенсивно встряхивают и выдерживают до расслаивания на верхнюю - водную и нижнюю - органическую фазы и исследуют на интенсивность флуоресценции нижнюю - органическую фазу. Достигается повышение чувствительности и достоверности анализа. 1 пр., 3 табл., 5 ил.
Реферат
Изобретение относится к аналитической химии органических соединений и предназначено для химического контроля питьевых вод, воды объектов, а также может использоваться в очистке сточных вод от фенолов.
Известны методы определения фенолов, рекомендованные для водных инспекций, санитарно-эпидемиологических станций и водоочистных сооружений, основанные на экстракции фенолов из водных растворов диэтиловым эфиром. Содержание фенолов определяют:
1. гравиметрически [1];
2. бромометрически с пересчетом на C6H5OH [2];
3. фотометрически с применением 4-амино-антипирина с пересчетом на C6H5OH [3];
4. хроматографически в тонком слое (ТСХ) [4];
5. газохроматографически [4].
Методики 1-3 позволяют определять фенолы суммарно, 4, 5 - индивидуальные производные фенолов после стадии концентрирования на твердом полисорбенте с последующим элюированием. Все перечисленные методики имеют определенные недостатки, выбор методики связан с задачами химико-аналитического исследования химического состава контролируемого объекта.
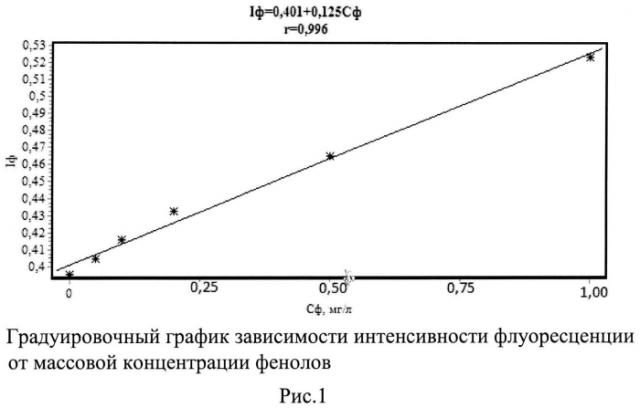
В качестве независимого контроля стандарта ПНД Ф 14.1:2:4.34-95 [5] рекомендуют флуориметрическую методику измерений массовой концентрации фенолов в пробах природной, питьевой и сточной воды с применением анализатора «Флюорат-02». Флуориметрический метод основан на извлечении фенолов из воды бутилацетатом, реэкстракции их в водный раствор гидроксида натрия и измерении массовой концентрации по интенсивности флуоресценции фенолов (табл.1). Для построения градуировочного графика готовят ряд смесей в диапазоне концентраций 0,05-1,00 мг/дм3, рис.1. Недостатки экстракционно-флуориметрического способа (аналога):
- во-первых, применение органического растворителя - бутилацетата;
- во-вторых, обязательно требуется предварительное отделение нефтепродуктов экстракцией гексана и стадия реэкстракции фенолов гидроксидом натрия.
Применение гексана и бутилацетата как токсичных органических растворителей не соответствует методам «зеленой» аналитической химии. Гексан и бутилацетат имеют плотность меньше воды и концентрируют целевой продукт в верхней части экстрактора.
Выбираем прототип - экстракционно-фотометрический способ определения фенолов с помощью расслаивающейся экстракционной системы вода - антипирин-сульфосалициловая кислота.
Смешивают 4,0 мл анализируемого раствора фенола (рабочего раствора, приготовленного из ГСО методом последовательного разбавления) с 1,0 г антипирина (фармакопейный препарат) и 0,5 г сульфосалициловой кислоты (ч.д.а.) в мольном соотношении реагентов 2:1. После перемешивания и расслаивания системы на верхнюю водную и нижнюю - органическую фазы концентрат фенола в гидрато-сольвате сульфосалицилата антипириния исследуют на интенсивность оптического поглощения [5].
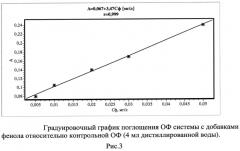
Для определения оптимальной длины волны поглощения фенолов готовят расслаивающуюся систему в 3 мерных градуированных пробирках. В систему вносят добавки 12,5; 50,0; 100,0 мкг/л рабочего раствора фенола, приготовленных из ГСО фенола соответственно. После расслаивания отделяют органическую фазу от водной. Спектр пропускания ОФ регистрируют в области от 333 до 714 нм (Specord UV - VIS) в кварцевой кювете толщиной 20 мм относительно контрольной органической фазы без добавок фенола (рис.2). Оптимальная длина волны поглощения фенолов в ОФ гидрато-сольватного концентрата выбрана в пределах 340 нм. Для построения градуировочного графика готовились системы с добавками рабочего раствора фенола (ГСО 7254-97) 5,00; 10,00; 20,00; 50,00 мкг/л соответственно. После расслаивания и отделения ОФ от водной измеряют оптическую плотность экстрактов фотометрически (СФ-46) при выбранной длине волны, рис.3. Недостатки прототипа: регистрация аналитического сигнала поглощения в ближней ультрафиолетовой области спектра (340 нм), мешающее влияние антипириновых соединений с нитрит-анионами (максимум поглощения 365 нм, коэффициент экстинции 360-420 моль-1·л·см-1 [6], сульфосалицилата железа (III) [1].
Заявляемый экстракционно-флуориметрический способ определения фенолов в водных растворах и регистрации аналитического сигнала позволяет снизить предел обнаружения фенолов.
Повышение достоверности определения фенолов в водных растворах и регистрации аналитического сигнала флуоресценции фенолов под углом 90 градусов к направлению падающего на измерительную кювету света, методом градуировочного графика с вычетом сигнала контрольного опыта, то есть флуоресценции органической фазы системы вода-антипирин-нафталин-2-сульфокислота без добавок фенолов.
Замена сульфокислоты на нафталин-2-сульфокислоту обеспечивает достижение нового технического результата.
Сущность изобретения
В предлагаемом экстракционно-флуориметрическом способе определения фенолов в водных растворах используется расслаивающаяся система вода-антипирин - органическая кислота, отличающаяся заменой одной кислоты - сульфосалициловой (СК) на другую - нафталин 2-сульфокислоту (НСК), при молярном соотношении антипирина и НСК (1:1) нагревают до температуры плавления 97°C, добавляют 1 мл расплава органической соли нафталин - 2 сульфонат антипириния, добавляют 10,0 мл анализируемого водного раствора, затем интенсивно встряхивают и выдерживают до расслаивания на верхнюю - водную и нижнюю - органическую фазы и исследуют на интенсивность флуоресценции нижнюю - органическую фазу.
Осуществление изобретения
Пример
Берут 5 г нафталин 2-сулъфокислоты (НСК) марки «ч», тщательно очищают смесью дистиллированной воды и концентрированной хлороводородной кислоты в объемном соотношении 1:1 порцией 10 мл, затем фильтруют через полимерную мембрану с диаметром пор 0,1 мкм от механических примесей. Фильтрат упаривают для удаления следов летучих фенолов. После упаривания продукт хранят при комнатной температуре. Чистота НСК очень важна, так как микропримеси фенольных соединений влияют на величину контрольного опыта (фонового сигнала флуоресценции органической фазы системы без введения добавок фенолов).
Модельные расслаивающиеся системы готовят, контролируя общий объем в пределах 11,0±0,1 мл, следующим образом.
В кварцевую чашку объемом 50 мл помещают навески антипирина Ант (0,94 г) и очищенную нафталин 2-сульфокислоту НСК (0,65 г), нагревают до температуры плавления 97°C. В результате химического протолитического взаимодействия получают органическую соль нафталин - 2 сульфонат антипириния - C11H12N2O*C10H7SO3H. Первоначально твердые реагенты: основание (антипирин, Ант) и кислота (нафталин-2-сульфокислота НСК) превращаются при молярном отношении 1:1 в органическую соль сульфонат антипириния - C11H12N2O*C10H7SO3H. При температуре, близкой к температуре кипения воды, соль представляет собой легкоплавкий расплав - аналог ионной жидкости, вещество светлого цвета, без запаха с плотностью около 2,3 г/мл, то есть в два раза плотнее чистой воды, с растворимостью 0,09 г/10 г H2O. В расплавленном состоянии соль имеет вязкую структуру и желтоватый цвет. Полученный расплав сливают в пробирку, вносят добавку фенола рабочего раствора, предварительно приготовленного из стандарта ГСО, доводят водой до общего объема 11,0 мл. Нижняя фаза в контрольном образце представляет собой желтоватую, достаточно подвижную жидкость. В присутствии железа (III) в воде органическая фаза окрашивается в красный цвет. Объем органической фазы составляет в пределах 0,70 мл. Оптимальные количественные компоненты, обеспечивающие расслаивание и объем нижней фазы (0,7 мл), 0,01 моль - 10 ммоль Антипирина и 0,01 моль - 10 ммолъ НСК, при общем объеме 11,0 мл. Расслаивание имеет место в широком интервале концентраций составляющих веществ: от 28 до 97 мас.% воды при соотношении по массе антипирин (Ант) : нафталин-2-сульфокислота (НСК) от 25:75 до 70:30 по данным [8].
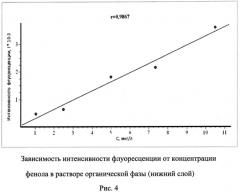
Содержание фенола определяют по градуировочному графику
Iф.=1,10+0,12С [мкг/л](r=0,981), рис.4.
В качестве контрольной пробы используют органическую фазу (ОФ) расслаивающейся системы без добавки фенола. Массовую концентрацию фенолов в водной фазе вычисляют по градуировочному графику Iф.=0,014+0,331Сф. [мкг/л] (r=0,987), рис.5.
Контрольную пробу готовят, используя водную фазу модельной системы без добавки фенола.
В табл.2 наблюдают распределение фенола между водной (ВФ) и органической (ОФ) фазой, по результатам флуоресцентного анализа. В табл.3, представлены сравнительные результаты известного и заявляемого способов. Более высокие содержания фенолов в речной воде после экстракции без органического растворителя связаны с нижним положением концентрата в системе. Заявляемая система без органического растворителя работает эффективнее, чем бутилацетат, не требует реэкстракции. По справочным данным [9], коэффициент распределения фенола в бутилацетат 48,5, в заявляемом способе достигает 70±3 (табл.2).
Количественное извлечение фенола в предлагаемом способе обеспечивается высаливанием, например хлоридом натрия, также наблюдается при однократной экстракции фенола расплавом нафталин-2-сульфоната антипириния из соленых вод.
В заявляемом способе без органического растворителя применяется однократная экстракция, которая обеспечивает переход фенола в нижнюю фазу на 80% и с учетом средних величин R увеличивается (пример 1, для соленых вод). ОФ системы без органического растворителя образует концентрат в нижней фазе и также экстрагирует фенолы из взвесей (планктона). ОФ концентрирует железо (III), которое можно анализировать в той же пробе фотометрически (анализатор «Флюорат» позволяет получать сигнал оптической плотности).
Заявляемый способ прост, не требуется предварительной отгонки летучих фенолов, отделения нефтепродуктов, применения твердых сорбентов или органического растворителя. Концентрат нижней фазы используется для регистрации сигналов поглощения железа (III) и других ионов по величине оптической плотности относительно контрольного опыта с дистиллированной водой.
Литература
1. Лурье Ю.Ю. Унифицированные методы анализа вод // изд. «Химия», М., 1971. 375 с.
2. Мазор Л. Методы органического анализа // М.: «Мир», 1986, 584 с.
3. Лурье Ю.Ю. Аналитическая химия промышленных и сточных вод // М.: Химия, 1984, 448 с.
4. Фомин Г.С. Вода. Контроль химической, бактериальной и радиационной безопасности по международным стандартам. Энциклопедический справочник. - 3-е изд., перераб. и дополн. - М., изд-во «Протектор», 2000. - 848 с. С.465-470.
5. Ускова А.Ю., Темерев С.В. Особенности определения фенолов в природных поверхностных водах // Известия Алтайского государственного университета. 2012. 3/1(75). С.207-209.
6. Носкова В.В., Темерев С.В. Применение расслаивающейся системы вода - антипирин-сульфосалициловая кислота в химическом мониторинге нитрит-ионов // Известия Алтайского государственного университета. 2011. 3/2(71). С.148-153.
7. ПНД Ф 14.1:2:4.117-97 Методика выполнения измерений массовых концентраций фенолов в пробах природной, питьевой и сточной воды на анализаторе «Флюорат-02».
8. Петров Б.И., Денисова С.А., Леснов А.Е., Шестакова Г.Е. Межфазное распределение некоторых элементов в системе вода - антипирин-нафталин-2-сульфокислота // Известия вузов. Химия и химическая технология. 1999. Т.42, №1. С 21-23.
9. Коренман Я.И. Коэффициенты распределения органических соединений. - Воронеж: Изд-во ВГУ, 1992. - 336 с. С.153.
| Таблица 1 | |||
| № п/п | Место отбора проб | Содержание фенолов мкг/л | |
| Фотометрия, СФ-46, λmax=340 нм | Флуориметрия, Флюорат 02-3М | ||
| 1 | 1 км ниже авт. моста | 20±4 | 17±7 |
| 2 | Дельта Кулунды | 27±3 | 30±5 |
| Озеро Большое Яровое | |||
| 3 | 150 м западнее комбината | 47±5 | 42±3 |
| 4 | 5 км восточное комбината | 27±7 | 22±7 |
| 5 | 5 км южнее комбината 27±8 | 30±6 | 27±8 |
| 7 | 8 км южнее комбината | 42±3 | 39±3 |
| Результаты определения фенолов в дельте Кулунды и оз. Б. Яровое |
| Таблица 2 | |||||||||
| № | Vв.ф., мл | Vо.ф., мл | введено фенола, мкг | найдено фенола, мкг | D±ε | (R±ε), % | <D>±ε | <R>±ε | |
| в водной фазе | в орг. фазе | ||||||||
| 1 | 10,0 | 0,7 | 1,05 | 0,36 | 0,79 | 33,25±4,5 | 70±2,7 | 47±18 | 76±6 |
| 0,33 | 0,80 | ||||||||
| 0,34 | 0,79 | ||||||||
| 2 | 2,50 | 0,45 | 2,12 | 69,9±2,9 | 83±1,5 | ||||
| 0,44 | 2,18 | ||||||||
| 0,43 | 2,18 | ||||||||
| 3 | 5,00 | 1,29 | 4,03 | 42,0±3,3 | 75±2,7 | ||||
| 1,29 | 3,71 | ||||||||
| 1,30 | 3,70 | ||||||||
| 4 | 7,35 | 1,54 | 5,69 | 53,4±1,2 | 79±3 | ||||
| Распределение фенолов в расслаивающейся системе вода - антипирин-нафталин-2-сульфокислота |
| Таблица 3 | ||
| № пробы | Бутилацетат | Вода - Ант - НСК |
| Содержание фенола, мкг/л | ||
| 1 | 8,55±0,05 | 9,10±0,07 |
| 2 | 8,26±0,04 | 8,85±0,02 |
| 3 | 8,11±0,05 | 8,78±0,03 |
| Результаты определения (n=3) фенолов в р. Барнаулка флуоресцентным методом |
Экстракционно-флуориметрический способ определения фенолов в водных растворах, включающий использование расслаивающейся экстракционной системы вода - антипирин-кислота, отличающийся тем, что берут антипирин и нафталин 2-сульфокислоту при молярном соотношении 1:1, нагревают до температуры плавления 97°C, добавляют к 1 мл полученного расплава органической соли нафталин - 2 сульфонат антипириния 10,0 мл анализируемого водного раствора, интенсивно встряхивают и выдерживают до расслаивания на верхнюю - водную и нижнюю - органическую фазы и исследуют на интенсивность флуоресценции нижнюю - органическую фазу.