Кристаллоидные кардиоплегические растворы, содержащие додекапептиды (варианты)
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается кристаллоидного кардиоплегического раствора, содержащего солевой раствор, включающий натрия хлорид, калия хлорид, магния хлорид, кальция хлорид, натрия гидрокорбонат, воду для инъекций, и структурный аналог природного апелина X-Arg(NGY)-Pro-Arg-Leu-Ser-His-Lys-Cly-Pro-Nle-Pro-Phe-Z, где X=СН3, Y=Н, Z=ОН. Группа изобретений также касается кристаллоидного кардиоплегического раствора, содержащего солевой раствор, включающий натрия хлорид, калия хлорид, магния хлорид, кальция хлорид, натрия гидрокарбонат, воду для инъекций и структурный аналог природного апелина X-Arg(NGY)-Pro-Arg-Leu-Ser-His-Lys-Cly-Pro-Nle-Pro-Phe-Z, где X=Н, Y=NO2, Z=NH2. Группа изобретений обеспечивает восстановление коронарного потока, сократительной и насосной функции сердца при реперфузии и уменьшение повреждения мембран кардиомиоцитов. 2 н.п. ф-лы, 2 ил., 8 табл., 4 пр.
Реферат
Изобретение относится к области медицины, а именно к разработке растворов, предназначенных для использования при операциях на «открытом» сердце в условиях искусственного кровообращения.
Одним из основных методов защиты миокарда в кардиохирургической практике является использование фармако-холодовой кристаллоидной кардиоплегии.
Известны кардиоплегические растворы Консол, Кустодиол, Цельсиор, содержащие в своем составе калия хлорид, кальция глюконат, магния сульфат, натрия гидрокарбонат, натрия хлорид, воду для инъекций с добавление различных компонентов.
(Островский Ю.П. Хирургия сердца. М.: Мед. Лит., 2007. - 576 с.)
Наиболее близким к заявляемому кардиоплегическому раствору является солевой раствор госпиталя Св. Томаса (КПР ГСТ), выпускающийся фирмой Abbott Laboratories (США) под названием Plegisol, в состав которого входят: натрия хлорид, калия хлорид, магния хлорид, кальция хлорид, натрия гидрокарбонат. В России и за рубежом этот препарат наиболее часто используют для кардиоплегии.
Gharagozloo F., Bulkley В.Н., Hutchins G.M., Bixler T.J., Schaff H.V., Flaherty J.T., Gardner T.J. Potassium-induced cardioplegia during normothermic cardiac arrest. Morphologic study of the effect of varying concentrations of potassium on myocardial anoxic injury. J Thorac Cardiovasc Surg. 1979; 77(4):602-607.
К общему недостатку перечисленных кардиоплегических растворов можно отнести неполное предотвращение метаболических и структурных изменений, развивающихся в миокарде при продолжительной ишемии и последующем возобновлении коронарного кровотока во время оперативных вмешательств. Как известно, основными повреждающими факторами при ишемии являются нарушения в энергетическом обеспечении миокардиальных клеток и генерация активных форм кислорода, сопряженные с изменением внутриклеточного ионного гомеостаза. Их воздействие на ишемизированный миокард способно блокировать окислительное фосфорилирование, повреждать структуру митохондриальных и плазматических мембран, вызывать контрактуру миофибрилл, а также быть причиной внутриклеточного отека и гибели кардиомиоцитов. Следствием указанного выше недостатка использующихся кардиоплегических препаратов является развитие интраоперационных инфарктов, сниженное восстановление насосной функции сердца при возобновлении кровообращения, которое осложняется возникновением реперфузионных аритмий и развитием сердечной недостаточности.
Задачей изобретения является разработка эффективных оригинальных кристаллоидных кардиоплегических растворов, содержащие додекапептиды, способных уменьшить риск кардиохирургических вмешательств, улучшающих энергетический обмен и стабилизирующих сарколемму кардиомиоцитов, а также оптимизация ионного состава и осмолярности растворов.
Технический результат изобретения заключается в восстановлении коронарного потока, сократительной и насосной функции сердца при реперфузии и уменьшение повреждения мембран кардиомиоцитов.
Это достигается тем, что в заявляемом кристаллоидном кардиоплегическом растворе, по первому варианту, содержащем солевой раствор, включающий, мкмоль/л: натрия хлорид 119-121, калия хлорид 15-17, магния хлорид 15-17, кальция хлорид 1,1-1,3, воду для инъекций, согласно изобретению, дополнительно содержит структурный аналог природного апелина Х-Arg(NGY)-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-Z, где X=СН3, Y=Н, Z=ОН в количестве 0,13-0,15 мкмоль на 1 л солевого раствора.
По второму варианту в заявляемом кардиоплегическом растворе, содержащем солевой раствор, включающий, мкмоль/л: натрия хлорид 119-121, калия хлорид 15-17, магния хлорид 15-17, кальция хлорид 1,1-1,3, воду для инъекций, согласно изобретению, дополнительно содержит структурный аналог природного апелина X-Arg(NGY)-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-Z, где X=Н, Y=NO2, Z=NH2 в количестве 0,13-0,15 мкмоль на 1 л солевого раствора.
В последние годы внимание исследователей привлекают эндогенный адипокин апелин - 77-членный полипептид и его APJ рецептор, участвующие в регуляции тонуса коронарных сосудов и сократимости миокарда. Показано, что экзогенные С-концевые фрагменты апелина (апелин-36, -13 и -12) способны ограничивать размер инфаркта миокарда и улучшать восстановление функции сердца у экспериментальных животных после периода тотальной или региональной ишемии. В кардиомиоцитах крыс при моделировании оксигенационного стресса и в условиях энергетического дефицита эти пептиды блокировали открытие митохондриальной поры и апоптоз. Снижение гибели кардиомиоцитов при реперфузии под действием С-концевых фрагментов апелина связано с активацией каскадов, включающих PI3-Akt киназы и MAP киназы, мишенями которых являются эндотелиальная NO-синтаза (eNOS), рибосомальная p70S6-киназа и проапоптозный белок BAX/BAD.
Известно, что пептид апелин-12 (H-Arg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Met-Pro-Phe-OH, А12), полностью идентичный С-концевому фрагменту апелина у животных различных видов и человека, является минимальной активной частью молекулы исходного апелина-77; он обладает высоким сродством к APJ рецептору и кардиопротекторными свойствами. Однако высокая активность ферментов (амино- и карбоксипептидаз) в крови затрудняет применение апелина-12 в клинике. Кроме того, в состав А12 входит метионин, который чрезвычайно легко окисляется кислородом воздуха до соответствующего сульфоксида, что снижает его стабильность при хранении. Нами были синтезированы структурные аналоги А12, сочетающие высокую кардиопротекторную активность с повышенной протеолитической стабильностью и устойчивостью при хранении - пептиды (I) и (II).
В молекулах этих пептидов подверженный окислению метионин заменен на норлейцин - природную аминокислоту небелкового происхождения, абсолютно устойчивую к окислению кислородом. N-Концевая часть пептидов содержит либо остаток Nα-алкил аминокислоты - Nα-метиларгинина (пептид I), либо NG-нитрогруппу (пептид II), что повышает устойчивость к действию аминопептидаз. С-Концевая часть пептида (II) дополнительно защищена от действия карбоксипептидаз амидной функцией.
Синтез пептидов.
Использованные сокращения:
Использованы сокращения, рекомендованные комиссией IUPAC-IUB (Eur. J. Biochem. (1984). V.183. P.9-37), а также: Вос-трет-бутилоксикарбонил, But-трет-бутил, DCM - дихлорметан, DIC - N,N'-диизопропилкарбодиимид, Fmoc - 9-флуоренилметоксикарбонил, HOBt - 1-гидроксибензотриазол, 4-MePip - 4-метилпиперидин, NMP - N-метилпирролидон, Pmc - 2,2,5,7,8-пентаметилхроман-6-сульфонил, TIBS - триизопропилсилан, TFA - трифторуксусная кислота, Trt - тритил.
В работе использованы производные L-аминокислот (Fluka и Bachem, Швейцария), DIC, DIPEA, HOBt, TIBS, (Fluka, Швейцария). Для синтеза применяли N-метилпирролидон, дихлорметан, 4-метилпиперидин, метанол и TFA (Fluka, Швейцария). Аналитическую ВЭЖХ проводили на хроматографе (Gilson, Франция), использовали колонки Kromasil 100 С18, 5 мкм, 4.6×250 мм (Швеция), подвижная фаза: буфер А - 0.1% TFA, буфер Б - 80% ацетонитрила в буфере А, элюция градиентом концентрации буфера Б в буфере А от 10% до 70% за 30 мин; скорость потока 1 мл/мин, детекция при 220 нм. Структура полученных пептидов доказана спектрами 1Н-ЯМР и данными масс-спектрометрии. Масс-спектры регистрировали на приборе Ultrafex TOF/TOF (Bruker Daltonics, ФРГ) с времяпролетной базой методом MALDI (матрично-активированной масс-спектрометрии с лазерной десорбцией/ионизацией).
Твердофазный синтез пептида (I) был проведен на автоматическом синтезаторе Applied Biosystems 431 А (Германия) в соответствии со стандартным протоколом для однократной конденсации Fmoc-аминокислот. Для блокирования функциональных групп боковых цепей аминокислот применяли следующие защитные группы: Pmc - для гуанидиновой группы аргинина, But - для оксигруппы серина, Boc - для ε - аминогруппы лизина, Trt - для имидазола гистидина. В качестве носителя использовали полимер Ванга - сополимер стирола с 1% дивинилбензола с 4-гидроксиметилфеноксиметильной якорной группой. Синтез проводили с С-конца, исходя из 0.4 г (0.25 ммоль) Fmoc-Phe-полимера фирмы Bachem (Швейцария) с содержанием фенилаланина - 0.67 ммоль/г. Ниже приведен стандартный протокол ТФС. Дипептид Fmoc-Nle-Pro-OH был получен классическими методами пептидной химии в растворе, очищен хроматографией на силикагеле и охарактеризован данными ТСХ и 1Н-ЯМР-спектроскопии.
| Таблица 1. | |||
| Протокол твердофазного синтеза пептидов (I) и (II). | |||
| № | Операция | Реагент | Время обработки |
| Цикл 1 | |||
| 1 | Промывка | 5×NMP | 3 мин |
| 2 | Деблокирование α-аминогрупп | 25% 4-MePip/NMP | 10 мин |
| 3 | Промывка | 5×NMP | 3 мин |
| 4 | Активация | 1 ммоль Fmoc-Nle-Pro-OH+1 ммоль TBTU+1 ммоль НОВТ+2 ммоль DIPEA в NMP, | 3-5 мин |
| 5 | Конденсация | 1 ммоль активированного производного Fmoc-дипептида в NMP | 90 мин |
| 6 | Промывка | 5×NMP | 3 мин |
| 7 | Тест с нингидрином | ||
| Цикл 2-10 |
| 1 | Промывка | 5×NMP | 3 мин |
| 2 | Деблокирование α-аминогрупп | 25% 4-Ме Pip/NMP | 10 мин |
| 3 | Промывка | 5×NMP | 3 мин |
| 4 | Активация | 1 ммоль Fmoc-AA-OH+1 ммоль HOBT+1 ммоль DIC в NMP/DMF | 20 мин |
| 5 | Конденсация | 1 ммоль активированного производного Fmoc-AA в NMP | 90 мин |
| 6 | Промывка | 5×NMP | 3 мин |
Заключительное деблокирование и отщепление пептида (I) от полимера проводили в одну стадию путем обработки соответствующего пептидилполимера 10 мл смеси 90% TFA, 2.5% деионизованной воды, 5% тиоанизола и 2.5% TIBS в течение 2-3 ч. Затем полимер отфильтровывали, промывали 2×2 мл деблокирующей смеси, фильтрат упаривали и к остатку прибавляли сухой этилацетат или эфир. Осадок отфильтровывали, промывали DCM (3×3 мл), эфиром (3×5 мл), сушили в вакуум-эксикаторе. «Сырой» продукт твердофазного синтеза очищали с помощью препаративной ВЭЖХ, используя колонку Диасорб С16 130Т (25×250 мм), размер частиц сорбента 10 мкм. В качестве элюентов использовали буфер А - 0.1% водный раствор TFA и буфер Б - 80% ацетонитрила в воде. Элюцию проводили градиентом 0.5% в минуту буфера Б в буфере А от 100% буфера А со скоростью 10 мл/мин. Пептиды детектировали при длине волны 220 нм. Фракции, содержащие целевой продукт, объединяли, ацетонитрил упаривали и лиофилизовали. Гомогенность продукта определяли с помощью аналитической ВЭЖХ, структуру подтверждали данными масс-спектрометрии и 1Н-ЯМР-спектроскопии. Выход пептида, данные ВЭЖХ и масс-спектрометрии приведены в таблице 3.
Для твердофазного синтеза пептида (II) использовали сополимер стирола с 1% дивинилбензола с 4-(2′,4′-диметоксифенил-Fmoc-аминометил)-феноксиметильной-якорной группой (Rink-amide-полимер) фирмы Nova BioChem, Швейцария, предназначенный для получения амидов пептидов, содержащий 0.60 ммоль/г аминогрупп. Синтез амида (II) проводили с С-конца в соответствии с вышеприведенным протоколом твердофазного синтеза (см. табл.2), исходя из 0.40 г (0.24 ммоль) Rink-amide-полимера. Синтез проводили в автоматическом режиме на пептидном синтезаторе Applied Biosystems 431А по стандартной программе для однократной конденсации Fmoc-аминокислот.
Отщепление защит проводили с использованием 10 мл смеси 85% TFA, 5% DMB, 2.5% TIBS, 5% деионизованной воды и 2.5% тиоанизола в течение 3 ч; очистку и идентификацию пептида (II) проводили так же, как описано для соединений (I). Данные приведены в таблице 2.
| Таблица 2. | ||||||
| Характеристики пептидов. | ||||||
| № | Формула пептида | Мрасчет. | Выхода, % | ВЭЖХ* | MALDI-MS, m/z | |
| Rt, мин | % | |||||
| (I) | H-(NαMe)Arg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-OH | 1418.7 | 77 | 17.06 | 98 | 1418.9 |
| (II) | H-Arg(NGNO2)-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-NH2 | 1448.7 | 50б | 16.92 | 98 | 1448.8; 1403.8(-NO2) |
| а - Выходы пептидов приведены в расчете на стартовую аминокислоту, присоединенную к полимеру. | ||||||
| * Колонка Kromasil 100 С18, 4.6×250 мм, 5 мкм; буфер А - 0.1% TFA, буфер Б - 80% ацетонитрил, градиент Б в А от 10 до 70% за 30 мин; скорость потока 1 мл/мин; 220 нм. |
Приготовление кардиоплегического раствора состоит из двух этапов: 1) приготовление солевого раствора госпиталя Св. Томаса); 2) приготовления КПР-1 и КПР-2 с заданной концентрацией пептидов.
1) Приготовление КПР ГСТ. В 0,95 л воды для инъекций растворяют последовательно при перемешивании NaCl - 5,85 г, KCl - 1,19 г, MgCl2·6H2O - 3,25 г, CaCl2 - 0.13 г, NaHCO3 - 0,84 г. pH раствора доводят до 7,8 2н NaOH. Объем раствора доводят до 1,0 л водой и проверяют pH. Конечные концентрации ингредиентов составляют в моль/л: NaCl - 120; КС - 16,0; MgCl2·6H2O - 16,0; CaCl2 1,2; NaHCO3 - 16,0.
2) Приготовление КПР-1 и КПР-2. В 1,0 л КПР ГСТ-2 при комнатной температуре и перемешивании растворяют 198,6 мг пептида I или 202,8 мг пептида II. Кардиопрегический раствор доводят до pH 7,8 5 н NaOH при 25°C и фильтруют через фильтр с размером пор 5 мкм (Millipore, Bedford, USA). Конечные концентрации пептида I и II в КПР-1 и КПР-2 составляют 140,0 мкмоль/л. Концентрации остальных ингредиентов такие же как КПР ГСТ.
Разработанные растворы представляют собой кристаллоидные кардиоплегические растворы внеклеточного типа, предназначенные для защиты сердца человека от глобальной ишемии и реперфузионного повреждения во время кардиохирургических операций. Состав и физико-химические показатели растворов кардиоплегического раствора (вариант 1) КПР-1 и кардиоплегического раствора (вариант 2) КПР-2 в сравнении с кардиоплегическим раствором госпиталя Св. Томаса - КПР ГСТ, выбранного в качестве прототипа, приведены в Табл.3.
| Таблица 3. | |||
| Составы и физико-химические показатели предлагаемых кардиоплегических средств (КПР-1 и КПР-2) и препарата сравнения КПР ГСТ. | |||
| КПР-1 | КПР-2 | КПР ГСТ (прототип) | |
| Натрия хлорид, ммоль/л | 120,0 | 120,0 | 120,0 |
| Калия хлорид, ммоль/л | 16,0 | 16,0 | 16,0 |
| Магния хлорид, ммоль/л | 16,0 | 16,0 | 16,0 |
| Кальция хлорид, ммоль/л | 1,2 | 1,2 | 1,2 |
| Натрия гидрокарбонат, ммоль/л | 10,0 | 10,0 | 10,0 |
| Пептид I, мкмоль/л | 140,0 | - | - |
| Пептид II, мкмоль/л | - | 140,0 | - |
| Вода для инъекций, л | 1,0 | 1,0 | 1,0 |
| pH (25°C) | 7,8 | 7,8 | 7,8 |
| Осмолярность, мОсм/л | 285-300 | 285-300 | 285-300 |
Предложенные средства для кардиоплегии обладают рядом преимуществ по сравнению с КПР ГСТ (протипом). Во-первых, они обеспечивают лучшее восстановление коронарного потока и сократительной и насосной функции сердца при реперфузии. Во-вторых, способствуют более эффективному восстановлению аэробного обмена в реперфузированном миокарде. В-третьих, в большей степени уменьшают повреждения мембран кардиомиоцитов в период ранней реперфузии. Преимущества заявляемых кардиоплегических растворов продемонстрированы в примерах ниже.
Составы КПР-1 и КПР-2 оригинальны и не описаны в доступной литературе. Библиография патентов по модифицированным аналогам С-концевого фрагмента апелина-12 не содержит сведений по предмету изобретения - разработке кардиоплегических средств на основе использования пептидов такой химической структуры. Более того, до проведения экспериментов на перфузируемом сердце лабораторных животных рациональность использования пептидов I и II в качестве полезных добавок к солевым кардиоплегическим растворам не была очевидной. Это связано как с оригинальностью химической структуры соединений, так и отсутствием данных о влиянии природных С-концевых фрагментов природного апелина-36, -13 и -12 на метаболизм и функцию сердца, подвергнутого кардиоплегической остановке. Экспериментальные доказательства биологической активности пептидов I и II в условиях гипортемической солевой кардиоплегии открывают возможность создания оригинальных водорастворимых композиций для интраоперационной защиты миокарда на основе этого класса соединений.
Пример 1. Восстановление функции сердца и коронарных сосудов.
Для изучения кардиопротекторных свойств КПР-1 и КПР-2 использовали модель глобальной ишемии и реперфузии изолированного перфузируемого сердца крысы. Подобные модели применяют для оценки эффективности различных кардиоплегических растворов. Они обеспечивают адекватную оценку влияния предлагаемых препаратов на показатели функции и метаболизма сердца и повреждения клеточных мембран при реперфузии. Все эксперименты проведены в соответствии с «Руководством по уходу и использованию лабораторных животных» (публикация Национального Института Здоровья, США №85-23).
Перфузия изолированного сердца крысы. Опыты выполнены на сердце крыс-самцов линии Wistar (290-340 г). У наркотизированных уретаном (внутрибрюшинно 1,25 мг на г массы тела) животных извлекали сердце и перфузировали ретроградно в течение 15-20 мин раствором Кребса-Хензелейта (РКХ) с 11 мМ глюкозой, насыщенным карбогеном (95% O2±5% CO2) pH 7,4±0,1 при 37°C, при постоянном перфузионном давлении 60 мм рт.ст. После этого сердца перфузировали антеградно по Нийли при постоянном давлении наполнения левого предсердия 15 мм рт.ст. и среднем перфузионном давлении в аорте 60 мм рт.ст. Давление в аорте и левом желудочке регистрировали при помощи тензометрических датчиков Р 50, монитора SP 1405 и регистратора SP 2010 (Gould Statham, США). Показателем интенсивности сократительной функции (СФ) левого желудочка служило произведение частоты сокращений сердца на развиваемое давление (разность между систолическим и минимальным диастолическим давлением). Насосную функцию левого желудочка оценивали по величине минутного (МО - сумме коронарного потока и аортального объема) и ударного (отношению минутного объема к частоте сокращений сердца) объемов.
Протокол эксперимента. После перфузии по Нийли в течение 20 мин (исходное состояние) сердца подвергали кардиоплегической остановке. В контроле использовали КПР ГСТ, в экспериментальных группах - КПР-1 или КПР-2. Кардиоплегические растворы вводили ретроградной перфузией в течение 5 мин с постоянной скоростью 4 мл/мин; температура растворов во всех группах составляла 25°C. Остановленные сердца подвергали нормотермической глобальной ишемии в течение 40 мин, а затем реперфузировали стандартным РКХ - первые 5 мин ретроградно со скоростью 4 мл/мин, последующие 25 мин антеградно по Нийли. По окончании опытов сердца замораживали в жидком азоте для определения содержания макроэргических фосфатов и лактата в реперфузированном миокарде. В отдельной серии сердца замораживали после 20-мин перфузии по Нийли для определения исходного содержания метаболитов. Статистическая обработка полученных результатов выполнена с использованием программы Systat SigmaPlot 11.
В табл.4 сопоставлено восстановление коронарного потока, интенсивности СФ и минутного и ударного объема к 30-й минуте реперфузии по сравнению с этими показателями в исходном состоянии. В опытах препаратом сравнения КПР ГСТ (прототип) эти показатели восстанавливались, соответственно, до 74±2%, 44±1%, 26±1% и 33±1% от исходного значения. Включение в КПР ГСТ пептидов I или II значительно увеличивало восстановление функции сердца и сосудов. Так, при использовании КПР-1 и КПР-2 коронарный поток восстанавливался в среднем до 90%, восстановление интенсивности СФ увеличивалось в среднем в 1,7 раза, а минутного и ударного объема - в 2,8 и 2,5 раза, соответственно.
| Таблица 4. | ||||
| Влияние КПР-1 и КПР-2 на восстановление основных показателей функции сердца и сосудов в конце реперфузии. | ||||
| Коронарный поток, мл/мин | Интенсивность СФ, мм рт.ст./мин | Минутный объем, мл/мин | Ударный объем, мкл/мин | |
| Исходное состояние | ||||
| 18±2 | 32493±669 | 46±1 | 148±1 |
| 30 мин реперфузии | ||||
| Контроль (прототип) | 47+2а | |||
| 13±1а | 13158±301а | 11±1а | ||
| КПР-1 | 17±1б | 25038±1641аб | 33±3аб | 114±6аб |
| КПР-2 | 18±1б | 26470±1208аб | 35±2аб | 120±4аб |
| Данные представлены как M±m для серий из 12 опытов. Достоверно отличается (Р<0,05) от: а - исходного состояния, б - контроля (КПР ГСТ). |
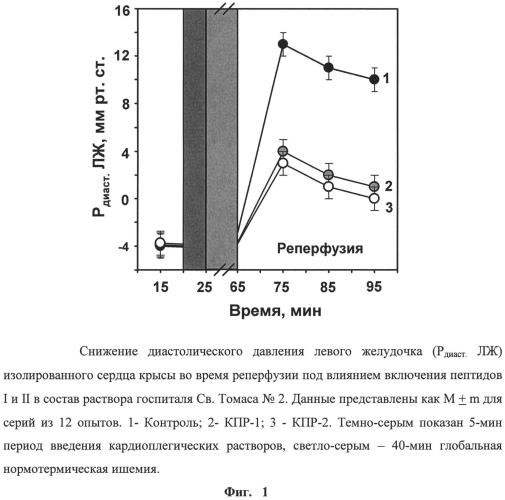
На фигуре 1 показана динамика диастолического давления в левом желудочке (Рдиаст. ЛЖ) в контроле и в опытах с предлагаемыми кардиоплегическими растворами. Рдиаст. ЛЖ является одним из важнейших показателей сократительной и насосной функции сердца, характеризующим расслабление миокарда и наполнение полости левого желудочка в диастолу. Исходное значение Рдиаст. ЛЖ составляло - 4 мм рт.ст. В контроле в начале реперфузии Рдиаст. ЛЖ было высоким, постепенно снижаясь от 13 до 10 мм рт.ст. При использовании КПР-1 и КПР-2 Рдиаст.ЛЖ значительно уменьшалось и составляло в среднем 3,5 мм рт.ст в начале реперпфузии и 0 мм рт.ст конце опыта, соответственно.
Таким образом, добавление пептидов I и II в КПР ГСТ существенно улучшает восстановление показателей функции ишемизированного сердца крысы во время реперфузии. Различия в эффективности действия между КПР-1 и КПР-2 не были статистически достоверными.
Пример 2. Метаболическое состояние сердца при реперфузии.
Обработка ткани сердца. Сердце замораживали охлажденными в жидком азоте щипцами Волленбергера в исходном состоянии или в конце реперфузии. Ткань гомогенизировали в холодной 6% HClO4 (10 мл на г ткани) в гомогенизаторе Ultra-Turrax Т-25 (IKA-Labortechnik, Германия). Белки осаждали центрифугированием при 3000 g и 4°C в течение 10 минут. Супернатанты нейтрализовали 5 М К2СО3 до pH 7,4. Осадок KClO4 отделяли центрифугированием в тех же условиях. Безбелковые экстракты хранили при -20°C до определения метаболитов. Сухой вес гомогенизированной ткани определяли после высушивания образцов в течение суток при 110°C. АТФ и фосфокреатин (ФКр) в тканевых экстрактах определяли спектрофотометрически, используя глюкозо-6-фосфатдегидрогеназу, гексокиназу и креатинкиназу; содержание АДФ и АМФ - с помощью миокиназы, пируваткиназы и лактатдегидрогеназы; содержание креатина (Кр) - с помощью креатинкиназы, фосфоенолпируваткиназы и лактатдегидрогеназы, лактата - с помощью лактатдегидрогеназы. Содержание метаболитов выражали в мкмоль/г сухого веса ткани.
По окончании реперфузии в сердцах исследованных групп были определены уровни адениннуклеотидов (АТФ, АДФ, АМФ) и ФКр и Кр. На основании этих данных были рассчитаны показатели энергетического состояния постишемического сердца: энергетический заряд кардиомиоцитов - ЭЗ=(АТФ+0,5АДФ)/ΣАН; степени фосфорилирования АТФ и ФКр - АТФ/АДФ, и ФКр/Кр. Для оценки интенсивности анаэробного гликолиза/гликогенолиза в реперфузированном сердце было определено содержание лактата. Сопоставление полученных данных с метаболическим состоянием сердца в исходном состоянии (до моделирования ишемии и реперфузии) приведено в табл.5.
| Таблица 5. | ||||
| Влияние использования КПР-1 и КПР-2 на восстановление метаболизма в изолированном сердце крысы при реперфузии. | ||||
| Metabolite | Исходное состояние | 30 мин реперфузии | ||
| Контроль (прототип) | КПР-1 | КПР-2 | ||
| ЭЗ | 0,97+0,01 | 0,76±0.02а | 0,79±0.02а | 0,83±0.01аб |
| АТФ/АДФ | 13,00+0,98 | 2,48±0,02а | 2,38±0,03а | 2,95±0,04абв |
| ФКр | 24,75±1.63 | 17,88±0.46а | 19,04±0,93 | 23,14±1,12бв |
| ФКр/Кр | 0,55+0,04 | 0,37±0,02а | 0,42±0,02 | 0,52±0,03бв |
| Лактат | 1,53±0.93 | 6,03±2.15а | 1,64±0.28б | 1,77±0.83б |
| Данные представлены как M±m для серий из 12 опытов. Достоверно отличается (Р<0,05) от: а - исходного состояния, б - контроля (КПР ГСТ-2), в - КПР-1. |
Использование КПР-1 и КПР-2 увеличивало восстановление энергетического обмена в реперфузированном сердце. Это подтверждалось более высоким значением ЭП постишемических кардиомиоцитов, увеличенным содержанием ФКр и более высокими отношениями АТФ/АДФ и ФКр/Кр по сравнению с этими показателями в контроле. Наиболее эффективно восстановление энергетического обмена происходило под действием пептида II при введении КПР-2. Содержание лактата при использовании КПР-1 и КПР-2 к окончанию реперфузии снижалось в среднем в 3,5 раза по сравнению с контролем и достоверно не отличалось от исходного значения. Это свидетельствовало о лучшем восстановлении аэробной утилизации глюкозы - основного энергетического субстрата перфузированного сердца под действием пептидов I и II. Полученные данные прямо подтверждают улучшение энергетического состояния реперфузированного сердца под действием КПР-1 и КПР-2.
Пример 3. Повреждение мембран кардиомиоцитов.
Повреждение мембран кардиомиоцитов оценивали по увеличению активности лактатдегидрогеназы (ЛДГ) в оттекающем от сердца перфузате, который собирали в охлажденные льдом пробирки в течение 5 мин перед ишемией (исходное состояние) и в течение первых 5 мин реперфузии. Активность ЛДГ определяли, используя в качестве субстрата пируват, на спектрофотометре Yanako UO-2000 (Япония) при λ=340 нм.
В исходном состоянии выход ЛДГ был практически одинаковым во всех группах (Табл.6). В контроле (при использовании КПР ГСТ-2) выход ЛДГ на стадии ранней реперфузии увеличивался почти вдвое по сравнению с исходным состоянием. При остановке сердца перед ишемией кардиоплегическими растворами КПР-1 или КПР-2 этот показатель был значительно меньше (в среднем на 40%, Р<0,05) и достоверно не отличался от выхода ЛДГ в перфузат в исходном состоянии.
| Таблица 6. | ||
| Влияние включения пептидов в состав кардиоплегического раствора госпиталя Св. Томаса №2 на активность ЛДГ (МЕ/г сух. веса) в миокардиальном оттоке изолированного перфузируемого сердца крысы на стадии ранней реперфузии. | ||
| Исходное состояние | Реперфузия | |
| Контроль(прототип) | 5,66±1,15 | 10,51±1,53а |
| КПР-1 | 4,32±0,77 | 6,03±1,22б |
| КПР-2 | 5,55±0.56 | 6,54±0,78б |
| Приведены M±m для серий из 10 опытов. Исходное состояние - активность ЛДГ в перфузате, собранном в течение 5 мин до ишемии. Реперфузия - активность ЛДГ в перфузате, собранном в течение 5 мин после ишемии. Достоверно отличается (Р<0,05) от: а - исходного состояния, б - контроля (КПР ГСТ-2). |
Таким образом, применение маркера повреждения клеточных мембран ЛДГ однозначно свидетельствует о большей стабильности сарколеммы постишемических кардиомиоцитов в случае использования растворов КПР-1 и КПР-2.
Пример 4. Варьирование концентраций пептидов в КПР.
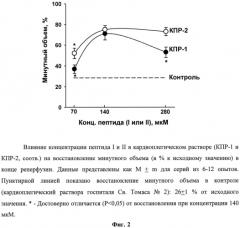
Были тестированы модифицированные составы растворов КПР-1 и КПР-2, содержащие более низкие и более высокие концентрации пептидов I и II. Конечный pH растворов и осмолярность оставались неизменными (табл.7). Эффективность этих препаратов оценивали на модели изолированного перфузируемого сердца крысы по восстановлению показателей его функции и коронарного потока при реперфузии. Протокол опытов был таким, как указано выше. В качестве примера на фигуре 2 показано влияние концентрации пептидов в кардиоплегическом растворе на восстановление минутного объема сердца при реперфузии.
| Таблица 7. | ||
| Составы и физико-химические показатели модифицированного кардиоплегического раствора КПР-1. | ||
| КПР-1-70 | КПР-1-280 | |
| Натрия хлорид. ммоль/л | 120,0 | 120,0 |
| Калия хлорид, ммоль/л | 16,0 | 16,0 |
| Магния хлорид, ммоль/л | 16,0 | 16,0 |
| Кальция хлорид, ммоль/л | 1,2 | 1,2 |
| Натрия гидрокарбонат, ммоль/л | 10,0 | 10,0 |
| Пептид I, мкмоль/л | 70,0 | 280,0 |
| Вода для инъекций, л | 1,0 | 1,0 |
| pH (25°C) | 7,8 | 7,8 |
| Осмолярность, мОсм/л | 285-300 | 285-300 |
| Примечание. Ионный состав и физико-химические показатели модифицированного кардиоплегического раствора КПР-2, содержащего 70 или 280 мкмоль пептида II/л были такими же. |
Из данных представленных на фигуре 2 следует, что для пептидов I и II максимальное восстановление минутного объема достигалось при использовании концентрации 140 мкМ. При двукратном уменьшении или увеличении концентрации пептидов в кардиоплегическом растворе эффективность восстановления снижалась. При использовании КПР с концентрациями пептида I или II 70 и 280 мкМ наблюдалось также снижение восстановления коронарного потока и интенсивности СФ по сравнению со значениями этих показателей для концентрации пептидов 140 мкМ (Табл.4, 8). Полученные результаты свидетельствуют о том, что оптимальной для защиты сердца от ишемического и реперфузионного повреждения является концентрация пептидов I или II в солевом кардиоплегическом растворе, равная 140 мкМ.
| Таблица 8. | ||
| Влияние варьирования концентраций пептидов I и II в кардиоплегическом растворе на восстановление коронарного потока и интенсивности сократительной функции сердца в конце реперфузии. | ||
| Коронарный поток, мл/мин | Интенсивность СФ, мм рт.ст./мин | |
| Исходное состояние | ||
| 18±2 | 32311±782 | |
| 30 мин реперфузии | ||
| Контроль (прототип) | ||
| 13±1а | 13158±301а | |
| КПР-1-70 | 13±1а | 15479±1019а |
| КПР-1-240 | 15±1 | 19545±1835аб |
| КПР-2-70 | 15±1 | 19969±1585аб |
| КПР-2-240 | 18±2б | 27784±536аб |
| Данные представлены как M±m для серий из 6 опытов. Достоверно отличается (Р<0,05) от: а - исходного состояния, б - контроля (КПР ГСТ). |
Таким образом, применение кардиоплегических средств КПР-1 и КПР-2 обеспечивает лучшее восстановление функции сердца и сосудов при реперфузии после периода тотальной ишемии. Это сочетается с более эффективным восстановлением метаболического состояния сердца и меньшими повреждениями мембран постишемических кардиомиоцитов по сравнению с традиционно использующимся кардиоплегическим раствором госпиталя Св. Томаса.
1. Кристаллоидный кардиоплегический раствор, содержащий солевой раствор, включающий натрия хлорид, калия хлорид, магния хлорид, кальция хлорид, натрия гидрокорбонат и воду для инъекций, отличающийся тем, что дополнительно содержит структурный аналог природного апелина X-Arg(NGY)-Pro-Arg-Leu-Ser-His-Lys-Cly-Pro-Nle-Pro-Phe-Z, где X=СН3, Y=Н, Z=ОН, при следующем соотношении компонентов, ммоль/л:натрия хлорид 119-121,калия хлорид 15-17,магния хлорид 15-17,кальция хлорид 1,1-1,3,натрия гидрокарбонат 10,структурный аналог природного апелина 0,13-0,15,вода для инъекций.
2. Кристаллоидный кардиоплегический раствор, содержащий солевой раствор, включающий натрия хлорид, калия хлорид, магния хлорид, кальция хлорид, натрия гидрокарбонат и воду для инъекций, отличающийся тем, что дополнительно содержит структурный аналог природного апелина X-Arg(NGY)-Pro-Arg-Leu-Ser-His-Lys-Cly-Pro-Nle-Pro-Phe-Z, где X=Н, Y=NO2, Z=NH2, при следующем соотношении компонентов, ммоль/л:натрия хлорид 119-121,калия хлорид 15-17,магния хлорид 15-17,кальция хлорид 1,1-1,3,натрия гидрокарбонат 10,структурный аналог природного апелина 0,13-0,15,вода для инъекций.