Олигопептидные соединения и их применения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению олигопептидных соединений, содержащих мотив, взаимодействующий с ядерным антигеном пролиферирующих клеток (PCNA), и может быть использовано в медицине. Олигопептидное соединение состоит из 14-70 аминокислот и содержит PCNA-взаимодействующий мотив, представляющий собой [K/R]-[F/Y/W]-[L/I/V/A]-[L/I/V/A]-[K/R], по меньшей мере одну сигнальную последовательность ядерной локализации и по меньшей мере одну сигнальную последовательность проникновения в клетку, при этом PCNA-взаимодействующий мотив расположен в направлении к N-концу относительно сигнальной последовательности. Изобретение позволяет эффективно лечить гиперпролиферативные расстройства путем использования олигопептидного соединения в цитостатической терапии или в радиотерапии в качестве сенсибилизирующего вещества. 16 н. и 18 з.п. ф-лы, 6 ил., 4 табл., 8 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретению относится к новым агентам, фармацевтическим композициям и их применению в терапии, в частности в любой терапии, где желательно или выгодно уменьшать или предупреждать пролиферацию или рост клеток, например в лечении гиперпролиферативных заболеваний или фактически любого состояния, которое нуждается в цитостатической терапии или восприимчиво к ней. Изобретение основано на установлении новых взаимодействий между ядерным антигеном пролиферирующих клеток (PCNA) и различными белками, вовлеченными в репарацию ДНК, поддержании и регуляции клеточного цикла и последующей идентификации нового пентапептидного мотива, отвечающего за такие взаимодействия, который авторы изобретения назвали APIM. Таким образом, настоящее изобретение в частности относится к пептидам или их миметикам, содержащим такой мотив и способным взаимодействовать с PCNA, к фармацевтическим композициям, содержащим такие агенты, и к применению таких агентов в терапии, в частности в терапиях, включающих уменьшение или предупреждение клеточной пролиферации, как указано выше. Также предложены терапевтические способы, которые включают использование агента, содержащего мотив, связывающий PCNA, предпочтительно в комбинации с цитостатическим агентом.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Человеческие и животные клетки подвергаются воздействию ряда факторов, вызывающих повреждение ДНК, таких как активные формы кислорода, ультрафиолетовое излучение, рентгеновские лучи и эндогенные или экзогенные цитостатические агенты.
Цитостатические агенты представляют собой агенты, которые подавляют или замедляют клеточный рост и/или размножение (пролиферацию/репликацию), например путем повреждения ДНК или воздействуя на механизм клеточный репликации. Алкилирующие агенты представляют собой класс цитостатических агентов, некоторые из которых используют клинически или в исследовательских целях.
Алкилирующие агенты вызывают повреждения ДНК, модифицируя основания по атомам N или О. Тип повреждения зависит от типа агента, большинство агентов вызывают конкретную модификацию ДНК. Повреждения ДНК включают аддукты алкилирования и межнитевые сшивки, которые могут приводить к неправильному кодированию во время репликации и/или к блокировкам репликации с последующими двухнитевыми разрывами или транслезионным синтезом.
Человеческие и животные клетки имеют различные системы репарации ДНК, включая эксцизионную репарацию оснований, эксцизионную репарацию нуклеотидов и репарацию ошибочно спаренных нуклеотидов. Примером является окислительная ДНК-деметилаза человека, hABH2, которая превращает 3-метилцитозин (3meC) обратно в цитозин и 1-метиладенин (1meA) в аденин посредством окислительного деметилирования.
Тесная координация между репарацией ДНК и репликацией ДНК, регулируемой клеточным циклом, имеет большое значение для целостности генома. Важно, чтобы при наличии повреждения репликация ДНК прекращалась до исправления повреждения, в противном случае возникают и воспроизводятся мутации. Известен один белок, включенный как в репликацию ДНК, так и в репарацию ДНК представляющий собой ядерный антиген пролиферирующих клеток (PCNA).
PCNA является членом семейства белков скользящего захвата, которые функционально сохраняются от бактерий до высших эукариот, и основная функция которых состоит в предложении репликационных полимераз с высокой процессивностью, необходимой для копирования генома. В живых клетках S-фазы PCNA, меченный зеленым флуоресцентным белком (GFP), образует отчетливые фокусы, представляющие сайты репликации. Таким образом, его можно использовать как маркер S-фазы.
Многочисленные белки, вовлеченные в клеточные процессы, такие как репарация ДНК, сборка хроматина, эпигенетическое и хроматиновое ремоделирование, когезия сестринских хроматид, контроль клеточного цикла и выживаемость, локализованы в так называемых репликационных зонах, которые содержат более дюжины репликационных вилок. Многие из этих белков взаимодействуют с PCNA посредством консервативной пептидной последовательности, взаимодействующей с PCNA, называемой PIP-бокс (QxxL/I/MxxF/DF/Y), где х может представлять собой любую аминокислоту. Альтернативный мотив, связывающий PCNA, называемый КАх-бокс, идентифицировали, используя библиотеку пептидного дисплея, но важность данного мотива для взаимодействий с PCNA in vivo не была подтверждена.
Различные белки взаимодействуют с PCNA, и было доказано, что некоторые из данных белков, включая hABH2, локализованы вместе с PCNA в фокусах репликации. Однако совместная локализация сама по себе не означает, что между совместно локализованными белками происходит какое-либо прямое или непрямое взаимодействие. Действительно, отсутствие в hABH2 PCNA-связывающего мотива, такого как PIP-бокс или КАх бокс, предполагает, что hABH2 не взаимодействует с PCNA.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В работе, приводящей к настоящему изобретению, авторы изобретения неожиданно обнаружили, что различные белки взаимодействуют с PCNA посредством нового мотива, взаимодействующего с PCNA. В одном из таких белков, hABH2, данный мотив расположен на N-конце. Авторы изобретения установили, что данный мотив является и необходимым и достаточным для взаимодействия с PCNA (смотри Пример 1).
В Примерах ниже подробно объясняется, что для изучения функции данного мотива, взаимодействующего с PCNA, в репарации ДНК при повреждении алкилированием клеточные линии, экспрессирующие рекомбинантный пептид, содержащий этот мотив, подвергали воздействию различных доз MMS (метилметансульфоната), который представляет собой алкилирующий агент SN2, вызывающий образование 3-метилцитозина и 1-метиладенина. Было обнаружено, что экспрессия рекомбинантного пептида, содержащего мотив, повышала чувствительность клеток к повреждению ДНК, вызванному MMS, указывая на то, что рекомбинантный пептид, содержащий мотив, конкурентно ингибировал взаимодействие между PCNA и hABH2.
Также тестировали другие агенты, включающие BCNU (бис-этилхлорнитрозомочевина), темозоломид (TZM) и митомицин С (ММС), которые вызывают другие виды повреждения ДНК, и к своему большому удивлению, авторы изобретения обнаружили, что рекомбинантный пептид, содержащий мотив, также повышал чувствительность клеток к повреждениям, вызванным такими агентами. Это было совершенно неожиданно, так как BCNU представляет собой О6-хлорэтилирующий агент, который главным образом приводит к межнитевым поперечным связям, а также к некоторым одноосновным циклическим аддуктам (1,N(6)этаноаденин), сообщается, что TZM является O6G-метилирующим агентом, и ММС вызывает образование межнитевых поперечных связей посредством N-алкилирования гуанина в CpGs, и hABH2 не исправляет такие типы повреждения ДНК. Альтернативно, существуют другие ферменты, которые исправляют данный вид повреждения, например повреждения посредством TZM исправляют непосредственно O-метилгуанин-ДНК-трансферазой (MGMT). Полученные данные показывают, что рекомбинантный пептид, содержащий этот мотив, не только ингибирует взаимодействие между hABH2 и PCNA, и что могут быть вовлечены другие белки, то есть другие белки могут взаимодействовать с PCNA посредством нового мотива.
Авторы изобретения также обнаружили, что экспрессия рекомбинантного пептида, содержащего мотив, увеличивала цитотоксический эффект цитостатических агентов (особенно MMS) выше наблюдаемого в клеточных линиях от нокаутных мышей АВН2, то есть мышей, которые не имеют АВН2, это также указывало на то, что рекомбинантный пептид, содержащий мотив, имеет расширенный эффект, и возможно ингибирует другие белки в дополнение к hABH2.
Такие неожиданные данные позволили авторам изобретения предложить терапевтическое применение пептида, содержащего мотив, связывающий PCNA.
Новый PCNA-связывающий мотив по изобретению, названный APIM, был охарактеризован и может быть определен следующим образом:
X1X2X3X3'X1' (SEQ ID NO:1),
где X1 и Х1' независимо выбран из группы основных аминокислот, Х2 представляет собой липофильную аминокислоту, и Х3 и Х3' - независимо выбраны из группы незаряженных, предпочтительно неполярных аминокислот.
Пептид (или олигопептидное соединение), способный взаимодействовать с PCNA, может включать или содержать такой мотив пептида (или последовательности). Таким образом, олигопептидное соединение, способное взаимодействовать с PCNA и содержащее такой мотив, раскрыто в данном описании изобретения, и может представлять собой некоторые аспекты настоящего изобретения.
Например, в одном воплощении настоящего изобретения могут быть предложено олигопептидное соединение, которое способно к взаимодействию с PCNA, и которое содержит мотив X1X2X3X3'X1' (SEQ ID NO:1), где X1 и X1' независимо выбраны из группы основных аминокислот, Х3 представляет собой липофильную аминокислоту, и Х3 и Х3' - независимо выбраны из группы незаряженных, предпочтительно неполярных аминокислот, где олигопептидное соединение дополнительно отличается по меньшей мере одним из следующих:
(1) олигопептидное соединение содержит по меньшей мере 11 аминокислот или эквивалентных субъединиц;
(2) Х2 не является фенилаланином;
(3) олигопептидное соединение содержит по меньшей мере одну D-аминокислоту;
(4) олигопептидное соединение содержит по меньшей мере одну сигнальную последовательность, а именно последовательность, которая направляет олигопептидное соединение в конкретное место, например в клетку (например последовательность для проникновения в клетку, которая направляет олигопептидное соединение в клетку) и/или в особый клеточный компартмент (например сигнал ядерной локализации, который направляет олигопептидное соединение в ядро); и
(5) олигопептидное соединение содержит мотив [K/R]-F-[L/I/V]-[L/I/V]-[K/R] (SEQ ID NO:27).
В частности, в таком воплощении олигопептидное соединение содержит сигнальную последовательность ядерной локализации. В другом воплощении олигопептидное соединение содержит последовательность для проникновения в клетку (пептид проникновения в клетку). В еще одном воплощении олигопептидное соединение содержит последовательность проникновения в клетку и последовательность ядерной локализации.
Таким образом, можно видеть, что в таких воплощениях соединение по изобретение может принимать форму конструкции, содержащей (то есть включающей) олигопептидное соединение, которое содержит мотив, взаимодействующий с PCNA, как определено выше, вместе по меньшей мере с одной сигнальной последовательностью. В этом аспекте изобретение можно, таким образом, рассматривать как предложение конструкции, содержащей олигопептидное соединение, которое способно взаимодействовать с PCNA, и которое содержит мотив X1X2X3X3'X1' (SEQ ID NO:1), где X1 и Х1' независимо выбраны из группы основных аминокислот, Х2 представляет собой липофильную аминокислоту, и Х3 и Х3' независимо выбраны из группы незаряженных, предпочтительно неполярных аминокислот, вместе по меньшей мере с одной сигнальной последовательностью.
Как указано выше, было определено, что новый мотив по изобретению опосредует взаимодействие олигопептидного соединения (например пептида) или белка, содержащего такой мотив, с PCNA.
Взаимодействие может быть прямым или опосредованным, и может включать непосредственное связывание мотива с PCNA, или мотив может связываться опосредованно, например связывание может быть опосредовано другой молекулой. Указанная ссылка на «PCNA-взаимодействие» или «PCNA-связывание» может, таким образом, включать любую форму взаимодействия и как прямое, так и опосредованное связывание.
Любую ссылку в данном описании изобретения на «мотив» следует понимать как означающую Х1Х2Х3Х3'Х1', как определено в данном описании изобретения.
Предпочтительно, X1 и Х1' независимо выбраны из лизина (К), аргинина (R), гистидина (И), орнитина (Om), метиллизина (МеК) и ацетиллизина (АсК), и более предпочтительно К, R и Н, или К и R;
Х2 предпочтительно представляет собой ароматическую аминокислоту, более предпочтительно он выбран из фенилаланина (F), триптофана (W), тирозина (Y), трет-бутилглицина, циклогексилаланина, трет-бутилфенилаланина, бифенилаланина и три-трет-бутилтриптофана (в некоторых воплощениях этот перечень может исключать F), в частности F, W и Y, или W и Y, F и Y, или F и W, или в конкретных воплощениях Х2 может представлять собой F, или W, или Y;
Х3 и Х3' - предпочтительно представляют собой алифатические аминокислоты и могут, например, быть независимо выбраны из лейцина (L), изолейцина (I), валина (V), аланина (А) метионина (М) и норлейцина (Nor);
Предпочтительно, Х3 и Х3' не являются оба А, более предпочтительно Х3 и Х3' - выбраны из L, I, V и М, еще более предпочтительно из L, I и V.
Связывание мотива с PCNA может быть улучшено в некоторых воплощениях, когда Х2 представляет собой W или Y. Таким образом, в одном воплощении X2 не является F. Однако, как отмечено выше, в других воплощениях он может представлять собой F.
Таким образом, в изобретении может быть предложено олигопептидное соединение, содержащее мотив [K/R]-[F/Y/W]-[L/I/V/AM]-[L/I/V/A/M]-[K/R] (SEQ ID NO:28), где указанное олигопептидное соединение способно взаимодействовать с PCNA.
В другом воплощении мотив может быть определен как: [K/R]-[Y/W]-[L/I/V/A/M]-[L/I/V/A/M]-[K/R] (SEQ ID NO:29).
В другом воплощении мотив может быть определен как: [K/R]-[F/Y/W]-[L/I/V/A]-[L/I/V/A]-[K/R] (SEQ ID NO:30).
В другом воплощении мотив может быть определен как: [K/R]-[Y/W]-[L/I/V/A]-[L/I/V/A]-[K/R] (SEQ ID NO:31).
В другом воплощении мотив может быть определен как: [K/R]-[F/W]-[L/I/V/A/M]-[L/I/V/A/M]-[K/R] (SEQ ID NO:32).
В другом воплощении мотив может быть определен как: [K/R]-[F/W]-[L/I/V/A]-[L/I/V/A]-[K/R] (SEQ ID NO:33).
В другом воплощении мотив может быть определен как: [K/R]-[F/W]-[L/I/V]-[L/I/V]-[KR] (SEQ ID NO:34).
В другом воплощении мотив может быть определен как: [K/R]-[F/Y/W]-[L/I/V]-[L/I/V]-[K/R] (SEQ ID NO:35).
В еще одном воплощении мотив может быть определен как: [K/R]-[Y/W]-[L/I/V]-[L/I/V]-[K/R] (SEQ ID NO:36).
В еще одном воплощении мотив может быть определен как: [K/R]-F-[L/I/V]- [L/I/V]-[K/R] (SEQ ID NO:37).
Олигопептидное соединение предпочтительно представляет собой выделенное соединение.
В предпочтительном воплощении олигопептидное соединение имеет или содержит последовательность RFLVK (SEQ ID NO:2). В других предпочтительных воплощениях олигопептидное соединение имеет или содержит последовательность, выбранную из KFLLR (SEQ ID NO:3), KYLLR (SEQ ID NO: 4), KWLLR(SEQ ID NO: 5), KYILR (SEQ ID NO: 6), KYVLR (SEQ ID NO: 7), RFLLR (SEQ ID NO: 8), RYLLR (SEQ ID NO: 9), RWLLR (SEQ ID NO: 10), RYILR (SEQ ID NO: 11), RYVLR (SEQ ID NO: 12), RFLIR (SEQ ID NO: 13), RYLVR (SEQ ID NO: 14) RWLMR (SEQ ID NO: 15), RYVLR (SEQ ID NO: 16), RYVIR (SEQ ID NO: 17), RWLVK (SEQ ID NO: 18), RYLVK (SEQ ID NO: 19), RWLIK (SEQ ID NO: 20), RWIVK (SEQ ID NO: 21), RWVVK (SEQ ID NO: 22), RWAVK (SEQ ID NO: 23), RYVVK (SEQ ID NO: 24), RYLIK (SEQ ID NO: 25) или RYLMK (SEQ ID NO: 26). Эти конкретные последовательности перечислены в качестве примера, и их не предназначают для ограничения объема настоящего изобретения.
В одном предпочтительном воплощении олигопептидное соединение по изобретению также содержит сигнальную последовательность, которая нацеливает мотив на конкретный тип клеток, облегчает проникновение соединения в клетку, и/или локализует соединение в конкретном внутриклеточном компартменте, предпочтительно ядре.
Таким образом, сигнальную последовательность можно рассматривать как любую последовательности, которая влияет на локализацию, или иначе говоря, на направление, транслокацию или транспорт олигопептидного соединения в любое желательное положение, например в любое желательное клеточное или субклеточное положение. В предпочтительных воплощениях желательное положение представляет собой клетку (то есть внутреннее пространство клетки) и/или ядро клетки.
Таким образом, сигнальная последовательность может представлять собой последовательность, которая влияет на транспорт олигопептидного соединения в клетку, или через клеточную мембрану (то есть внутрь клетки). Это может быть, таким образом, так называемая последовательность «проникновения в клетку» (или более конкретно «пептид проникновения в клетку»), также известная в данной области техники как домен белковой трансдукции (PTD) или последовательность белковой трансдукции.
Таким образом, как указано выше, предпочтительное воплощение изобретения представляет собой конструкцию, содержащую (1) олигопептидное соединение, содержащее мотив APIM (то есть PCNA-взаимодействующий мотив), как определено в данном описании изобретения, и (2) последовательность проникновения в клетку (более конкретно пептид проникновения в клетку).
Технология пептидного проникновения в клетку (СРР) в последние годы развивалась в значительной степени, и известен большое множество пептидов проникновения в клетку, описанных в данной области техники, и конечно, ряд таких пептидов имеется в продаже. Пептиды проникновения в клетку могут широко варьироваться по размеру, последовательности и заряду, и конечно по механизму их действия (который в настоящее время неизвестен для некоторых пептидов и не полностью выяснен для других), но разделяют общую способность перемещаться через плазменную мембрану и доставлять прикрепленную или ассоциированную группировку (так называемый «груз») в цитоплазму, или даже в некоторых случаях в ядро, клетки. СРР представляют собой, таким образом, пептидные векторы доставки.
СРР могут быть произведены из имеющихся в природе белков, которые способны перемещаться через клеточные мембраны, такие как гомеобоксный белок антеннапедия Drosophila (транскрипционный фактор), вирусные белки, такие как HIV-1 (вирус иммунодефицита человека - 1), транскрипционный фактор ТАТ и капсидный белок VP22 из HSV-I (вирус простого герпеса - 1), и/или они могут быть произведены синтетически, например из химерных белков или синтетических полипептидов, таких как полиаргинин. Как указано выше, не существует одного механизма, отвечающего за эффект трансдукции, и, следовательно, конструирование СРР может быть основано на разных структурах и последовательностях. Пептиды проникновения в клетку рассмотрены в Jarver et al. 2006 Biochimica et Biophysica Acta 1758, pages 260-263, и в Таблице 2 ниже перечислены различные типичные пептиды. В US 6645501 дополнительно описаны различные пептиды проникновения в клетку, которые можно использовать.
| ТАБЛИЦА 2 | ||
| Класс Antp | ПОСЛЕДОВАТЕЛЬНОСТЬ | ССЫЛКА |
| Пенетратин | RQIKIWFQNRRMKWKK (SEQ ID NO:38) | Bolton (2000) Eur. J. Neuro. 12:287 |
| Производные пенетратина | RRMKWKK (SEQ ID NO:39) | US 6472507 |
| NRRMKWKK (SEQ ID NO:40) | EP4855781 | |
| QNRRMKWKK (SEQ ID NO:41) | WO 97/12912 | |
| FQNRRMKWKK (SEQ ID NO:42) | ||
| RREKWKK (SEQ ID NO:43) | ||
| RRQKWKK (SEQ ID NO:44) | ||
| KRMKWKK (SEQ ID NO:45) | ||
| RKMKWKK (SEQ ID NO:46) | ||
| RROKWKK (SEQ ID NO:47) | ||
| RRMKQKK (SEQ ID NO:48) | ||
| RRMKWFK (SEQ ID NO:49) | ||
| RORKWKK (SEQ ID NO:50) | ||
| RRMWKKK (SEQ ID NO:51) | ||
| RRMKKWK (SEO ID NO:52) | ||
| (используя стандартное однобуквенное обозначение аминокислоты, орнитин (O), диаминомасляная кислота (В), норлейцин (N) | ||
| D-пенетратин | rqikiwfqnrrmkwkk (SEQ ID NO:53) | Rouselle, C. etal.(2000) Mol. Pharm 57: 679 |
| Класс протергина | ||
| Пегелин (Syn В) | RGGRLSYSRRRFSTSTGR (SEQ ID NO:54) | Rouselle, C. et al. (2000) Mol. Pharm 57: 679 |
| Класс HIV-TAT | ||
| HIV-TAT | GRKKRRQRRRPPQ (SEQ ID NO:55) | Vives E.J Biol, Chem 1997, 272: 16010 Snyder (2004) PLOS 2: 186 |
| 47-57 OF HIV-TAT | YGRKKRRORRR (SEO ID NO:56) | Potocky et al. (2003)JBC |
| VP22 | DAATATRGRSAASRPTERPRAPARSASRPRRVD (SEQ ID NO:57) | Elliott g. Cell 1997, 88: 223-233 |
| Амфипатические пептиды | ||
| MAP | KLALKLALKALKAALKLA (SEQ ID NO:58) | Morris MC., Nat Biotechnol. 2001, 19: 1173-1176 |
| Транспортан | GWTLNSAGYLLGKINLKALAALAKKIL (SEQ ID NO:59) | Pooga M, FASEB J 1998, 12: 67-77 |
| Транспортан-10 | AGYLLGKINLKALAALAKKIL (SEQ ID NO:60) | Soomets U, Biochim Biophys Acta 2000, 1467: 165-176 |
| KALA | WEAKLAKALAKALAKHLAKALAKALKACEA (SEQ ID NO:61) | Oehike J., Biochim Biophys Acta 1998, 1414: 127-139 |
| Рер-1 | KETWWETWWTEWSQPKKKRKV (SEQ ID NO:62) | Wyman Biochemistry 1997, 36: 3008-3017 |
| Рер-2 | KETWFETWFTEWSQPKKKRKV (SEQ ID NO:63) | |
| MPG | GALFLGFLGAAGSTMGAWSQPKSKRKV (SEQ ID NO:64) | Wagstaff KM Curr Med Chem 2006, 13: 1371-1387 |
| Пептиды Vectocell | VKRGLKLRHVRPRVTRMDV (SEQ ID NO:65) | Coupade (2005) Bochem. J. 407 |
| SRRARRSPRHLGSG* (SEQ ID NO:66) | ||
| LRRERQSRLRRERQSR* (SEQ ГО NO:67) | ||
| GAYDLRRRERQSRLRRRERQSR CSEO ГО NO:68) | ||
| *указывает на добавление cys для конъюгации с грузом | ||
| Wr-T транспортер | KETWWETWWTEWWTEWSQ-GPG-rrrrrrrr (SEQ ID NO:69) r = D-энантиомер аргинина | Kondo (2004) Mol. Can. Thera 1623 |
| Другие пептиды | ||
| R7 | RRRRRRR (SEQ ID NO:70) | Rothbard et al., Nat. Med 6 (2000) 1253-1257 |
СРР, произведенные от Антеннапедия (класс Antp), являются особенно интересным классом, основанным приблизительно на 16 аминокислотах последовательности пенетратина, как показано в Таблице 2, которые соответствуют третьей петле белка антеннапедия, и, как было показано, отвечают за транслокацию белка. Пенетратин активно разрабатывали в качестве носителя, включая в частности фармацевтическое использование, и был предложен и описан широкий ассортимент производных пенетратина и модифицированных последовательностей. Можно сделать ссылку в частности на WO 91/1891, WO 00/1417, WO 00/29427, WO 2004/069279 и US 6080724. Таким образом, 16-аминокислотная последовательность Пенетратина может быть модифицирована и/или укорочена, или пептид может быть химически модифицированным или могут быть получены ретро-, инверсные- или ретро-инверсные аналоги, все еще сохраняющие активность проникновения в клетку.
Другая группа пептидов проникновения в клетку, которые можно успешно использовать, основаны на последовательности HIV-TAT, и HIV-TAT и ее фрагменты представляют собой предпочтительный класс СРР для применения согласно настоящему изобретению. Различные СРР на основе ТАТ описаны в US 5656122. Типичный пептид HIV-TAT, который используют в Примерах ниже, представляет собой RKKRRQRRR (SEQ ID NO:71), но как нетрудно понять, можно использовать более длинные или более короткие фрагменты ТАТ.
Как упоминается выше, отсутствуют конкретные структурные признаки или мотивы последовательности, которые являются общими для всех СРР. Однако разные классы СРР можно идентифицировать по конкретным признакам, таким как, например, пептиды, которые являются амфипатическими и имеют положительный результирующий заряд. Другие группы СРР могут иметь структуру с высоким содержанием α-спиралей. Другая группа может представлять собой пептиды, отличающиеся высоким содержанием основных аминокислот. СРР могут, таким образом, представлять собой или могут содержать олигомеры основных аминокислот, таких как аргинин, например от 5 до 20, от 6 до 15 или от 6 до 12 R-остатков, например R7 (SEQ ID NO:70), R8 (SEQ ID NO:72), или R11 (SEQ ID NO:73), или QSR8 (SEQ ID NO:74).
Богатые пролином амфипатические пептиды являются еще одним классом СРР, и такие пептиды, отличающиеся присутствием пирролидиновых колец из пролинов, описаны в Pujals et al. 2008 Advanced Drug Delivery Reviews 60, pages 473-484.
Другие успешно разработанные СРР включают pVEC (Elmquist et al. 2003 Biol. Chem 384, pages 387-393; Holm et al. 2005 Febs Lett. 579, pages 5217-5222) и пептиды, произведенные из кальцитонина (Krauss et al. 2Q04 Bioorg. Med. Chem. Lett., 14, pages 51-54).
Имеющиеся в продаже СРР включают Chariot на основе пептида Рер-1 (Active Motif, France), векторы Syn-B на основе пептида протегрина PG-1 (Syntem, France) и Express-si Delivery на основе пептида MPG от Genospectra, USA.
В дополнение к общедоступным и описанным СРР, могут быть спроектированы и синтезированы новые пептиды или производные СРР на основе известных или описанных критериев (например известных последовательностей или признаков СРР, таких как содержание основных аминокислот, содержание α-спиралей и так далее, как обсуждалось выше). Кроме того, случайно сконструированные или другие пептиды могут быть подвергнуты скринингу на активность СРР, например путем присоединения или прикрепления такого пептида, содержащего репортерную молекулу, например определяемую метку или маркер, такую как флуоресцентную метку, к требуемому грузу (олигопептидному соединению по настоящему изобретению) и тестирования, чтобы убедиться в перемещении этой конструкции через клеточную мембрану, например путем добавления таких пептидов к живым клеткам с последующим изучением клеточного импорта, например с использованием конфокальной микроскопии.
Действительно, в то время как обычно СРР будет проникать или входить в практически любой тип клеток, в некоторых случаях можно наблюдать, что успешная или эффективная доставка может зависеть, или может варьироваться в зависимости от точной природы груза (например пептидной последовательности груза) и/или используемого СРР. В рамках обычной квалификации специалиста в данной области техники определить оптимальные пептидные последовательностями и комбинации и так далее, и протестировать и/или модифицировать груз и/или последовательность СРР или структуру и так далее.
Как упоминалось выше, сигнальная последовательность, которая может содержаться в олигопептидных соединениях (или конструкциях) по изобретению, может представлять собой сигнальный пептид, который направляет соединение (или конструкцию) в конкретный субклеточный компартмент, и в частности ядро. Сигналы ядерной локализации (NLS) также хорошо известны в данной области техники и широко описаны в литературе, и можно использовать любой известный или функциональный NLS.
Таким образом, еще одним предпочтительным воплощением изобретения является конструкция, содержащая (1) олигопептидное соединение, содержащее мотив APIM (то есть мотив, взаимодействующий с PCNA), как определено в данном описании изобретения, и (2) сигнал ядерной локализации.
NLS может варьироваться по длине и/или последовательности и был описан широкий ряд конкретных последовательностей NLS. В общем случае, однако, было обнаружено, что пептиды, содержащие положительно заряженные аминокислоты (в частности лизин (К), аргинин (R) и/или гистидин (Н)) могут функционировать в качестве NLS. Типичный NLS может, таким образом, представлять собой пептид, например из 4-20, более конкретно из 4-15, 4-12, 4-10 или 4-8 аминокислот, где по меньшей мере 4 аминокислоты (и более конкретно по меньшей мере 60, 70, 75, 80, 85 или 90% аминокислотных остатков в пептиде NLS) представляют собой положительно заряженные аминокислоты, предпочтительно выбранные из К, R или Н. Такой типичный NLS может, например, иметь или содержать последовательность RKRH (SEQ ID NO:75).
Сигналы ядерной локализации, включая как реальные экспериментально определенные, так и спрогнозированные или предложенные последовательности NLS, и стратегии идентификации NLS, описаны в Lange et a.l, J. Biol. Chem. 2007, 282 (8), 5101-5105 ; Makkerh et al., Current Biology 1996, 6 (8), 1025-1027; Leslie et al., Methods 2006, 39, 291-308; и Lusk et al. Nature Reviews MCB 2007, 8, 414-420.
Классический NLS состоит либо из одного (одинарный), либо из двух (двойной) участков основных аминокислот. Примером одинарного NLS может быть SV40 большой Т-антиген NLS (126PKKKRKV132 [SEQ ID NO:76]) и двойного - нуклеонеоплазмин NLS (155KRPAATKKAGOAKKKK170 [SEQ ID NO:77]). Была предложена консенсусная последовательность одинарного NLS K-[K/R]-X-[K/R] (SEQ ID NO:78), и, таким образом, NLS по настоящему изобретению может в одном воплощении содержать или состоять из такой консенсусной последовательность (где Х представляет собой любую аминокислоту).
Типичный двойной NLS по изобретению может иметь последовательность KR-[X]5-20-KKKK (SEQ ID NO:79), например KR-Х10-КККК (SEQ ID NO:80) (где Х представляет собой любую аминокислоту).
Альтернативный типичный двойной NLS может принимать форму RKRH-[Х]2-10-КК (SEQ ID NO:81), например RKRH-X2-KK (SEQ ID NO:82), например RKRH-II-KK (SEQ ID NO:83).
NLS онкобелка c-myc отличается от классических NLS тем, что только 3 из 9 аминокислотных остатков являются основными (PAAKRVKLD [SEQ ID NO:84]), указывая на то, что NLS не обязательно соответствует консенсусным или классическим последовательностям, приведенным выше. Makkerh et al. (выше) описывает последовательности NLS, в которых кластер основных аминокислот (например КККК [SEQ ID NO:85]) фланкирован нейтральными и кислыми остатками, например PAAKKKKLD (SEQ ID NO:86).
Другие возможные последовательности NLS, которые могут быть приведены в качестве примера, включают: PKKKRKVL (SEQ ID NO:87), KKKRK (SEQ ID NO:88), KKKRVK (SEQ ID NO:89), KKKRKVL (SEQ ID NO:90) и RKKRKVL (SEQ ID NO:91). Можно использовать любой NLS, который является производным известного NLS, например NLS для SV40, нуклеоплазмина, UNG2 или c-myc NLS.
Предполагаемую, предложенную или прогнозируемую последовательность NLS можно протестировать на активность NLS, используя принципы и анализы, известные и описанные в данной области техники. Например, кандидатную последовательность NLS можно прикреплять к желательному «грузу» (в данном случае олигопептиду по изобретению, как определено в данном описании изобретения), и конструкцию можно снабдить определяемой репортерной молекулой (например меткой или маркером, который можно визуализировать, например флуоресцентной меткой) и приводить в контакт с тестируемой клеткой. Затем можно определять распределение конструкции в клетке.
Таким образом, в качестве обобщения, специалист осведомлен о подходящих сигнальных последовательностях, но в качестве примера в данном описании изобретения упоминается следующее. Примеры пептидных последовательностей проникновения в клетку включают Пенетратин™, 16-аминокислотный пептид, соответствующий третьей спирали гомеодомена белка Антеннапедия, R-обогащенные метки, такие как Рб-Пенетратин (где остатки аргинина добавлены к N-концу Пенетратина) и производные белка HIV Tat, такие как GRKKRRQRRRPPQQ (SEQ ID NO:92). Примеры последовательностей ядерной локализации включают производное белка SV40 KKKRK (SEQ ID NO:93).
Предпочтительная конструкция по настоящему изобретению содержит (1) олигопептидное соединение, содержащее мотив APIM, как определено в данном описании изобретения, (2) сигнал ядерной локализации и (3) сигнальную последовательность проникновения в клетку.
Отдельные элементы или компоненты конструкции по настоящему изобретению могут содержаться или присутствовать в любом порядке, но предпочтительно в порядках, указных выше (например олигопептидное соединение APIM-CPP; олигопептидное соединение APIM-NLS; олигопептидное соединение APIM-NLS-CPP).
Кроме того, олигопептидное соединение или конструкция по изобретению может содержать более одного мотива, взаимодействующего с PCNA. Таким образом, альтернативно выражаясь, конструкция по настоящему изобретению может содержать более одного олигопептидного соединения, содержащего мотив, взаимодействующий с PCNA. Конструкция или олигопептидное соединение может, например, содержать, 1-10, например 1-6, или 1-4, или 1-3, или один или два мотива. В конструкции, также содержащей сигнальную последовательность, такие мотивы могут быть расположены или помещены по желанию, например они могут быть сгруппированы вместе, или они могут быть разделены элементами сигнальной последовательности, например мотив-NLS-мотив-СРР; или мотив-NLS-мотив-мотив-СРР; или мотив-мотив-NLS-CPP и так далее.
Компоненты или элементы конструкции по изобретению могут быть прикреплены или связаны друг с другом любым желательным или удобным путем методами, хорошо известными в данной области техники. Таким образом, компоненты или отдельные части могут быть связаны или конъюгированы химически, например с использованием известных методов химического связывания, или эти конструкции могут быть образованы в виде единого целого, с использованием методов генной инженерии, например способов образования слитых белков, или они могут быть просто синтезированы в виде целого, например с использованием методов синтеза пептидов.
Отдельные части или компоненты можно связывать непосредственно друг с другом, или их можно связывать опосредованно при помощи одной или более линкерных (или спейсерных) последовательностей. Таким образом, линкерная последовательность может заполнять промежутки или разделять две или более отдельные части конструкцию или разделять элементы мотива в олигопептидной конструкции. Точная природа линкерной последовательности не является критической, и она может иметь разную длину и/или последовательность, например она может иметь 0-40, более конкретно 0-20, 0-15, 0-12, 0-10, 0-8 или 0-6, 0-4 или 0-3 остатков, например 1, 2 или З или более остатка. В качестве типичного примера линкерная последовательность, если она присутствует, может иметь 1-15, 1-12, 1-10, 1-8, 1-6 или 1-4 остатка и так далее. Природа остатков не является критической, и они могут, например, представлять собой любую аминокислоту, например нейтральную аминокислоту, или алифатическую аминокислоту, или, альтернативно, они могут быть гидрофобными, или полярными, или заряженными, или структурообразующими, например пролином. Был показано, что применим ряд разных линкерных последовательностей, включая короткие (например 1-6) последовательности нейтральных и/или алифатических аминокислот.
Типичные линкерные последовательности, таким образом, включают любой единственный аминокислотный остаток, например A, I, L, V, G, R, Q, Т или W, или ди-, три-, тетра-, пента- или гексапептид, состоящий из таких остатков.
В качестве типичных линкеров можно упомянуть I, II, IL, R, W, WW, WWW, RIL, RIW, GAQ, GAW, VAT, IILVI (SEQ ID NO:94), IILVIII (SEQ ID NO:95) и так далее.
Линкеры между различными элементами могут быть одинаковыми или разными.
В одном воплощении предлагается олигопептидное соединение, имеющее или содержащее последовательность MDRWLVKRILVATK (SEQ ID N0: 96) или MDRWLVKRILKKKRKVATKG (SEQ ID NO:97).
Другие типичные соединения (или более конкретно конструкции) по изобретению включают
MDRWLVKGAQPKKKRKVLRQIKIWFQNRRMKWKK (SEQ ID NO:98),
MDRWLVKGAWKKKRVKIIRKKRRQRRRK (SEQ ID NO:99),
MDRWLVKGAWKKKRKIIRKKRRQRRRG (SEQ ID NO:100),
MDRWLVKGAWKKKRKIIRKKRRQRRRK (SEQ ID NO:101),
MDRWLVKJUWKKKRKIIRKKRRQRRRK (SEQ ID NO:102),
MDRWLVKWWWKKKRKIIRKKRRQRRRK (SEQ ID NO:103),
MDRWLVKWWRKRHIIKKRKKRRQRRRK (SEQ ID NO:104),
MDRWLVKillWKKKRKIIRRRRRRRRRRRK (SEQ ID NO:105),
MDRWLVKJirWKKKRKIIRQIKIWFQNRRMKWKK(SEQ ID NO:106),
MDRFLVKGAWRKRHIIKKRKKRRQRRRK (SEQ ID NO:107),
MDRWLVKWKKKRKIRRRRRRRRRRRK (SEQ ID NO:108),
MDRWLVKWKKKRKIRKKRRQRRRK (SEQ ID NO:109),
MDRWLVKWRKRHIRKKRRQRRRK (SEQ ID NO:110),
Ac-MDRWLVKGAWRKRHIRKKRRQRRRK (SEQ ID NO:111),
Ac-MDRWLVKWKKKRKIRRRRRRRRRRR (SEQ ID NO:112),
Ac-MDRALVKWKKKRKIRRRRRRRRRRR (SEQ ID NO; 113),
Ac-MDRWLVKKKKRKRRRRRRRRRRRK (SEQ ID NO:114),
Ac-MDRWLVKKKKRKRRRRRRRRRRR (SEQ ID NO:115),
MDRWLVKRIWKKKRKIIRWLVKWWWRKKRRQRRRK (SEQ ID NO:116),
KRRRQRRKKRIIKRKKKWWWKVLWRDM (SEQ ID NO:117).
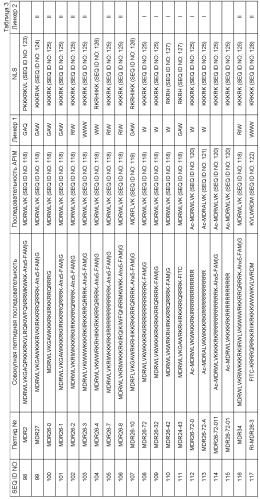
Олигопептидные соединения, имеющие последовательности, как представлено в SEQ ID NO:98-117, показаны в Таблице 3 в Примере 6 ниже, которая показывает отдельные компоненты, составляющие конструкции (то есть мотив-содержащая последовательность, линкер, NLS, СРР и так далее) Таким образом, можно видеть, что SEQ ID NO:98-117 представляют собой конструкции, содержащие по меньшей мере одну мотив-содержащую последовательность, NLS и СРР, в некоторых случаях связанные линкерными последовательностями, которые могут варьироваться в последовательности, как указано. SEQ ID NO:117 (RI-MDR26-3) представляет собой ретро-инверсный пептид, состоящий из D-аминокислот. Используют NLS-последовательности на основе SV40 или UNG2 NLS-последовательности, и СРР-последовательности на основе Пенетратина, HIV-TAT или R-обогащенного пептида.
В еще одном аспекте изобретения предлагается молекула нуклеиновой кислоты, кодирующая пептид, имеющий или содержащий (например) SEQ ID NO:1, как определено выше. Также предлагается комплемент такой молекулы нуклеиновой кислоты. Предпочтительно молекула нуклеиновой кислоты содержит промоторную последовательность, функционально связанную с последовательностью, кодирующей пептид, имеющий или содержащий (например) SEQ ID NO:1. В предпочтительном воплощении молекула нуклеиновой кислоты также кодирует сигнальную последовательность, как определено выше.
Молекула нуклеиновой кислоты по изобретению содержит по меньшей мере 15 нуклеотидов и предпочтительно по более 800 нуклеотидов, более предпочтительно не более 700, 650, 600, 550, 500, 450, 400, 350, 300, 250, 200, 150, 100 или 50 нуклеотидов. Молекула нуклеиновой кислоты предпочтительно представляет собой выделенную молекулу.
Еще один аспект относится к вектору, содержащему молекулу нуклеиновой кислоты, как определено в данном описании изобретения. Вектор может также содержать дополнительные элементы, обычно находящиеся в векторе, такие как точка начала репликации, селектируемый маркер, например устойчивость к антибиотикам, и/или сайт множественного клонирования. Кроме того вектор может представлять собой вектор экспрессии и может содержать дополнительные элементы, например элементы транскрипционного и/или трансляционного контроля или регуляторные элементы для экспрессии молекул нуклеиновой кислоты. Такие контрольные элеме