Оптимизированный ген моноклонального антитела инфликсимаб (варианты), рекомбинантная клеточная линия-продуцент этого антитела и способ его биосинтеза
Иллюстрации
Показать всеИзобретение относится к биотехнологии и иммунологии. Предложены оптимизированные гены легкой и тяжелой цепей инфликсимаб - антитела против фактора некроза опухоли альфа (ФНО-альфа), а также клеточная линия ВКПМ-Н-131 и способ биосинтеза антитела. Нуклеотидные последовательности генов, кодирующих легкую и тяжелую цепи инфликсимаба, оптимизированы с тем, чтобы обеспечить содержание кодонов, наиболее типичных для млекопитающих; содержание G/C должно составлять 50-60% от общего состава; отсутствие протяженных трактов вырожденного состава и отсутствие вторичных структур РНК. Линия клеток яичников китайского хомячка (СНО), полученная в результате трансфекции экспрессионными конструкциями, содержащими генетические последовательности по изобретению, позволяет получать не менее 50 мг/л моноклонального антитела инфликсимаб. 4 н.п. ф-лы, 3 ил., 4 пр.
Реферат
Изобретение относится к биотехнологии и предназначено для получения рекомбинантного моноклонального антитела инфликсимаб. Биосинтез целевого белка осуществляют путем суспензионного культивирования рекомбинантной клеточной линии ВКПМ-Н-131, полученной путем введения экспрессионного вектора, содержащего оптимизированные гены тяжелой и легкой цепей инфликсимаба, в клетки яичников китайского хомячка CHO.
Рекомбинантная клеточная линия ВКПМ-Н-131 получена путем трансфекции суспензионной клеточной линии CHO-S вектором pVitroneo-Infliximab-LC-HC, содержащей оптимизированный ген легкой цепи антитела инфликсимаб, а также оптимизированный ген тяжелой цепи, соединенный с геном, кодирующим маркер устойчивости к антибиотику генетицину (G418) с помощью участка внутренней посадки рибосомы (IRES-элемента).
Инфликсимаб представляет собой химерное моноклональное антитело, специфичное к фактору некроза опухоли альфа (ФНО-альфа). Его применяют для лечения ревматоидного артрита и других заболеваний воспалительного характера. Инфликсимаб обладает высокой степенью аффинности к ФНО-альфа-цитокину с широким спектром биологического действия [1]. ФНО-альфа является посредником воспалительного ответа, запускающим каскад различных иммунологических реакций. Инфликсимаб быстро связывается и образует устойчивое соединение с обеими формами человеческого ФНО-альфа (растворимой и трансмембранной), снижая его функциональную активность [2]. Блокирование данным антителом связывания ФНО-альфа с иммунокомпетентными клетками обеспечивает противовоспалительный эффект и стойкую ремиссию у больных [1, 3].
Инфликсимаб является антителом класса IgG, подкласса 1 и состоит из 2 идентичных легких и 2 идентичных тяжелых цепей. Масса полноразмерного антитела составляет 145,6 кДа, легкой и тяжелой цепей 23,4 кДа и 49,4 кДа, соответственно [1]. Для инфликсимаба, как и для других антител характерно N-гликозилирование, заключающееся в присоединении двухантенных углеводных цепочек к остаткам аспарагина, расположенным в константных областях молекул. Основными гликоформами антитела являются G0F (фукозилированная, без остатков галактозы - 50-60%) и G1F (фукозилированная, с одним остатком галактозы - 30-40%). Гликозилирование является важнейшей характеристикой моноклональных антител, применяемых в биофармацевтике, поскольку от него зависят укладка молекул, стабильность, растворимость, а также биологическая активность и фармакокинетические параметры [4-6].
Полноразмерные моноклональные антитела производятся исключительно с использованием клеток млекопитающих, так как только аппарат клеток млекопитающих способен обеспечить правильную сборку целого антитела и его корректное гликозилирование, что является необходимым условием проявления его биологической активности и стабильности in vivo [7, 8]. Известный препарат моноклонального антитела инфликсимаб (Ремикейд) получен фирмой в клетках миеломы мыши Sp2/0 [9]. Однако использование клеточных линий, имеющих опухолевое происхождение, при производстве биотехнологических препаратов, не соответствует требованиям качества, предъявляемым к препаратам данного типа.
Задача изобретения: расширение арсенала способов биосинтеза моноклонального антитела инфликсимаб.
Задача решена путем:
- получения оптимизированных генов, кодирующих легкую и тяжелую цепи моноклонального антитела инфликсимаб;
- конструирования клеточной линии ВКПМ-Н-131 путем ведения вектора pVitroneo-Infliximab-LC-HC, содержащего оптимизированные гены легкой и тяжелой цепи инфликсимаба, в клетки яичников китайского хомячка линии CHO-S;
- разработки способа биосинтеза моноклонального антитела инфликсимаб путем суспензионного культивирования рекомбинантной клеточной линии ВКПМ-Н-131.
Для производства сложных рекомбинантных белков, таких как моноклональные антитела, в основном используют культуру клеток яичников китайского хомячка CHO [10]. Преимущества использования клеток СНО заключаются в их высокой скорости пролиферации, простоте культивирования и хорошей степени охарактеризованности, что значительно упрощает регистрацию рекомбинантных лекарственных препаратов [7]. При создании стабильной клеточной линии оптимальным выбором для дальнейшего использования в производстве является суспензионный вариант культуры клеток CHO-S [8, 11, 12]. Суспензионное культивирование позволяет выращивать клетки до высоких плотностей (107-108 клеток/мл среды) без использования сывороток крови, что увеличивает их биологическую безопасность и облегчает последующие стадии очистки [11, 13].
При производстве гликозилированных рекомбинантных белков человека применяют клеточные линии CHO, несущие интегрированные в геном гены целевых белков под контролем сильных промоторов клеточного или вирусного происхождения. В число наиболее эффективных входят промоторы CMV (промоторно-энхансерный элемент предранних генов цитомегаловируса человека), EF1α (промотор альфа-субъединицы фактора 1 элонгации трансляции) [14-16] или сконструированный на их основе гибридный промотор CMV-EF1α, содержащий коровую область промотора EF1α и энхансер промоторно-энхансерной области гена CMV. Показано, что для некоторых трансгенов CMV-EF1α обеспечивает более высокий уровень экспрессии по сравнению с CMV [15, 17]. Вышеперечисленные элементы использованы при конструировании заявляемой клеточной линии.
С целью оптимизации экспрессии помимо выбора эффективных промоторов разработаны приемы, ведущие к увеличению биосинтеза целевого белка. Важным оптимизируемым параметром является частота использования синонимических кодонов в гене интереса [18]. Многочисленные программы и стратегии такой оптимизации опираются на известную положительную корреляцию между уровнем экспрессии генов интереса и соответствием частот использования кодонов в гене интереса и организме в целом [18, 19]. При этом с целью оптимизации кодонового состава изменяют первичную структуру гена интереса. Однако следствием такого изменения бывает не только улучшение кодонового состава гена, но и появление в составе транскриптов этого гена вторичных структур, способствующих улучшению его трансляции [20]. В заявляемом изобретении осуществлена оптимизация кодонового состава генов, кодирующих целевой рекомбинантный белок.
Способ в общем виде
Для получения моноклонального антитела инфликсимаб клетки рекомбинантной клеточной линии яичников китайского хомячка ВКПМ-Н-131 засевают в вентилируемые колбы объемом 125 мл, содержащие 20-30 мл среды, до плотности 0,2-0,5 млн клеток/мл. Для культивирования используют бессывороточную среду Power CHO-2 (Lonza, Швейцария) с добавлением L-глутамина, гипоксантина натрия и тимидина до конечной концентрации 2-8 мМ, 50-150 мкМ и 12-20 мкМ, соответственно. Культивирование осуществляют при температуре 37°C во влажной среде (влажность не менее 70-90%) с 5%-ным содержанием CO2 при перемешивании скоростью 100-130 об/мин. Процесс останавливают после снижения содержания живых клеток до уровня 50-70%. По истечении 7-9 суток концентрацию целевого продукта в культуральной жидкости определяют методом иммуноферментного анализа, в частности, с использованием набора реагентов Serazym IgG ELISA kit (Seramun, Германия). Она составляет не менее 50 мг/л моноклонального антитела инфликсимаб, что соответствует значению специфической продуктивности не менее 15 пг на клетку в день.
Изобретение проиллюстрировано следующими фигурами
Фиг.1. Карта экспрессионного вектора pVitroneo-Infliximab-LC-HC: LC infliximab - легкая цепь мАТ, НС infliximab - тяжелая цепь мАТ, CMV promoter - промотор предранних генов человеческого цитомегаловируса, ЕМ7 promoter - бактериальный промотор генов устойчивости к антибиотикам, rEF1, mEF1 - промотор альфа-субъединицы фактора 1 элонгации трансляции, CMV enhancer - энхансер предранних генов цитомегаловируса человека, SV40 enhancer - энхансер предранних генов полиомавируса человека, Neo - ген неомицинфосфортрансферазы, pMB1 ori - сайты начала репликации плазмид, SV40 poly A, EF1 SV40 - сигналы полиаденилирования, FMDV IRES - участок внутренней посадки рибосомы вируса FMDV.
Фиг.2. Электрофореграмма плазмиды pVitroneo-Infliximab-LC-HC до и после расщепления рестриктазами BamHI и Kpn2I. Ожидаемые фрагменты 6988, 1422 п.о. (по дорожкам: 1 - нерасщепленная плазмида, 2 - маркер молекулярных масс, 3 - расщепленная плазмида).
Фиг.3. Электрофореграмма культуральной жидкости клонов-продуцентов моноклонального антитела инфликсимаб. SDS-ПААГ электрофорез проводили в восстанавливающих условиях, культуральную жидкость клонов 3, 5, 8 и 14 концентрировали в 10 раз. St - стандарт, препарат Ремикейд (Janssen Biotech., США): 0,15, 0,3 и 1 мкг на дорожку, соответственно.
Пример 1. Конструирование экспрессионного вектора pVitroneo-Infliximab-LC-HC, содержащего оптимизированные гены тяжелой и легкой цепи инфликсимаба
Нуклеотидные последовательности генов, кодирующих легкую и тяжелую цепи инфликсимаба, подбирают на основании их аминокислотных последовательностей.
Оптимизацию генов проводят в соответствии со следующими параметрами:
- содержание кодонов, наиболее типичных для млекопитающих;
- содержание G/C должно составлять 50-60% от общего состава;
- отсутствие протяженных трактов вырожденного состава;
- отсутствие вторичных структур РНК.
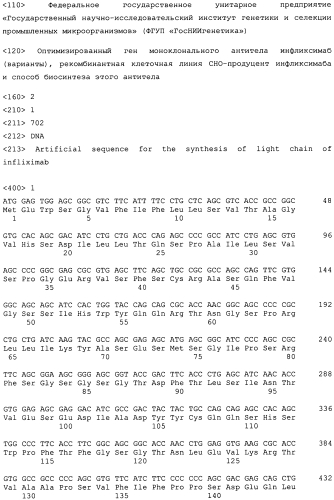
Оптимизированные нуклеотидные последовательности легкой цепи инфликсимаба SEQ ID NO:1 и тяжелой цепи инфликсимаба SEQ ID NO:2 синтезированы компанией "Сервис-ген" (Санкт-Петербург). Для конструирования экспрессионного вектора используют базовый экпрессионный вектор pVitro-neo (InvivoGen, США). Вектор pVITROneo содержит в своем составе ген неомицинфосфотрансферазы, обеспечивающий устойчивость к антибиотикам группы неомицина, а также два химерных промотора, один из которых представляет собой гибрид промоторной области гена EF1α крысы и энхансерной области CMV, а второй - гибрид промоторной области гена EF1α мыши и энхансерной области SV40 (фиг.1).
Гены, кодирующие легкую и тяжелую цепи инфликсимаба, клонируют в вектор pVitro-neo для получения экспрессионного вектора pVitroneo-Infliximab-LC-HC (фиг.1). При этом ген тяжелой цепи SEQ ID NO:2 соединяют через IRES-элемент с геном, кодирующим маркер устойчивости к антибиотику G418. Таким образом, эти два гена транскрибируются в одну мРНК, с которой транслируется два белка, благодаря чему достигается более жесткий контроль экспрессии тяжелой цепи. Ген легкой цепи антитела инфликсимаб SEQ ID NO:1 вводят в плазмиду по сайтам рестрикции BglII и NheI, ген тяжелой цепи антитела инфликсимаб SEQ ID NO:2 - по сайтам рестрикции Kpn2I и BamHI. В результате клонирования получают вектор pVitroneo-Infliximab-LC-HC, в составе которой ген легкой цепи находится под контролем химерного промотора SV40/mEF1, ген тяжелой цепи - под контролем промотора CMVenh/rEF1 (фиг.1). Правильность сборки экспрессионного вектора проверяют с помощью расширенного рестрикционного анализа (фиг.2). Нуклеотидные последовательности обоих генов и прилежащих к ним участков подтверждают секвенированием.
Пример 2. Проведение транзиентной трансфекции и анализ уровня экспрессии инфликсимаба методом ИФА
Для проведения транзиентной (временной) трансфекции экспрессионными конструкциями, содержащими гены тяжелой и легкой цепей инфликсимаба, используют клетки линии CHO-S (Invitrogen, США), которые культивируют в вентилируемых колбах объемом 125 мл при температуре 37°C во влажной среде (влажность 80%) с 5%-ным содержанием CO2 в бессывороточной среде Power CHO-2 (Lonza, Швейцария) с добавлением L-глутамина, гипоксантина натрия и тимидина до конечной концентрации 4 мМ, 100 мкМ и 16 мкМ, соответственно. Культивирование проводят со скоростью перемешивания 120 об/мин. После достижения суспензионной культурой плотности ~1*106 клеток/мл среду Power CHO-2 заменяют на равный объем среды CD CHO (Invitrogen, США) для проведения трансфекции.
Трансфекцию экспрессионным вектором производят с использованием реагента FreeStyle MAX (Invitrogen, США) в соответствии со стандартным протоколом фирмы Invitrogen для 6-луночных планшетов. Через 24 ч после проведения трансфекции среду CD CHO заменяют равным объемом среды Power CHO-2. Для оценки эффективности трансфекции используют контрольный вектор pEYFP-N1 (Clontech, США), содержащий ген зеленого флуоресцентного белка.
Для измерения концентрации синтезированного клетками инфликсимаба используют метод иммуноферментного анализа (ИФА), в частности с использованием набора реагентов Serazym IgG ELISA kit (Seramun, Германия). Для построения калибровочной кривой ИФА используют оригинальный препарат Ремикейд (Janssen Biotech., США).
Измерение концентрации целевого антитела проводят на 4 сутки после трансфекции. Концентрация инфликсимаба в культуральной жидкости составляет не менее 7 мг/л.
Пример 3. Получение стабильного клона клеточной линии ВКПМ-Н-131, продуцента моноклонального антитела инфликсимаб
Для отбора стабильных клонов на следующий день после трансфекции клетки, полученные по примеру 2, переносят в среду Power CHO-2, содержащую антибиотик G418 до концентрации 400 мкг/мл. Суспензию клеток с антибиотиком переносят в лунки 96-луночных планшетов в концентрации 300 клеток на лунку. Общее количество планшетов составляет 10 штук. Культивирование планшетов с клетками проводят в стационарном положении в течение 20 дней при температуре 37°C во влажной среде с 5%-ным содержанием CO2. Каждые 7 дней в лунки планшетов добавляют по 100 мкл свежей среды.
Начиная с 12 суток, контролируют рост клеток в лунках под микроскопом, отмечая те лунки, в которых наблюдают рост колоний от одной клетки. Поскольку число клеток, попавших в лунку, подчиняется распределению Пуассона, то вероятность отсутствия клональности (попадания 2 и более клеток в одну лунку) можно рассчитать исходя из доли позитивных лунок по формуле:
P(n>1)=1-Σ(e-λλn/n!),
где λ=-ln (P(0)) - доля лунок, в которых наблюдается клеточный рост,
n=0; 1 - число клеток в лунке.
По достижении 80-100% конфлюэнтности индивидуальные клоны переносят в новые 96-луночные планшеты. Через 5 суток анализируют пробы культуральной жидкости на наличие инфликсимаба. Клоны, показавшие наибольшую продуктивность при культивировании в 96-луночных планшетах, переносят в 24-луночные планшеты и культивируют в течение 5 суток, а затем переносят в колбы объемом 125 мл для суспензионного культивирования. По результатам цикла продукции в колбах оценивают продуктивность клонов. На основании критериев роста, жизнеспособности и продуктивности выбирают лучшие клоны, для которых создают клеточный банк.
Отбор стабильных клонов методом предельных разведении проводят в течение 20 дней. По результатам анализа продуктивности лучшие клоны для масштабирования процесса переносят последовательно в 24-луночные, 6-луночные планшеты, далее в культуральные флаконы и колбы. В процессе культивирования анализируют клеточную плотность и жизнеспособность.
По результатам экспоненциальной фазы роста (первые 4 дня культивирования) рассчитывают время удвоения клеток по формуле:
T2=T / log2(Nкон/Nнач),
где T - продолжительность культивирования (96 ч), Nкон и Nнач - конечная и начальная клеточная плотность, соответственно.
После завершения культивирования (на 7 сутки) измеряют концентрацию инфликсимаба в образцах культуральной жидкости методом ИФА. Для отобранного таким образом клона-продуцента проведено депонирование во Всероссийскую коллекцию промышленных микроорганизмов ФГУП «ГосНИИгенетика» (ВКПМ) под номером ВКПМ-Н-131.
Пример 4. Характеристика полученного моноклонального антитела инфликсимаб
Анализ продуктивности заявляемой клеточной линии проводят с использованием ИФА-набора Serazym IgG ELISA kit (Seramun, Германия). Для оценки соотношения легкой и тяжелой цепи, а также уровня синтеза антитела полученными клонами культуральную жидкость анализируют с помощью белкового электрофореза в полиакриламидном геле (SDS-ПААГ-электрофорез) в денатурирующих условиях (фиг.3).
SDS-ПААГ-электрофорез в восстанавливающих условиях проводят по стандартной методике Лэммли в 12% геле с последующим окрашиванием Кумасси-R250 [21]. В качестве стандарта используют препарат Ремикейд (Janssen Biotech., США). Обсчет интенсивности полос на гелях и мембранах проводят с помощью программы Quantity One (BioRad, США). Из результатов, приведенных на фиг.3, следует, что синтезированное моноклональное антитело инфликсимаб по соотношению содержания легкой и тяжелой цепей соответствует стандарту.
Таким образом, разработан способ получения моноклонального антитела инфликсимаб на основе клеток яичников китайского хомячка линии СНО, которые являются предпочтительными для получения биофармацевтических препаратов, в отличие от способа получения ближайшего аналога, где в качестве продуцента используют клетки мышиной миеломы. Культивирование продуцента, согласно заявляемому способу, в отличие от способа ближайшего аналога, осуществляют в бессывороточной питательной среде, что удовлетворяет современным требованиям безопасности, предъявляемым к качеству биофармацевтических препаратов. Использование такого способа позволяет достичь специфической продуктивности не менее 15 пикограмм на клетку в день. Такая величина специфической продуктивности сравнима или превышает значения, достигаемые классическим путем селекции или амплификации высокопродуктивных клонов моноклональных антител с использованием метотрексата или иных способов селекции [22-26].
Список литературы
1. Knight D.M., Trinh Н., Le J., Siegel S., Shealy D., McDonough M., Scallon В., Moore M.A., Vilcek J., Daddona P. et al. Construction and initial characterization of a mouse-human chimeric anti-TNF antibody. Mol Immunol. 1993, 30(16):1443-1453.
2. Scallon BJ, Moore MA, Trinh H, Knight DM, Ghrayeb J. Chimeric anti-TNF-alpha monoclonal antibody cA2 binds recombinant transmembrane TNF-alpha and activates immune effector functions. Cytokine 1995, 7(3): 251-259.
3. Maini R., St Clair E.W., Breedveld F., Furst D., Kalden J., Weisman M., Smolen J., Emery P., Harriman G., Feldmann M., Lipsky P. Infliximab (chimeric anti-tumour necrosis factor alpha monoclonal antibody) versus placebo in rheumatoid arthritis patients receiving concomitant methotrexate: a randomised phase III trial. ATTRACT Study Group.Lancet 1999, 354(9194): 1932-1939.
4. Beck A, Sanglier-Cianferani S, van Dorsselaer A. Biosimilar, Biobetter, and Next Generation Antibody Characterization by Mass Spectrometry. Anal. Chem. 2012, 84: 4637-4646.
5. Krapp S, Mimura Y, Jefferis R, Hube, R, Sondermann P. Structural analysis of human IgG-Fc glycoforms reveals a correlation between glycosylation and structural integrity. J. Mol Biol 2003, 325: 979-989.
6. MimuraY, Church S, Ghirlando R, Ashton PR. et al. The influence of glycosylation on the thermal stability and effector function expression of human IgG1-Fc: properties of a series of truncated glycoforms. Mol. Immunol. 2000, 37: 697-706.
7. Wurm FM. Production of recombinant protein therapeutics in cultivated mammalian cells Nat Biotechnol 2004, 22 (11): 1393-1398.
8. Butler M. Animal cell cultures: recent achievements and perspectives in the production of biopharmaceuticals. Appl Microbiol Biotechnol. 2005, 68(3): 283-291.
9. Ghaderi D, Zhang M, Hurtado-Ziola N, Varki A. Production platforms for biotherapeutic glycoproteins. Occurrence, impact, and challenges of non-human sialylation. Biotechnol Genet Eng Rev 2012, 28: 147-175.
10. Elliott S, Lorenzini T, Asher S, Aoki K, Brankow D, Buck L, Busse L et al. Enhancement of therapeutic protein in vivo activities through glycoengineering. Nat Biotechnol 2003, 21(4): 414-421.
11. Chu L, Robinson DK. Industrial choices for protein production by large-scale cell culture Curr Opin Biotechnol 2001, 12 (2): 180-187.
12. Xie L, Zhou W, Robinson D. Protein production by large-scale mammalian cell culture. New Comprehensive Biochemistry T. Volume 38. Makrides S.C.: Elsevier, 2003. - P. 605-623.
13. Sinacore MS, Charlebois TS, Harrison S, Brennan S, Richards T et al. CHO DUKX cell lineages preadapted to growth in serum-free suspension culture enable rapid development of cell culture processes for the manufacture of recombinant proteins. Biotechnol Bioeng 1996, 52(4): 518-528.
14. Hansen IA, Qin JY, Zhang L, Clift KL, Hulur I, Xiang AP et al. Systematic Comparison of Constitutive Promoters and the Doxycycline-Inducible Promoter. PLoS One 2010, 5: el0611.
15. Magnusson T, Haase R, Schleef M, Wagner E, Ogris M. Sustained, high transgene expression in liver with plasmid vectors using optimized promoter-enhancer combinations. J Gene Med 2011, 13: 382-391.
16. Tokushige K, Moradpour D, Wakita T, Geissler M, Hayashi N, Wands JR. Comparison between cytomegalovirus promoter and elongation factor-1 alpha promoter-driven constructs in the establishment of cell lines expressing hepatitis С virus core protein. J Virol Methods 1997, 64: 73-80.
17. Teschendorf С, Warrington KH, Jr., Siemann DW, Muzyczka N. Comparison of the EF-1 alpha and the CMV promoter for engineering stable tumor cell lines using recombinant adeno-associated virus. Anticancer Res 2002, 22: 3325-3330.
18. Grote A, Hiller K, Scheer M, Munch R, Nortemann B, Hempel DC, et al. JCat: a novel tool to adapt codon usage of a target gene to its potential expression host. Nucleic Acids Res 2005, 33.-W526-531.
19. Comeron JM, Aguade M. An evaluation of measures of synonymous codon usage bias. J Mol Evol 1998, 47: 268-274.
20. Kim CH, Oh Y, Lee TH. Codon optimization for high-level expression of human erythropoietin (EPO) in mammalian cells. Gene 1997,199: 293-301.
21. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970, 227: 680-685.
22. Brezinsky SC, Chiang GG, Szilvasi A, Mohan S, Shapiro RI, MacLean A, et al. A simple method for enriching populations of transfected CHO cells for cells of higher specific productivity. J Immunol Methods 2003, 277(1-2): 141-155.
23. Ho SC, Koh EY, van Beers M, Mueller M, Wan C, Teo G, Song Z, Tong YW, Bardor M, Yang Y. Control of IgG LC:HC ratio in stably transfected CHO cells and study of the impact on expression, aggregation, glycosylation and conformational stability. J Biotechnol 2013, 165(3-4): 157-166.
24. Kerschbaumer, R., P. Boeck-Taferner, et al. (2013). Procedure for the generation of a high producer cell line for the expression of a recombinant anti-CD34 antibody, Google Patents.
25. Kiu, S. and K. C. Wang (2007). Method for producing stable mammalian cell lines producing high levels of recombinant proteins, Google Patents.
26. Lee, С, C. Ly, et al. (2005). A rapid way to obtain high expression clones of mammalian cells using a methylcellulose and immunoprecipitation screening method, Google Patents.
1. Ген легкой цепи моноклонального антитела инфликсимаб, имеющий оптимизированную нуклеотидную последовательность SEQ ID NO:1.
2. Ген тяжелой цепи моноклонального антитела инфликсимаб, имеющий оптимизированную нуклеотидную последовательность SEQ ID NO:2.
3. Рекомбинантная клеточная линия ВКПМ-Н-131 - продуцент моноклонального антитела инфликсимаб, включающего две идентичные легкие цепи, кодируемые оптимизированным геном по п.1, и две идентичные тяжелые цепи, кодируемые оптимизированным геном, по п.2.
4. Способ биосинтеза моноклонального антитела инфликсимаб путем суспензионного культивирования рекомбинантной клеточной линии по п.3.