Получение и применение моно- и ди-пэг il-10
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к способу получения смеси моно- и дипегилированного IL-10, и может быть использовано в медицине. Указанный способ заключается в осуществлении реакции белка IL-10 в концентрации от 1 до 12 мг/мл с активированным ПЭГ-линкером, где отношение IL-10 к ПЭГ-линкеру составляет от 1:1 до 1:7,7, в присутствии от 25 до 35 мМ восстанавливающего агента. При необходимости, может быть проведена очистка полученной смеси IL-10. Изобретение также относится к фармацевтической композиции для лечения пролиферативного состояния или расстройства, включающей терапевтически эффективное количество смеси моно- и ди-ПЭГ-IL-10, полученной вышеуказанным способом, и фармацевтически приемлемый носитель. Изобретение позволяет получить смесь моно- и дипегилированного IL-10 без образования нежелательных побочных продуктов и без разрушения димерной структуры белков. 2 н. и 14 з.п. ф-лы, 2 ил., 1 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к композициям монопегилированного (ПЭГ) и ди-ПЭГ-IL-10 и способам их применения.
Уровень техники изобретения
Цитокин интерлейкин-10 (IL-10) является димером, который становится биологически неактивным при разрушении нековалентных взаимодействий, соединяющих его две мономерные субъединицы. IL-10 был впервые идентифицирован как продукт T-клеток-хелперов второго типа, и позднее было показано, что он продуцируется другими типами клеток, включая B-клетки и макрофаги. Он также ингибирует синтез некоторых цитокинов, продуцируемых T-клетками-хелперами первого типа, таких как γ-интерферон, IL-2 и фактор некроза опухолей-α (TNF-α, ФНО-α). Способность IL-10 ингибировать модуляторы клеточно-опосредованного иммунного ответа и подавлять обусловленный антигенпрезентирующими клетками T-клеточный ответ свидетельствует о том, что IL-10 обладает иммуносупрессивными свойствами. Этот цитокин также ингибирует синтез моноцитами/макрофагами других цитокинов, таких как IL-1, IL-6, IL-8, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF, ГМКСФ), гранулоцитарный колониестимулирующий фактор (G-CSF, ГКСФ) и ФНО-α. Благодаря своей плейотропной активности IL-10 изучается с точки зрения многочисленных клинических применений, таких как лечение воспалительных состояний, бактериального сепсиса, индуцируемого энтеротоксином летального шока и аутоиммунных заболеваний, например ревматоидного артрита, отторжения аллотрансплантата и диабета.
Рак и опухоли можно контролировать или полностью устранять при помощи иммунной системы. Иммунная система включает несколько типов лимфоидных и миелоидных клеток, например моноциты, макрофаги, дендритные клетки (ДК), эозинофилы, T-клетки, B-клетки и нейтрофилы. Эти лимфоидные и миелоидные клетки продуцируют секретируемые сигнальные белки, известные как цитокины. Цитокины включают, например, интерлейкин-10 (IL-10), интерферон-гамма (TNFγ, ИФНγ), IL-2 и IL-23. Иммунный ответ включает воспаление, т.е. накопление иммунных клеток во всем организме или в отдельном месте тела. В ответ на инфекционный агент или инородное вещество иммунные клетки выделяют цитокины, которые, в свою очередь, регулируют пролиферацию, развитие, дифференциацию или миграцию иммунных клеток. Избыточный иммунный ответ может иметь патологические последствия, такие как аутоиммунные заболевания, в то время как ослабленный иммунный ответ может приводить к онкологическим заболеваниям. Противоопухолевый ответ иммунной системы включает врожденный иммунитет, например, опосредованный макрофагами, природными клетками-киллерами и нейтрофилами, и приобретенный иммунитет, например, опосредованный антигенпрезентирующими клетками (АПК), T-клетками и B-клетками (см., например, Abbas, et al. (eds.) (2000) Cellular and Molecular Immunology, W.B. Saunders Co., Philadelphia, PA; Oppenheim and Feldmann (eds.) (2001) Cytokine Reference, Academic Press, San Diego, CA; von Andrian and Mackay (2000) New Engl. J. Med. 343: 1020-1034; Davidson and Diamond (2001) New Engl. J. Med. 345: 340-350).
Способы регулирования иммунного ответа использовались в терапии рака, например меланомы. Эти способы включают лечение или цитокинами, такими как IL-2, IL-10, IL-12, фактор некроза опухолей-альфа (ФНО-альфа), ИФНγ (IFNγ), гранулоцитарно-моноцитарный колониестимулирующий фактор (ГМКСФ) и трансформирующий фактор роста (TGF, ТФР), или антагонистами цитокинов (например, антителами). Интерлейкин-10 был впервые описан как фактор, ингибирующий синтез цитокинов (CSIF, ФИСЦ; см., например, Fiorentino, et al. (1989) J. Exp. Med. 170: 2081-2095). IL-10 является плейотропным цитокином, продуцируемым T-клетками, B-клетками, моноцитами, который может функционировать как в качестве иммунодепрессанта, так и в качестве иммуностимулятора (см., например, Groux, et al. (1998) J. Immunol. 160: 3188-3193; и Hagenbaugh, et al. (1997) J. Exp. Med. 185: 2101-2110).
Животные модели наводят на мысль о том, что IL-10 может индуцировать активацию природных клеток-киллеров и облегчать деструкцию клеток-мишеней дозозависимым образом (см., например, Zheng, et al. (1996) J. Exp. Med. 184: 579-584; Kundu, et al. (1996) J. Natl. Cancer Inst. 88: 536-541). Дальнейшие исследования показали, что присутствие IL-10 в опухолевом микроокружении коррелирует с лучшей выживаемостью больных (см., например, Lu, et al. (2004) J. Clin. Oncol. 22: 4575-4583).
По причине своего относительно короткого времени полужизни IL-10 соединялся с различными агентами, включая полиэтиленгликоль. Другие цитокины также подвергались пегилированию, как правило, путем монопегилирования, например молекулы ПЭГ присоединялись к одному остатку белка цитокина. К сожалению, монопегилирование одной субъединицы IL-10 приводит к образованию неоднородной смеси из монопегилированных, дипегилированных и непегилированных молекул IL-10, что вызвано перестановками субъединиц. Если реакции пегилирования позволяют дойти до конца, то это также приводит к получению неспецифичных и мультипегилированных целевых белков, что снижает биологическую активность этих белков. Таким образом, существует потребность в более эффективном получении правильно пегилированного IL-10 с более высоким выходом продукта. Настоящее изобретения удовлетворяет эту потребность путем предложения способов получения смеси моно- и дипегилированного IL-10.
Краткое описание чертежей
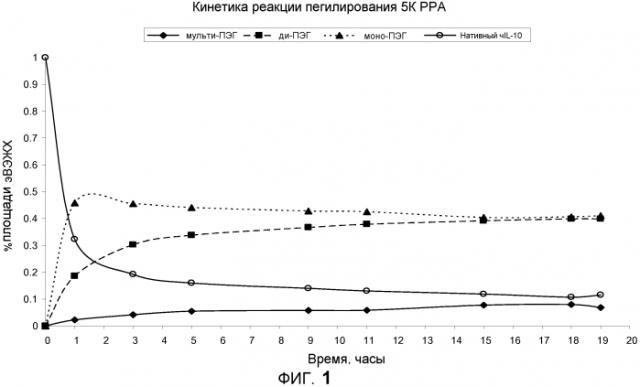
На фиг.1 показана кинетика реакции получения моно- и ди-ПЭГ-IL-10.
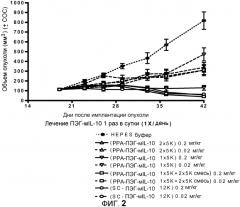
На фиг.2 показана эффективность действия различных моно- и ди-ПЭГ-IL-10 (мышиных) прототипов на имплантированную плоскоклеточную карциному PDV6.
Сущность изобретения
Настоящее изобретение основано на открытии, что в результате контролируемой реакции образуется смесь избирательно пегилированного моно- и ди-ПЭГ-IL-10, что в свою очередь повышает выход конечного продукта, имеющего сопоставимую эффективность с другими типами ПЭГ-IL-10.
Настоящее изобретение относится к способу получения смеси моно- и дипегилированного IL-10, где по меньшей мере одна молекула ПЭГ ковалентно присоединена к по меньшей мере одному аминокислотному остатку по меньшей мере одной субъединицы IL-10, включающему a) осуществление реакции белка IL-10 в концентрации от 1 мг/мл до 12 мг/мл с активированным ПЭГ-линкером, так чтобы отношение IL-10 к ПЭГ-линкеру составляло от 1:1 до 1:7,7, в присутствии от 0,75 мМ до 35 мМ восстанавливающего агента, при значении pH от примерно 5,0 до 7,4 и температуре от 5°С до 30°С в течение 12-15 часов; и b) очистку смеси моно- и дипегилированного IL-10. В некоторых вариантах осуществления изобретения ПЭГ-линкер выбран из группы, состоящей из ПЭГ-сукцинимидилкарбоната, ПЭГ-бутиральдегида, ПЭГ-пентальдегида, ПЭГ-амидопропиональдегида, ПЭГ-уретанопропиональдегида и ПЭГ-пропилальдегида, ПЭГ-линкер имеет массу от 5000 дальтон до 12000 дальтон, или восстанавливающий агент выбран из группы, состоящей из боргидрида, цианоборгидрида натрия, аминоборана и пиколин-борана. В еще одном варианте осуществления изобретения смесь моно- и ди-ПЭГ очищают при помощи хроматографии, выбранной из группы, состоящей из катионообменной хроматографии, анионообменной хроматографии, эксклюзионной хроматографии и хроматографии с гидрофобным взаимодействием. Также настоящее изобретение относится к фармацевтической композиции, включающей моно- и ди-ПЭГ-IL-10, полученный этим способом осуществления реакции, и фармацевтически приемлемый носитель.
Настоящее изобретение относится к способу получения смеси моно- и дипегилированного IL-10, где по меньшей мере одна молекула ПЭГ ковалентно присоединена к по меньшей мере одному аминокислотному остатку по меньшей мере одной субъединицы IL-10, включающему a) осуществление реакции белка IL-10 в концентрации 7,5 мг/мл с активированным ПЭГ-линкером, так чтобы отношение IL-10 к ПЭГ-линкеру составляло 1:3,5, в присутствии 25 мM восстанавливающего агента, при значении pH 6,3 и температуре 15°С в течение 15 часов; и b) очистку смеси моно- и дипегилированного IL-10. В некоторых вариантах осуществления изобретения ПЭГ-линкер выбран из группы, состоящей из ПЭГ-сукцинимидилкарбоната, ПЭГ-бутиральдегида, ПЭГ-пентальдегида, ПЭГ-амидопропиональдегида, ПЭГ-уретанопропиональдегида и ПЭГ-пропилальдегида. Молекулярная масса ПЭГ, составляющего ПЭГ-линкер, составляет от 5000 дальтон до 12000 дальтон, восстанавливающий агент выбран из группы, состоящей из боргидрида, цианоборгидрида натрия, аминоборана и пиколинборана, или смесь моно- и ди-ПЭГ очищают при помощи хроматографии, выбранной из группы, состоящей из катионообменной хроматографии, анионообменной хроматографии, эксклюзионной хроматографии и хроматографии с гидрофобным взаимодействием. Также настоящее изобретение относится к фармацевтической композиции, включающей моно- и ди-ПЭГ-IL-10, полученный этим способом осуществления реакции, и фармацевтически приемлемый носитель.
Подробное описание изобретения
Используемые в настоящем изобретении, включая прилагаемую формулу изобретения, формы единственного числа слов включают их соответствующие формы множественного числа, если из контекста явно не следует иное. Все цитируемые в настоящем описании библиографические источники включены в него путем ссылки в такой же степени, как если бы для каждой отдельной публикации, патентной заявки или патента было специально и отдельно указано, что они включены в настоящее описание путем ссылки.
I. Определения терминов
Термины «активация», «стимуляция» и «обработка», когда они применяются по отношению к клеткам или рецепторам, могут иметь одинаковое значение, например активация, стимуляция или обработка клетки или рецептора лигандом, если иное не следует из контекста или не является очевидным. Термин «лиганд» включает природные и синтетические лиганды, например цитокины, варианты, аналоги, мутеины цитокинов и связывающие композиции, полученные из антител. Термин «лиганд» также включает низкомолекулярные соединения, например пептиды-миметики цитокинов и пептиды-миметики антител. Термин «активация» может относиться к активации клеток, регулируемой внутренними механизмами, а также внешними факторами и факторами окружающей среды. Термин «ответ», например, клетки, ткани, органа или организма включает изменение биохимических или физиологических характеристик, например концентрации, плотности, адгезии или миграции внутри биологического компартмента, скорости экспрессии генов или стадии дифференциации, где это изменение связано с активацией, стимуляцией или обработкой или с внутренними механизмами, такими как генетическое программирование.
Термин «активность» может описывать или относиться к связыванию молекулы с лигандом или рецептором, к каталитической активности; к способности стимулировать экспрессию генов или сигнальную систему клетки, дифференциацию или созревание; к антигенной активности, к регуляции активности других молекул и тому подобному. Термин «активность» молекулы может также относиться к активности по изменению или поддержанию взаимодействий между клетками, например адгезии, или активности по поддержанию клеточных структур, например клеточных мембран или цитоскелета. Термин «активность» может также означать удельную активность, например [каталитическая активность]/[мг белка] или [иммунологическая активность]/[мг белка], концентрацию в биологическом компартменте или тому подобное. Термин «пролиферативная активность» относится к активности, которая стимулирует, является необходимой для или непосредственно связана с, например, нормальным делением клеток, раком, опухолями, дисплазией, преобразованием клеток, метастазированием и ангиогенезом.
Термины «введение» и «лечение», когда они применяются по отношению к животному, человеку, подопытному субъекту, клетке, ткани, органу или биологической жидкости, относятся к контакту экзогенного фармацевтического, терапевтического, диагностического агента, соединения или композиции с животным, человеком, субъектом, клеткой, тканью, органом или биологической жидкостью. Термины «введение» и «лечение» могут относиться, например, к терапевтическим, плацебо, фармакокинетическим, диагностическим, научно-исследовательским и экспериментальным способам. Термин «обработка клетки» включает контакт реагента с клеткой, а также контакт реагента с жидкостью, где жидкость находится в контакте с клеткой. Термины «введение» и «обработка» также означают in vitro и ex vivo обработку, например, клетки реагентом, диагностическим средством, связывающей композицией или другой клеткой. Термин «лечение», когда он применяется по отношению к человеку, животному или подопытному субъекту, относится к терапевтическому лечению, профилактическим или превентивным мерам, к научно-исследовательскому и диагностическому применениям. Термин «лечение», когда он применяется по отношению к человеку, животному или подопытному субъекту, клетке, ткани или органу, включает контакт ПЭГ-IL-10 с человеческим или животным субъектом, клеткой, тканью, физиологическим компартментом или физиологической жидкостью. Термин «обработка клетки» также включает ситуации, когда ПЭГ-IL-10 контактирует с рецептором IL-10 (гетеродимером IL-10R1 и IL-10R2), например, в жидкой фазе или коллоидной фазе, а также ситуации, когда агонист или антагонист IL-10 контактирует с жидкостью, например, когда жидкость находится в контакте с клеткой или рецептором, но когда не было показано, что агонист или антагонист непосредственно контактирует с клеткой или рецептором.
Термином «кахексия» обозначается синдром истощения, включающий потерю мышечной (мышечная атрофия) и жировой массы, происходящую в результате нарушений в метаболизме. Кахексия имеет место при различных формах рака («раковая кахексия»), хронической обструктивной болезни легких (ХОБЛ), запущенных формах органной недостаточности и СПИД. Раковая кахексия характеризуется, например, выраженной потерей веса, анорексией, астенией и анемией. Анорексия является расстройством, происходящим в результате отсутствия мотивации принимать пищу, например, отвращения к пище (см., например, MacDonald, et al. (2003) J. Am. Coll. Surg. 197: 143-161; Rubin (2003) Proc. Natl. Acad. Sci. USA 100: 5384-5389; Tisdale (2002) Nature Reviews Cancer 2: 862-871; Argiles, et al. (2003) Drug Discovery Today 8: 838-844; Lelli, et al. (2003) J. Chemother. 15: 220-225; Argiles, et al. (2003) Curr. Opin. Clin. Nutr. Metab. Care 6: 401-406).
Термин «консервативно модифицированные варианты ПЭГ-IL-10» применяется по отношению как к аминокислотным, так и к нуклеотидным последовательностям. В случае конкретных последовательностей нуклеиновых кислот термин «консервативно модифицированные варианты» относится к тем нуклеиновым кислотам, которые кодируют идентичные или по существу идентичные аминокислотные последовательности или, когда нуклеиновая кислота не кодирует аминокислотную последовательность, к по существу идентичным последовательностям нуклеиновых кислот. Вследствие вырожденности генетического кода большое количество функционально идентичных нуклеиновых кислот может кодировать любой конкретный белок.
Что касается аминокислотных последовательностей, то специалисту в данной области техники известно, что отдельная замена в нуклеотидной, пептидной, полипептидной или белковой последовательности, которая заменяет аминокислоту или небольшой процент аминокислот в кодируемой последовательности консервативной аминокислотой, представляет собой «консервативно модифицированный вариант». Таблица консервативных замен, обеспечивающих получение функционально аналогичных аминокислот, хорошо известна в данной области техники. Примером консервативной замены является замена аминокислоты в одной из следующих групп на другую аминокислоту из той же группы (патент США № 5767063, выданный Lee, et al.; Kyte and Doolittle (1982) J. Mol. Biol. 157: 105-132):
(1) гидрофобные: Ile, Val, Leu, Phe, Cys или Met;
(2) нейтральные гидрофильные: Cys, Ser, Thr;
(3) кислотные: Asp, Glu;
(4) основные: Asn, Gln, His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe;
(7) малые аминокислоты: Gly, Ala, Ser.
Термин «эффективное количество» включает количество, достаточное для ослабления или предупреждения симптома или признака заболевания. Термин «эффективное количество» также означает количество, достаточное для того, чтобы сделать возможным или облегчить диагностику. Эффективное количество для конкретного пациента или животного может меняться в зависимости от таких факторов, как заболевание, подлежащее лечению, общее состояние здоровья пациента, способ и доза введения и тяжесть побочных эффектов (см., например, патент США № 5888530, выданный Netti, et al.). Эффективным количеством может быть максимальная доза или схема дозировки, которые позволяют избежать значительных побочных или токсических эффектов. Эффект заключается в улучшении диагностического показателя или параметра по меньшей мере на 5%, обычно по меньшей мере на 10%, более обычно по меньшей мере на 20%, чаще всего по меньшей мере на 30%, предпочтительно по меньшей мере на 40%, более предпочтительно по меньшей мере на 50%, наиболее предпочтительно по меньшей мере на 60%, оптимально по меньшей мере на 70%, более оптимально по меньшей мере на 80% и наиболее оптимально по меньшей мере на 90%, где 100% определяются как диагностический параметр, характерный для нормального субъекта (см., например, Maynard, et al. (1996) A Handbook of SOPs for Good Clinical Practice, Interpharm Press, Boca Raton, FL; Dent (2001) Good Laboratory and Good Clinical Practice, Urch Publ., London, UK). Эффективным количеством ПЭГ-IL-10 будет количество, достаточное для уменьшения объема опухоли, подавления роста опухоли, предотвращения метастазирования или увеличения инфильтрации CD8+ T-клеток в область локализации опухоли.
Термин «экзогенный» относится к веществам, которые вырабатываются вне организма, клетки или тела человека, в зависимости от контекста. Термин «эндогенный» относится к веществам, которые вырабатываются в клетке, организме или теле человека, в зависимости от контекста.
Термин «иммунное заболевание» или «иммунное расстройство» включает, например, патологическое воспаление, воспалительное заболевание, аутоиммунное расстройство или заболевание. Термин «иммунное заболевание» также относится к инфекциям, хроническим инфекциям и пролиферативным заболеваниям, таким как рак, опухоли и ангиогенез, включая инфекции, опухоли и рак, которые выдерживают воздействие со стороны иммунной системы. Термин «раковое заболевание» включает, например, рак, раковые клетки, опухоли, ангиогенез и предраковые состояния, такие как дисплазия.
Термины «ингибиторы» и «антагонисты» или «активаторы» и агонисты» относятся к ингибирующим или активирующим молекулам, соответственно, например, для активации, например, лиганда, рецептора, кофактора, гена, клетки, ткани или органа. Модулятором, например, гена, рецептора, лиганда или клетки является молекула, которая изменяет активность гена, рецептора, лиганда или клетки, где активность может быть активирована, ингибирована или изменена по своим регуляторным свойствам. Модулятор может действовать сам по себе или он может использовать кофактор, например белок, ион металла или низкомолекулярное соединение. Ингибиторы представляют собой химические соединения, которые уменьшают, блокируют, предотвращают, задерживают активацию, инактивируют, понижают чувствительность или подавляюще регулируют, например, ген, белок, лиганд, рецептор или клетку. Активаторы представляют собой химические соединения, которые увеличивают, активируют, облегчают, усиливают активацию, повышают чувствительность или стимулирующе регулируют, например, ген, белок, лиганд, рецептор или клетку. Ингибитор может быть также определен как композиция, которая уменьшает, блокирует или инактивирует конститутивную активность. Агонистом является химическое соединение, которое, взаимодействуя с мишенью, вызывает или стимулирует увеличение активации этой мишени. Антагонистом является химическое соединение, которое препятствует действию агониста. Антагонист предотвращает, уменьшает, ингибирует или нейтрализует активность агониста. Антагонист может также предотвращать, ингибировать или уменьшать конститутивную активность мишени, например целевого рецептора, даже тогда, когда агонист не выявлен.
Для изучения степени ингибирования, например, образцы или наборы для исследований, содержащие данный, например, белок, ген, клетку или организм, обрабатывают потенциальным активатором или ингибитором и сравнивают с контрольными образцами без ингибитора. Контрольным, т.е. не обработанным антагонистом, образцам присваивают значение относительной активности, равное 100%. Ингибирование достигается, когда значение активности относительно контроля составляет примерно 90% или менее, типично 85% или менее, более типично 80% или менее, наиболее типично 75% или менее, характерно 70% или менее, более характерно 65% или менее, наиболее характерно 60% или менее, типично 55% или менее, обычно 50% или менее, более обычно 45% или менее, наиболее обычно 40% или менее, предпочтительно 35% или менее, более предпочтительно 30% или менее, еще более предпочтительно 25% или менее и наиболее предпочтительно менее 25%. Активация достигается, когда значение активности относительно контроля составляет примерно 110%, характерно по меньшей мере 120%, более характерно по меньшей мере 140%, более характерно по меньшей мере 160%, часто по меньшей мере 180%, более часто по меньшей мере в 2 раза, наиболее часто по меньшей мере в 2,5 раза, обычно по меньшей мере в 5 раз, более обычно по меньшей мере в 10 раз, предпочтительно по меньшей мере в 20 раз, более предпочтительно по меньшей мере в 40 раз и наиболее предпочтительно более чем в 40 раз больше.
Конечные результаты активации и ингибирования можно отслеживать, как указано ниже. Активацию, ингибирование и ответ на лечение, например, клетки, физиологической жидкости, ткани, органа и животного или человека можно изучать через конечный результат. Конечный результат может включать заранее определенную величину или процент, например, признаков воспаления, онкогенности или клеточной дегрануляции или секреции, такой как высвобождение цитокинов, токсичного кислорода или протеаз. Конечный результат может включать, например, заранее определенную величину ионного потока или ионного транспорта; миграции клеток; адгезии клеток; пролиферации клеток; потенциала метастазирования; дифференциации клеток и изменения в фенотипе, например изменения в экспрессии генов, связанных с воспалением, апоптозом, трансформацией, клеточным циклом или метастазированием (см., например, Knight (2000) Ann. Clin. Lab. Sci. 30: 145-158; Hood and Cheresh (2002) Nature Rev. Cancer 2: 91-100; Timme, et al. (2003) Curr. Drug Targets 4: 251-261; Robbins and Itzkowitz (2002) Med. Clin. North Am. 86: 1467-1495; Grady and Markowitz (2002) Annu. Rev. Genomics Hum. Genet. 3: 101-128; Bauer, et al. (2001) Glia 36: 235-243; Stanimirovic and Satoh (2000) Brain Pathol. 10: 113-126).
Конечный результат ингибирования обычно составляет 75% от контроля или менее, предпочтительно 50% от контроля или менее, более предпочтительно 25% от контроля или менее и наиболее предпочтительно 10% от контроля или менее. Как правило, конечный результат активации составляет по меньшей мере 150% от контроля, предпочтительно по меньшей мере в два раза больше контроля, более предпочтительно по меньшей мере в четыре раза больше контроля и наиболее предпочтительно по меньшей мере в 10 раз больше контроля.
«Помеченная» композиция детектируется или прямо, или опосредованно при помощи спектроскопических, фотохимических, биохимических, иммунохимических, изотопных и химических способов. Например, подходящие метки включают стабильные изотопы 32P, 33P, 35S, 14C, 3H, 125I, флуоресцентные красители, электроноплотные реагенты, субстраты, эпитопные метки или ферменты, например, такие, которые используются в иммуноферментном или флуоресцентном анализе (см., например, Rozinov and Nolan (1998) Chem. Biol. 5: 713-728).
Термин «лиганд» относится, например, к низкомолекулярному соединению, пептиду, полипептиду и мембраноассоциированной или мембраносвязанной молекуле или их комплексу, которые могут действовать как агонист или антагонист рецептора. Термин «лиганд» также включает агент, который не является агонистом или антагонистом, но который может связываться с рецептором, не оказывая по существу влияния на его биологические свойства, например на проведение сигнала или адгезию. Кроме того, термин «лиганд» включает мембраносвязанный лиганд, который был преобразован, например, химическим или рекомбинантным способом в растворимую форму этого мембраносвязанного лиганда. Как правило, когда лиганд связан с мембраной первой клетки, рецептор обычно находится на второй клетке. Вторая клетка может обладать той же идентичностью, что и первая или отличаться от нее. Лиганд или рецептор могут быть полностью внутриклеточными, т.е. они могут находиться в цитозоле, ядре или каком-либо другом внутриклеточном компартменте. Лиганд или рецептор могут менять свое местоположение, например, с внутриклеточного компартмента на наружную поверхность цитоплазматической мембраны. Комплекс лиганда и рецептора называется «лиганд-рецепторный комплекс». Когда лиганд и рецептор вовлечены в сигнальный путь, положение лиганда в этом сигнальном пути находится до положения рецептора.
Низкомолекулярные соединения предназначены для лечения физиологических состояний и нарушений при опухолях и раке. «Низкомолекулярные соединения» определяются как соединения, молекулярный вес которых составляет менее 10 кДа, обычно менее 2 кДа и предпочтительно менее 1 кДа. К числу низкомолекулярных соединений относятся, без ограничений, неорганические молекулы, органические молекулы, содержащие неорганический компонент, молекулы, включающие радиоактивный атом, синтетические молекулы, пептиды-миметики и антитела-миметики. Как лекарственные средства низкомолекулярные соединения могут легче проникать в клетку, менее подвержены деградации и менее склонны вызывать иммунный ответ по сравнению с высокомолекулярными соединениями. Низкомолекулярные соединения, такие как пептиды-миметики антител и цитокинов, а также низкомолекулярные токсины, описаны в литературе (см., например, Casset, et al. (2003) Biochem. Biophys. Res. Commun. 307: 198-205; Muyldermans (2001) J. Biotechnol. 74: 277-302; Li (2000) Nat. Biotechnol. 18: 1251-1256; Apostolopoulos, et al. (2002) Curr. Med. Chem. 9: 411-420; Monfardini, et al. (2002) Curr. Pharm. Des. 8: 2185-2199; Domingues, et al. (1999) Nat. Struct. Biol. 6: 652-656; Sato and Sone (2003) Biochem. J. 371: 603-608; патент США № 6326482, выданный Stewart, et al.).
Термин «химиотерапевтический агент» относится к химическому соединению, пригодному для лечения рака. Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и циклофосфамид (CITOXANTM); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномицин, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; антиадренальные средства, такие как аминоглютетимид, митотан, трилостан; пополнитель фолиевой кислоты, такой как фолиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновая кислота; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; элфорнитин; ацетат эллиптиния; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; PSK®; разоксан; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); циклофосфамид; тиотепа; таксаны, например паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Princeton, N.J.) и доцетаксел (Taxotere®; Rhone-Poulene Porer, Antony, France); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин C; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода (Xeloda® Roche, Switzerland); ибандронат; CPT11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноевую кислоту; эсперамицины; капецитабин; и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше веществ. Также в данное определение включены антигормональные агенты, которые действуют, регулируя или ингибируя действие гормонов на опухоли, такие как антиэстрогены, включая, например, тамоксифен, ралоксифен, ингибирующие ароматазу 4(5)-имидазолы, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (Fareston); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и госерелин; и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше веществ.
Термин «специфичное» или «избирательное» связывание, по отношению к лиганд/рецептор, антитело/антиген или другой связывающейся паре, означает реакцию связывания, которая определяется наличием белка в разнородной совокупности белков и других биологических соединений. Таким образом, в определенных условиях конкретный лиганд связывается с конкретным рецептором и не связывается в значительных количествах с другими белками, присутствующими в образце. Антитело или связывающая композиция, полученная из антигенсвязывающего сайта антитела, рассматриваемого способа, связывается со своим антигеном или его вариантом или мутеином с аффинностью, которая по меньшей мере в два раза больше, предпочтительно по меньшей мере в десять раз больше, более предпочтительно по меньшей мере в 20 раз больше и наиболее предпочтительно по меньшей мере в 100 раз больше, чем аффинность любого другого антитела или связывающей композиции, полученной из него. В предпочтительном варианте осуществления изобретения антитело обладает аффинностью большей, чем примерно 109 литров на моль, определенной, например, с помощью метода Скэтчарда (Munsen, et al. (1980) Analyt. Biochem. 107: 220-239).Термин «интерлейкин-10» или «IL-10», используемый в настоящем изобретении, независимо от того, конъюгирован ли он с полиэтиленгликолем или находится в неконъюгированной форме, относится к белку, содержащему две субъединицы, нековалентно соединенные в гомодимер. Используемый в настоящем изобретении термин «интерлейкин-10» или «IL-10», если не указано иное, может относиться к человеческому или мышиному IL-10 (номера доступа в Genbank NP_000563; M37897; или патент США № 6217857), которые также обозначаются как «чIL-10» или «мIL-10».
Термин «пегилированный IL-10» или «ПЭГ-IL-10» относится к молекуле IL-10, имеющей одну или несколько молекул полиэтиленгликоля, ковалентно присоединенных к одному или нескольким аминокислотным остаткам белка IL-10 через линкер, так что это соединение является стабильным. Термины «монопегилированный IL-10» и «моно-ПЭГ-IL-10» означают, что по меньшей мере одна молекула полиэтиленгликоля через линкер ковалентно присоединена к одному аминокислотному остатку на одной субъединице димера IL-10. Термины «дипегилированный IL-10» и «ди-ПЭГ-IL-10» означают, что по меньшей мере одна молекула ПЭГ через линкер присоединена к одному остатку на каждой субъединице димера IL-10. Средняя молекулярная масса молекулы ПЭГ предпочтительно составляет от примерно 5000 до примерно 50000 дальтон. Способ или место присоединения ПЭГ к IL-10 не является критичным, но предпочтительно, чтобы пегилирование не изменяло или только минимально изменяло активность биологически активной молекулы. Предпочтительно, чтобы увеличение времени полужизни было больше, чем любое уменьшение биологической активности. Для ПЭГ-IL-10 биологическая активность обычно измеряется путем оценки уровня воспалительных цитокинов (например, ФНОα, ИФНγ) в сыворотке субъектов, которых сенсибилизировали бактериальным антигеном (липополисахаридом, ЛПС) и которым вводили ПЭГ-IL-10, как описано в патенте США № 7052686.
Используемый в настоящем изобретении термин «время полужизни в сыворотке», сокращенно «t1/2», означает период полувыведения, т.е. время, за которое концентрация агента в сыворотке достигает половины от своего начального или максимального значения. Термин «увеличенное время полужизни», используемый в настоящем изобретении по отношению к синтетическому агенту, означает, что синтетический агент выводится с меньшей скоростью, чем несинтетический, эндогенный агент или его вариант, полученный рекомбинантным способом.
II. Общие сведения
Настоящее изобретение относится к способам получения смеси моно- и ди-ПЭГ-IL-10. Было показано, что пегилированный IL-10 является более эффективным при лечении опухолей (см., например, заявку на патент США 20080081031). Настоящее изобретение относится к способу увеличения выхода пегилированного IL-10 путем очистки монопегилированного (по меньшей мере одна молекула ПЭГ на одной субъединице гомодимера IL-10) и дипегилированного (по меньшей мере одна молекула ПЭГ на каждой субъединице гомодимера IL-10) IL-10.
III. Полиэтиленгликоль («ПЭГ»)
Полиэтиленгликоль («ПЭГ») является химическим веществом, которое используется для приготовления лечебных белковых продуктов. Глагол «пегилировать» означает присоединить по меньшей мере одну молекулу ПЭГ к другой молекуле, например лечебному белку. Например, Адаген, пегилированный препарат аденозиндеаминазы, одобрен для лечения тяжелого комбинированного иммунодефицита; пегилированная супероксиддисмутаза проходила клинические испытания для лечения черепно-мозговых травм; пегилированный интерферон альфа проходил проверку в первой фазе клинических испытаний для лечения гепатита; сообщалось, что пегилированная глюкоцереброзидаза и пегилированный гемоглобин проходили доклинические испытания. Было показано, что присоединение полиэтиленгликоля защищает от протеолиза (см., например, Sada, et al., (1991) J. Fermentation Bioengineering 71: 137-139).
В своей наиболее распространенной форме ПЭГ представляет собой линейный или разветвленный простой полиэфир с концевыми гидроксильными группами и имеющий общую формулу
HO-(CH2CH2O)n-CH2CH2-OH
Для того чтобы присоединить ПЭГ к молекуле (полипептидам, полисахаридам, полинуклеотидам и низкомолекулярным органическим соединениям), ПЭГ необходимо активировать путем приготовления производного ПЭГ, имеющего функциональную группу на одном или обоих концах. Наиболее распространенным способом конъюгации ПЭГ с белками является активация ПЭГ при помощи функциональных групп, способных реагировать с лизином и группами N-концевой аминокислоты. В частности, наиболее распространенными реакционноспособными группами, вовлеченными в связывание ПЭГ с полипептидами, являются альфа- и эпсилон-аминогруппы лизина.
Реакция пегилирования линкера с белком приводит к присоединению молекулы ПЭГ преимущественно к следующим сайтам: альфа-аминогруппа на N-конце белка, эпсилон-аминогруппа на боковой цепи остатков лизина и имидазольная группа на боковой цепи остатков гистидина. Так как большинство рекомбинантных белков имеет одну альфа- и несколько эпсилон-аминогрупп и имидазольных групп, многочисленные позиционные изомеры могут быть получены в зависимости от химической природы линкера.