Рнк-аптамер, обладающий способностью узнавать характерные для рассеянного склероза аутоантитела
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и медицины и касается РНК-аптамера. Предложенный РНК-аптамер представляет собой 57-звенный олигонуклеотид смешанного типа, имеющий нуклеотидную последовательность GGGAGGACGAUGCGGUGUUUUCUGAGUACAUCUCUGCCCCACCCUU GUUUACCCCCA, где A,G - рибонуклеотиды, U, С - 2'-дезокси-2'-фторрибонуклеотиды, обладает способностью узнавать характерные для рассеянного склероза аутоантитела. Охарактеризованное изобретение специфично и высокоафинно связывается с аутоантителами, характерными для рассеянного склероза и может быть использовано для диагностики рассеянного склероза. 3 ил., 2 пр.
Реферат
Изобретение относится к области биотехнологии и медицины, а именно к РНК-аптамерам, способным специфично и с высоким сродством связываться с аутоантителами, характерными для рассеянного склероза.
Аптамеры - синтетические нуклеиновые кислоты, способные специфично узнавать молекулы-мишени за счет образования уникальной третичной структуры. Для их получения используют метод селекции in vitro из пулов олигонуклеотидов со случайными последовательностями. Мишенями аптамеров могут быть как низкомолекулярные соединения, так и белки или целые клетки.
Аптамеры, подобно пептидам, созданным с использованием фагового дисплея, или моноклональным антителам, способны модулировать активность выбранных мишеней за счет специфического связывания. Так, например, связывание аптамера с мишенью может блокировать ее функции. На данный момент получены аптамеры для большого количества разнообразных белков, включая факторы роста, факторы транскрипции, ферменты, иммуноглобулины и рецепторы [Zhu G., Ye M., Donovan M.J., Song E., Zhao Z., Tan W. // Chem. Commun. 2012. V.48. P.10472-10480]. Как правило, размер аптамеров лежит в диапазоне 25-90 нуклеотидов (10-30 кДа), они связывают свои мишени с наномолярной или субнаномолярной аффинностью и способны различать близкородственные мишени (например, белки из одного семейства генов). Связывание аптамеров с мишенями реализуется за счет тех же типов взаимодействий, которые определяют аффинность и специфичность связывания антитело-антиген (водородные связи, электростатические и ван-дер-ваальсовы взаимодействия) [Pendergrast P.S, Marsh H.N., Grate D., Healy J.M., Stanton M. // J. Biomol. Tech. 2005. V.16. P.224-234].
Аптамеры обладают рядом свойств, требуемых для применения в качестве терапевтических и диагностических средств, включая высокую специфичность и аффинность связывания, биологическую активность и превосходные фармакокинетические свойства. Кроме того, они обеспечивают конкретные конкурентоспособные преимущества по сравнению с антителами и другими биологически активными веществами белковой природы.
Рассеянный склероз (PC) - хроническое прогрессирующее аутоиммунное заболевание центральной нервной системы, которое характеризуется образованием хаотически рассеянных очагов демиелинизации, т.е. утраты миелина - белково-липидной мембраны, покрывающей нервное волокно [Т.Е. Шмидт, Н.Н. Яхно Рассеянный склероз. -M.: Медицина. 2003]. Своевременная диагностика и ранняя терапия иммуномодулирующими препаратами позволяют изменить течение PC и существенно замедлить его развитие. В то же время диагностика PC, особенно на начальных стадиях заболевания, представляет собой сложную комплексную задачу и требует анализа совокупности клинических и лабораторных данных в сочетании с результатами МРТ.
В настоящее время в качестве лабораторного теста для ранней диагностики PC используют анализ спинномозговой жидкости на наличие олигоклональных IgG-антител, однако положительный результат данного теста не является исчерпывающим доказательством и служит лишь для подтверждения диагноза [Awad A., Hemmer В., Hartung H.-P., Kieseier В., Bennett J.L., Stuve О. // J. Neuroimmunol. 2010. V.219. P.1-7], a специфичного метода лабораторной диагностики PC пока не существует.
Перспективным способом лабораторной диагностики является количественное определение белков-маркеров, характерных для тех или иных заболеваний. В настоящее время интенсивно развиваются подходы к детекции белков, основанные на использовании биосенсоров, в которых в качестве узнающей белок части выступает аптамер. По сродству к мишеням аптамеры сравнимы с моноклональными антителами и обладают при этом рядом дополнительных преимуществ [Ruigrok V., Levisson M., Eppink M.H.M., Smidt H., van der Oost J. Biochem. J. // 2011. V.436. P.1-13], среди которых отдельно следует выделить возможность отбора аптамеров практически к любой мишени, а также возможность химического синтеза аптамеров и введения в их состав различных модификаций [Mayer G. // Angew. Chem. Int. Ed. 2009. V.48. P.2672-2689].
На данный момент существует целый ряд ДНК- и РНК-аптамеров, способных высокоаффинно и специфично узнавать белки-маркеры различных заболеваний и биосенсоров на их основе [Hong P., Li W., Li J. // Sensors. 2012. V.12. P.1181-1193]. В частности, получены аптамеры, способные узнавать белки - медиаторы воспалительного ответа, характерные для ряда аутоиммунных заболеваний, в том числе и рассеянного склероза.
Например, известны РНК-аптамеры, способные специфично связываться с интерлейкином-17 [Nakamura Y., Ishigiro A., Miyakawa S. // Genes Cells. 2012. V.17. P.344-364], интерлейкином-12 и интерлейкином-23 [Aptamersto the human il-12 cytokine family and their use as autoimmune disease therapeutics. Cload S.T., Diener J.L, Ferguson A., Hamaguchi N., Keene S.C., Lagasse H. A.D., Sawhney P., Thompson K. WO 2005086835 A2, оп. 22.09.2005].
Наиболее ближайшим к заявляемому аптамеру - прототипом, является РНК-аптамер к мидкину (MKapt), представляющий собой 49-звенный олигорибонуклеотид, содержащий 2′-O-метилрибонуклеотиды, 2′-дезокси-2′-фторрибонуклеотиды и дезоксирибонуклеотиды в определенных положениях олигонуклеотидной цепи, остаток холестерина на 5′-конце и остаток тимидина, присоединенный 3′-3′-фосфодиэфирной связью. [Wang J. et al. Inhibition of midkine alleviates experimental autoimmune encephalomyelitis through the expansion of regulatory Т cell population. Proc. Natl. Acad. Sci. USA. 2008. V.105. P.3915-3920]. Мидкин - фактор роста с широким спектром биологической активности, который играет важную роль в процессе развития воспаления, в частности, для рассеянного склероза характерен повышенный уровень этого белка. Данный аптамер обладает высоким сродством к своей мишени (Kd=0.9 нМ) и способен замедлять развитие экспериментального аутоиммунного энцефаломиелита у мышей (заболевание, аналогичное рассеянному склерозу).
С точки зрения потенциального диагностического применения, недостатком упомянутых выше аналогов и прототипа изобретения - аптамеров, направленных на белки-медиаторы воспалительного ответа, является отсутствие специфичности по отношению к конкретным аутоиммунным заболеваниям. При использовании таких аптамеров для детекции белка-мишени в биологических образцах можно получить лишь информацию о наличии или отсутствии аутоиммунных заболеваний в целом, однако определить конкретный вид заболевания с помощью таких аптамеров невозможно.
Одним из характерных признаков рассеянного склероза является появление в организме аутоантител-протеаз, способных гидролизовать основной белок миелина (ОБМ) [Ponomarenko N.A., Durova O.M., Vbrobiev I.I., Aleksandrova E.S., Telegin G.B., Chamborant O.G., Sidorik L.L., Suchkov S.V., Alekberova Z.S., Gnuchev N.V., Gabibov A.G. // J. Immunol. Meth. 2002. V.269. P.197-211; Polosukhina D.I., Kanyshkova T.G., Doronin B.M., Tyshkevich O.B., Buneva V.N., Boiko A.N., Gusev E.I., Favorova 0.0., Nevinsky G.A. // J. Cell. Mol. Med. 2004. V.8. P.359-368].
Задачей настоящего изобретения является создание устойчивого в биологических средах РНК-аптамера, способного специфично и с высоким сродством связываться с анти-ОБМ аутоантителами, полученными из крови больных рассеянным склерозом.
Технический результат: получение нового РНК-аптамера, который обладает способностью специфично и высокоафинно связываться с аутоантителами, характерными для рассеянного склероза.
Поставленная задача достигается предлагаемым РНК-аптамером (Apt-2-9с), представляющим собой 57-звенный олигонуклеотид смешанного типа, содержащий пуриновые рибонуклеотиды и 2′-дезокси-2′-фторпиримидиновые рибонуклеотиды, имеющий следующую нуклеотидную последовательность: GGGAGGACGAUGCGGUGUUUUCUGAGUACAUCUCUGCCCCACCCUU GUUUACCCCCA, где A, G - рибонуклеотиды; U, С - 2′-дезокси-2′-фторрибонуклеотиды.
Нуклеотидная последовательность аптамера Apt2-9c установлена с помощью метода селекции in vitro с использованием в качестве мишеней поликлональных анти-ОБМ антител, выделенных из крови больных рассеянным склерозом. После установления нуклеотидных последовательностей индивидуальных аптамеров проводили скрининг аффинности и специфичности их связывания с аутоантителами-мишенями. В результате минимизации нуклеотидной последовательности был получен 57-звенный аптамер Apt2-9c со следующими характеристиками:
- обладает высоким сродством к протеолитическим анти-ОБМ аутоантителам из крови больных рассеянным склерозом;
- обладает значительно более низким сродством к антителам из крови здоровых доноров.
Синтез РНК-аптамера по изобретению осуществляют на автоматическом ДНК/РНК-синтезаторе ASM-800 с использованием стандартного твердофазного фосфитамидного метода.
Определяющими отличиями предлагаемого РНК-аптамера от прототипа являются:
- заявляемый РНК-аптамер представляет собой 57-звенный олигонуклеотид смешанного типа, содержащий пуриновые рибонуклеотиды и 2′-дезокси-2′-фторпиримидиновые нуклеотиды, имеющий нуклеотидную последовательность SEQ ID NO:1, что позволяет повысить его стабильность к ферментативному и химическому разрушению в биологических образцах;
- РНК-аптамер специфично и с высоким сродством связывается с анти-ОБМ аутоантителами, являющимися биомаркерами рассеянного склероза, что позволит использовать его для диагностики данного заболевания.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение РНК-аптамера Apt2-9c
Синтез Apt2-9c проводили на автоматическом ДНК/РНК синтезаторе ASM-800 (Биоссет, Россия) по стандартным протоколам [Bellon L. Oligoribonucleotides with 2′-O-(tert-butyldimethylsilyl) groups. Current protocols in nucleic acids chemistry. 2001. S.1. P.3.6.1-3.6.13], оптимизированным для данного прибора, с использованием β-цианэтил фосфитамидов 5′,2′,N-защищенных пуриновых рибонуклеозидов и 5′,N-защищенных пиримидиновых 2′-дезокси-2′-F-рибонуклеозидов. В качестве полимерного носителя использовали стеклянные частицы CPG (controlled pore glass) с диаметром пор 500 А с присоединенным через 3′-гидроксильную группу 5′,2′,N-защищенным рибонуклеозидом.
Каждый цикл синтеза состоял из следующих стадий:
1) детритилирование - удаление диметокситритильной защитной группы с 5′-гидроксила растущей олигонуклеотидной цепи путем обработки 3%-ным раствором дихлоруксусной кислоты в дихлорметане;
2) присоединение очередного мономерного звена, которое представляет собой β-цианэтил-N,N-бис-диизопропиламидофосфит одного из защищенных нуклеозидов. В качестве активирующего агента при конденсации использовали 5-этилтио-1Н-тетразол;
3) кэпирование - блокирование непрореагировавших 5′-гидроксилов с использованием уксусного ангидрида и N-метилимидазола, что позволяет избежать пропусков нуклеозидов в последовательности требуемого олигонуклеотида;
4) окисление раствором йода в пиридине, в ходе которого происходит превращение фосфиттриэфирных межнуклеозидных связей в фосфотриэфирные.
После проведения необходимого числа синтетических циклов и удаления 5′-концевой диметокситритильной группы получали защищенный полимерсвязанный 2′-F-пиримидинсодержащий РНК-аптамер. Для отделения олигонуклеотида от полимерного носителя, деблокирования гетероциклических оснований и межнуклеозидных фосфатов к полимерсвязанному аптамеру добавляли 300 мкл 40%-ного водного метиламина, выдерживали в течение 2 ч при 25°С и постоянном перемешивании, затем при -20°С в течение 15-20 мин и отделяли от полимера центрифугированием. Полимер промывали 3×100 мкл смесиэтанол:ацетонитрил:вода (1:1:1). Растворы объединяли и упаривали до сухого остатка в вакуумном испарителе Speed-Vac Concentrator SVC-100Н. Для удаления трет-бутилдиметилсилильных защитных групп с 2′-гидроксилов пуриновых нуклеозидов к сухому остатку олигонуклеотида добавляли 200 мкл смеси N-метил-2-пирролидинон:триэтиламин:ТЕА·ЗНР (1.5:0.75:1, v/v/v) и выдерживали при 65°С в течение 1.5 ч. После охлаждения раствора до комнатной температуры добавляли 300 мкл этокситриметилсилана и перемешивали в течение 10 мин. К полученной смеси добавляли 1 мл серного эфира и центрифугировали, раствор декантировали, осадок промывали серным эфиром, высушивали на воздухе. Полностью деблокированный аптамер очищали препаративным электрофорезом в денатурирующем 12%-ном акриламидном геле в условиях: акриламид:N,N′-метиленбисакриламид (30:1), 8 М мочевина, 50 мМ Трис-борат (рН 8.3), 0.1 мМ Na2EDTA, при напряжении 50 В/см. После проведения электрофореза гель помещали на пластину для ТСХ и визуализировали аптамер в УФ-свете, затем вырезали соответствующие участки геля и осаждали в виде натриевой соли. Аптамер элюировали водным раствором 0.3 М перхлората натрия, элюат обессоливали с помощью картриджа Waters SepPac С18, упаривали до объема 100 мкл и осаждали аптамер добавлением 10-кратного избытка 2%-ного NaClO4 в ацетоне. Осадок отделяли центрифугированием в течение 10 мин при 4°С и 13200 об/мин. Супернатант отбирали, осадок олигонуклеотида промывали ацетоном, высушивали при 37°С.
Полученный Apt2-9c, представляющий собой 57-звенный олигонуклеотид смешанного типа, содержащий пуриновые рибонуклеотиды и 2′-дезокси-2′-фторпиримидиновые нуклеотиды, имеет нуклеотидную последовательность SEQ ID NO:1 (фиг.1).
РНК-аптамер Apt2-9c анализировали методами аналитического электрофореза в 12%-ном денатурирующем ПААГ с последующим окрашиванием геля раствором красителя "Stains-All" и MALDI-TOF масс-спектрометрии.
Пример 2. Использование РНК-аптамера Apt2-9c для детекции характерных для рассеянного склероза (PC) аутоантител.
Исследовано связывание Apt2-9c, несущего радиоактивную [32Р]-метку на 3′-конце, со смесью поликлональных анти-ОБМ аутоантител (смесь IgG, IgA и IgM-антител с преобладанием IgG) из крови 12 больных PC. Реакцию проводили при 25°С в течение 16 часов в буферном растворе (50 мМ Трис-HCl, рН 7.5, 100 мМ NaCl, 0.1% Tween 20) в присутствии следовых количеств радиоактивно меченого аптамера. Концентрация антител варьировала от 0.5 до 100 нМ. За образованием комплексов следили методом электрофореза в 6%-ном полиакриламидном геле, который позволяет отделить свободные аптамеры от комплексов аптамер-антитело, в условиях: акриламид:N,N′-метиленбисакриламид (50:1), 25 мМ Трис-борат (рН 8.3), напряжение 15 В/см. Аналогичным способом было исследовано связывание аптамера со смесью суммарных IgG-антител, выделенных из крови 12 здоровых доноров. После окончания электрофореза гель высушивали и помещали в кассету с фоточувствительным экраном. Экран сканировали при помощи фосфоримиджера Bio-Rad. Для получения количественных характеристик радиоавтографы переводили в цифровую форму в программном пакете Quantity One. С использованием программного пакета GraphPad Prism 5.0.4.533 для каждой серии опытов были постороены изотермы связывания, что позволило оценить сродство аптамеров к антителам и рассчитать константы связывания.
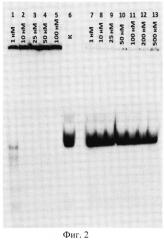
На фиг.2 приведен радиоавтограф 6%-ного неденатурирующего полиакриламидного геля после разделения реакционных смесей. Дорожки 1-5 - инкубация аптамера с патогенными аутоантителами из крови больных рассеянным склерозом в указанной концентрации; дорожка 6 (контроль) - аптамер после инкубации в условиях реакции в отсутствие антител; дорожки 7-13 - инкубация с суммарными IgG-антителами здоровых доноров в указанной концентрации.
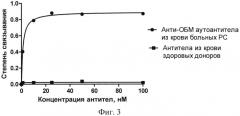
На фиг.3 приведены изотермы связывания Apt2-9c с анти-ОБМ аутоантителами из крови больных PC и антителами из крови здоровых доноров.
Из фиг.2, 3 видно, что Apt2-9c эффективно связывается с анти-ОБМ аутоантителами от больных PC, в то время как с антителами от здоровых доноров образуется лишь незначительное количество комплексов. Константы диссоциации комплексов аптамер-антитело для патогенных антител (Kd=1.2±0.1 нМ) и антител здоровых доноров (Kd=2300±460 нМ) различаются почти в 2000 раз. Полученные результаты свидетельствуют о том, что Apt2-9c обладает высоким сродством к аутоантителам, характерными для рассеянного склероза, и селективно узнавать данные антитела.
Таким образом, предлагаемый РНК-аптамер Apt2-9c обладает высоким сродством и специфичностью связывания с протеолитическими анти-ОБМ аутоантителами, являющимися характерными для рассеянного склероза аутоантителами, и может быть использован для диагностики рассеянного склероза.
| <110> | Федеральное государственное бюджетное учреждение науки Институт химической биологии и фундаментальной медицины Сибирского отделения Российской академии наук (ИХБФМ СО РАН) |
| <120> | РНК-аптамер, обладающий способностью узнавать характерные для рассеянного склероза аутоантитела |
| <160> | Номер SEQ ID NO |
| <210> | SEQ ID NO: 1 |
| <211> | 57 |
| <212> | Олигонуклеотид смешанного типа, содержащий пуриновые рибонуклеотиды и 2'-дезокси,2'-фторпиримидиновые нуклеотиды |
| <213> | искусственная последовательность |
| <400> | 1 |
| GGGAGGACGAUGCGGUGUUUUCUGAGUACAUCUCUGCCCCACCCUUGUUU | 50 |
| ACCCCCA | 57 |
Фиг. 1.
РНК-аптамер, представляющий собой 57-звенный олигонуклеотид смешанного типа, содержащий пуриновые рибонуклеотиды и 2'-дезокси- 2'-фторпиримидиновые рибонуклеотиды, имеющий следующую нуклеотидную последовательность: GGGAGGACGAUGCGGUGUUUUCUGAGUACAUCUCUGCCCCACCCUU GUUUACCCCCA, где A,G -рибонуклеотиды, U, С - 2'-дезокси-2'-фторрибонуклеотиды, обладающий способностью узнавать характерные для рассеянного склероза аутоантитела.