Фотосенсибилизатор для фотодинамической терапии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к фотосенсибилизаторам для фотодинамической терапии. Предложено применение мезо-тетра(3-пиридил)бактериохлорина структурной формулы (I) в качестве фотосенсибилизатора в ближней ИК области спектра для фотодинамической терапии. Технический результат состоит в том, что мезо-тетра(3-пиридил)бактериохлорин обладает высокой фотоиндуцированной активностью в отношении опухолевых клеток человека различного эпителиального происхождения (величина ИК50 составляет 35±5 нМ) и обеспечивает высокую дозозависимую противоопухолевую эффективность у животных с опухолями различного генеза. Дозы заявленного фотосенсибилизатора в 1,0-2,5 мг/кг обеспечили 70-100% торможение роста опухоли, увеличение продолжительности жизни на 80-131% и 25-100% излеченность животных, за счет селективного накопления в опухоли и быстрого выведения из организма. 5 ил., 8 пр.
Структурная формула(I)
Реферат
Настоящее изобретение относится к медицине, а именно - к фотосенсибилизаторам (ФС) для фотодинамической терапии (ФДТ) злокачественных новообразований и ряда других патологических состояний.
Метод ФДТ основан на применении ФС, которые обладают способностью к избирательному накоплению (тропностью) в опухолевой ткани и при облучении светом определенной длины волны переходят в активированное состояние, которое инициирует образование цитотоксических агентов - синглетного кислорода и свободных радикалов, вызывающих разрушение структурных элементов опухолевой ткани.
Успешное применение метода ФДТ для лечения злокачественных новообразований стимулирует поиск новых ФС с улучшенными свойствами. Наиболее перспективные для ФДТ ФС с максимумом поглощения в дальнем красном и ближнем инфракрасном диапазонах (700-800 нм), так называемом «терапевтическом окне», где собственное поглощение биологической ткани минимально, что обеспечивает возможность более глубокого проникновения излучения в ткань и, как следствие, высокую эффективность терапии (Bonnett R.J. Heterocyclic Chem. 2002. V.39. P.455-470).
Перспективными ФС для ФДТ, поглощающими в ближнем инфракрасном диапазоне спектра, являются бактериохлорины (тетрагидропорфирины) (Миронов А.Ф., Грин М.А., Ципровский А.Г. и др. // Биоорганическая химия. 2003. Т.29. Вып.2. С.214-221). Так, тукад, палладиевое производное бактериохлорина (Tookad), с максимумом поглощения при 760 нм разрешен для лечения простаты.
Однако преобладающее количество бактериохлоринов является полусинтетическими препаратами, для получения которых используют в качестве исходных соединений вещества природного происхождения. Известные же бактериохлорины чисто синтетического происхождения весьма труднодоступны - получаются многостадийными синтезами, как правило, нестабильны при хранении или неустойчивы фотохимически в результате протекающих окислительных процессов.
Задачей предлагаемого изобретения является изыскание ФС, который характеризовался бы поглощением в ближнем инфракрасном диапазоне спектра, высокой фотоиндуцированной активностью, высокой тропностью к опухолевой ткани, уменьшением побочных эффектов за счет сокращения времени циркуляции в организме, что позволило бы значительно повысить эффективность лечения.
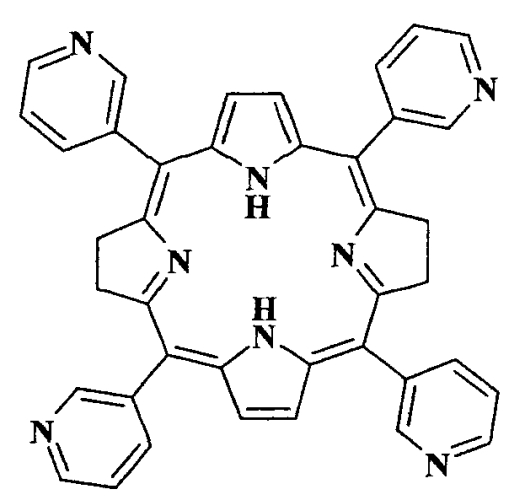
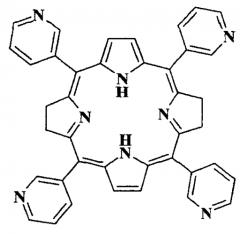
Для решения поставленной задачи в качестве ФС для ФДТ предлагается использование весьма доступного чисто синтетического бактериохлорина - мезо-тетра(3-пиридил)бактериохлорина (H2Py4BC) следующей формулы:
Данное соединение описано в качестве полупродукта при синтезе мезо-тетра[1-(4′-бромбутил)-3-пиридил]бактериохлорина тетрабромида (Патент РФ №2479585, C07D 487/22, 2013). H2Py4BC получен двухстадийным синтезом исходя из пиррола и 3-пиридинальдегида. Для его солюбилизации в водных растворах использован разрешенный к медицинскому применению неионогенный ПАВ Cremophor EL (4%-ный раствор).
Изобретение иллюстрируется следующими рисунками:
Фиг.1 - Спектр поглощения раствора 0,41 мг/мл H2Py4BC в 4%-ом Cremophor EL.
Фиг.2 - Спектры флуоресценции раствора H2Py4BC в 0,9% растворе NaCl (A) и содержащей 10% ЭТС среде Игла MEM (Б) при инкубации в темновых условиях (1-ex tempore, 2 - через месяц).
Фиг.3 - Спектры флуоресценции H2Py4BC в 0,9% растворе NaCl (А) и содержащей 10% ЭТС среде Игла MEM (Б) при облучении (1-ex tempore, 2-5 Дж/см2, 3-10 Дж/см2).
Фиг.4 - Фотоиндуцированная активность H2Py4BC в отношении клеток HEp2 (сплошная линия) и EJ (пунктирная линия).
Фиг.5 - Фотоиндуцированная противоопухолевая активность H2Py4BC у мышей с опухолью S37 в зависимости от дозы и интервала между введением и облучением (1 - 2,5 мг/кг, 30 мин; 2 - 2,5 мг/кг, 2 ч; 3 - 1,0 мг/кг, 30 мин; 4 - 1,0 мг/кг, 2 ч; 5 - 0,5 мг/кг, 30 мин).
Предлагаемое изобретение иллюстрируется нижеследующими примерами, но не ограничивается ими.
Пример 1. мезо-Тетра(3-пиридил)бактериохлорин синтезирован по ранее описанной методике (Патент РФ №2479585, C07D 487/22, 2013) восстановлением мезо-тетра(3-пиридил)порфирина диимидом, генерируемым в условиях реакции из n-толуолсульфонилгидразида, в присутствии сухого поташа в сухом пиридине. λмакс, нм (lgε), хлороформ: 747 (5,05), 683 (3,78), 521 (4,71), 491 (3,78), 380 (5,08), 367 (4,95), 357 (5,00).
Исходный мезо-тетра(3-пиридил)порфирин получен конденсацией эквимолярных количеств пиррола с 3-пиридинальдегидом в кипящей пропионовой кислоте в присутствии воздуха.
Пример 2. Приготовление раствора H2Py4BC в 4%-ном Cremophor EL
Навески H2Py4BC (4,1 мг) и неионогенного ПАВ Cremophor EL (0,4 г) растворяли в 20 мл хлороформа. Перемешивали раствор в круглодонной колбе объемом 1 л магнитной мешалкой, нагревая до 40-55°C для интенсификации процесса растворения. Затем упаривали растворитель на роторном испарителе в вакууме при температуре водяной бани 30-40°С. Образовавшуюся пленку досушивали в вакууме, после чего гидратировали добавлением 10 мл фосфатного буферного раствора (PBS) с pH=7,34. Перемешивание осуществляли до полного растворения пленки; полученный раствор фильтровали через мембранный фильтр (Millipore, Type GS) с размером пор 0,22 мкм. Все стадии приготовления раствора проводили при минимальном воздействии внешнего освещения.
Растворы хранили при температуре 6-10°C в защищенном от света месте. Спектр поглощения раствора 0,41 мг/мл H2Py4BC в 4%-ном Cremophor EL приведен на Фиг.1 (регистрировали относительно 4%-ого раствора Cremophor EL в кювете l=0,02 см).
Пример 3. Оценка стабильности H2Py4BC.
Оценку стабильности ФС проводили с помощью флуоресцентного метода анализа. Растворы для проведения исследований готовили ex tempore, достигая выбранной концентрации (5 мкг/мл) путем последовательных разведений исходного раствора. Концентрация исходного раствора составляла 0,41 мг/мл. В качестве растворителя использовали среду Игла, содержащую 10% ЭТС, и 0,9% раствор NaCl. Регистрацию флуоресценции растворов проводили в динамике контактным способом на лазерном спектральном анализаторе для флуоресцентной диагностики опухолей «ЛЭСА-6» (ТОО «БиоСпек», Россия). Флуоресценцию возбуждали He-Ne лазером при длине волны генерации 632,8 нм, спектральный диапазон от 600 до 950 нм.
На Фиг.2 представлены спектры флуоресценции раствора H2Py4BC в 0,9% растворе NaCl (А) и содержащей 10% ЭТС среде Игла MEM (Б) при инкубации в темновых условиях. Отсутствие изменений в профиле спектра и интенсивности флуоресценции свидетельствует о его стабильности в выбранном временном диапазоне.
Пример 4. Оценка фотостабильности H2Py4BC в бесклеточной среде.
Оценку фотовыцветания проводили в 0,9% растворе хлористого натрия и в среде Игла MEM, содержащей 10% ЭТС, при облучении полихроматическим светом. В качестве источника света использовали галогеновую лампу мощностью 500 Вт с широкополосным фильтром КС-13 (λ≥680 нм) и водным фильтром толщиной 5 см. Световая доза составляла 5 и 10 Дж/см2 при плотности мощности 32,0±1,0 мВт/см2. Измерения флуоресценции проводили контактным способом на лазерном спектральном анализаторе «ЛЭСА-06» в спектральном диапазоне 600-950 нм. Спектры флуоресценции регистрировали сразу после приготовления раствора и после воздействия светом.
При облучении ФС (Фиг.3) в 0,9% растворе NaCl (А) и в среде Игла MEM (Б) наблюдалось лишь незначительное снижение (не более 18-20%) интенсивности флуоресценции (λmax=745±2 нм) без изменений профиля спектра, что свидетельствовало о его фотоустойчивости.
Пример 5. Фотоиндуцированная активность и темновая цитотоксичность H2Py4BC в отношении культуры клеток человека HEp2 и EJ.
Исследования проводили на опухолевых клетках человека. Культуры клеток эпидермоидная карцинома гортаноглотки (HEp2) и карцинома мочевого пузыря (EJ) получены из Института вирусологии им. Д.И. Ивановского РАМН, которые культивировались при 37°C в увлажненной атмосфере, содержащей 5% CO2 (стандартные условия).
Клетки рассевали в лунки плоскодонного 96-луночного микропланшета. Тестируемые соединения вносили в лунки через 24 часа после посева, варьируя концентрацию от 13 до 3200 нМ. Для оценки фототоксичности через 0,5, 2, 4 и 6 часов инкубации с фотосенсибилизатором клетки облучали галогеновой лампой через широкополосный фильтр КС-13 (λ≥680 нм). Плотность мощности составляла 32,0±1,0 мВт/см2, расчетная световая доза - 10 Дж/см2. Также исследования проводили как с удалением ФС из среды перед облучением, так и без удаления.
После облучения клетки инкубировали в течение суток в стандартных условиях. Для оценки цитотоксической активности плашки помещали в затемненные условия на 24 часа. Оценку выживаемости определяли визуально и колориметрическим методом с использованием МТТ-теста. Биологически значимым эффектом считали ингибирование роста клеток в культуре более чем на 50%. Данную величину рассчитывали как среднюю по результатам трех независимых тестов.
Выявлено, что ФС проявил максимальную фотоиндуцированную активность относительно клеток культур HEp2 и EJ при 4-часовой инкубации, ИК50 составляла 32±2 нМ и 35±3 нМ соответственно, с увеличением времени инкубации до 6 часов величина ИК50 не изменялась (Фиг.4). Инкубация клеток с красителем в концентрациях до 3200 нМ в отсутствие светового воздействия в течение 24 часов не влияла на рост клеточных культур.
Удаление ФС из культуральной среды перед воздействием светом незначительно снижало эффективность фотодинамического воздействия (на 15-20%), что свидетельствует о реализации фотоиндуцированной активность преимущественно за счет активации внутриклеточного ФС.
Таким образом, результаты, полученные in vitro, показали, что H2Py4BC накапливается в клетках и обладает высокой фотоиндуцированной активностью.
Пример 6. Распределение H2Py4BC в опухоли S37 и флуоресцентная контрастность относительно окружающей ткани.
Оценку распределения ФС в опухолевой и окружающих тканях проводили у мышей с саркомой S37 в интервале от 5 минут до 48 часов методом локальной флуоресцентной спектроскопии (ЛФС). Фотосенсибилизатор вводили внутривенно в дозе 2,5 мг/кг. Флуоресценцию регистрировали контактным способом на лазерном спектральном анализаторе для флуоресцентной диагностики опухолей и контроля за ФДТ «ЛЭСА-06».
В опухолевой ткани нормированная флуоресценция ФС достигала максимального значения (2,1±0,7 усл. ед.) через 5 минут и сохранялась на высоком уровне в течение 1 часа после введения, а затем к 48 часам снижалась на 95% от максимального значения. Наиболее высокие уровни нормированной флуоресценции в коже (1,8±0,6 усл. ед.) наблюдались через 4 часа после введения ФС, в мышце (3,3±0,3 усл. ед.) - через 5 минут - 2 часа. Максимальная флуоресцентная контрастность ФС относительно окружающих нормальных тканей кожи регистрировалась через 5 минут после введения и составляла 2,3±0,4 усл. ед., а относительно мышцы - 0,9±0,1 усл. ед. через 5 минут и 24 часа после введения.
Пример 7. Фотоиндуцированная противоопухолевая активность H2Py4BC у животных с саркомой S37, привитой подкожно с внешней стороны правого бедра мышам BDF1.
Исследование эффективности фотодинамической терапии проводили на 7 сутки после инокуляции опухоли. ФС вводили животным однократно внутривенно в дозах 0,5, 1,0 и 2,5 мг/кг. Облучение проводили через 0,5 и 2 часа после введения красителя. Для облучения использовали светодиодный источник (ФГУП «ГНЦ «НИОПИК») с длиной волны 754±14 нм и плотностью мощности 150 мВт/см2 (световая доза 150 Дж/см2). Контрольная группа животных без воздействия.
Эффективность ФДТ оценивали, используя общепринятые в экспериментальной онкологии критерии:
- торможение роста опухоли ТРО=[(Vк-Vоп)/Vк]·100%, где Vоп и Vк - объем опухоли в опытной и контрольной группах соответственно;
- увеличение продолжительности жизни УПЖ=[(СПЖоп-СПЖк)/СПЖк]·100%, где СПЖоп и СПЖк - средняя продолжительность жизни в опытной и контрольной группах соответственно;
- критерий излеченности КИ=[Nи/No]·100%, где Nи и Nо - количество излеченных животных и общее количество животных в опытной группе соответственно.
Объем опухоли рассчитывали по формуле: V=d1·d2·d3, где d1, d2 и d3 - три взаимно перпендикулярных диаметра опухоли.
Измерение объема опухоли проводили в течение 21 суток после проведенного облучения с помощью электронного цифрового кронциркуля STORMtm 3C301 «Central». За животными наблюдали 120 суток.
В опытных группах в течение суток после облучения у животных формировался интенсивный отек в зоне воздействия, который сохранялся до 5-15 суток. Биологически значимый противоопухолевый эффект был получен при использовании ФС в дозах 1,0 и 2,5 мг/кг при облучении через 30 минут и 2 часа после введения и достигал 70-100% ТРО (Фиг.5), 25-100% излеченности животных; продолжительность жизни животных увеличивалась на 80-131%. Наиболее высокий противоопухолевый эффект (100% ТРО и 100% КИ) при минимальном повреждающем действии получен при использовании ФС в дозе 2,5 мг/кг и облучении через 2 часа после введения.
Пример 8. Фармакокинетика H2Py4BC у интактных мышей.
Фармакокинетику H2Py4BC изучали методом ЛФС в органах и тканях интактных мышей в дозе 2,5 мг/кг по нормированной флуоресценции (ФН).
Максимум спектра флуоресценции ФС в тканях животных регистрировали при 744±2 нм. Флуоресцирующая форма красителя быстро (в течение 5-30 минут) поступала во внутренние органы и ткани организма, преимущественно в печень, затем ФН снижалась с различной скоростью. Максимальная флуоресценция в крови определялась сразу после внутривенного введения и в течение 4-х часов снижалась на 95% от максимального значения и через сутки уже не регистрировалась.
Во внутренних органах через 24 часа уровень нормированной флуоресценции снижался в печени на 87%, почках - на 90%, селезенке - на 92% от максимального значения. Флуоресцирующая форма ФС в дозе 2,5 мг/кг определялась в почках и селезенке до 2 суток, а в печени остаточное количество определялось до 7 суток.
В коже максимальное значение флуоресценции регистрировалось через 4 часа после введения ФС, затем его нормированная флуоресценция снижалась и через 24 часа составляла 50% от максимального значения и через 5 суток не определялась. Это свидетельствует о быстром элиминировании ФС из кожи. В мышце через 24 часа уровень нормированной флуоресценции также снижался на 82%, а в жировой ткани - на 20%. Флуоресцирующая форма ФС определялась в мышце до 5 суток, а в жировой ткани остаточное количество (26%) регистрировалось более 7 суток.
Полученные данные свидетельствуют о быстрой циркуляции H2Py4BC в организме млекопитающих и его выведении преимущественно через печень с желчью.
Таким образом, тетра-(3-пиридил)бактериохлорин является высокоактивным ФС нового поколения, поглощающим в ближней ИК области спектра (λmax=745±2 нм); является стабильным при хранении и обладает высокой фотостабильностью, проявляет высокую фотоиндуцированную противоопухолевую активность в системах in vitro (при 4-часовой инкубации культур HEp2 и EJ ИК50 составляла 32±2 нМ и 35±3 нМ соответственно) и in vivo (100% ТРО и 100% КИ при применении ФС в дозе 2,5 мг/кг и облучении через 2 часа). ФС обладает быстрым выведением из организма животных (через 24 часа содержание во внутренних органах уменьшается на 87-92% от максимального значения, остаточное количество наблюдается до 7 суток).
Применение мезо-тетра(3-пиридил)бактериохлорина структурной формулы в качестве фотосенсибилизатора ближней ИК области спектра для фотодинамической терапии.