Модифицированный эритропоэтин, к которому присоединена водорастворимая длинноцепочечная молекула
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики и касается фармацевтической композиции, которая содержит эритропоэтин кошки в качестве активного ингредиента, к которому присоединены две или более молекул полиэтиленгликоля с неразветвленной цепью, причем водорастворимая длинноцепочечная молекула имеет молекулярную массу, составляющую не менее 30 кДа и производит гемопоэтический эффект. На композиции основано гемопоэтическое средство и лекарственное средство для лечения анемии. Группа изобретений обеспечивает гемопоэтический эффект, который длится в течение не менее семи дней, при введении человеку и/или животному. 3 н. и 5 з.п. ф-лы, 4 ил., 2 табл., 2 пр.
Реферат
Область техники
Настоящее изобретение относится к фармацевтической композиции, содержащей эритропоэтин, к которому присоединена водорастворимая длинноцепочечная молекула.
Предпосылки создания изобретения
Для облегчения анемии эритропоэтин (с использованием иногда сокращения «EPO»), гормон, который усиливает гемопоэз, продуцируют с помощью методов генетической рекомбинации и используют в качестве фармацевтического продукта, который обеспечивает хорошие результаты при лечении анемии. Было установлено, что присоединение полиэтиленгликоля (с использованием иногда сокращения «ПЭГ»), который является водорастворимой длинноцепочечной молекулой, к EPO человеческого происхождения ингибирует метаболизм EPO в печени, что удлиняет продолжительность существования EPO в крови (патентный документ 1). Вследствие этого эффекта удлинения периода времени нахождения в крови действие лекарственного средства длится дольше, что позволяет снизить частоту введения. Это преимущество привлекло внимание к лекарственным средствам в виде ПЭГ-модифицированных белков, а также ПЭГ-модифицированным формам EPO в качестве фармацевтических продуктов следующего поколения. В действительности, некоторые из них уже вводятся в практическое использование.
При осуществлении модификации белка с использованием ПЭГ белок обычно тем труднее метаболизируется, чем больше молекулярная масса присоединенного ПЭГ или чем больше число присоединенных молекул ПЭГ. По этой причине ожидают, что белок, к которому присоединено большое число высокомолекулярных молекул ПЭГ, после in vivo введения, будет иметь большую продолжительность существования в крови (непатентный документ 1). С другой стороны, в случае таких белков, как EPO, которые проявляют физиологическую активность при связывании с рецептором, по мере увеличения молекулярной массы присоединенных водорастворимых длинноцепочечных молекул и числа таких присоединенных молекул физиологическая активность in vitro уменьшается.
В случае, когда ЕРО с происходящей от человека последовательностью (с использованием иногда сокращения «EPO человека») был модифицирован с использованием ПЭГ, ПЭГ-модифицированный ЕРО, в котором одна молекула ПЭГ присоединена к лизину в положении 52 (с использованием иногда сокращения «моно-ПЭГилированная форма»), как сообщалось, обладает превосходным эффектом продления гемопоэтической активности (на что указывало увеличение ретикулоцитов) после введения в однократной дозе крысам через хвостовую вену (патентный документ 1).
При современном применении препараты ЕРО человека вводят внутривенным, подкожным, внутримышечным и другими способами. Были предприняты дополнительные попытки разработать, например, пероральные и абсорбируемые через слизистую оболочку носа препараты (патентный документ 2). Внутрисосудистое введение препаратов ЕРО человека не имеет широкой применимости. Отсюда существует необходимость в отношении препаратов ЕРО, которые вводят более простым способом, накладывают на пациента незначительную нагрузку, например, вызывают меньшую боль, после инъекции и, сверх того, обладают длительной эффективностью лекарственного средства.
Симптомы анемии, вызванные такими причинами, как хроническая почечная недостаточность, химиотерапия и хирургическое вмешательство, которые в соответствии с сообщениями встречаются у человека, также отмечаются у домашних животных, таких как собаки и кошки, и часто являются причинами смерти таких животных. Например, среди кошек (в Японии) коэффициент заболеваемости хронической почечной недостаточностью заметно возрос с 0,64% до 3,95% за десятилетний период, начиная с 1996, поднявшись с 28-го места на 4-е место при ранжировании заболеваний (непатентный документ 2). Препараты ЕРО человека терапевтически используются также для лечения анемии у животного. Однако, поскольку физиологически активные белки, такие как ЕРО, имеют видоспецифические аминокислотные последовательности, в случае введения отличным от человека животным препаратов ЕРО человеческого происхождения существует риск индукции экспрессии антител против ЕРО. В результате в настоящее время проводятся исследования по разработке препаратов ЕРО, каждый из которых имеет аминокислотную последовательность, специфичную для конкретного вида, для лечения кошек или собак.
Патентный документ 1: WO 02/32957
Патентный документ 2: JP-A S62-89627
Непатентный документ 1: “Polyethylene glycol-conjugated pharmaceutical proteins”, PSTT, Vol.1, № 8, 352-356 (1998).
Непатентный документ 2: Tama Jūi Rinshō Kenkyūkai Chōsa Hōkoku (2006 Nendo) [2006 Report on Survey of Tama Veterinary Clinics Association].
Краткое изложение сущности изобретения
Задача настоящего изобретения состоит в обеспечении фармацевтической композиции, которая содержит ЕРО в качестве активного ингредиента, имеет высокий уровень безопасности in vivo, несмотря на наличие высокой физиологической активности, и имеет особенность, состоящую в том, что после введения человеку и/или животному она вызывает гемопоэтический эффект, который длится в течение не менее семи дней.
Авторы настоящего изобретения провели тщательные исследования в отношении химической модификации ЕРО с использованием ПЭГ, в результате которых они установили, что в зависимости от числа присоединенных молекул ПЭГ и молекулярной массы или структуры ПЭГ гемопоэтический эффект длится в течение не менее семи дней. Полученные результаты были положены в основу настоящего изобретения.
Соответственно, настоящее изобретение относится к фармацевтической композиции, включающей эритропоэтин, к которому присоединены две или более водорастворимых длинноцепочечных молекул, в которой количество указанного эритропоэтина составляет не менее 50% от общего содержания эритропоэтина.
Настоящее изобретение, кроме того, относится к фармацевтической композиции, содержащей эритропоэтин, к которому присоединена водорастворимая длинноцепочечная молекула, причем водорастворимая длинноцепочечная молекула имеет молекулярную массу, составляющую не менее 30 кДа.
Настоящее изобретение, более того, относится к фармацевтической композиции, содержащей эритропоэтин, к которому присоединена водорастворимая длинноцепочечная молекула, причем водорастворимая длинноцепочечная молекула имеет разветвленную цепь.
Предпочтительно водорастворимая длинноцепочечная молекула представляет собой не менее одного соединения, выбранного из группы, состоящей из полиэтиленгликоля, полиаминокислот и полипропиленгликоля.
Фармацевтическая композиция предпочтительно обладает гемопоэтическим эффектом при введении человеку и/или животному, который длится в течение не менее семи дней, и животные являются предпочтительно животными семейства Felidae и/или семейства Canidae.
Предпочтительно фармацевтическая композиция является раствором или гелем, раствором или гелем с рН, равным не менее 4, но не более 8.
Предпочтительно раствор составляют так, что он имеет осмотическое давление и рН, по существу одинаковые с таковыми, которые имеют жидкости в организме млекопитающих, чтобы не вызывать боль после введения.
Предпочтительно эритропоэтин имеет происходящую от человека, кошки или собаки аминокислотную последовательность.
Предпочтительно эритропоэтином является следующий полипептид из (а)-(с):
(а) полипептид, имеющий аминокислотную последовательность, определенную в SEQ ID NO:1;
(b) полипептид, который имеет аминокислотную последовательность, идентичную на не менее 70% аминокислотной последовательности, определенной в SEQ ID NO:1, и обладает активностью эритропоэтина в анализе пролиферации клеток с использованием клеток BaF/EPOR; или
(c) полипептид, который имеет одну или множество замен, делеций, вставок и/или добавлений аминокислот относительно аминокислотной последовательности, определенной в SEQ ID NO:1, и обладает активностью эритропоэтина в анализе пролиферации клеток с использованием клеток BaF/EPOR.
Предпочтительно не менее чем одно место присоединения полиэтиленгликоля представляет собой остаток лизина-78.
Даже после неоднократного введения фармацевтическая композиция предпочтительно не вызывает продукцию антитела против эритропоэтина.
Настоящее изобретение, кроме того, относится к лекарственному средству для лечения анемии и гемопоэтическому средству, каждое из которых включает вышеприведенную фармацевтическую композицию.
В результате введения фармацевтической композиции настоящего изобретения человеку или животному гемопоэтический эффект может длиться в течение не менее семи дней. Фармацевтическая композиция настоящего изобретения, в случае введения препарата, накладывает на пациента незначительную нагрузку, например, вызывает меньшую боль, после инъекции и, сверх того, обладает длительной эффективностью лекарственного средства.
Краткое описание чертежей
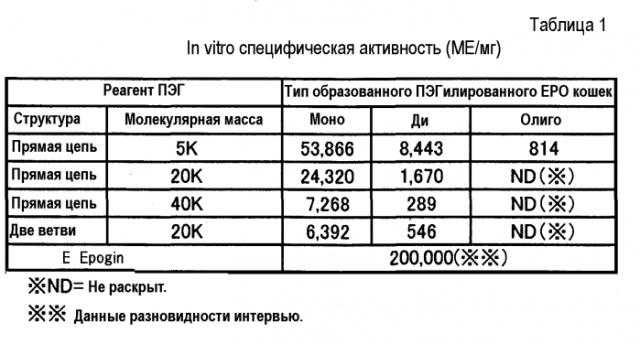
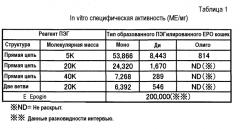
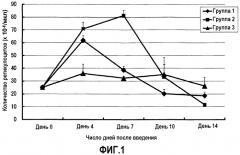
На фиг.1 сравниваются гемопоэтические эффекты, вызванные введением крысам ПЭГ-модифицированных ЕРО кошек, к которым были присоединены различные количества молекул ПЭГ с неразветвленной цепью, который имеет молекулярную массу, равную 20000.
На фиг.2 сравниваются гемопоэтические эффекты, вызванные введением крысам ПЭГ-модифицированных ЕРО кошек, к которым были присоединены различные количества молекул ПЭГ с неразветвленной цепью, который имеет молекулярную массу, равную 5000 (контролем служил моно-ПЭГилированный ЕРО кошек, к которому была присоединена одна молекула ПЭГ с неразветвленной цепью, который имеет молекулярную массу, равную 20000).
На фиг.3 сравниваются гемопоэтические эффекты, вызванные введением крысам ПЭГ-модифицированных ЕРО кошек, к которым была присоединена одна или две молекулы ПЭГ с неразветвленной цепью, который имеет молекулярную массу, равную 40000 (контролем служил моно-ПЭГилированный ЕРО кошек, к которому была присоединена одна молекула ПЭГ с неразветвленной цепью, который имеет молекулярную массу, равную 20000).
На фиг.4 сравниваются гемопоэтические эффекты, вызванные введением крысам ПЭГ-модифицированных ЕРО кошек, к которым была добавлена одна или две молекулы ПЭГ с разветвленной цепью, который имеет молекулярную массу, равную 20000 (контролем служил моно-ПЭГилированный ЕРО кошек, к которому была присоединена одна молекула ПЭГ с неразветвленной цепью, который имеет молекулярную массу, равную 20000).
Лучший вариант осуществления изобретения
1. Настоящее изобретение относится к трем фармацевтическим композициям.
Первый аспект настоящего изобретения относится к фармацевтической композиции, содержащей в количестве, равном не менее 50% от общего содержания эритропоэтина, эритропоэтин (с использованием иногда сокращения «EPO»), к которому присоединены две или более водорастворимых длинноцепочечных молекул.
В первом аспекте настоящего изобретения число водорастворимых длинноцепочечных молекул, присоединенных к ЕРО, равно двум или более, при этом предпочтительными являются две молекулы. Дополнительно может содержаться ЕРО, к которому присоединена одна водорастворимая длинноцепочечная молекула. Однако, с точки зрения продолжительности гемопоэтического эффекта, ЕРО, к которому присоединены две или более водорастворимых длинноцепочечных молекул, является предпочтительно основным компонентом, более предпочтительно составляет не менее 50% и даже более предпочтительно составляет не менее 70% от общего содержания ЕРО.
Здесь процент ЕРО, к которому присоединены две или более водорастворимых длинноцепочечных молекул, на основе общего содержания ЕРО, рассчитывают путем определения интенсивности флуоресценции полос, полученной при окрашивании с применением флуоресцентных веществ, которое следует за разделением с помощью электрофореза в SDS-ПААГ.
То, что ЕРО, к которому присоединены две или более водорастворимых длинноцепочечных молекул, является основным компонентом в общем ЕРО, означает, что ЕРО, к которому присоединены две или более водорастворимых длинноцепочечных молекул, демонстрирует самую интенсивную полосу в SDS-ПААГ. Здесь выражение «демонстрирует самую интенсивную полосу в SDS-ПААГ» означает, что при выявлении белков, содержащихся в образце, подвергнутом электрофорезу в SDS-ПААГ, с помощью окрашивания с применением флуоресцентных веществ, применяя, например, SYPRO Ruby или т.п., интенсивность сигнала от ЕРО, к которому присоединены две или более водорастворимых длинноцепочечных молекул, выше интенсивности других сигналов.
Для определения того, является ли ЕРО, к которому присоединены две или более водорастворимых длинноцепочечных молекул, основным компонентом в общем ЕРО, может также использоваться HPLC. Например, образец, проходящий через колонку, например, YMC Pack Diol-200 (в наличии на рынке от YMC Co., Ltd.), выявляют посредством измерения оптической плотности, и можно определить, что интенсивность сигнала от ЕРО, к которому присоединены две или более водорастворимых длинноцепочечных молекул, выше интенсивности других сигналов.
С точки зрения продолжительности гемопоэтического эффекта, молекулярная масса водорастворимой длинноцепочечной молекулы предпочтительно равна не менее 10 кДа и более предпочтительно не менее 20 кДа. При менее 5 кДа гемопоэтический эффект обычно не длится долго.
Второй аспект настоящего изобретения относится к фармацевтической композиции, содержащей EPO, к которому присоединена водорастворимая длинноцепочечная молекула, причем водорастворимая длинноцепочечная молекула имеет молекулярную массу, равную не менее 30 кДа.
Во втором аспекте настоящего изобретения число водорастворимых длинноцепочечных молекул, присоединенных к ЕРО, не подвержено какому-либо особому ограничению и может быть равно одной молекуле или может быть равно двум или более молекулам.
С точки зрения продолжительности гемопоэтического эффекта, молекулярная масса водорастворимой длинноцепочечной молекулы предпочтительно равна не менее 30 кДа и более предпочтительно не менее 40 кДа. При менее 20 кДа гемопоэтический эффект обычно не длится долго.
Третий аспект настоящего изобретения относится к фармацевтической композиции, содержащей EPO, к которому присоединена водорастворимая длинноцепочечная молекула, причем водорастворимая длинноцепочечная молекула имеет разветвленную цепь. Под выражением «водорастворимая длинноцепочечная молекула имеет разветвленную цепь», подразумевается, что число ветвей равно двум или более, при этом число точек ветвления равно двум или более.
В случаях, когда водорастворимая длинноцепочечная молекула является разветвленной цепью, число водорастворимых длинноцепочечных молекул, присоединенных к ЕРО, не подвержено какому-либо особому ограничению. Даже в случаях, когда число присоединенных водорастворимых длинноцепочечных молекул равно одной молекуле, гемопоэтический эффект, вызываемый при введении фармацевтической композиции, как обнаруживается, длится в течение не менее семи дней. Способ присоединения ПЭГ, имеющего разветвленную цепь, описан в JP-T H9-504299.
Ниже описываются водорастворимая длинноцепочечная молекула, способ и эффект введения, контейнер и эритропоэтин в вышеприведенных фармацевтических композициях.
2. Водорастворимая длинноцепочечная молекула
Водорастворимую длинноцепочечную молекулу присоединяют к ЕРО с целью ингибирования метаболизма и улучшения кинетики, характеризующегося удлинением времени нахождения в крови. Водорастворимая длинноцепочечная молекула не подвержена какому-либо особому ограничению, и ее примеры включают полиэтиленгликоль (ПЭГ), полиаминокислоты и полипропиленгликоль. Использование такой молекулы может включать приготовление промежуточного продукта реакции с последующим присоединением к белку в ходе реакции синтеза. Для продуцирования белков, с которыми связаны эти молекулы, могут также использоваться методы генетической рекомбинации. Из вышеуказанных молекул ПЭГ не обладает антигенностью и является нетоксичным, и, следовательно, эффективен также в отношении снижения антигенности модифицированного белка и подавления экспрессии антител против ЕРО в качестве побочного эффекта.
Способы ковалентного связывания ПЭГ с белком, как правило, включают химическую реакцию с белком или с активируемой при окислении функциональной группой на его цепи из сахаров, такой как полиол, лактол, амин, карбоновая кислота или производное карбоновой кислоты. Также существуют способы, в которых используется активированный с помощью эфира сульфокислоты полимер, такой как активированный с помощью эфира сульфокислоты ПЭГ. В случае присоединения к ЕРО также возможно присоединение с помощью таких способов.
Промежуточные продукты реакции ПЭГилирования, которые могут использоваться, включают длинноцепочечные молекулы, которые были метоксилированы на одном конце. Кроме того, были разработаны промежуточные продукты, которые этерифицированы при использовании сукцинимидил-жирной кислоты на другом неметоксилированном конце ПЭГ; из них те, в которых частью в виде жирной кислоты является пропионовая кислота или масляная кислота, являются предпочтительными с точки зрения реакционной способности. Когда образованный сукцинимидил-пропионовой кислотой эфир метокси-ПЭГ (с использованием сокращения «SPA-ПЭГ») вступает в реакцию ЕРО человека, присоединение, как известно, происходит избирательно к остаткам лизина. Поскольку в ЕРО присутствует множество остатков лизина, по мере развития реакции число присоединенных молекул ПЭГ увеличивается, что приводит к смеси изомеров, имеющих различные количества присоединенных молекул.
Сообщалось, что в результатах, полученных после введения однократной дозы ЕРО человека крысам через хвостовую вену, моно-ПЭГилированная форма, в которой одна молекула ПЭГ (20 кДа) присоединена к лизину 52, производила самый длительный гемопоэтический эффект; однако оптимальное соотношение изомеров или компонентов смеси зависит от вида животного, от которого происходит ЕРО, и способа введения. И ПЭГ-модифицированный ЕРО, в котором число присоединенных молекул ПЭГ равно одному, и ПЭГ-модифицированный ЕРО, в котором число присоединенных молекул ПЭГ равно двум или более, можно вводить отдельно или можно вводить в смеси.
Место присоединения ПЭГ к белку ЕРО будет, вероятно, зависеть от вида, от которого происходит ЕРО, и типа реакции. Однако даже в случаях присоединения множества молекул ПЭГ предпочтительно, чтобы не менее одного места присоединения было остатком лизина, соответствующим лизину 52 в ЕРО человека. Например, в ЕРО кошек, имеющем последовательность, определенную в SEQ ID NO:1, предпочтительным является присоединение к лизину 78.
3. Способ и эффект введения
Таким образом, ЕРО-содержащая фармацевтическая композиция настоящего изобретения производит гемопоэтический эффект при введении человеку и/или животному, который длится в течение не менее семи дней.
Что касается гемопоэтического эффекта, соотношение ретикулоцитов (предшественников эритроцитов) и эритроцитов можно количественно определить и использовать в качестве показателя гемопоэтической активности после введения фармацевтической композиции настоящего изобретения. Количество ретикулоцитов можно определить с использованием мазка из шейки матки, используя красящее вещество или краску, или с использованием автоматического счетчика форменных элементов крови.
Субъект, подходящий для введения фармацевтической композиции, не подвержен какому-либо особому ограничению; введение может осуществляться человеку, а также животному, отличному от человека. На отличных от человека животных особое ограничение не налагается, хотя предпочтительными являются животные семейства Felidae и/или семейства Canidae. Как будет описано позже, при использовании происходящего от кошек ЕРО для животных семейства Felidae и семейства Canidae вероятность того, что ЕРО будет действовать как антиген, низка, что позволяет избежать возникновения побочных эффектов.
Способы введения фармацевтической композиции включают, но без особого ограничения, внутривенное, подкожное, пероральное, внутримышечное, чрескожное и назальное введения.
ПЭГ-модифицированный ЕРО в настоящем изобретении может использоваться с веществом, выбираемым из фармакологически приемлемых наполнителей, вызывающих дезинтеграцию агентов и связующих веществ.
Примеры наполнителей включают крахмал, агар, сахарозу, лактозу, глюкозу, декстрин, сорбит, аравийскую камедь, кукурузный крахмал, маннит, кристаллическую целлюлозу, лецитин, фосфат кальция и сульфат кальция. Могут также использоваться фармацевтически приемлемые наполнители, отличные от этих.
Примеры вызывающих дезинтеграцию агентов включают крахмал, агар, цитрат кальция, карбонат кальция, гидрокарбонат натрия, декстрин, кристаллическую целлюлозу, карбоксиметилцеллюлозу и трагакант. Могут также использоваться фармацевтически приемлемые вызывающие дезинтеграцию агенты, отличные от этих.
Примеры связующих веществ включают крахмал и производные крахмала, целлюлозу и производные целлюлозы, аравийскую камедь, трагакант, желатин, сахара, этанол и поливиниловый спирт. Могут также использоваться фармацевтически приемлемые связующие вещества, отличные от этих.
ПЭГ-модифицированный ЕРО в настоящем изобретении может использоваться с веществом, выбираемым из стабилизаторов, модификаторов рН, модификаторов осмотического давления и поверхностно-активных веществ.
Примеры стабилизаторов включают аминокислоты. Здесь используемые в качестве стабилизаторов аминокислоты могут быть в форме кристаллов или могут быть аморфными. Альтернативно могут использоваться аминокислоты, которые включают примеси, такие ингредиенты растений или животных с высокой степенью таких аминокислот. Используемые кристаллы могут быть в L-форме, D-форме или в виде смеси L- и D-форм.
Примеры модификаторов рН включают буферные системы, выбираемые из группы, состоящей из уксусной кислоты/ацетата, яблочной кислоты/малата, лимонной кислоты/цитрата, винной кислоты/тартрата, молочной кислоты/лактата, фосфорной кислоты/фосфата, глицина/глицината, Трис, глутаминовой кислоты/глутамата и карбоната натрия, и другие буферные системы. Нижний предел рН геля или раствора, содержащего ЕРО, предпочтительно равен 4, более предпочтительно 4,5 и даже предпочтительнее 5. Верхний предел рН предпочтительно равен 8, более предпочтительно 7,5 и даже предпочтительнее 7.
Примеры модификаторов осмотического давления включают, но без ограничения, соли, сахара, спирты и аминокислоты. В частности, соответственно можно использовать хлорид натрия, многоатомные спирты, одноатомные спирты, моносахариды, дисахариды, олигосахариды и аминокислоты, а также их производные.
Примеры многоатомных спиртов, которые могут использоваться, включают трехатомные спирты, такие как глицерин, пятиатомные спирты, такие как арабит, ксилит и адонит, и шестиатомные спирты, такие как маннит, сорбит и дульцит. Из них предпочтительными являются шестиатомные спирты, а особенно подходящим для применения является маннит.
Примеры одноатомных спиртов включают метанол, этанол и изопропиловый спирт. Из них этанол является предпочтительным.
Примеры моносахаридов, которые могут использоваться, включают сахара с состоящим из пяти атомов углеродным скелетом (пентозы), такие как арабиноза, ксилоза, рибоза и 2-дезоксирибоза, и сахара с состоящим из шести атомов углеродным скелетом (гексозы), такие как глюкоза, фруктоза, галактоза, манноза, сорбоза, рамноза и фукоза. Из них предпочтительными являются сахара с состоящим из шести атомов углеродным скелетом.
Примеры олигосахаридов, которые могут использоваться, включают трисахариды, такие как мальтотриоза и раффиноза, и тетрасахариды, такие как стахиоза. Из них предпочтительными являются трисахариды.
Примеры производных этих моносахаридов, дисахаридов и олигосахаридов, которые могут использоваться, включают глюкозамин, галактозамин, глюконовую кислоту и галактуроновую кислоту.
Кроме того, поверхностно-активное вещество может содержаться вместе с ПЭГ-модифицированным ЕРО в настоящем изобретении. Приводимые в качестве примеров поверхностно-активные вещества включают анионные поверхностно-активные вещества, неионные поверхностно-активные вещества, амфотерные поверхностно-активные вещества и катионные поверхностно-активные вещества, хотя возможности не ограничиваются этими веществами. Приводимые в качестве примеров анионные поверхностно-активные вещества включают, но без ограничения, анионные поверхностно-активные вещества на основе жирных кислот, анионные поверхностно-активные вещества на основе линейных алкилбензолов, анионные поверхностно-активные вещества на основе высших спиртов, анионные поверхностно-активные вещества на основе α-олефинов и анионные поверхностно-активные вещества на основе нормальных парафинов. Приводимые в качестве примеров неионные поверхностно-активные вещества включают, но без ограничения, неионные поверхностно-активные вещества на основе жирных кислот, неионные поверхностно-активные вещества на основе высших спиртов и неионные поверхностно-активные вещества на основе алкилфенолов. Иллюстративные неограничивающие примеры неионных поверхностно-активных веществ включают полисорбат и/или алкиловые эфиры полиоксиэтиленгликольсорбитана. Приводимые в качестве примеров амфотерные поверхностно-активные вещества включают, но без ограничения, амфотерные поверхностно-активные вещества на основе аминокислот, бетаинов или аминоксидов. Приводимые в качестве примеров катионные поверхностно-активные вещества включают, но без ограничения, катионные поверхностно-активные вещества на основе четвертичных аммониевых солей.
Эти указанные выше наполнители, вызывающие дезинтеграцию агенты, связующие вещества, стабилизаторы, модификаторы рН, модификаторы осмотического давления и поверхностно-активные вещества можно неограниченно сочетать. Кроме того, могут быть добавлены фармацевтически приемлемые добавки, отличные от наполнителей, вызывающих дезинтеграцию агентов, связующих веществ, стабилизаторов, модификаторов рН, модификаторов осмотического давления и поверхностно-активных веществ. Их примеры включают смазывающие вещества, покровные вещества, красители, диспергаторы, активаторы всасывания, солюбилизаторы, материалы для диетических пищевых продуктов, материалы для пищевых добавок, витамины, ароматизирующие вещества, подсластители, антисептики, консерванты и антиоксиданты.
Для получения фармацевтического препарата ингредиенты можно сформировать в виде раствора, геля или порошка и впоследствии перевести в препарат типа раствора, лиофилизированный препарат, предварительно наполненный шприц, препарат с замедленным высвобождением для подкожной имплантации, мицельный препарат, гелевый препарат или липосомный препарат, например.
Когда ЕРО-содержащая фармацевтическая композиция используется в виде раствора, важно составить раствор так, чтобы он имел осмотическое давление и рН, одинаковые с таковыми жидкости в организме млекопитающих (осмотическое давление: 280 мОсм/кг Н2О; рН 7,4), чтобы не вызывать боль во время подкожного введения. Когда ЕРО-содержащая фармацевтическая композиция используется в виде раствора, композиции, имеющие осмотическое давление, не превышающее 400 мОсм/кг Н2О, могут соответственно использоваться в настоящем изобретении. Также могут соответственно использоваться композиции, имеющие осмотическое давление, составляющее не менее 200 мОсм/кг Н2О.
4. Контейнер
Поскольку ЕРО эффективен in vivo даже после введения в небольшой дозе, потери в результате адсорбции препарата к стенке контейнера оказывают большое влияние на фактическую активность после введения in vivo. Поэтому контейнером для этого препарата предпочтительно является полимерный продукт, к которому адсорбируется незначительное количество белка. Соответственно, желательно выбирать материал для контейнера, исходя из условия, чтобы адсорбция ЕРО к контейнеру не превышала 1% от общего количества ЕРО в контейнере. Предпочтительно выбирать материал исходя из условия, чтобы такая адсорбция предпочтительно не превышала 0,7% и более предпочтительно 0,5%.
На полимерные материалы, которые, как известно, характеризуются низкой адсорбцией белков, особое ограничение не налагается. Их примеры включают материалы для контейнеров для терапевтического применения, такие как полиэтилен (РЕ), полипропилен (РР), полиэтилентерефталат (РЕТ), поликарбонат и полиэтилметакрилат. Предпочтительные примеры полимерных материалов, которые, как известно, характеризуются низкой адсорбцией белков, включают полимеры, которые представляют собой полимеры, полученные в результате полимеризации с открытием кольца циклоолефина, такого как норборнен, тетрациклододецен или его производное, и продукты гидрирования этих полимеров; и сополимеры, в молекулярную цепь которых циклопентильный остаток или замещенный циклопентильный остаток включен при полимеризации циклоолефина, такого как норборнен, тетрациклододецен или его производное, с этиленом или пропиленом. Циклоолефиновые сополимеры (СОС), которые представляют собой сополимеры, полученные из тетрациклододецена и олефина, такого как этилен, в качестве исходных материалов предпочтительнее, поскольку они характеризуются низкой адсорбцией. Кроме того, также предпочтительными являются циклоолефиновые полимеры (СОС), которые представляют собой полимеры, полученные в результате полимеризации с открытием кольца норборнена, а затем гидрирования (см. JP-A H5-300939 или JP-A H5-317411).
5. Аминокислотная последовательность ЕРО
Аминокислотная последовательность ЕРО может быть последовательностью, происходящей из любого организма. Было осуществлено клонирование кДНК для ЕРО, например, мышей, крыс, собак и кошек, так же, как и человека (Wen et al. Blood 82, 1507 (1993)), и были выяснены аминокислотные последовательности, кодирующие эти ЕРО. В этом изобретении можно использовать не только ЕРО человека, но также ЕРО, имеющие аминокислотные последовательности, специфичные для видов, отличных от человека.
Предпочтительно аминокислотной последовательностью ЕРО в настоящем изобретении является аминокислотная последовательность, происходящая от человека, или аминокислотная последовательность, происходящая от животного отряда Carnivora. В отряде Carnivora семейство Felidae и семейство Canidae являются предпочтительными, при этом семейство Felidae является более предпочтительным.
Известно, что ЕРО кошек идентичен по последовательности ЕРО человека на 83,4%. Также ЕРО кошек, экспрессированный в клетках СНО, обладает гемопоэтической активностью у кошек (Am. J. Vet. Res. 64, 1465-71 (2003)).
Причины анемии, как известно, включают обширное кровоизлияние, витаминную недостаточность, аутоиммунные заболевания, злокачественные опухоли, хроническое воспаление, хроническую почечную недостаточность, гемолиз и нарушение гемопоэза. Анемия, вызванная этими причинами, наблюдается не только у человека, но также у домашних животных, таких как собаки и кошки, у домашнего скота, такого как крупный рогатый скот, лошади, овцы, козы и свиньи, и даже у таких животных, как львы, тигры, кенгуру, слоны, жирафы, зебры, коалы и панды, которых выращивают и публично выставляют ради экологического исследования в зоологических садах и т.п. Такие случаи анемии можно лечить ЕРО, используемым в настоящем изобретении. ЕРО кошек можно использовать для лечения анемии у животных семейства Felidae, таких как кошки, львы и тигры. Кроме того, ЕРО кошек идентичен в высокой степени по последовательности ЕРО собак и также эффективен у собак и других животных семейства Canidae, которое относится таксономически к отряду Carnivora.
В отличие от человека, из-за отсутствия системы запаса консервированной крови для переливания вышеуказанным животным трудно принимать меры в виде инфузии крови, например в случае потери крови вследствие травмы или во время хирургического вмешательства. Однако для таких животных можно применять, либо вместо переливания, или во время капельной инфузии, препарат ЕРО настоящего изобретения, который производит длительный гемопоэтический эффект. Если животное чувствует боль во время введения, это может помешать введению, и в случае крупных животных может даже представлять опасность для ветеринара. Однако боль можно минимизировать посредством установки осмотического давления и рН на значения, близкие к значениям в жидкости в организме рассматриваемого животного.
Предпочтительно аминокислотной последовательностью ЕРО, происходящего от животных семейства Felidae, является аминокислотная последовательность, определенная в SEQ ID NO:1.
В ЕРО настоящего изобретения также включен полипептид, имеющий аминокислотную последовательность, идентичную на не менее 70% аминокислотной последовательности, составляющей ЕРО, представленной в SEQ ID NO:1.
Идентичность последовательности полипептида ЕРО аминокислотной последовательности, определенной в SEQ ID NO:1, составляет предпочтительно не менее 70%, более предпочтительно не менее 80%, даже более предпочтительно не менее 85%, еще более предпочтительно не менее 90% и наиболее предпочтительно не менее 95%.
Альтернативно, ЕРО может быть полипептидом, в котором была замещена, делетирована, вставлена и/или добавлена одна или множество аминокислот при условии, что гемопоэтическая активность не утрачивается. Число таких внесенных изменений предпочтительно не превышает 50, более предпочтительно не превышает 40, даже более предпочтительно не превышает 30, еще более предпочтительно не превышает 20 и наиболее предпочтительно не превышает 10.
Что касается способа продуцирования ЕРО, помимо рекомбинантно продуцируемого ЕРО, который продуцируют с использованием общедоступных клеток животных (например, клеток СНО), прокариотических организмов или дрожжей в качестве хозяев, могут также использоваться такие ЕПО, как те, которые получены из природного источника, и те, которые продуцированы в рекомбинантных животных, хотя возможности не ограничиваются этими ЕРО. Могут также использоваться трансгенные птицы в качестве рекомбинантных животных, которые продуцируют ЕРО. Подходящим является либо очищенный продукт, либо продукт в неочищенном состоянии, хотя очищенный продукт является предпочтительным с точки зрения контроля качества.
Очистку ЕРО можно выполнить, используя распространенные методы получения белков, такие как высаливание, адсорбционная хроматография на колонке, ионообменная хроматография на колонке, гельфильтрационная хроматография на колонке и осуществляемые на колонках методы с использованием антител, либо отдельно, либо в комбинации, хотя возможности не ограничиваются этими методами. Примеры адсорбционной хроматографии на колонке включают хроматографию на голубой сефарозе и хроматографию на гепарин-сефарозе. Примеры ионообменной хроматографии на колонке включают катионообменную хроматографию и анионообменную хроматографию.
ПРИМЕРЫ
Настоящее изобретение описывается подробнее в виде следующих примеров, хотя настоящее изобретение не ограничивается этими примерами. Кроме случаев, оговоренных особо, при упоминании торговых названий следовали инструкциям в сопроводительном руководстве для пользователя.
Синтез происходящего от кошек эритропоэтина осуществляли с помощью процесса, описанного в JP-A 2007-89578. Стадии этого процесса изложены еще раз ниже.
Пример приготовления 1
Микроинъекция ретровирусного вектора в куриный эмбрион и искусственное выведение цыплят в инкубаторе
Ретровирусный вектор для экспрессии происходящего от кошек эритропоэтина микроинъецировали в куриный эмбрион, получая таким образом трансгенного цыпленка, который экспрессирует происходящий от кошек эритропоэтин. Микроинъецирование и искусственное выведение цыплят в инкубаторе осуществляли в асептических условиях. Оплодотворенные куриные яйца (в наличии на рынке от Shiroyama Shukeijo) дезинфицировали снаружи дезинфицирующим средством (в наличии на рынке от Showa Furanki) и этанолом. Инкубатор (модель Р-008(В), в наличии на рынке