Способ микроскопического исследования нативного соскоба корня языка
Иллюстрации
Показать всеИзобретение относится к микробиологии, а именно к способу микроскопического исследования нативного соскоба слизистой корня языка. Сущность способа состоит в том, что деревянным шпателем забирают 0,5 мл биоматериала из глубокого соскоба со слизистой на границе задней трети спинки и корня языка, готовят два мазка на двух предметных стеклах площадью 1,5-2,0 см2, мазки высушивают 20 минут, осуществляют фиксацию мазка жаром в пламени спиртовки непрерывно в течение 5-6 секунд, окрашивают сложным дифференциальным методом Грама, микроскопируют с иммерсией при объективе х100, просматривают не менее 10 полей зрения на каждом стекле, учитывая количественные и качественные характеристики микроорганизмов, клеток и ядер эпителия. Изобретение позволяет осуществить более точное исследование нативного соскоба c языка. 4 ил., 1 табл., 2 пр.
Реферат
Изобретение относится к медицине, в частности к микробиологии, и может быть использовано в стоматологии, терапии, педиатрии, дерматологии.
Микрофлора полости рта является важной составляющей, необходимой для здоровья человека. В настоящее время известно, что с изменением качественного и количественного состава микробиома полости рта связано развитие кариеса, специфических и неспецифических воспалительных процессов полости рта, многих заболеваний, включая неврологические и сердечно-сосудистые (Боровский Е.В., Машкиллейсон А.Л. Заболевания слизистой оболочки полости рта и губ. - М.: Медицина, 1994. - 297 с; Терапевтическая стоматология: национальное руководство /под ред. Проф. Л.А. Дмитриевой, проф. Ю.М. Максимовского «ГЭОТАР - Медиа», 2009. - 912 с; Янушевич О.О., Гринин В.М., Почтаренко В.А., Рунова Г.С. Заболевания пародонта. Современный взгляд на клинико-диагностические и лечебные аспекты/ под ред. О.О. Янушевича. - М.: ГЭОТАР-Медиа, 2010. - 160 с). Однако использование микроскопических методов исследования как клинической лабораторной диагностики заболеваний полости рта, ограничено. В последние годы предпочтение отдается культуральным/микробиологическим методам исследования микрофлоры полости рта из патологического очага (Николаев А.И., Цепов Л.М. Практическая терапевтическая стоматология. - М.: МЕДпресс-информ, 2010. - 924 с).
Но недостатком культурального/микробиологического исследования микрофлоры полости рта является:
- его высокая стоимость;
- трудоемкость методики;
- невыполнение правил забора и транспортировки биологического материала снижает качество результатов;
- требование создания как аэробных, так и анаэробных условий культивирования увеличивает стоимость расходных материалов;
- наличие в составе микроорганизмов полости рта трудно культивируемых и некультивируемых форм не позволяет выделять их и изучать свойства.
Кроме того, с целью диагностики и профилактики заболеваний внедряются новые молекулярно-генетические методы исследования микрофлоры полости рта: ПНР, секвенирование, генотипирование.
Но недостатком их является:
- доступность метода в крупных и хорошо оснащенных центрах, НИИ;
- высокая стоимость оборудования и расходных материалов;
- значительная затрата времени на исследование;
- требование высокой квалификации обученного персонала.
Известны способы микроскопического исследования окрашенных препаратов соскоба слизистой оболочки спинки языка, применяемые в стоматологии для диагностики лептотрихиоза полости рта (Боровский Е.В., Чумаков А.А., Миренова Л.Г. Диагностика и лечение лептотрихоза слизистой полости рта: методические рекомендации. - М.: ММСИ имени Н.А. Семашко, 1987. - 4 с). По данной методике берут соскоб металлическим стоматологическим инструментом/шпателем и наносят на предметное стекло. После высушивания на воздухе 20 минут проводится фиксация мазка смесью Никифорова 20-30 минут. На высушивание и окрашивание по Романовскому-Гимзе официнальной смесью азура и эозина требуется 40 минут. Дальнейшее промывание и высушивание - 20 минут и микроскопия с увеличением ×40, затем ×100.
Но недостатком этого микроскопического метода исследования окрашенного мазка из флоры полости рта является:
- затраты времени на фиксацию, окрашивание и высушивание мазка не менее 120 минут;
- недоступность эфира для приготовления смеси Никифорова;
- использование одного предметного стекла снижает качество приготовления мазка заданной толщины;
- невозможность морфологической дифференциации химической структуры клеточной стенки, то есть принадлежности микроба к грам+ или грам- бактериям;
- необходимость делать соскоб с языка в кабинете стоматолога специальными инструментами.
Известен также негативный способ микроскопического исследования соскоба слизистой оболочки спинки языка, других слизистых полости рта, применяемый в дерматологии для лабораторной диагностики лептотрихиоза и грибковой инфекции полости рта (Клиническая дерматовенерология: в 2 т. / под ред. Ю.К. Скрипкина, Ю.С. Бутова. - М.: ГЭОТАР-Медиа, 2009. - Т.1. - 720 с.). Делают соскоб с языка металлическим шпателем, наносят на предметное стекло, не высушивая, смешивают с каплей 10% раствора щелочи - КОН (калиевой) или NaOH (натриевой) и накрывают покровным стеклом. Препарат немедленно изучают под микроскопом с увеличением ×10 и ×40.
Но недостатком этого микроскопического метода исследования неокрашенного мазка флоры полости рта является:
- изучение микрофлоры в соскобе возможно не более 10 минут после смешивания с щелочью, в дальнейшем микробы в препарате разрушаются, утрачивая морфологию, искажая микроскопическую картину;
- для исследования доступна только форма микробной клетки и количество микроорганизмов в поле зрения;
- преимущественно используется для изучения клеток грибов, которые не разрушаются под действием щелочи, а не множества представителей бактериального мира;
- щелочь разрушает связи между бактериями, невозможно составить представление о взаимодействии бактерий в микробиоме;
- невозможность дифференциации бактерий по химической структуре клеточной стенки, то есть принадлежности микроба к грам+ или грам- бактериям;
- щелочь разрушает эпителий, что делает невозможным исследование в соскобе эпителиальных клеток ни по количеству, ни по структуре;
- консультирование по спорным результатам микроскопии возможно проводить только непосредственно во время исследования; невозможно вернуться к изучению препарата на следующий день или позже.
Специфическим маркером баланса симбиотических отношений макроорганизма и микроорганизмов микрофлоры тела человека считают состояние его микробиомов (Нетрусов А.И., Бонч-Осмоловская Е.А., Горленко Е.М. Экология микроорганизмов / под ред. Проф. А.И. Нетрусова. - М.: Академиа, 2004. - 272 с.), которое коррелирует с потреблением питательных веществ, отражает различные физиологические состояния макроорганизма и показывает изменение иммунного статуса.
Задача - предложить способ микроскопического исследования нативного соскоба со слизистой корня языка, лишенный вышеперечисленных недостатков.
Технический результат состоит в возможности выявления количества микроорганизмов микробиома полости рта, их химической принадлежности по строению клеточной стенки к грамнегативным или грампозитивным бактериям, морфологии, пространственного расположения, коадгезии между собой и гистадгезии к клеткам эпителия, путем применения сложной дифференциальной окраски фиксированного мазка из глубокого соскоба корня языка, содержащего основных представителей микробиома, методом Грама.
Технический результат достигается тем, что в качестве биоматериала для микроскопии используется глубокий соскоб корня языка, который берут на границе задней трети спинки и корнем языка стерильным деревянным шпателем, с усилием надавливая на слизистую. Забранный в количестве 0,5 мл нативный биоматериал наносится шпателем поочередно на два сухих стерильных предметных стекла и равномерно распределяется на каждом стекле площадью около 1,5-2 см2 в пределах круга-метки. Препараты высушиваются на воздухе 20 минут, фиксируются мазками вверх в пламени спиртовки непрерывно 5-6 секунд и окрашиваются сложным дифференциальным методом Грама (Общая и санитарная микробиология с техникой микробиологических исследований: учебное пособие / под ред. А.С. Лабинской, Л.П. Блинковой, А.С. Ещиной. - М.: Медицина, 2004. - 576 с. / с. 93-94). Метод датского бактериолога Ханса Христиана Грама включает последовательное окрашивание фиксированного мазка карболовым генцианвиолетом, обработку раствором Люголя, обесцвечивание спиртом, промывание водой и докрашивание водно-спиртовым раствором фуксина. Используют приготовленные по рецептуре красители и/или набор реагентов для окраски по Граму производителя ЗАО ЭКОлаб ТУ 9389-083-70423725-2007, РУ ФСР 2008/03335 от 23.09.08.
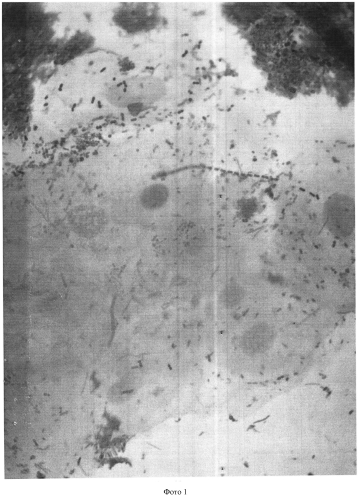
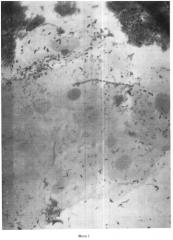
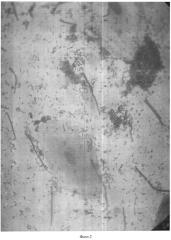
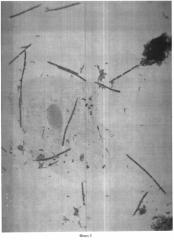
Результаты оценивают следующим образом: окрашенные по Граму мазки на двух предметных стеклах исследуются под биологическим микроскопом с иммерсией, используется объектив иммерсионный ×100 и окуляр ×15 (см. фото 1-4).
Методом случайной выборки нами было обследовано 2700 человек разного пола, национальности, социального положения и возраста - дети от 1 года и взрослые люди до 87 лет. У всех исследуемых установлен микроскопический статус соскоба корня языка: микроскопическим методом определены количественное содержание бактерий в 0,5 мл соскоба, принадлежность к грам+ или грам- бактериям, морфология и размеры бактерий, наличие бактерий, схожих с лептотрихиями, и грибов, схожих с кандидами, коэффициенты коадгезии и гистадгезии, количество и характеристика клеток и ядер эпителия.
Результаты представлены в таблице 1.
При анализе данных, представленных в таблице 1, видно, что применение способа микроскопии нативного соскоба корня языка, окрашенного методом Грама, объективно характеризует как качественный, так и количественный состав микробиома полости рта в его естественном состоянии, включая клетки эпителия слизистой корня языка.
Преимущества предложенного способа:
- в качестве метода клинической лабораторной диагностики способ полностью раскрывает картину биопленок/взаимодействия бактерий между собой и состояния эпителия;
- способ не инвазивен и безопасен для пациента;
- для получения результата о составе микробиома требуется 30 минут;
- предложенный способ может быть применен в любом лечебном учреждении, в амбулаторных условиях кабинета любого специалиста;
- фиксированные мазки можно доставлять и окрашивать в баклаборатории стандартным методом Грама; не требует специально обученного персонала;
- способ может использоваться при проведении мероприятий по скрининг-диагностике состояния микробиома полости рта;
- может явиться профилактическим методом в группах риска по заболеванию кариесом зубов и патологии желудочно-кишечного тракта.
Пример 1
Аркадий Г., 19 лет. Практически здоров. Содержание бактерий в соскобе с языка умеренное, преобладают грампозитивные кокки, имеются грамнегативные диплококки, что соответствует норме микробиома. Лептотрихии единичные в поле зрения микроскопа, длиной до 15 мкм, клеток грибов не обнаружено. Клетки эпителия типичные, 0-1 в поле зрения, с хорошо структурированным ядром, коэффициент гистадгезии умеренный, коадгезия микроорганизмов между собой невысокая.
Пример 2
Марина Д., 51 год. Диагноз: красный плоский лишай. Сахарный диабет II типа. В соскобе с языка большое количество микроорганизмов, которые располагаются скоплениями по типу «шаров», преобладают грамнегативные кокки и палочки. Лептотрихии до 20-30 в каждом поле зрения, длина их до 40 мкм, имеются ложные гифы грибов до 3-5 в поле зрения. Эпителий разрушен, 8-10 в поле зрения, множество ядер, коэффициент гистадгезии высокий, коадгезия микроорганизмов между собой очень высокая.
| Таблица 1 | ||||
| Микроскопическое исследование соскоба корня языка (M±n) | ||||
| Группы (n=100) | Выявление разницы в строении клеточной стенки бактерий (грам+ и грам-) | Выявление клеток эпителия и ядер | Выявление гистадгезии (бактерии на поверхности клеток эпителия) | Выявление коадгезии (склеивание бактерий между собой) |
| (абс.иссл.) | (абс.иссл.) | (абс.иссл.) | (абс.иссл.) | |
| Исследуемая группа (метод Грама) | 100,0 | 98,0±2,0 | 100,0 | 96,0±1,8 |
| Контрольная группа (метод Романовского - Гимзы) | 0,0 | 88,0±1,8 | 68,0±2,8 | 76,0±2,7 |
| Группа сравнения (негативный метод - 10% КОН) | 0,0 | 0,0 | 0,0 | 0,0 |
| *(M±m) |
Т.о. предлагается способ микроскопического исследования нативного соскоба слизистой корня языка, включающий забор материала стерильным шпателем, приготовление мазка на предметном стекле, высушивание, фиксацию мазка и его окрашивание, микроскопию с иммерсией и объектив ×100, отличающийся тем, что для исследования забирают 0,5 мл биоматериала из глубокого соскоба со слизистой на границе задней трети спинки и корня языка, готовят два мазка на двух предметных стеклах площадью 1,5-2,0 см2 каждый, далее мазки высушивают на воздухе 20 минут, фиксируют жаром в пламени спиртовки в течение 5-6 секунд, окрашивают сложным дифференциальным методом Грама, просматривают не менее 10 полей зрения на каждом стекле, подсчитывают общее количество микроорганизмов, коэффициенты коадгезии и гистадгезии, пространственное расположение бактерий, преобладание грам+ или грам- бактерий, наличие бактерий, схожих с лептотрихиями, геликобактерами, наличие ложных гиф грибов, количество и состояние клеток и ядер эпителия.
Способ микроскопического исследования нативного соскоба слизистой корня языка, включающий забор материала стерильным шпателем, приготовление мазка площадью 1,5-2,0 см2 на предметном стекле, высушивание на воздухе 20 минут, фиксацию мазка жаром в пламени спиртовки и его окрашивание сложным дифференциальным методом Грама, микроскопию с иммерсией и объектив ×100, отличающийся тем, что для исследования деревянным шпателем забирают 0,5 мл биоматериала из глубокого соскоба со слизистой на границе задней трети спинки и корня языка, готовят два мазка на двух предметных стеклах, далее мазки высушивают и фиксируют жаром в пламени спиртовки непрерывно в течение 5-6 секунд, окрашивают, просматривают не менее 10 полей зрения на каждом стекле, учитывая количественные и качественные характеристики микроорганизмов, клеток и ядер эпителия.