Способ фотодинамической инактивации бактерий enterococcus faecalis (варианты)
Иллюстрации
Показать всеГруппа изобретений относится к фармацевтической промышленности, а именно к способу фотодинамической инактивации и подавления роста бактерий Enterococcus faecalis. Cпособ фотодинамической инактивации и подавления роста бактерий Enterococcus faecalis, основанный на предварительной обработке бактерий гиперициносодержащим фотосенсибилизатором на основе спиртовой настойки травы зверобоя «Диагиперон» или «Зверобоя настойка» и последующем воздействии на полученную суспензию оптического излучения лазерных или светодиодных источников с максимумами испускания в области, соответствующей максимумам спектра поглощения или максимумам спектра возбуждения флуоресцирующих компонент препаратов при плотности энергии излучения 0,9-9,0 Дж/см2, при определенных условиях. Вышеописанный способ позволяет упростить инактивацию бактерий Enterococcus faecalis. 2 н. и 20 з.п. ф-лы, 7 ил., 3 табл.
Реферат
Изобретение относится к биотехнологии и медицине, а именно к способу фотодинамической инактивации и подавления роста бактерий Enterococcus faecalis в присутствии лекарственного препарата, обладающего сенсибилизирующими свойствами.
Enterococcus faecalis (фекальный энтерококк) - условно-патогенный микроб, характерный для нормального состава микрофлоры ротовой полости, пищеварительных органов и кишечника, а также мочеполовой системы человека.
Патогенная форма Enterococcus faecalis вызывает воспаления мочевых и половых путей, мочевого пузыря, органов малого таза и почек, большинство внутрибольничных инфекций, циститы, пиелонефриты, аднекситы, простатиты, уретриты и т.д. Указанный микроорганизм также обнаруживается при персистирующих эндодонтических инфекциях. Его распространенность при таких инфекциях по данным разных источников колеблется от 24% до 77%. Это объясняется особенной устойчивостью и вирулентностью Enterococcus faecalis, способностью конкурировать с другими микроорганизмами.
Бактерии Enterococcus faecalis относятся к роду грамположительных энтерококков подкласса лактобактерий. Enterococcus faecalis способны осуществлять клеточное дыхание как в бескислородной, так и насыщенной кислородом среде; устойчивы к воздействию дезинфицирующих средств и некоторых антибиотиков, хорошо выдерживают высокие температуры и сложные условия окружающей среды: растут при температуре 10-45°C, pH 4,5-10,0, а также при высоких концентрациях хлорида натрия. Enterococcus faecalis обладает определенными факторами вирулентности, включая литические ферменты, цитолизин, вещество аггрегации, феромоны. Enterococcus faecalis в состоянии подавить действие лимфоцитов, потенциально способствуя эндодонтической неудаче.
Известен способ инактивации бактерий Enterococcus faecalis, основанный на обработке микрофлоры раствором антибиотиков (ампицилин, ванкомицин, пенициллин, цефолоспорины, аминогликозиды и др.), антисептиков или других препаратов, обладающим противомикробным действием [1].
Недостатком известного способа подавления энтерококковой активности Enterococcus faecalis является высокий уровень резистентности бактерий к указанным средствам [2]. Некоторые штаммы энтерококков имеют внутренние механизмы устойчивости к бета-лактамным антибиотикам (пенициллины и цефалоспорины), а также ко многим аминогликозидам. В последние два десятилетия появились особо вирулентные штаммы энтерококков, резистентные к ванкомицину и способные вызывать внутрибольничные инфекции.
Известен также способ фотодинамической инактивации бактерий Enterococcus faecalis в присутствии красителя, обладающего сенсибилизирующими свойствами, за счет фотодинамического воздействия оптического излучения, соответствующего полосе поглощения красителя [3-16]. В качестве красителей-сенсибилизаторов используются следующие соединения: метиленовый зеленый, акридиновый оранжевый и профлавин [3], метиленовый синий и толуидиновый синий [3, 4, 5, 6, 7], индоцианиновый зеленый [7, 8], бенгальский розовый [6, 7, 9], эозин [9], куркумин [9], хлорин [10], порфирины [11], фталоцианины [12, 13], халькоген-содержащие бензофеноксазиниевые красители [14], конъюгаты наночастиц с метиленовым синим [15], порфирином [16] или хлорином e6 [17].
В указанных способах фотодинамической инактивации бактерий Enterococcus faecalis микробные клетки выращивают на питательной среде. После предварительной инкубации в темноте Enterococcus faecalis в аэробных условиях в течение 10-30 мин с одним из вышеуказанных красителей при концентрации красителя 1-250 мкМ содержимое облучают оптическим излучением, спектральный диапазон которого соответствует полосе поглощения фотосенсибилизатора. В качестве источников излучения в указанных способах фотодинамической инактивации бактерий Enterococcus faecalis используют лазерные диоды, светодиоды, широкополосные ламповые источники белого света, или ламповые источники, из общего спектра испускания которых с помощью светофильтров выделяют область, соответствующую максимуму полосы поглощения сенсибилизатора.
Недостатками известных способов фотодинамической инактивации бактерий Enterococcus faecalis являются: (а) ограничение в использовании некоторых из вышеуказанных сенсибилизаторов (метиленовый синий, толуидиновый синий, метиленовый зеленый, акридиновый оранжевый, бенгальский розовый, индоцианиновый зеленый, эозин, фталоцианины, халькоген-содержащие бензофеноксазиниевые красители) в медицинских целях (антимикробная фотодинамическая терапия заболеваний полости рта, лица и т.п.) по эстетическим соображениям из-за сильного и устойчивого окрашивания поверхности ткани, подвергнутой аппликации красителя; (б) сложность химического синтеза (конъюгаты наночастиц с метиленовым синим, порфирином или хлорином e6) и/или химической очистки (профлавин, куркумин, хлорины, порфирины) препаратов, используемых в качестве фотосенсибилизатора.
Наиболее близким к заявляемому является способ фотодинамической инактивации бактерий Enterococcus faecalis, основанный на предварительной инкубации изолированных бактерий с красителем-фотосенсибилизатором гиперицином [18]. В известном способе бактерии Enterococcus faecalis выращивают на питательном агаре в аэробных условиях при 37°C в течение 18-24 часов. Затем на стерильном фосфатно-солевом буфере (pH 7,4) приготавливают суспензию бактерий с концентрацией клеток 107 КОЕ/мл (КОЕ - колониеобразующих единиц). К бактериальной суспензии Enterococcus faecalis в темноте вносят раствор гиперицина в конечной концентрации 1,0 мкг/мл. Указанную смесь инкубируют в темноте при 37°C в течение 5 мин. Аликвоты по 200 мкл клеток Enterococcus faecalis, содержащих краситель-фотосенсибилизатор гиперицин, облучают светом в течение 3, 5 и 10 мин. В качестве источника облучения используют светодиод, из спектра испускания которого с помощью желтого светофильтра выделяют излучение с максимумом в области 590 нм (область, соответствующая максимуму спектра поглощения гиперицина). Мощность излучения составляла 30 мВт, плотность мощности излучения, воздействующего на Enterococcus faecalis, 80 мВт/см2. При времени воздействия 3, 5 и 10 мин энергетическая доза (плотность дозы) составляла соответственно 14,4; 24; 48 Дж/см2 [18].
Согласно известному способу [18] инкубация в темноте бактерий Enterococcus faecalis с гиперицином при его концентрации 0,1; 0,3; 0,6; 1,0 мкг/мл в течение 5 мин не оказывала на них токсичного действия. Воздействие на Enterococcus faecalis в отсутствие гиперицина оптического излучения с максимумом в области 590 нм при плотности мощности 80 мВт/см2, экспозиции от 3 до 10 мин и энергетической дозе от 14,4 до 48 Дж/см2 также не вызывала изменений активности бактерий Enterococcus faecalis.
Однако облучение Enterococcus faecalis в присутствии гиперицина при его концентрации 1 мкг/мл в течение 3 мин при плотности мощности 80 мВт/см2 (энергетическая доза 14,4 Дж/см2) вызывала снижение способности к росту и колониеобразованию. Так, если в контроле (клетках, не содержащих гиперицина и не облученных) концентрация клеток составляла 107 КОЕ/мл, то после их облучения - она снижалась на четыре порядка.
Недостатками известного способа фотодинамической инактивации бактерий Enterococcus faecalis являются: (а) использование в качестве фотосенсибилизатора коммерческого химического препарата (гиперицина), неразрешенного к применению в медицинской практике; (б) высокая стоимость препарата, вызванная сложностью его выделения и химической очистки (согласно каталогу фирмы Sigma-Aldrich стоимость 10 мг препарата составляет 326,5 евро).
Задача предлагаемого изобретения - разработка эффективного способа фотодинамической инактивации бактерий Enterococcus faecalis с использованием в качестве фотосенсибилизатора официнального лекарственного средства, разрешенного к применению в медицинской практике, и обеспечивающего за счет фотодинамического эффекта полное бактерицидное действие в отношении Enterococcus faecalis при более низкой стоимости реализуемого способа.
Поставленная задача решается следующим образом.
Вариант 1
В способе фотодинамической инактивации бактерий Enterococcus faecalis, основанный на предварительной обработке бактерий гиперицинсодержащим фотосенсибилизатором и последующем воздействии оптическим излучением видимой области спектра, соответствующим полосе поглощения фотосенсибилизатора, в качестве гиперицинсодержащего фотосенсибилизатора используют препарат «Диагиперон» на основе спиртовой настойки травы зверобоя, разводят его суспензией бактерий 1/30±10 по объему и воздействуют на суспензию излучением лазерного или светодиодного источников с максимумом испускания в области, соответствующей максимумам спектра поглощения или максимумам спектра возбуждения флуоресцирующих компонент суспензии при плотности энергии излучения 0,9-9,0 Дж/см2.
Вариант 2
В способе фотодинамической инактивации бактерий Enterococcus faecalis, основанный на предварительной обработке бактерий гиперицинсодержащим фотосенсибилизатором и последующем воздействии оптическим излучением видимой области спектра, соответствующим полосе поглощения фотосенсибилизатора, в качестве гиперицинсодержащего фотосенсибилизатора используют официнальный лекарственный препарат «Зверобоя настойка» на основе спиртовой настойки травы зверобоя продырявленного, разводят его суспензией бактерий 1/30±10 по объему и воздействуют на суспензию излучением лазерного или светодиодного источников с максимумом испускания в области, соответствующей максимумам спектра поглощения или максимумам спектра возбуждения флуоресцирующих компонент суспензии при плотности энергии излучения 0,9-9,0 Дж/см2.
Воздействие осуществляют лазерным излучением с длиной волны λ=665±10 нм при плотности энергии 0,9-6,0 Дж/см2.
Воздействие осуществляют лазерным излучением с длиной волны 405 нм при плотности энергии 0,9-6,0 Дж/см2.
Воздействие осуществляют лазерным излучением с длиной волны в области 435-445 нм при плотности энергии 0,9-6,0 Дж/см2.
Воздействие осуществляют лазерным излучением с длиной волны 532 нм при плотности энергии 0,9-9,0 Дж/см2.
Воздействие осуществляют излучением светодиодного источника с максимумом испускания на длине волны λ=405±10 нм при плотности энергии 0,9-6,0 Дж/см2.
Воздействие осуществляют излучением светодиодного источника с максимумом испускания на длине волны λ=450±10 нм при плотности энергии 0,9-6,0 Дж/см2.
Воздействие осуществляют излучением светодиодного источника с максимумом испускания на длине волны λ=545±10 нм при плотности энергии 0,9-6,0 Дж/см2.
Воздействие осуществляют излучением светодиодного источника с максимумом испускания на длине волны λ=590±10 нм при плотности энергии 0,9-4,5 Дж/см2.
Воздействие осуществляют излучением светодиодного источника с максимумом испускания на длине волны λ=660±15 нм при плотности энергии 0,9-6,0 Дж/см2.
Воздействие осуществляют излучением светодиодного источника белого света с максимумами испускания на длинах волн λ1=450±10 нм и λ2=575±10 нм при плотности энергии 0,9-6,0 Дж/см2.
Сущность изобретения поясняется чертежами, где:
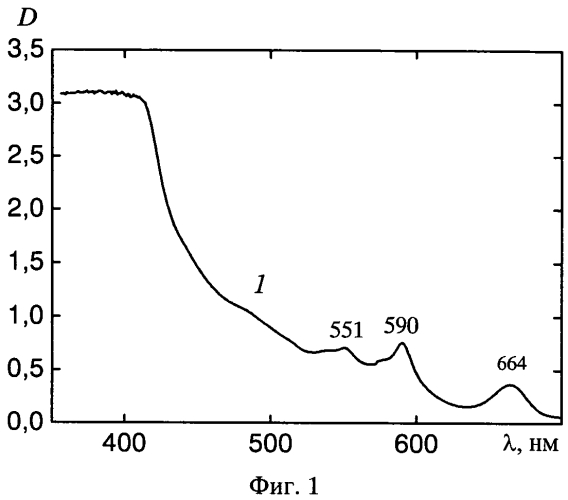
на фиг.1 показан спектр поглощения «Диагиперона»;
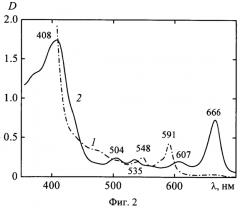
на фиг.2 - спектры поглощения гиперициновой (кривая 1) и хлорофилловой (кривая 2) фракций «Диагиперона» после их предварительного выделения с помощью тонкослойной хроматографии;
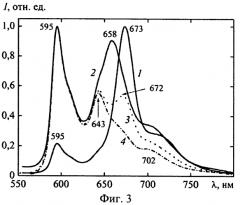
на фиг.3 - спектры флуоресценции диагиперона при длине волны возбуждения λвозб=405 (кривая 1), 445 (кривая 2), 532 (кривая 3) и 545 нм (кривая 4);
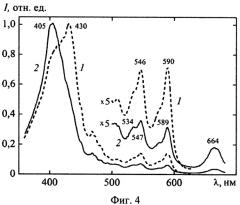
на фиг.4 - спектры возбуждения флуоресценции «Диагиперона» при длине волны регистрации λрег=653 (кривая 1), 702 нм (кривая 2);
на фиг.5 - спектр поглощения «Зверобоя настойки» после разбавления спиртом в соотношении 200 мкл настойки/4000 мкл этанола;
на фиг.6 - спектры возбуждения флуоресценции «Зверобоя настойки», разбавленной в соотношении 50 мкл настойки/4000 мкл этанола при длине волны регистрации λрег=620 (кривая 7) нм и разбавленной в соотношении 200 мкл настойки/4000 мкл этанола при длине волны регистрации λрег=720 нм (кривая 2);
на фиг.7 - спектры излучения светодиодных источников с максимумом интенсивности при λмакс=405 (кривая 1); 450 (кривая 2); 545 (кривая 3); 600 (кривая 4); 660 (кривая 5); 450 и 575 нм (кривая 6).
Лекарственный препарат «Диагиперон» представляет собой настойку (на 70% спирте этиловом) травы зверобоя для внутреннего и наружного применения. Оказывает анксиолитическое (снимает тревогу, напряжение) и антидепрессивное действие (повышает настроение). Улучшает функциональное состояние центральной и вегетативной нервной системы. Обладает вяжущим и противовоспалительным действием, а также антибактериальной активностью (в темновых условиях) по отношению к ряду микроорганизмов, устойчивых к действию антибиотиков.
Как следует из данных, представленных на фиг.1, в спектре поглощения «Диагиперона» отчетливо регистрируются три максимума: при λпогл=551; 590 и 664 нм. Разделение компонент методом тонкослойной хроматографии показало, что два первых максимума принадлежат гиперицину, входящему в состав «Диагиперона», а длинноволновый максимум при λпогл=664 нм обусловлен, главным образом, присутствием в препарате хлорофилла a (фиг.2). В пользу такого заключения свидетельствует тот факт, что максимумы спектров поглощения очищенных препаратов хлорофилла a в этиловом спирте расположены при λпогл=431 и 665 нм, хлорофилла b - при λпогл=463 и 649 нм, а гиперицина - при λпогл=477, 510, 548 и 590 нм. После хроматографического разделения компонентов одна из фракций (гиперицин-содержащая, кривая 1, фиг.2) имеет максимумы в спектре поглощения при λпогл=548 и 591 нм, другая (хлорофилл-содержащая, кривая 2, фиг.2) - при λпогл=408, 504, 535, 607, 666 нм. Наличие нескольких типов хромофоров, поглощающих в видимой области спектра, в составе «Диагиперона» подтверждается также и данными спектров флуоресценции и возбуждения флуоресценции препарата (фиг.3 и фиг.4). При этом спектры флуоресценции химически чистых этанольных растворов хлорофилла a расположены при λфл=674 и 725 нм; хлорофилла b - при λфл=650 и 710 нм; гиперицина - при λфл=594; 642 и 702 нм. Следовательно, изменение длины волны возбуждения флуоресценции «Диагиперона» приводит к изменению вкладов гиперицина и хлорофилла в общую флуоресценцию настойки диагиперона, а соответственно - и к изменению положения максимумов спектра флуоресценции. Причем, если при возбуждении в области λвоз≥630 нм (при которой поглощение гиперицина практически отсутствует) в спектре флуоресценции «Диагиперона» регистрируется (фиг.3) только хлорофилловая компонента (λфл=673 нм), то при λвоз=545 нм - преобладает гиперициновая составляющая (λфл=595 и 643 нм, кривая 4). При возбуждении в области λвоз=405 (кривая 1), 445 (кривая 2) и 532 нм (кривая 3) в спектре флуоресценции регистрируются как гиперициновая, так и хлорофилловая компоненты. Отметим, что изменяя длину волны возбуждения, удается зарегистрировать как флуоресценцию хлорофилла a (максимум в спектре в области λфл=672 нм, кривая 3), так и хлорофилла b (λфл=658 нм, кривая 2), присутствующих в составе «Диагиперона».
Информация об оптимальном диапазоне возбуждения фотосенсибилизирующих компонент в «Диагипероне» получена из данных спектров возбуждения флуоресценции (фиг.4): при регистрации флуоресценции в области λрег=653 нм (кривая 1) соответствующие максимумы расположены при λмакс=430; 546 и 590 нм; при регистрации в области 702 нм (кривая 2) λмакс=405; 547; 589 и 664 нм.
Обращают на себя внимание заметные отличия спектра возбуждения флуоресценции (фиг.4) от спектра поглощения препаратов (фиг.1 и фиг.2), что обусловлено присутствием в их составе нефлуоресцирирующих (в красной области спектра) компонент: эфирных масел, дубильных веществ, фенолоальдегидов, цинеолов и др. Указанные соединения обладают выраженным поглощением в ультрафиолетовой области спектра и являются причиной высокой оптической плотности растворов «Диагиперона» в диапазоне 350-400 нм (фиг.1).
Из анализа представленных данных следует, что возбуждение гиперициновой и хлорофилловой компонент «Диагиперона» возможно практически во всей видимой области спектра, однако наиболее эффективным является выбор диапазонов, соответствующих максимумам поглощения его флуоресцирующих компонент: 405±10 нм, 430±25 нм; 545±15 нм; 590±10 нм; 665±15 нм.
Практически указанный способ фотодинамической инактивации бактерий Enterococcus faecalis при использовании «Диагиперона» в качестве фотосенсибилизатора может быть реализован за счет использования наиболее доступных в настоящее время полупроводниковых лазеров с длиной волны излучения в области 405 нм; 435-445 нм; 665±15 нм; твердотельного Nd : YAG-лазера с диодной накачкой и удвоением частоты излучения с длиной волны 532 нм; сверхъярких светодиодов, максимум спектра излучения которых расположен в области 405±10 нм (кривая 1 на фиг.7); 450±10 нм (кривая 2); 545±10 нм (кривая 3); 590±10 нм (кривая 4); 660±15 нм (кривая 5). Возможно также использование светодиода белого света, один из максимумов испускания которого расположен при 450 нм, другой - при 575 нм (кривая 6).
Лекарственный препарат «Зверобоя настойка» представляет собой настойку травы зверобоя продырявленного на 40% спирте этиловом для внутреннего и наружного применения. Оказывает вяжущее и противовоспалительное действие, обусловленное содержащимися флавоноидами, азуленом и эфирными маслами, а также мягким антидепрессивным, седативным и анксиолитическим действием.
Данные о спектре поглощения «Зверобоя настойки» представлены на фиг.5. Видно, что в видимой области спектра (400-760 нм) точки экстремумов, которые могли бы быть соотнесены с присутствием в растворе фотосенсибилизирующих компонентов, слабо выражены. Отмечается лишь слабо проявляющийся максимум в области 591 нм и «плечи» в области 485 нм и 548 нм, связанные с присутствием в препарате гиперицина. Не вызывает сомнения, что такая маскировка полос поглощения в препарате обусловлена многокомпонентным составом лекарства, в том числе и присутствием в нем компонентов, не способных оказывать фотосенсибилизирующее действие. По этой причине наиболее достоверная информация о фотосенсибилизирующих соединениях «Зверобоя настойка» получена из анализа спектров возбуждения флуоресценции (фиг.6). Причем для регистрации спектра возбуждения в области 400-600 нм (кривая 1) λрег=620 нм использовалась настойка, разбавленная в соотношении 50 мкл настойки/4000 мкл этанола. Необходимость такого разбавления обусловлена высокой оптической плотностью раствора в области 400 нм, что (из-за эффекта экранирования) не позволяет выяснить истинное положение максимумов в спектре возбуждения. При исследовании разбавленных растворов в спектре возбуждения (λрег=620 нм) регистрируются максимумы в области 430; 477, 548 и 590 нм. Кроме того, отмечается также максимум в области слабого поглощения (низкой интенсивности в спектре возбуждения при 511 нм). Для регистрации спектра возбуждения флуоресценции в красной области (λрег=720 нм, кривая 2) использовались более концентрированные растворы «Зверобоя настойки» (200 мкл настойки/4000 мкл этанола), которые позволили обнаружить в спектре возбуждения флуоресценции наряду с ранее зарегистрированными «гиперициновыми» максимумами в области 548 и 590 нм полосу с максимумом при 659 нм, обусловленную присутствием в растворе хлорофилловой компоненты.
Из представленных данных следует, что для активации фотосенсибилизирующих компонентов «Зверобоя настойки» наиболее подходят источники излучения, максимумы спектра излучения которых находятся в области 430±25 нм; 548±15 нм, 590±10 нм и 659±15 нм.
Практически способ фотодинамической инактивации бактерий Enterococcus faecalis при использовании «Зверобоя настойки» в качестве фотосенсибилизатора реализован за счет использования наиболее доступных в настоящее время полупроводниковых лазеров с длиной волны излучения в области 435-445 нм; 665±10 нм; твердотельного Nd : YAG-лазера с диодной накачкой и удвоением частоты излучения с длиной волны 532 нм; сверхъярких светодиодов, максимум спектра излучения которых расположен в области 450±10 нм (кривая 2 на фиг.7); 545±10 нм (кривая 3); 590±10 нм (кривая 4); 660±15 нм (кривая 5). Возможно также использование светодиода белого света, один из максимумов испускания которого расположен при 450 нм, другой - при 575 нм (кривая 6).
Сущность заявляемого способа фотодинамической инактивации бактерий Enterococcus faecalis заключается в следующем.
В опытах по фотодинамической инактивации бактерий Enterococcus faecalis используют пять-восемь штаммов выращенной на скошенном питательном агаре суточной культуры клинически выделенных энтерококков с обязательным контролем чистоты культуры и проверкой основных биохимических родовых и видовых признаков. Из выросшей суточной культуры на стерильном физиологическом растворе готовят суспензию клеток в концентрации 1,5×108 КОЕ/мл, что соответствует 10 ЕД стандарта мутности. Путем последовательных 10-кратных (1:10) разведении готовят суспензию с разведением 1:(100000-10000000) для каждой культуры энтерококков.
По 2 мл полученной суспензии каждого штамма вносят в стерильные чашки Петри диаметром 3,5 см (площадь дна S=9,6 см2). Готовят четыре группы суспензий:
- 1-я группа (контрольная без фотосенсибилизатора). В каждую чашку в стерильных условиях добавляют по 0,5 мл разведенного 1:5 стерильным физиологическим раствором 70% этилового спирта (этанола),
- 2-я группа (опытная без фотосенсибилизатора). В каждую чашку в стерильных условиях добавляют по 0,5 мл разведенного 1:5 стерильным физиологическим раствором 70% этилового спирта (этанола). Через 5 мин содержимое каждой чашки подвергают воздействию оптического излучения (светодиодного источника или полупроводникового лазера),
- 3-я группа (контрольная с фотосенсибилизатором). В каждую чашку в стерильных условиях добавляют по 0,5 мл разведенного 1:5 стерильным физиологическим раствором «Диагиперона»,
- 4-я группа (опытная с фотосенсибилизатором). В каждую чашку в стерильных условиях добавляют по 0,5 мл разведенного 1:5 стерильным физиологическим раствором «Диагиперона». Через 5 мин содержимое каждой чашки подвергают воздействию оптического излучения (светодиодного источника или полупроводникового лазера).
При использовании для облучения бактерий Enterococcus faecalis официнального лекарственного препарата «Диагиперона» применяют один из следующих источников:
- полупроводниковый лазер с длиной волны излучения в области 405 нм (фиолетовая область спектра);
- полупроводниковый лазер с длиной волны излучения в области 435-445 им (синяя область спектра);
- полупроводниковый лазер с длиной волны излучения в области 665±10 нм (красная область спектра);
- твердотельный Nd : YAG-лазера с диодной накачкой и удвоением частоты излучения с длиной волны 532 нм (зеленая область спектра);
- сверхъяркие светодиоды, максимумы спектра излучения которых расположен в области 405±10 нм (фиолетовая область спектра);
- сверхъяркие светодиоды, максимумы спектра излучения которых расположен в области 450±10 нм (синяя область спектра);
- сверхъяркие светодиоды, максимумы спектра излучения которых расположен в области 545±10 нм (зеленая область спектра);
- сверхъяркие светодиоды, максимумы спектра излучения которых расположен в области 590±10 нм (желтая область спектра);
- сверхъяркие светодиоды, максимумы спектра излучения которых расположен в области 660±15 нм (красная область спектра).
- сверхъяркие светодиоды излучающие белый свет, один из максимумов испускания которых расположен при 450±10 нм, другой - при 575±10 нм.
Источник оптического излучения располагают над чашкой Петри таким образом, чтобы оптическая ось излучения была направлена перпендикулярно поверхности чашки, а размер светового пятна несколько превышал площадь дна (S=9,6 см2) чашки с культурой, обеспечивая облучение всей суспензии микроорганизмов.
Мощность оптического излучения каждого источника измеряют с помощью измерителя ИМО-2Н и регулируют за счет изменения тока накачки полупроводникового излучателя. Мощность лазерного излучения изменяют в диапазоне 100-1000 мВт, а мощность излучения светодиода 75-225 мВт. При этом плотность мощности воздействующего излучения составляет 5-100 мВт/см2; а время воздействия оптического излучения составляет от 1 до 5 мин.
Затем из каждой чашки контрольной и опытной групп отбирают по 1 мл содержимого и высевают в стерильные чашки Петри диаметром 9 см с энтерококк агаром. Посевы культур на энтерококк агаре инкубируют в термостате при температуре 37°C в течение 24 часов. Через 24 часа инкубации проводят подсчет колониеобразующих единиц в контрольных (nk) чашках и в чашках, содержащих облученные клетки (no). Остаточную активность бактерий определяют как γ=nо/nк·100%.
Полученные результаты при воздействии на бактерии Enterococcus faecalis излучения полупроводникового лазера с длиной волны λ=665 нм суммированы в таблице 1.
| Таблица 1 | ||||
| Культура, штамм | Количество колониеобразующих единиц (КОЕ) в группе | |||
| 1-я группа (контроль без «Диагиперона») (nk) | 2-я группа (облучение без «Диагиперона») (no) | 3-я группа (контроль с «Диагипероном») (nk) | 4-я группа (облучение с «Диагипероном») (nо) | |
| Enterococcus faecalis №1 | 40 | 27 | 26 | 0 |
| Enterococcus faecalis №2 | 35 | 20 | 18 | 0 |
| Enterococcus faecalis №3 | 40 | 30 | 29 | 0 |
| Enterococcus faecalis №4 | 20 | 10 | 10 | 0 |
| Enterococcus faecalis №5 | 25 | 15 | 13 | 0 |
| Enterococcus faecalis №6 | 30 | 20 | 21 | 1 |
| Enterococcus faecalis №7 | 50 | 35 | 36 | 1 |
| Enterococcus faecalis №8 | 20 | 17 | 16 | 0 |
| Среднее значение | 30 | 21,8 | 21,1 | 0,25 |
| Среднее значение, % | 100 | 72,7 | 70,3 | 0,8 |
В таблице 1 представлена фотодинамическая инактивация бактерий Enterococcus faecalis при воздействии излучения полупроводникового лазера с длиной волны λ=665 нм при плотности мощности 100 мВт/см2 в течение 1 мин в отсутствии и присутствии «Диагиперона», добавленного в суспензию бактерий в соотношении 1/30 по объему. Плотность энергии лазерного излучения 6,0 Дж/см2.
Из таблицы 1 следует, что воздействие на суспензию бактерий Enterococcus faecalis без добавления фотосенсибилизаторов излучения полупроводникового лазера с длиной волны λ=665 нм при плотности мощности 100 мВт/см2 в течение 1 мин (плотность энергии лазерного излучения 6,0 Дж/см2) приводит (2-я группа таблицы) к снижению количества колониеобразующих единиц. Остаточная активность при этом составляет γ=nо/nk·100%=72,7%. Наличие эффекта фотодинамической инактивации без добавления «Диагиперона» может быть обусловлено сенсибилизирующим действием эндогенных сенсибилизаторов порфириновой природы, присутствующих в бактериях Enterococcus faecalis.
Внесение к суспензии Enterococcus faecalis «Диагиперона» в соотношении 1/30 по объему и последующая инкубация с ним приводят (см. 3-ю группу таблицы) к частичной инактивации клеток. Остаточная активность при этом составляет γ=nо/nk·100%=70,3%. Указанная инактивация может быть обусловлена антисептическими свойствами «Диагиперона», что подтверждается имеющимися данными о способности одного из компонентов препарата, гиперицина, оказывать инактивирующее действие на Enterococcus faecalis в темновых условиях (без воздействия света). Однако при воздействии на суспензию бактерий Enterococcus faecalis в присутствии «Диагиперона», предварительно добавленного в соотношении 1/30 по объему, излучения полупроводникового лазера с длиной волны λ=665 нм при плотности мощности 100 мВт/см2 в течение 1 мин (плотность энергии лазерного излучения 6,0 Дж/см2) наблюдается (4-я группа таблицы) практически полная фотодинамическая инактивация клеток. Остаточная активность при этом составляет γ=no/nk·100%=0,8%. Полная фотодинамическая инактивация бактерий (γ=0) наблюдается в 6 из 8 опытов и лишь в 2 опытах обнаруживаются единичные колониеобразующие единицы.
Таким образом, представленные данные свидетельствуют, что фотодинамическое действие, сенсибилизированное входящим в состав «Диагиперона» хлорофиллом, поглощающим на длине волны воздействующего излучения λ=665 нм, приводит к фотодинамической инактивации бактерий Enterococcus faecalis.
Инактивация бактерий Enterococcus faecalis наблюдается также при воздействии излучения фиолетовой области спектра, что обусловлено возбуждением как хлорофилловой, так и гиперициновой компонент «Диагиперона».
Полученные результаты при воздействии на бактерии Enterococcus faecalis излучения светодиодного источника с максимумом испускания при длине волны λ=405 нм при плотности мощности 15 мВт/см2 суммированы в таблице 2. Из представленных данных видно, что воздействие излучения при плотности энергии 4,5 Дж/см2 приводит (см. 4-ю группу) к полной потере способности к колониеобразованию клеток (остаточная активность γ=no/nk·100%=0.
| Таблица 2 | ||||
| Культура, штамм | Количество колониеобразующих единиц (КОЕ) в группе | |||
| 1-я группа (контроль без «Диагиперона») (nk) | 2-я группа (облучение без «Диагиперона») (no) | 3-я группа (контроль с «Диагипероном») (nk) | 4-я группа (облучение с «Диагипероном») (no) | |
| Enterococcus faecalis №1 | 220 | 140 | 165 | 0 |
| Enterococcus faecalis №2 | 200 | 130 | 150 | 0 |
| Enterococcus faecalis №3 | 190 | 130 | 140 | 0 |
| Enterococcus faecalis №4 | 250 | 100 | 175 | 0 |
| Enterococcus faecalis №5 | 180 | 90 | 125 | 0 |
| Среднее значение | 208 | 118 | 151 | 0 |
| Среднее значение, % | 100 | 56,7 | 72,5 | 0 |
В таблице 2 представлена фотодинамическая инактивация бактерий Enterococcus faecalis при воздействии излучения светодиодного источника с максимумом испускания при длине волны λ=405 нм при плотности мощности 15 мВт/см2 в течение 5 мин в отсутствии и присутствии «Диагиперона», добавленного в суспензию бактерий в соотношении 1/30 по объему. Плотность энергии лазерного излучения 4,5 Дж/см2.
Следует отметить, что фотодинамическое действие, сенсибилизированное красителем, не зависит от степени монохроматичности оптического излучения и степени его поляризации, а определяется лишь плотностью энергии (плотностью энергетической дозы), поглощенной сенсибилизатором. По этой причине фотодинамическая инактивация бактерии Enterococcus faecalis наблюдается как при действии монохроматического излучения лазерных источников (длина волны 405 нм, 435-445 нм, 532 нм, 665±15 нм), так и квазимонохроматического излучения светодиодных источников (с максимумом спектра испускания при 405±10 нм, 450±10 нм, 545±10 нм, 590±10 нм, 660±15 нм), диапазон излучения которых соответствует максимумам в спектре поглощения или спектрах возбуждения флуоресценции хлорофилловых и гиперициной компонентов «Диагиперона». Данные, приведенные в таблице 2, подтверждают сказанное при использовании излучения светодиодного источника с максимумом 405 нм.
При этом, учитывая многокомпонентный состав фотосенсибилизирующих соединений, изменение длины волны оптического излучения приводит к изменению суммарного поглощения света фотосенсибилизирующими компонентами «Диагиперона», а также вклада хлорофилловых и гиперициновых компонетов лекарственного препарата. Однако, поскольку фотодинамическую инактивацию бактерий вызывает как возбуждение хлорофилловых составляющих, так и гиперициновой компоненты, то изменение длины волны лазерного (405 нм, 435-445 нм, 532 нм, 665±15 нм) или светодиодного источника (405±10 нм, 450±10 нм, 545±10 нм, 590±10 нм, 660±15 нм) в пределах полос поглощения указанных компонентов обеспечивает фотодинамическую инактивацию бактерий при сопоставимых плотностях энергии излучения. По этой же причине фотодинамическая инактивация Enterococcus faecalis наблюдается также и при воздействии на бактерии в присутствие «Диагиперона» светодиодного источника белого света, один из максимумов спектра испускания которого расположен при 450 нм, другой - при 575 нм.
Следует отметить, что выбор концентрации фотосенсибилизатора при его конечном разведении в соотношении к суспензии бактерий 1/(30±10) по объему обусловлен следующими соображениями. Оптимальным является разведение 1/30, что обеспечивает эффективную фотодинамическую инактивацию бактерий Enterococcus faecalis. Снижение концентрации фотосенсибилизатора за счет увеличения его разведения суспензии бактерий 1/40 по объему приводит к резкому снижению фотодинамического эффекта. Увеличение концентрации фотосенсибилизатора за счет снижения его разведения суспензии бактерий 1/20 является нежелательным в силу выраженной темновой (в отсутствие света) инактивации бактерий спиртом.
Наряду с «Диагипероном» в качестве фотосенсибилизатора для фотодинамической инактивации бактерий Enterococcus faecalis может использоваться также официнальный лекарственный препарат «Зверобоя настойка». Фотодинамическая инактивация бактерий при конечном разведении препарата «Зверобоя настойка» в соотношении к суспензии бактерий 1/(30±10) по объему реализуется при воздействии одного из следующих источников: лазеров (с длиной волны излучения 405 нм, 435-445 нм, 532 нм, 665±10 нм) или светодиодов (с максимумом спектра испускании при 405±10 нм; 450±10 нм; 545±10 нм, 590±10 нм и 660±10 нм), диапазон излучения которых соответствует максимумам (430±25 нм; 548±15 нм, 590±10 нм и 659±15 нм) в спектре поглощения или спектрах возбуждения флуоресценции хлорофилловых и гиперициной компонентов «Зверобоя настойки».
При использовании «Диагиперона» в качестве официнального лекарственного препарата на основе спиртовой настойки травы зверобоя или официнального лекарственного препарата «Зверобоя настойка» на основе спиртовой настойки травы зверобоя продырявленного в соотношении к суспензии бактерий 1/(30±10) по объему:
Воздействие осуществляют лазерным излучением с длиной волны λ=665±10 нм при плотности энергии 0,9-6,0 Дж/см2.
Воздействие осуществляют лазерным излучением с длиной волны 405 нм при плотности энергии 0,9-6,0 Дж/см2.
Воздействие осуществляют лазерным излучением с длиной волны в области 435-445 нм при плотности энергии 0,9-6,0 Дж/см2.
Воздействие осуществляют лазерным излучением с длиной волны 532 нм при плотности энергии 0,9-9,0 Дж/см2.
Воздействие осуществляют излучением светодиодного источника с максимумом испускания на длине волны λ=405±10 нм при плотности энергии 0,9-6,0 Дж/см2.
Воздействие осуществляют излучением светодиодного источника с максимумом испускания на длине волны λ=450±5 нм при плотности дозы 0,9-6,0 Дж/см2.
Воздействие осуществляют излучением светодиодного источника с максимумом испускания на длине волны λ=545±10 нм при плотности дозы 0,9-6,0 Дж/см2.
Воздействие осуществляют излучением светодиодного источника с максимумом испускания на длине волны λ=590±10 нм при плотности дозы 0,9-4,5 Дж/см2.
Воздействие осуществляют излучением светодиодного источника с максимумом испускания на длине волны λ=660±10 нм при плотности дозы 0,9-6,0 Дж/см2.
Воздействие осуществляют излучением светодиодного источника белого света с максимумами испускания на длинах волн λ1=450±10 нм и λ2=575±10 нм при плотности дозы 0,9-6,0 Дж/см2.
Результаты воздействия излучения каждого из вышеуказанных лазерных или светодиодных источников на суспензию бактерий Enterococcus faecalis в присутствии официнального лекарственного препарата «Зверобоя настойка» на основе спиртовой настойки травы зверобоя продырявленного при разведении в соотношении к суспензии бактерий 1/30 по объему представлены в таблице 3.
| Таблица 3 | |||
| Тип источника оптического излучения | Длина волны излучения, нм | Плотность энергии воздействующего излучения, Дж/см2 | Количество колониеобразующих единиц (КОЕ) после воздействия излучения |
| Лазер | 665±10 | 6,0 | 0 |
| Лазер | 405 | 6,0 | 0 |
| Лазер | 435-445 | 6,0 | 0 |
| Лазер | 532 | 9,0 | 0 |
| Светодиод | 405±10 | 6,0 | 0 |
| Светодиод | 450±5 | 6,0 | 0 |
| Светодиод | 545±10 | 6,0 | 0 |
| Светодиод | λ=590±10 | 4,5 | 0 |
| Светодиод | 660±10 | 6,0 | 0 |
| Светодиод | 450±10 и 575±10 | 6,0 | 0 |
При использовании в качестве фотосенсибилизатора официнального лекарственн