Твердые дисперсии, содержащие способствующее апоптозу
Иллюстрации
Показать всеПроапоптотическая твердая дисперсия содержит в, по существу, некристаллической форме ингибирующее белки семейства Bcl-2 соединение, например ABT-263, диспергированное в твердом связующем веществе, содержащем (a) фармацевтически приемлемый водорастворимый полимерный носитель и (b) фармацевтически приемлемое поверхностно-активное вещество. Способ получения такой твердой дисперсии включает растворение соединения, полимерного носителя и поверхностно-активного вещества в подходящем растворителе и удаление растворителя для получения твердого связующего вещества, содержащего полимерный носитель и поверхностно-активное вещество и обладающего соединением, диспергированным в нем в, по существу, некристаллической форме. Твердая дисперсия подходит для перорального введения нуждающемуся в этом индивидууму для лечения заболевания, характеризуемого сверхэкспрессией одного или нескольких антиапоптотических белков семейства Bcl-2, например злокачественного новообразования. 4 н. и 18 з.п. ф-лы, 6 пр., 2 табл., 3 ил.
Реферат
Настоящая заявка испрашивает приоритет по предварительной заявке США № 61/185105, зарегистрированной 8 июня 2009 года.
Дают перекрестную ссылку на следующую совместно зарегистрированную заявку США, содержащую объект изобретения, относящийся к настоящей заявке: серийный № 12/796000, зарегистрированную 8 июня 2010 года, названную "Pharmaceutical dosage form for oral administration of a Bcl-2 family inhibitor", по которой испрашивается приоритет по предварительной заявке США серийный № 61/185130 зарегистрированной 8 июня 2009 года.
Полное описание каждой из указанных выше заявок включают в настоящий документ в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к твердым дисперсиям, содержащим способствующее апоптозу средство, к фармацевтическим лекарственным формам, содержащим такие дисперсии, к способу получения таких дисперсий и лекарственных форм и к способам их применения для лечения заболеваний, характеризующихся сверхэкспрессией антиапоптотических белков семейства Bcl-2.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Избежание апоптоза является отличительным признаком злокачественного новообразования (Hanahan & Weinberg (2000), Cell 100:57-70). Злокачественные клетки должны преодолевать непрерывное воздействие клеточного стресса, такого как повреждение ДНК, активация онкогенов, нарушенное прохождение клеточного цикла и жесткое микроокружение, заставляющего нормальные клетки подвергаться апоптозу. Одним из основных средств, благодаря которому злокачественные клетки избегают апоптоза, является повышающая регуляция антиапоптотических белков семейства Bcl-2.
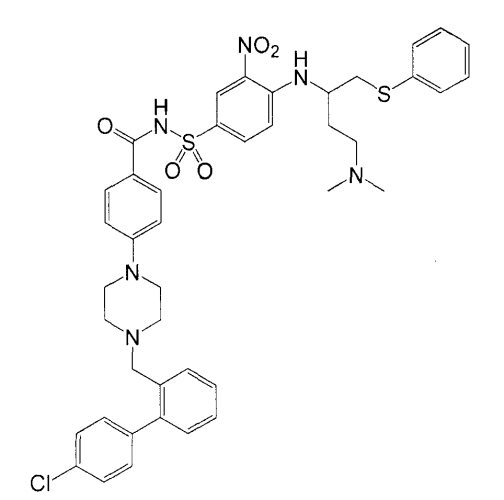
Описывают соединения, занимающие BH3-связывающую щель белков Bcl-2, например Bruncko et al. (2007) J. Med. Chem. 50:641-662. Данные соединения включают N-(4-(4-((4'-хлор-(1,1'-бифенил)-2-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(диметиламино)-1-((фенилсульфанил)метил)пропил)амино)-3-нитробензол-сульфонамид, также известный как ABT-737, обладающий формулой:
ABT-737 связывает белки семейства Bcl-2 (в особенности, Bcl-2, Bcl-XL и Bcl-w) с высокой аффинностью (Ki<1 нМ). Он проявляет одиночную активность против мелкоклеточного рака легких (SCLC) и злокачественных новообразований лимфоидной ткани и усиливает проапоптотические эффекты других химиотерапевтических средств. ABT-737 и родственные соединения и способы получения таких соединений описывают в публикации патентной заявки США № 2007/0072860 Bruncko et al.
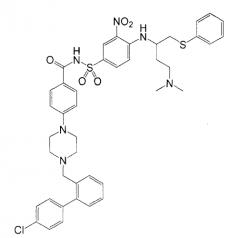
В последнее время идентифицировали дополнительную группу соединений, обладающих высокой аффинностью связывания к белкам семейства Bcl-2. Данные соединения и способы их получения описывают в публикации патентной заявки США № 2007/0027135 Bruncko et al. (в настоящем документе "публикация '135"), в полном объеме включенной в настоящий документ в качестве ссылки, и, как можно видеть из их формулы ниже, они являются структурно родственными ABT-737.
В публикации '135 указывают, что, в то время как известные ранее ингибиторы белков семейства Bcl-2 могут обладать сильной клеточной эффективностью или сильным системным воздействием после перорального введения, они не обладают обоими свойствами одновременно. Типичной мерой клеточной эффективности соединения является концентрация, вызывающая 50% клеточный эффект (EC50). Типичной мерой системного воздействия после перорального введения соединения является площадь под кривой (AUC), получаемая при построении графика концентрации соединения в плазме в зависимости от времени, прошедшего с момента перорального введения. Известные ранее соединения, как указывают в публикации '135, обладают низким отношением AUC/EC50, что означает, что они не являются перорально эффективными. В отличие от этого, указывают, что соединения с указанной выше формулой демонстрируют усиленные свойства в отношении клеточной эффективности и системного воздействия после перорального введения, приводя к значительно более высокому отношению AUC/EC50, чем таковое у известных ранее соединений.
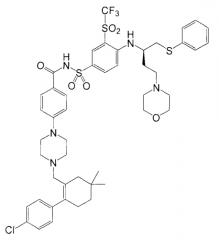
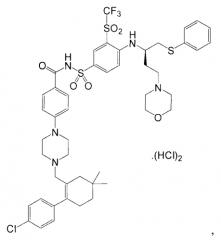
Одним соединением, указанным в публикации '135 как "Пример 1", является N-(4-(4-((2-(4-хлорфенил)-5,5-диметил-1-циклогексо-1-ен-1-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(морфолин-4-ил)-1-((фенилсульфанил)метил)пропил)амино)-3-((трифторметил)сульфонил) бензолсульфонамид, также известный как ABT-263. Данное соединение обладает молекулярной массой 974,6 г/моль и обладает формулой:
ABT-263 связывает Bcl-2 и Bcl-XL с высокой аффинностью (<1 нМ) и, как полагают, обладает аналогично высокой аффинностью по отношению к Bcl-w. Его отношение AUC/EC50 указывают в публикации '135 как 56, больше чем на порядок выше, чем указанный для ABT-737 (4,5). Для определения AUC по публикации '135 каждое соединение вводили крысам в однократной дозе 5 мг/кг через пероральный зонд как раствор 2 мг/мл в растворителе 10% DMSO (диметилсульфоксид) в PEG-400 (полиэтиленгликоль со средней молекулярной массой приблизительно 400).
В публикации '135 не указывают пероральную биодоступность (выражаемую, например, AUC после перорального введения как процентной доли AUC после внутривенного введения), но из нее можно делать вывод, что она является значительно большей для ABT-263, чем для ABT-737.
Недавно, в Tse et al. (2008) Cancer Res. 68(9):3421-3428, сообщали в дополнительных данных к статье, что на модели собаки пероральная биодоступность раствора ABT-263 в PEG-400/DMSO составляла 22,4%, а раствора ABT-263 в 60% Phosal™ ПГ (фосфатидилхолин + пропиленгликоль), 30% PEG-400 и 10% этаноле составляла 47,6%.
Окислительные реакции представляют собой важный путь деградации лекарственных средств, в особенности, при составлении в растворе. Окисление может происходить посредством ряда путей, включая некатализируемое аутоокисление субстрата молекулярным кислородом, фотолитическое инициирование, гемолитическое температурное расщепление и катализ металлами. Различные функциональные группы демонстрируют индивидуальную чувствительность к окислению. В частности, тиоэфиры могут деградировать посредством отщепления водорода в α-положении к атому серы или добавления α-пероксильного радикала напрямую или посредством одноэлектронного процесса переноса, превращающего сульфид в сульфин, сульфон или сульфоксид (Hovorka & Schöneich (2001) J. Pharm. Sci 90:253-269).
Показано, что (фенилсульфанил)метиловая группа, принадлежащая соединениям, описываемым в публикации '135, включая ABT-263, обладает тиоэфирной связью, восприимчивой к окислению, например, в присутствии кислорода или активных форм кислорода, таких как супероксид, пероксид водорода или гидроксильные радикалы. Публикация '135 включает антиоксиданты в расширенный лист эксципиентов, указанных как применимые для введения описываемых в настоящем документе соединений.
Однако благоприятными будут фармацевтические композиции, менее восприимчивые к окислению активного ингредиента. Дополнительно, благоприятными будут композиции, способные к более высокой дозировке активного ингредиента, чем в композициях раствора в публикации '135 или Tse et al. (2008) выше. Кроме того, жидкие составы, как описано в публикации '135 и Tse et al. (2008) выше, могут являться неприятными для перорального приема на вкус или по другим причинам, и по данным причинам могут иметь место проблемы с соблюдением пациентом схемы лечения; таким образом, благоприятными являются твердые композиции.
Очень низкая растворимость соединений из публикации '135, включая ABT-263, в воде ставит задачу перед составителем рецептур, в особенности, если существует необходимость поддерживать приемлемую пероральную биодоступность, строго зависящую от растворимости в водной среде желудочно-кишечного тракта. Для решения задачи низкой пероральной биодоступности в данной области предлагают различные растворы. Например, в Sharma & Joshi (2007) Asian Journal of Pharmaceutics 1(1):9-19 обсуждают различные стратегии повышения растворимости при получении твердых дисперсий. Для получения твердых дисперсий в этом отношении описывают способ выпаривания растворителя, упоминаемый как пример твердой дисперсии эторикоксиба, получаемого способом, включающим растворение полиэтиленгликоля (PEG), поливинилпирролидона (PVP или повидона) и активного ингредиента в 2-пропаноле.
Конкретным типом заболевания, для которого необходимы улучшенные способы терапии, является неходжкинская лимфома (NHL). NHL является шестым самым распространенным типом новой злокачественной опухоли в США и имеет место, главным образом, у пациентов возрастом 60-70 лет. NHL является не отдельным заболеванием, а семейством родственных заболеваний, классифицируемых на основе нескольких характеристик, включающих клинические и гистологические признаки.
Одним способом классификации разделяют различные гистологические субтипы на две большие категории на основе течения заболевания, т.е., является ли заболевание медленно развивающимся или агрессивным. В основном, медленно растущие субтипы развиваются медленно и являются, как правило, неизлечимыми, в то время как агрессивные субтипы растут быстро и потенциально являются излечимыми. Фолликулярные лимфомы являются наиболее распространенным медленно растущим субтипом, и диффузные крупноклеточные лимфомы составляют наиболее распространенный агрессивный субтип. Онкобелок Bcl-2 исходно описывали при неходжкинской B-клеточной лимфоме.
Лечение фолликулярной лимфомы, как правило, состоит из основанной на природных веществах или комбинированной химиотерапии. Общепринято применяют комбинированное лечение ритуксимабом, циклофосфамидом, доксорубицином, винкристином и преднизоном (R-CHOP), также как комбинированное лечение ритуксимабом, циклофосфамидом, винкристином и преднизоном (RCVP). Также применяют монотерапию ритуксимабом (направленным на CD20, фосфопротеин, постоянно экспрессирующийся на поверхности B-клеткок) или флударабином. Добавление ритуксимаба в схемы химиотерапии может обеспечивать улучшенную скорость ответа и повышенную выживаемость без прогрессирования.
Для лечения трудноподдающейся лечению или рецидивирующей NHL можно применять средства для радиоиммунотерапии, химиотерапию высокими дозами и трансплантаты стволовых клеток. В настоящее время не существует утвержденной схемы лечения, приводящей к излечению, и в современных руководствах рекомендуют лечить пациентов в ходе клинического испытания, даже в условии первой линии.
Лечение пациентов с агрессивной обширной B-клеточной лимфомой первой линии, как правило, состоит из ритуксимаба, циклофосфамида, доксорубицина, винкристина и преднизона (R-CHOP), или скорректированными по дозе этопозидом, преднизоном, винкристином, циклофосфамидом, доксорубицином и ритуксимабом (DA-EPOCH-R).
Большинство лимфом исходно отвечает на любой из данных способов терапии, но опухоли, как правило, рецидивируют, и в конечном итоге становятся трудноподдающимися лечению. С повышением количества получаемых пациентами схем лечения становится больше резистентных к химиотерапии заболеваний. Средний ответ на терапию первой линии составляет приблизительно 75%, 60% - на вторую линию, 50% - на третью линию и приблизительно 35-40% на терапию четвертой линии. Предполагают, что скорости ответа, приближающиеся к 20% с единственным средством в условии многократных рецидивирующих заболеваний, являются положительными, и служат основанием для дополнительного исследования.
Современные химиотерапевтические средства проявляют свой противоопухолевый ответ, индуцируя апоптоз посредством множества механизмов. Однако многие опухоли в конечном итоге становятся резистентыми к данным средствам. В анализах кратковременного выживания in vitro и, в последнее время, in vivo показано, что Bcl-2 и Bcl-XL придают резистентность к химиотерапии. Это позволяет предполагать, что если можно разрабатывать улучшенные способы терапии, нацеленные на супрессию функции Bcl-2 и Bcl-XL, то можно успешно преодолевать резистентность к химиотерапии.
Способствующие апоптозу лекарственные средства, нацеленные на белки семейства Bcl-2, такие как Bcl-2 и Bcl-XL, лучше всего вводить по схеме лечения, обеспечивающей непрерывное, например, ежедневное, пополнение концентрации в плазме для поддержания концентрации в терапевтически эффективном диапазоне. Этого можно достигать ежедневным парентеральным, например, внутривенным (i.v.) или интраперитонеальным (i.p.) введением. Однако ежедневное парентеральное введение часто является непрактичным в клинических условиях, в частности, для амбулаторных пациентов. Для повышения клинической применимости способствующего апоптозу средства, например, в качестве химиотерапевтического средства для пациентов со злокачественными новообразованиями, крайне желательной будет твердая лекарственная форма с приемлемой пероральной биодоступностью. Такая лекарственная форма и схема лечения для ее перорального введения будут представлять важное продвижение в лечении многих типов злокачественных новообразований, включая NHL, и будут больше облегчать способы комбинированного лечения с другими химиотерапевтическими средствами.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
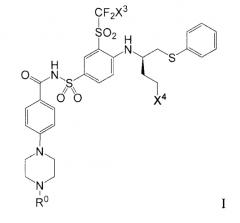
В настоящее время предоставляют твердую дисперсию, содержащую, по существу, в некристаллической, например аморфной, форме соединение формулы I:
где:
X3 является хлором или фтором; и
(1) X4 является азепан-1-илом, морфолин-4-илом, 1,4-оксазепан-4-илом, пирролидин-1-илом, -N(CH3)2, -N(CH3)(CH(CH3)2), 7-азабицикло[2.2.1]гептан-7-илом или 2-окса-5-азабицикло[2.2.1]гепт-5-илом; и R0 является
где
X5 является -CH2-, -C(CH3)2- или -CH2CH2-;
X6 и X7 оба являются -H или метильными радикалами; и
X8 является фтором, хлором, бромом или йодом;
или
(2) X4 является азепан-1-илом, морфолин-4-илом, пирролидин-1-илом, -N(CH3)(CH(CH3)2) или 7-азабицикло[2.2.1]гептан-7-илом; и R0 является
где X6, X7 и X8 являются указанными выше; или
(3) X4 является морфолин-4-илом или -N(CH3)2; и R0 является
где X8 является указанным выше;
или его фармацевтически приемлемую соль, пролекарство, соль пролекарства или метаболита; диспергированное в твердом связующем веществе, содержащем (a) фармацевтически приемлемый водорастворимый полимерный носитель и (b) фармацевтически приемлемое поверхностно-активное вещество.
Кроме того, предоставляют твердую перорально доставляемую лекарственную форму, содержащую такую твердую дисперсию, необязательно, совместно с одним или несколькими дополнительными эксципиентами.
Кроме того, предоставляют способ получения твердой дисперсии, как описано выше.
Данный способ включает:
(a) растворение активного фармацевтического ингредиента (API), содержащего (i) соединение формулы I или его фармацевтически приемлемую соль, пролекарство, соль пролекарства или метаболита, (ii) фармацевтически приемлемый водорастворимый полимерный носитель и (iii) фармацевтически приемлемое поверхностно-активное вещество в подходящем растворителе; и
(b) удаление растворителя для получения твердого связующего вещества, содержащего полимерный носитель и поверхностно-активное вещество и обладающего соединением или его солью, пролекарством, солью пролекарства или метаболита, диспергированными в нем, по существу, в некристаллической форме.
Соединение, присутствующее в конечной твердой дисперсии, может находиться в той же химической форме (например, нейтрального основания или соли), что и в API, применяемом для его получения. Альтернативно, способ включает один или несколько дополнительных этапов, где соединение превращают из нейтрального основания в соль, или наоборот. В конкретном варианте осуществления API является солью, например кристаллической солью, соединения формулы I, и конечная твердая дисперсия содержит соединение в форме нейтрального основания. По данному варианту осуществления способ дополнительно включает добавление основания до удаления растворителя для превращения соли в нейтральное основание и, необязательно, экстракцию побочного продукта такого превращения (например, побочного продукта в виде соли) из получаемой смеси.
Кроме того, предоставляют твердую дисперсию, получаемую описываемым выше способом.
Кроме того, предоставляют способ лечения заболевания, характеризуемого апоптотической дисфункцией и/или сверхэкспрессией антиапоптотического белка семейства Bcl-2, включающий пероральное введение страдающему заболеванием индивидууму терапевтически эффективного количества твердой дисперсии, как описано выше, или одной или нескольких твердых лекарственных форм, содержащих такую дисперсию. Примеры такого заболевания включают многие неопластические заболевания, включая злокачественные новообразования. Конкретным иллюстративным типом злокачественного новообразования, которое можно лечить по настоящему способу, является неходжкинская лимфома (NHL). Другим конкретным иллюстративным типом злокачественного новообразования, которое можно лечить по настоящему способу, является хронический лимфоцитарный лейкоз. Еще одним конкретным иллюстративным типом злокачественного новообразования, которое можно лечить по настоящему способу, является острый лимфоцитарный лейкоз, например, у детей.
По любому из описываемых выше вариантов осуществления изобретения соединение формулы I является иллюстративным ABT-263 или его фармацевтически приемлемой солью, пролекарством, солью пролекарства или метаболита, например, нейтральным основанием ABT-263 или бис-гидрохлоридной солью ABT-263 (бис-HCl ABT-263).
Кроме того, предоставляют способ для поддержания в кровотоке человека со злокачественным новообразованием, например, страдающего NHL пациента, терапевтически эффективной концентрации ABT-263 и/или одного или нескольких его метаболитов в плазме, включающий пероральное введение индивидууму твердой дисперсии ABT-263 или его фармацевтически приемлемой соли, пролекарства, соли пролекарства или метаболита (например, нейтрального основания ABT-263 или бис-HCl ABT-263) в, по существу, некристаллической форме в связующем веществе, содержащем фармацевтически приемлемый водорастворимый полимерный носитель и фармацевтически приемлемое поверхностно-активное вещество, в размере дозировки, эквивалентном приблизительно от 50 приблизительно до 500 мг эквивалента нейтрального основания ABT-263 в сутки, со средним интервалом между введениями лекарственного средства приблизительно от 3 часов приблизительно до 7 дней.
Дополнительные варианты осуществления изобретения, включающие более конкретные аспекты из указанных выше, будут находиться или будут понятны из следующего ниже подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 является графическим представлением эффектов различных поверхностно-активных веществ на скорости растворения твердых дисперсий, содержащих бис-HCl ABT-263, как описано в Примере 3.
Фиг. 2 является графическим представлением эффектов различных поверхностно-активных веществ на скорости растворения твердых дисперсий, содержащих нейтральное основание ABT-263, как описано в Примере 3.
Фиг. 3 является графическим представлением эффектов различных полимерных носителей на скорости растворения твердых дисперсий, содержащих бис-HCl ABT-263, как описано в Примере 4.
ПОДРОБНОЕ ОПИСАНИЕ
Твердая дисперсия по настоящему описанию содержит активный ингредиент, по существу, в некристаллической или аморфной форме, как правило, являющейся более растворимой, чем кристаллическая форма. Термин "твердая дисперсия" в настоящем документе включает системы, обладающие небольшими твердыми частицами одной фазы, диспергированными в другой твердой фазе. Более конкретно, настоящие твердые дисперсии содержат один или несколько активных ингредиентов, диспергированных в инертном носителе или связующем веществе в твердом состоянии, и которые можно получать нагреванием или азеотропным способом или сочетанием нагревания и азеотропного способа. По настоящему изобретению азеотропный способ, как описано в настоящем документе, является особенно предпочтительным, позволяющим избегать риска термического распада активного ингредиента при воздействии температур, требуемых для нагревания полимерного носителя.
"Аморфная форма" относится к частице без определенной структуры, т.е. без кристаллической структуры.
Термин "по существу, некристаллическая" в настоящем документе означает, что при рентгеноструктурном анализе наблюдают не более чем приблизительно 5%, например, не более чем приблизительно 2% или не более чем приблизительно 1% степени кристаллизации. В конкретном варианте осуществления при одном рентгеноструктурном анализе или поляризационной микроскопии, или обоих способах, не наблюдают определяемой кристаллизации.
Соединения формулы I, включая их соли, пролекарства, соли пролекарств и метаболитов, применяемые в настоящем документе, как правило, обладают очень низкой растворимостью в воде, например, менее чем приблизительно 100 мкг/мл, в большинстве случаев менее чем приблизительно 30 мкг/мл. Настоящее изобретение может являться особенно благоприятным для лекарственных средств, по существу, нерастворимых в воде, т.е. обладающих растворимостью менее чем приблизительно 10 мкг/мл, т.к. способ по изобретению повышает условную насыщаемость раствора такого плохо растворимого активного ингредиента. Примерами таких активных ингредиентов являются, например, лекарственные вещества класса IV по Биофармацевтической системе классификации (BCS), характеризуемые низкой растворимостью и низкой проницаемостью (смотри, "Waiver of in vivo bioavailability and bioequivalence studies for immediate-release solid oral dosage forms based on a biopharmaceutics classification system", U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), август 2000). Следует понимать, что растворимость в воде многих соединений является pH-зависимой; в случае таких соединений интересующая растворимость в настоящем документе соответствует физиологическому уровню pH, например, pH приблизительно от 1 приблизительно до 8. Таким образом, в различных вариантах осуществления лекарственное средство обладает растворимостью в воде, по меньшей мере, в какой-то момент в диапазоне pH приблизительно от 1 приблизительно до 8, менее чем приблизительно 100 мкг/мл, например, менее чем приблизительно 30 мкг/мл, или менее чем приблизительно 10 мкг/мл. В качестве иллюстрации, ABT-263 обладает растворимостью в воде менее чем 4 мкг/мл при pH 2.
Твердые дисперсии по настоящему изобретению содержат в качестве активного ингредиента соединение формулы I, как определено выше, или фармацевтически приемлемую соль, пролекарство, соль пролекарства или метаболита такого соединения. Необязательно, они могут дополнительно содержать второй активный ингредиент, например, терапевтическое средство, применимое в комбинированном лечении с соединением формулы I, как указано в настоящем документе ниже.
В одном из вариантов осуществления соединение обладает формулой I, где X3 является фтором.
В дополнительном варианте осуществления соединение обладает формулой I, где X4 является морфолин-4-илом.
В еще одном дополнительном варианте осуществления соединение обладает формулой I, где R0 является
где X5 является -O-, -CH2-, -C(CH3)2- или -CH2CH2-; X6 и X7 оба являются -H или метильными радикалами; и X8 является фтором, хлором, бромом или йодом. В качестве иллюстрации по данному варианту осуществления X5 может являться -C(CH3)2-, и/или каждый из X6 и X7 может являться -H, и/или X8 может являться хлором.
В еще одном дополнительном варианте осуществления соединение обладает формулой I, где R0 является
где X5 является -O-, -CH2-, -C(CH3)2- или -CH2CH2-; X6 и X7 оба являются -H или метильными радикалами; и X8 является фтором, хлором, бромом или йодом. В качестве иллюстрации по данному варианту осуществления X5 может являться -C(CH3)2-, и/или каждый из X6 и X7 может являться -H, и/или X8 может являться хлором.
В еще одном дополнительном варианте осуществления соединение обладает формулой I, где X3 является фтором, и X4 является морфолин-4-илом.
В еще одном дополнительном варианте осуществления соединение обладает формулой I, где X3 является фтором, и R0 является
где X5 является -O-, -CH2-, -C(CH3)2- или -CH2CH2-; X6 и X7 оба являются -H или метильными радикалами; и X8 является фтором, хлором, бромом или йодом. В качестве иллюстрации по данному варианту осуществления X5 может являться -C(CH3)2-, и/или каждый из X6 и X7 может являться -H, и/или X8 может являться хлором.
В еще одном дополнительном варианте осуществления соединение обладает формулой I, где X4 является морфолин-4-илом, и R0 является
где X5 является -O-, -CH2-, -C(CH3)2- или -CH2CH2-; X6 и X7 оба являются -H или метильными радикалами; и X8 является фтором, хлором, бромом или йодом. В качестве иллюстрации по данному варианту осуществления X5 может являться -C(CH3)2- и/или каждый из X6 и X7 может являться -H, и/или X8 может являться хлором.
В еще одном дополнительном варианте осуществления соединение обладает формулой I, где X3 является фтором, X4 является морфолин-4-илом, и R0 является
где X5 является -O-, -CH2-, -C(CH3)2- или -CH2CH2-; X6 и X7 оба являются -H или метильными радикалами; и X8 является фтором, хлором, бромом или йодом. В качестве иллюстрации по данному варианту осуществления X5 может являться -C(CH3)2-, и/или каждый из X6 и X7 может являться -H, и/или X8 может являться хлором.
Соединения формулы I могут содержать ассиметрично замененные атомы углерода в R- или S-конформации; такие соединения могут присутствовать в качестве рацематов или в избытке одной конформации по сравнению с другой, например, в энантиомерном отношении, по меньшей мере, приблизительно 85:15. Соединение может являться, по существу, энантиомерно чистым, например, обладающим энантиомерным отношением, по меньшей мере, приблизительно 95:5, или в некоторых случаях, по меньшей мере, приблизительно 98:2 или, по меньшей мере, приблизительно 99:1.
Соединения формулы I могут альтернативно или дополнительно содержать углерод-углеродные двойные связи или углерод-азотные двойные связи в Z- или E-конформации, термином "Z" обозначают конформацию, где больший заместитель находится на той же стороне такой двойной связи, и термином "E" обозначают конформацию, где больший заместитель находится на других сторонах двойной связи. Соединение альтернативно может присутствовать в качестве смеси Z- и E-изомеров.
Соединения формулы I могут альтернативно или дополнительно существовать в качестве таутомеров или их равновесных смесей, где протон сдвигается от одного атома к другому. Примеры таутомеров, в качестве иллюстрации, включают кето-енол, фенол-кето, оксим-нитрозо, нитро-аци, имин-енамин и т.п.
В некоторых вариантах осуществления соединение формулы I присутствует в твердой дисперсии в форме своего исходного соединения, отдельно или совместно с солевой или пролекарственной формой соединения.
Соединения формулы I могут образовывать кислые соли присоединения, основные соли присоединения или цвиттерионы. Соли соединения формулы I можно получать при экстракции или последующей очистке соединения. Кислые соли присоединения являются таковыми, получаемыми при реакции соединения формулы I с кислотой. Например, в композиции по изобретению можно применять соли, включающие ацетат, адипинат, альгинат, бикарбонат, цитрат, аспартат, бензоат, бензолсульфонат (бесилат), бисульфат, бутират, камфорат, камфоросульфонат, диглюконат, формиат, фумарат, глицерофосфат, глутамат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, лактобионат, лактат, малеат, мезителенсульфонат, метансульфонат, нафтиленсульфонат, никотинат, оксалат, памоат, пектинат, персульфат, фосфат, пикрат, пропионат, сукцинат, пируват, тиоцианат, трихлорацетат, трифторацетат, пара-толуолсульфонат и ундеканоат соединения формулы I. Аналогично можно применять основные соли присоединения, включающие таковые, получаемые при реакции соединения с бикарбонатом, карбонатом, гидроксидом или фосфатом катионов, таких как литий, натрий, калий, кальций и магний.
Соединение формулы I, как правило, обладает несколькими протонируемыми атомами азота и, таким образом, способно образовывать кислые соли присоединения с несколькими, например, приблизительно от 1,2 приблизительно до 2, приблизительно от 1,5 приблизительно до 2 или приблизительно от 1,8 приблизительно до 2, эквивалентами кислоты на эквивалент соединения.
Аналогично, ABT-263 может образовывать кислые соли присоединения, основные соли присоединения или цвиттерионы. Соли ABT-263 можно получать при экстракции или последующей очистке соединения. Кислые соли присоединения, получаемые при реакции ABT-263 с кислотой, включают указанные выше. Аналогично можно применять основные соли присоединения, включающие указанные выше. ABT-263 обладает, по меньшей мере, двумя протонируемыми атомами азота и, таким образом, способен образовывать кислые соли присоединения с несколькими, например, приблизительно от 1,2 приблизительно до 2, приблизительно от 1,5 приблизительно до 2 или приблизительно от 1,8 приблизительно до 2, эквивалентами кислоты на эквивалент соединения.
В качестве иллюстрации, в случае ABT-263 могут образовываться бис-соли, включая, например, бис-гидрохлоридные (бис-HCl) и бис-гидробромидные (бис-HBr) соли.
Например, бис-HCl ABT-263, обладающую молекулярной массой 1047,5 г/моль и представленную формулой
можно получать множеством способов, например, способом, который можно обозначать следующим образом.
Получают нейтральное основание ABT-263, в качестве иллюстрации, как описано в Примере 1 цитируемой выше публикации патентной заявки США № 2007/0027135, полное описание которой включено в настоящий документ в качестве ссылки. Подходящую массу нейтрального основания ABT-263 растворяют в этилацетате. Раствор соляной кислоты в этаноле (например, приблизительно 4,3 кг HCl в 80 г EtOH) добавляют к раствору ABT-263 в количестве, обеспечивающем, по меньшей мере, 2 моль HCl на моль ABT-263 и достаточно EtOH (по меньшей мере, приблизительно 20 объемов) для кристаллизации получаемой соли бис-HCl ABT-263. Раствор нагревают приблизительно до 45°C с перемешиванием, и добавляют кристаллы-затравки в качестве суспензии в EtOH. После приблизительно 6 часов получаемую суспензию охлаждают приблизительно до 20°C в течение приблизительно 1 часа, и перемешивают при данной температуре в течение приблизительно 36 часов. Суспензию фильтруют для восстановления кристаллического твердого вещества, являющегося этаноловым сольватом бис-HCl ABT-263. При высушивании данного твердого вещества под действием вакуума и азота с умеренным перемешиванием в течение приблизительно 8 дней получают белые высушенные кристаллы бис-HCl ABT-263. Данный материал подходит в качестве API для получения состава бис-HCl ABT-263 или (посредством добавления этапа превращения соли в основание в способ получения твердой дисперсии) нейтрального основания ABT-263 по настоящему изобретению.
Термин "нейтральное основание" применяют для удобства в настоящем документе для обозначения исходного соединения, в то же время понимая, что исходное соединение является, строго говоря, цвиттерионным и, таким образом, не всегда ведет себя как настоящее основание.
Соединения формулы I и способы получения таких соединений описывают в цитируемой выше публикации патентной заявки США № 2007/0027135 и/или в цитируемой выше публикации патентной заявки США № 2007/0072860, каждая из которых в полном объеме включена в настоящий документ в качестве ссылки. Термины для заместителей, применяемые в настоящем документе, определяют точно, как в тех публикациях.
Соединения формулы I, обладающие группами -NH, -C(O)OH, -OH или -SH, могут присоединять к ним образующие пролекарство группы, которые можно удалять метаболическими способами in vivo для высвобождения исходного соединения, обладающего свободными группами -NH, -C(O)OH, -OH или -SH. Также можно применять соли пролекарств.
Не ограничиваясь в теории, полагают, что терапевтическая эффективность соединений формулы I вызвана, по меньшей мере, частично, их способностью связываться с белком семейства Bcl-2, таким как Bcl-2, Bcl-XL или Bcl-w, способом, который ингибирует антиапоптотическое действие белка, например, занимая BH3-связывающую щель белка. Как правило, желательным является выбирать соединение, обладающее высокой аффинностью связывания для белка семейства Bcl-2, например, Ki не больше чем приблизительно 5 нМ, предпочтительно - не больше чем приблизительно 1 нМ.
Твердую дисперсию, как предоставляют в настоящем документе, содержащую любое специфическое соединение, описываемое в публикации '135, определенно включают в качестве варианта осуществления настоящего изобретения.
В более конкретном варианте осуществления, композиция содержит ABT-263 или его соль, пролекарство, соль пролекарства или метаболита. В еще более конкретном варианте осуществления, композиция содержит исходное соединение ABT-263 (т.е. нейтральное основание) или соль, пролекарство или соль пролекарства. В еще более конкретном варианте осуществления, композиция содержит нейтральное основание ABT-263 или его соль. В даже более конкретном варианте осуществления композиция содержит нейтральное основание ABT-263 или бис-HCl ABT-263.
Бис-HCl ABT-263, благодаря своей кристаллической природе, как правило, является более удобным для применения в качестве API, чем нейтральное основание ABT-263, получаемое по публикации '135 в аморфном или стеклообразном твердом состоянии. Однако могут существовать преимущества в предоставлении состава твердой дисперсии ABT-263, где ABT-263 находится в форме нейтрального основания, т.к. лекарственное средство будет менее склонным к кристаллизации внутри состава или непосредственно после высвобождения из него. Таким образом, в еще более конкретном варианте осуществления композиция содержит нейтральное основание ABT-263. Отмечают, что в данном варианте осуществления не является необходимой форма нейтрального основания ABT-263, применяемая в качестве API при получении композиции.
Соединение формулы I или его соль, пролекарство, соль пролекарства или метаболита присутствуют в твердой дисперсии по изобретению в количестве, которое может являться терапевтически эффективным, когда композицию вводят нуждающемуся в этом индивидууму по соответствующей схеме лечения. Размеры дозировки в настоящем документе выражают как количества эквивалента исходного соединения (эквивалента нейтрального основания), если контекст не требует иного. Как правило, однократная доза (количество, вводимое в одно время), которую можно вводить с соответствующей частотой, например, от двух раз в сутки до одного раза в неделю, составляет приблизительно от 10 приблизительно до 1000 мг в зависимости от рассматриваемого соединения. Если частота введения составляет один раз в сутки (q.d.), однократная доза и суточная доза являются одинаковыми. В качестве иллюстрации, например, если лекарственное средство является ABT-263, однократная доза, как правило, составляет приблизительно от 25 приблизительно до 1000 мг, более типично, приблизительно от 50 приблизительно до 500 мг, например, приблизительно 50, приблизительно 100, приблизительно 150, приблизительно 200, приблизительно 250, приблизительно 300, приблизительно 350, приблизительно 400, приблизительно 450 или приблизительно 500 мг. Если лекарственная форма содержит оболочку кап