Способ моделирования биоинженерного каркаса сердца в эксперименте на крысе
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к регенеративной медицине, и может быть использовано в клеточной и молекулярной биологии, а также в торакальной хирургии для создания биоинженерного органа в качестве трансплантата. Способ моделирования биоинженерного каркаса сердца в эксперименте включает введение крысе антикоагулянта, выделение органа, очищение его от окружающей жировой ткани, канюлирование аорты, осуществление децеллюляризации путем перфузии в биореакторе, а также контроль качества полученного каркаса на биосовместимость и жизнеспособность. При этом антикоагулянт гепарин вводят крысе интраперитонеально в дозе 100 ЕД перед забором органокомплекса сердце-легкие. Аорту канюлируют выше уровня отхождения левой подключичной артерии с последующим лигированием ветвей дуги аорты. Осуществляют лигирование устья полых вен, отсекают легкие. Перфузию для децеллюляризации осуществляют в течение 28 часов через аорту при атмосферном давлении и скорости потока реагентов через орган 2,4-3,6 мл/минуту. При этом перфузию фосфатным буфером с добавлением 1% пенициллина-стрептомицина и деионизированной водой проводят по 1,5 часа. Затем используют 4% раствор дезоксихолата натрия в комбинации с 0,002М Na2-ЭДТА в течение 3,5 часов. Фосфатный буфер с добавлением 1% пенициллина-стрептомицина используют в течение 1 часа, свиную панкреатическую ДНКазу-I 2000 ЕД /200 мл фосфатного буфера с кальцием и магнием - в течение 2,5 часов. Завершают децеллюляризацию фосфатным буфером с добавлением 1% пенициллина-стрептомицина со сменой раствора каждые 6 часов. Жизнеспособность клеток на полученном каркасе определяют по наличию дифференциального окрашивания живых и мертвых клеток, по способности дегидрогеназ живых клеток восстанавливать неокрашенные формы 3-4,5-диметилтиазол-2-ил-2,5-дифенилтераразола до голубого кристаллического фармазана, растворимого в диметилсульфоксиде. Способ позволяет сократить время экспозиции перфузионных растворов, снизить вероятность бактериальной контаминации, повысить качество получаемого каркаса в сравнении с другими способами того же назначения, оценить биосовместимость и жизнеспособность клеток, засеянных на каркас. 6 ил.
Реферат
Предлагаемое изобретение относится к медицине, а именно к регенеративной медицине, и может быть использовано в клеточной биологии, молекулярной биологии, торакальной хирургии для создания технологии получения и использования в практических целях биоинженерного органа в качестве трансплантата.
Сердечно-сосудистые заболевания - основная причина инвалидизации и преждевременной смерти жителей экономически развитых стран [ВОЗ. http://www.who.int/mediacentre/factsheets/fs310/ru/]. Рост заболеваемости, поражение людей все более молодого возраста делают эти болезни важнейшей медико-социальной проблемой здравоохранения [ВОЗ. http://www.who.int/gho/publications/world_health_statistics]. Хроническая сердечная недостаточность (ХСН) - одно из самых частых осложнений заболеваний сердечно-сосудистой системы. Количество больных, которые достигают терминальной стадии ХСН, постоянно растет. Трансплантация сердца - хирургический способ лечения терминальной стадии ХСН. Каждый год в мире проводят более 5400 операций по пересадке сердца [ВОЗ. http://www.who.int/transplantation/gkt/statistics/en/]. В настоящее время, основные проблемы трансплантологии связаны с острой нехваткой донорских органов, сложностью их доставки, трудностью поиска иммунологически совместимых органов и пожизненным назначением иммуносупрессивной терапии [Fuchs J.R et al., 2001]. Поэтому одной из наиболее перспективных задач можно считать развитие тканевой инженерии, как одного из направлений регенеративной медицины [Murphy S.V. et al., 2012, Taylor D.A. 2009].
В развитии современной тканевой инженерии приоритетным направлением является разработка биоинженерных каркасов и биоматериалов, применение которых позволило бы решать как этические, так и иммунологические проблемы трансплантологии. Для создания органов и тканей будут использоваться каркасы или матриксы (биологические или искусственные), клетки (ауто-, алло-, ксеногенные), биореакторы и биоактивные молекулы [Fuchs J.R et al., 2001, McIntire L.V. et al. 2002., Langer R. et al. 1993., Skalak R. Et al. 1988., Amulya S. 2005., Atala A. 2005].
Децеллюляризация - это способ получения биологических каркасов, который направлен на удаление клеток с сохранением внеклеточного матрикса (ВКМ) и трехмерности структуры органа [Badylak S.F. et al. 2011]. Межклеточное вещество рыхлой волокнистой соединительной ткани состоит из волокон и аморфного вещества. Оно является продуктом деятельности клеток этой ткани, в первую очередь фибробластов. Архитектоника и состав ВКМ в каждой ткани являются уникальными, определяют функциональность этой ткани. Тем не менее, структура и состав каждого конкретного белка ВКМ остаются неизменными у различных видов [Exposito J.Y. et al. 1992., Bernard M.P. et al. 1983., Bernard M.P. et al. 1983]. Это способствуют тому, что ВКМ одних видов не вызывает иммунного отторжения у других. При правильном удалении клеточных антигенов, которые вызывают иммунное отторжение без повреждения ВКМ, полученный каркас может служить мощным источником сигналов и содействовать конструктивному ремоделированию тканей после повреждения. «Конструктивное ремоделирование» означает, что каркас ВКМ содействует формированию участка соответствующей ткани в месте имплантации, вместо образования рубцовой ткани [Badylak S.F. 2007]. Для создания соответствующего требованиям каркаса биоинженерного органа требуется: во-первых, воссоздать структуру, сходную с нативной; во-вторых, развитая сосудистая сеть, способная обеспечить адекватную перфузию тканей; в-третьих, необходимо, чтобы клетки, используемые при рецеллюляризации, были способны к дифференцировке во все паренхиматозные и сосудистые структуры органа; в-четвертых, иметь возможность управления микроокружением клеток для воздействия на их физиологию и функции; в-пятых, должна существовать возможность управления дифференцировкой и созреванием клеток in vitro [Taylor D., 2009].
С учетом высокой смертности от хронических заболеваний сердечнососудистой системы, весьма актуальной является разработка способа моделирования биоинженерного каркаса сердца в эксперименте на крысе.
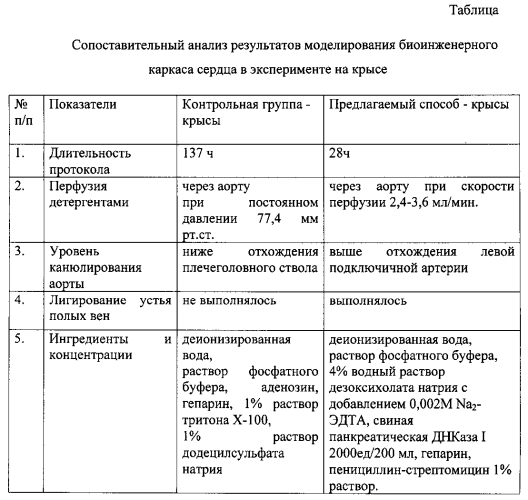
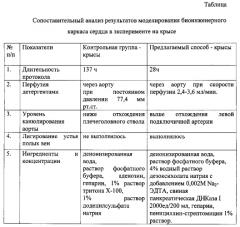
В частности, известен способ децеллюляризации сердца свиньи [Wainwright J.M., Czajka С.А., Patel U.B. et al. Preparation of cardiac extracellular matrix from an intact porcine heart. Tissue engineering: Part C; 2010; 16(3): 525-532]. Протокол включает в себя заморозку сердца свиньи при -80°C, с последующей перфузией через аорту очищенной водой, фосфатно-буферным солевым раствором, детергентами и ферментами: растворами, содержащими 0,02% трипсина, 0,05% ЭДТА, 0,05% NaN3, 3% тритона Х-100, 4% дезоксихолата натрия, а также дезинфекцию каркаса перфузией раствора, содержащего 0,1% надуксусной кислоты и 4% этанола и отмывку каркаса фосфатно-буферным солевым раствором и очищенной водой с общей продолжительностью 25 часов. Контроль качества полученного каркаса определяют гистологическими методами, путем сканирующей электронной микроскопии, количественного определения остаточного уровня ДНК, гликозаминогликанов, а также изучением механических свойств.
Основными недостатками данного способа являются использование больших объемов дорогостоящих реагентов для проведения децеллюляризации, а также необходимость длительного размораживания нативного сердца после извлечения из морозильной камеры, повышающая риск бактериальной контаминации. Способ предусматривает контроль получаемого биоинженерного каркаса сердца только по данным гистологического исследования, по оценке механических и эластических свойств каркаса. Также в данном протоколе децеллюляризацию проводят на модели сердца свиньи, что, в связи с физиологическими отличиями животных, не может транслироваться на модель сердца крысы без изменений и дополнений.
За ближайший аналог принят способ проведения децеллюляризации сердца крысы [Ott Н.С, Matthiesen T.S, Goh S.K. et al. Perfusion decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 2008; 14:213-21], заключающийся в выделении сердца крысы, очищении его от окружающей жировой клетчатки, канюлировании аорты до уровня отхождения плечеголовного ствола, проведении ретроградной перфузии сердца через аорту фосфатным буфером (PBS) с добавлением антикоагулянта гепарина, аденозина и антибиотика-антимикотика, деионизированной водой и растворами детергентов: 1% додецилсульфата натрия и 1% тритона Х-100 в течение ~137 часов. Контроль качества децеллюляризации проводился путем гистологического исследования, анализа морфологической структуры, количественного определения уровня ДНК и механических свойств полученного каркаса.
Основным недостатком данного способа является длительность проведения децеллюляризации, создающая угрозу бактериальной контаминации каркаса, нарушения структуры каркаса в связи с длительностью воздействия детергентов и их высокой концентрацией.
Задачи: максимальное сохранение гистологической структуры внеклеточного матрикса сердца, обеспечение щадящего режима обработки биологического материала, снижение концентрации детергентов, времени экспозиции растворов и вероятности бактериальной контаминации получаемого каркаса, т.е. повышение качества получаемого биоинженерного материала и обеспечение контроля его качества.
Сущностью предлагаемого способа моделирования биоинженерного каркаса сердца в эксперименте на крысе является то, что антикоагулянт гепарин вводят крысе интраперитонеально в дозе 100 ЕД перед забором органокомплекса сердце-легкие, аорту канюлируют выше уровня отхождения левой подключичной артерии с последующим лигированием ветвей дуги аорты, осуществляют лигирование устья полых вен, отсекают легкие, перфузию для децеллюляризации осуществляют в течение 28 часов через аорту при атмосферном давлении и скорости потока реагентов через орган 2,4-3,6 мл/минуту, при этом перфузию фосфатным буфером с добавлением 1% пенициллина-стрептомицина и деионизированной водой проводят по 1,5 часа, затем используют 4% раствор дезоксихолата натрия в комбинации с 0,002М Na2-ЭДТА в течение 3,5 часов, фосфатный буфер с добавлением 1% пенициллина-стрептомицина - в течение 1 часа, свиную панкреатическую ДНКазу-I 2000 ЕД/200 мл фосфатного буфера с кальцием и магнием - 2,5 часов и завершают децеллюляризацию фосфатным буфером с добавлением 1% пенициллина-стрептомицина со сменой раствора каждые 6 часов, причем жизнеспособность клеток на полученном каркасе определяют по наличию дифференциального окрашивания живых и мертвых клеток, по способности дегидрогеназ живых клеток восстанавливать неокрашенные формы 3-4,5-диметилтиазол-2-ил-2,5-дифенилтераразола до голубого кристаллического фармазана, растворимого в диметилсульфоксиде.
Техническим результатом способа является сокращение времени экспозиции перфузионных растворов. Ранее использовавшиеся протоколы повреждали каркас сердца и несли высокий риск развития бактериальной контаминации, что крайне неблагоприятно сказывалось на качестве полученного каркаса сердца и возможности последующего создания биоинженерного органа. Применение дезоксихолата натрия, снижение времени воздействия децеллюляризирующих растворов полностью нивелирует негативные эффекты известных способов того же назначения. Кроме того, способ предусматривает оценку биосовместимости и жизнеспособности клеток, засеянных на каркас, по наличию дифференциального окрашивания живых и мертвых клеток, по способности дегидрогеназ живых клеток восстанавливать неокрашенные формы 3-4,5-диметилтиазол-2-ил-2,5-дифенилтераразола до голубого кристаллического фармазана, растворимого в диметилсульфоксиде (МТТ-тест).
Способ моделирования биоинженерного каркаса сердца в эксперименте на крысе осуществляют следующим образом: для децеллюляризации используют предварительно гепаринизированных крыс (интраперитонеально вводят 100 ЕД антикоагулянта гепарина). Выделяют органокомплекс сердце-легкие. Очищают от окружающей жировой ткани. Аорту канюлируют на расстоянии 3-3,5 см от сердца выше уровня отхождения левой подключичной артерии. Ветви дуги аорты: плечеголовной ствол, левую общую сонную и левую подключичную артерии лигируют. Переднюю и заднюю полые вены отсекают. Устья полых вен лигируют. Отсекают легкие. Для проведения децеллюляризации сердце помещают в биореактор и начинают ретроградную перфузию жидкости через аорту в течение 28 часов при атмосферном давлении и скорости потока реагентов 2,4-3,6 мл/мин. Этапы децеллюляризации: фосфатный буфер с добавлением 1% пенициллина-стрептомицина - 1,5 часа, деионизированная вода - 1,5 часа, дезоксихолат натрия 4% в комбинации с 0,002М Na2 - ЭДТА - 3,5 часа, фосфатный буфер с добавлением 1% пенициллина-стрептомицина - 1 час, свиная панкреатическая ДНКаза-I 2000 ЕД /200 мл фосфатного буфера с кальцием и магнием - 2,5 часа, фосфатный буфер с добавлением 1% пенициллина-стрептомицина - 18 часов, со сменой раствора каждые 6 часов. Все растворы должны быть стерильными.
Контроль качества полученного биоинженерного каркаса осуществляют методами гистологического исследования (окрашивание гематоксилином и эозином, по Ван Гизон, трихромом по Массону, флуорофором DAPI (4′,6-диамидино-2-фенилиндолом)), сканирующей электронной микроскопии для подтверждения сохранности архитектоники внеклеточного матрикса сердца и отсутствия клеточных элементов на сердечном каркасе, количественного определения уровня оставшейся ДНК [Badylak S.F. et al., 2011], а также путем определения предельных биомеханических параметров на растяжение каркаса на универсальных испытательных машинах фирмы Инстрон модель 5965 (датчик 50 Н) и на Lloyd LRX (100 N load cell) [Witzenburg С. et al., 2012]. Сохранность белков внеклеточного матрикса и отсутствие внутриклеточных белков определяют при помощи иммуногистохимического исследования [Ott Н.С.et al., 2008]. Проходимость сосудистого русла определяют перфузией через аорту 0,4% раствора трипанового синего. Жизнеспособность клеток на полученном каркасе определяют путем колориметрического анализа с использованием МТТ-реагента по способности дегидрогеназ живых клеток восстанавливать неокрашенные формы 3-4,5-диметилтиазол-2-ил-2,5-дифенилтераразола до голубого кристаллического фармазана, растворимого в диметилсульфоксиде, в целях установления цитотоксичности полученного каркаса и проведения последующих экспериментов по рецеллюляризации. Колориметрический анализ проводят согласно рекомендациям в инструкции производителя (инструкция прилагается). Также для определения цитотоксичности каркаса проводят дифференциальное окрашивание живых и мертвых клеток с применением флуоресцентных красителей - кальцеина AM (окрашивает живые клетки) и гомодимера этидия (окрашивает мертвые клетки).
Способ апробирован в течение 2 лет на биологическом материале (сердце) экспериментальных животных (крысы). Результаты полностью подтвердили решаемые задачи. Получены естественные каркасы органов, с сохранным внеклеточным матриксом и отсутствием клеточных структур.
Данный способ моделирования биоинженерного каркаса сердца в эксперименте на крысе использован в эксперименте на 50 крысах-самцах линии Lewis. Выполнены забор и фиксация в биореакторе сердца с последующей децеллюляризацией по предлагаемому способу.
Пример: после проведения эвтаназии передозировкой наркотических средств в соответствии с этическими требованиями и интраперитонеального введения 100 ЕД гепарина произвели забор органокомплекса сердце-легкие у крысы-самца линии Lewis весом 200 г. Органокомплекс очистили от окружающей жировой ткани, лигировали устья полых вен, плечеголовной ствол, левую общую сонную артерию, левую подключичную артерию, отсекли легкие, канулировали аорту и фиксировали в биореакторе. Начали децеллюляризацию сердца путем перфузии сердца через аорту децеллюляризирующими растворами: фосфатным буфером с добавлением 1% пенициллина-стрептомицина в течение 1,5 часов, деионизированной водой - 1,5 часа, 4% водным раствором дезоксихолата натрия в комбинации с 0,002М Na2-ЭДТА 3,5 часа, фосфатным буфером с добавлением 1% пенициллина-стрептомицина в течение 1 часа, свиной панкреатической ДНКазой I (2000 ЕД растворили в 200 мл фосфатного буфера с кальцием и магнием - 2,5 часа, фосфатным буфером с добавлением 1% пенициллина-стрептомицина в течение 18 часов со сменой раствора каждые 6 часов. Контроль качества полученного биоинженерного каркаса осуществляли методами гистологического исследования (окрашиванием гематоксилином и эозином, по Ван Гизон, трихромом по Массону, флуорофором DAPI (4′,6-диамидино-2-фенилиндолом)), путем применения сканирующей электронной микроскопии для подтверждения сохранности архитектоники внеклеточного матрикса сердца и отсутствия клеточных элементов на сердечном каркасе, количественно определили уровень оставшейся ДНК, установили предельные биомеханические параметры на растяжение каркаса на универсальных испытательных машинах фирмы Инстрон модель 5965 (датчик 50 Н) и на Lloyd LRX (100 N load cell). Сохранность белков внеклеточного матрикса (коллагена I, III и IV типов, ламинина, эластина, фибронектина) и отсутствие внутриклеточных белков (актина, тропомиозина, фактора Виллебранда) определили при помощи иммуногистохимического исследования, по наличию либо отсутствию специфичной реакции с антителами против данных белков. Проходимость сосудистого русла выявили перфузией через аорту 0,4% раствора трипанового синего, которая показала проходимость коронарных артерий и позволила визуализировать сосуды вплоть до артерий третьего-четвертого порядка. Жизнеспособность клеток на полученном каркасе определяли путем колориметрического анализа с использованием МТТ-реагента по способности дегидрогеназ живых клеток восстанавливать неокрашенные формы 3-4,5-диметилтиазол-2-ил-2,5-дифенилтераразола до голубого кристаллического фармазана, растворимого в диметилсульфоксиде (МТТ-тест) в целях установления цитотоксичности полученного каркаса и проведения последующих экспериментов по рецеллюляризации. Также для определения цитотоксичности каркаса провели дифференциальное окрашивание живых и мертвых клеток с применением флуоресцентных красителей - кальцеина AM (окрашивал живые клетки) и гомодимера этидия (окрашивал мертвые клетки).
В результате экспериментов по децеллюляризации получен каркас сердца с сохранением гистологической архитектоники и белков внеклеточного матрикса. Результаты рецеллюляризации показывают, что полученный каркас не является токсичным для клеток.
Способ моделирования биоинженерного каркаса сердца в эксперименте на крысе, включающий введение крысе антикоагулянта, выделение органа, очищение его от окружающей жировой ткани, канюлирование аорты, осуществление децеллюляризации путем перфузии в биореакторе, а также контроль качества полученного каркаса на биосовместимость и жизнеспособность, отличающийся тем, что антикоагулянт гепарин вводят крысе интраперитонеально в дозе 100 ЕД перед забором органокомплекса сердце-легкие, аорту канюлируют выше уровня отхождения левой подключичной артерии с последующим лигированием ветвей дуги аорты, осуществляют лигирование устья полых вен, отсекают легкие, перфузию для децеллюляризации осуществляют в течение 28 часов через аорту при атмосферном давлении и скорости потока реагентов через орган 2,4-3,6 мл/минуту, при этом перфузию фосфатным буфером с добавлением 1% пенициллина-стрептомицина и деионизированной водой проводят по 1,5 часа, затем используют 4% раствор дезоксихолата натрия в комбинации с 0,002М Na2-ЭДТА в течение 3,5 часов, фосфатный буфер с добавлением 1% пенициллина-стрептомицина - в течение 1 часа, свиную панкреатическую ДНКазу-I 2000 ЕД/200 мл фосфатного буфера с кальцием и магнием - 2,5 часов и завершают децеллюляризацию фосфатным буфером с добавлением 1% пенициллина-стрептомицина со сменой раствора каждые 6 часов, причем жизнеспособность клеток на полученном каркасе определяют по наличию дифференциального окрашивания живых и мертвых клеток, по способности дегидрогеназ живых клеток восстанавливать неокрашенные формы 3-4,5-диметилтиазол-2-ил-2,5-дифенилтераразола до голубого кристаллического фармазана, растворимого в диметилсульфоксиде.