Основанные на амидах пролекарства пептидов глюкагонового надсемейства
Иллюстрации
Показать всеИзобретение относится к пролекарственным препаратам пептидов глюкагонового надсемейства, в которых пептид глюкагонового надсемейства модифицирован связыванием дипептида с пептидом глюкагонового надсемейства амидной связью. Пролекарства, раскрытые в настоящем изобретении, имеют увеличенное время полужизни и превращаются в активную форму в физиологических условиях в результате неферментативной реакции, вызываемой химической нестабильностью. 3 н. и 27 з.п. ф-лы, 15 ил., 8 табл., 16 пр.
Реферат
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет согласно предварительной патентной заявке США № 61/139210, поданной 19 декабря 2008, предварительной патентной заявке США № 61/144271, поданной 13 января 2009, и предварительной патентной заявке США № 61/187556, поданной 16 июня 2009. Описание каждой заявки специально включено в настоящее описание посредством ссылки во всей своей полноте.
Предшествующий уровень техники
Основанные на пептидах лекарственные средства являются высокоэффективными лекарственными средствами с относительно короткой продолжительностью действия и непостоянным терапевтическим индексом. Настоящее изобретение относится к основанным на пептидах пролекарствам, где пролекарственное производное предназначено для задержки начала действия и удлинения времени полужизни лекарственного средства. Задержка начала действия имеет преимущество, которое заключается в том, что она обеспечивает возможность системного распределения пролекарства перед его активацией. Соответственно, введение пролекарств исключает осложнения, вызываемые максимальными активностями при введении, и повышает терапевтический индекс исходного лекарственного средства.
Распознавание рецептором и последующий процессинг пептидных и белковых агонистов является основным путем разложения многих лекарственных средств, основанных на пептидах и белках. Таким образом, связывание пептидного лекарственного средства с его рецептором будет приводить к биологической стимуляции, но также будет инициировать последующую дезактивацию индуцированных фармакологических свойств пептида/белка путем ферментативного расщепления пептида или белка. Согласно настоящему изобретению пролекарства могут быть получены для того, чтобы продлить биологическое время полужизни пептида или белка, на основании методики ингибирования распознавания пролекарства соответствующим рецептором.
Пролекарства, раскрытые в настоящем изобретении, в конечном счете, будут химически превращаться в структуры, которые могут распознаваться рецептором, где скорость такого химического превращения будет определять время начала и продолжительность биологического действия in vivo. Конструкция молекулы, описанная в настоящем описании, основана на внутримолекулярной химической реакции, которая не зависит от дополнительных химических добавок или ферментов.
Препроглюкагон является полипептидом-предшественником длиной 158 аминокислот, который процессируется в разных тканях с образованием нескольких различных происходящих из проглюкагона пептидов, включая глюкагон (SEQ ID NO:701), глюкагон-подобный пептид-1 (GLP-1; аминокислоты 7-36, представленные SEQ ID NO:703 и SEQ ID NO:704), глюкагон-подобный пептид-2 (GLP-2; SEQ ID NO:708) и оксинтомодулин (OXM; SEQ ID NO:706), которые вовлечены в широкое множество физиологических функций, включая гомеостаз глюкозы, секрецию инсулина, опорожнение желудка и рост кишечника, а также регуляцию потребления пищи.
Глюкагон представляет собой 29-аминокислотный пептид (который соответствует аминокислотам 33-61 препроглюкагона), тогда как GLP-1 продуцируется в виде 37-аминокислотного пептида, который соответствует аминокислотам 72-108 препроглюкагона. GLP-1(7-36)-амид (SEQ ID NO:704; на C-конце находится амид аргинина) или GLP-1(7-37)-кислота (SEQ ID NO:703; на C-конце находится глицин) являются биологически эффективными формами GLP-1, которые проявляют по существу эквивалентную активность в отношении рецептора GLP-1.
Глюкагон является жизненно важным лекарственным средством, которое применяют при остром лечении тяжелой гипогликемии. Сообщалось, что оксинтомодулин обладает фармакологической способностью подавлять аппетит и снижать массу тела. Клинические исследования агонистов рецептора GLP-1 или стабилизированных аналогов GLP-1 подтвердили, что указанное семейство пептидов является эффективным при лечении диабета типа II. Кроме того, в действительности, они могут быть безопаснее, чем инсулиновая терапия, благодаря их зависимого от глюкозы действия, что исключает случаи гипогликемии. Исследования взаимосвязи структура-активность показали, что N-концевой гистидин каждого из трех указанных пептидов (глюкагона, GLP-1 и оксинтомодулина) особенно важен для полного воздействия, и что удлиненные на N-конце формы сильно снижают биологическую эффективность.
Известны дополнительные пептиды, которые сходны с глюкагоном и GLP-1 по структуре и обладают сходными активностями. Например, эксендин-4 представляет собой пептид, присутствующий в слюне ящерицы-ядозуба, который сходен с GLP-1 по структуре и подобно глюкагону и GLP-1 увеличивает высвобождение инсулина.
Кроме того, желудочный ингибирующий полипептид (GIP) также известен как зависимый от глюкозы инсулинотропный пептид и является представителем секретинового семейства гормонов. GIP образуется из 153-аминокислотного пробелка, кодируемого геном GIP, и циркулирует в виде биологически активного 42-аминокислотного пептида (SEQ ID NO:707). Ген GIP экспрессируется в тонком кишечнике, а также слюнных железах и является слабым ингибитором секреции кислоты в желудке. Кроме ингибирующего действия в желудке в присутствии глюкозы GIP усиливает высвобождение инсулина островковыми бета-клетками в поджелудочной железе при введении в физиологических дозах. Полагают, что GIP функционирует в качестве кишечного фактора, который стимулирует высвобождение инсулина поджелудочной железой и играет физиологическую роль в поддержании гомеостаза глюкозы.
Остеокальцин (SEQ ID NO:709) является неколлагеновым белком, встречающимся в костях и дентине. Он секретируется остеобластами и, как полагают, играет роль в минерализации и гомеостазе ионов кальция. Также сообщалось, что остеокальцин функционирует в качестве гормона в организме, вынуждая бета-клетки в поджелудочной железе высвобождать больше инсулина, и в то же время, приводя к тому, что жировые клетки высвобождают гормон адипонектин, который увеличивает чувствительность к инсулину.
Одним из недостатков, ассоциированных с терапевтическим применением биологически активных пептидов, таких как остеокальцин, GIP, глюкагон, GLP-1 и оксинтомодулин, является их экстремально короткое время полужизни (примерно две минуты для глюкагона и GLP-1) в плазме. Соответственно, чтобы обеспечить приемлемый контроль, нативные родственные глюкагону пептиды необходимо вводить непрерывно в течение длительного периода времени. Короткое время полужизни пептидов, родственных глюкагону и GLP-1, обусловлено быстрым расщеплением дипептидилпептидазой IV (DPP-IV), которая расщепляет между второй и третьей аминокислотами. Такое расщепление не только инактивирует нативные пептиды, но в случае глюкагона и GLP-1 укороченные формы могут быть функциональными антагонистами соответствующих рецепторов. Соответственно, существует необходимость в более длительно действующих вариантах GIP, глюкагона, GLP-1 и оксинтомодулина и родственных пептидов, чтобы реализовать полные терапевтические возможности таких механизмов действия лекарственных средств.
Сущность изобретения
Согласно некоторым вариантам осуществления предлагается пролекарственное производное биологически активного полипептида, выбранного из группы, состоящей из глюкагона, эксендина-4, GLP-1, GLP-2, GIP, вазоактивного интестинального пептида (VIP), полипептида 27, активирующего аденилатциклазу гипофиза (PACAP-27), пептид-гистидин-метионина (PHM), оксинтомодулина, секретина, остеокальцина, соматотропин-рилизинг-гормона, а также аналогов, производных и конъюгатов указанных выше пептидов. Пролекарственное производное содержит дипептидный элемент пролекарства, ковалентно связанный с активным участком биологически активного полипептида амидной связью. В некоторых вариантах осуществления дипептид ковалентно связан с биологически активным полипептидом в положении, которое препятствует способности биологически активного полипептида взаимодействовать с соответствующим ему рецептором или кофактором. В некоторых вариантах осуществления дипептидный элемент пролекарства связан с амино-концом биологически активного пептида. Последующее удаление дипептида в физиологических условиях и в отсутствие ферментативной активности восстанавливает полную активность полипептида.
В некоторых вариантах осуществления предлагается пролекарство, имеющее общую структуру A-B-Q. В данном варианте осуществления Q означает биологически активный пептид, выбранный из группы, состоящей из пептидов глюкагонового надсемейства, включая родственные глюкагону пептиды, остеокальцин, а также аналоги, производные и конъюгаты вышеуказанного; и A-B означает дипептидное пролекарство, связанное с биологически активным пептидом амидной связью. Более конкретно, в некоторых вариантах осуществления A означает аминокислоту или гидроксикислоту, и B означает N-алкилированную аминокислоту, связанную с Q через образование амидной связи между карбоксилом B (в A-B) и амином Q. Кроме того, в некоторых вариантах осуществления A, B или аминокислота в Q, с которой связан A-B, является некодируемой аминокислотой, и химическое отщепление A-B от Q осуществляется по меньшей мере примерно на 90% в пределах примерно от 1 до примерно 720 часов в PBS в физиологических условиях. В другом варианте осуществления химическое отщепление A-B от Q завершается по меньшей мере примерно на 50% в течение примерно 1 часа или примерно 1 недели в PBS в физиологических условиях.
В некоторых вариантах осуществления A и B выбирают так, чтобы ингибировать ферментативное отщепление дипептида A-B от Q ферментами, имеющимися в сыворотке млекопитающих. В некоторых вариантах осуществления A и/или B выбраны так, чтобы время полуотщепления A-B от Q в PBS в физиологических условиях не превышало двукратного времени полуотщепления A-B от Q в растворе, содержащем DPP-IV-протеазу (т.е. отщепление A-B от Q происходит не более чем в 2 раза быстрее в присутствии DPP-IV-протеазы и в физиологических условиях по сравнению с идентичными условиями в отсутствие фермента). В некоторых вариантах осуществления A и/или B означает аминокислоту в D-стереоизомерной конфигурации. В некоторых примерах вариантов осуществления A означает аминокислоту в D-стереоизомерной конфигурации, и B означает аминокислоту в L-стереоизомерной конфигурации. В некоторых примерах вариантов осуществления A означает аминокислоту в L-стереоизомерной конфигурации, и B означает аминокислоту в D-стереоизомерной конфигурации. В некоторых примерах вариантов осуществления A означает аминокислоту в D-стереоизомерной конфигурации, и B означает аминокислоту в D-стереоизомерной конфигурации.
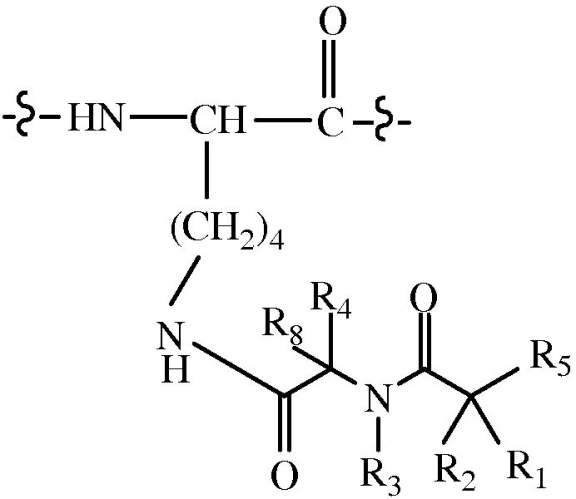
В некоторых вариантах осуществления дипептидный элемент пролекарства (A-B) содержит соединение, имеющее общую структуру формулы I:
где
R1, R2, R4 и R8 независимо выбраны из группы, состоящей из H, C1-C18алкила, C2-C18алкенила, (C1-C18алкил)OH, (C1-C18алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкила), (C0-C4алкил)(C2-C5гетероцикла), (C0-C4алкил)(C6-C10арил)R7, (C1-C4алкил)(C3-C9гетероарила) и C1-C12алкил(W1)C1-C12алкила, где W1 означает гетероатом, выбранный из группы, состоящей из N, S и O, или R1 и R2 вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил или арил; или R4 и R8 вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из C1-C18алкила, (C1-C18алкил)OH, (C1-C18алкил)NH2, (C1-C18алкил)SH, (C0-C4алкил)(C3-C6)циклоалкила, (C0-C4алкил)(C2-C5гетероцикла), (C0-C4алкил)(C6-C10арил)R7 и (C1-C4алкил)(C3-C9гетероарила), или R4 и R3 вместе с атомами, с которыми они связаны, образуют 4, 5 или 6-членное гетероциклическое кольцо;
R5 означает NHR6 или OH;
R6 означает H, C1-C8алкил, или R6 и R2 вместе с атомами, с которыми они связаны, образуют 4, 5 или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из H и OH.
В другом варианте осуществления дипептидный элемент пролекарства (A-B) содержит соединение, имеющее общую структуру формулы I:
где
R1, R2, R4 и R8 независимо выбраны из группы, состоящей из H, C1-C18алкила, C2-C18алкенила, (C1-C18алкил)OH, (C1-C18алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкила), (C0-C4алкил)(C2-C5гетероцикла), (C0-C4алкил)(C6-C10арил)R7, (C1-C4алкил)(C3-C9гетероарила) и C1-C12алкил(W1)C1-C12алкила, где W1 означает гетероатом, выбранный из группы, состоящей из N, S и O, или R1 и R2 вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил; или R4 и R8 вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из C1-C18алкила, (C1-C18алкил)OH, (C1-C18алкил)NH2, (C1-C18алкил)SH, (C0-C4алкил)(C3-C6)циклоалкила, (C0-C4алкил)(C2-C5гетероцикла), (C0-C4алкил)(C6-C10арил)R7 и (C1-C4алкил)(C3-C9гетероарила), или R4 и R3 вместе с атомами, с которыми они связаны, образуют 4, 5 или 6-членное гетероциклическое кольцо;
R5 означает NHR6 или OH;
R6 означает H, C1-C8алкил, или R6 и R1 вместе с атомами, с которыми они связаны, образуют 4, 5 или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, C1-C18алкила, C2-C18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH и галогена.
Как описано выше, в некоторых аспектах предлагается пролекарство, имеющее общую структуру A-B-Q, где Q означает пептид глюкагонового надсемейства (например, родственный глюкагону пептид, соматотропин-рилизинг-гормон (GHRH; SEQ ID NO:719), вазоактивный интестинальный пептид (VIP; SEQ ID NO:720), полипептид 27, активирующий аденилатциклазу гипофиза (PACAP-27; SEQ ID NO:721), пептид-гистидин-метионин (PHM; SEQ ID NO:722) или секретин (SEQ ID NO:723) и/или их аналоги, производные и конъюгаты). Пептиды глюкагонового надсемейства могут иметь общие структурные признаки, включая, но без ограничения, гомологи в пределах N-концевых аминокислот и/или альфа-спиральную структуру в C-концевой части. Полагают, что C-конец обычно функционирует в связывании рецептора, и N-конец обычно функционирует в передаче сигнала рецептора. Несколько аминокислот в N-концевой части и C-концевой части высоко консервативны среди представителей глюкагонового надсемейства, например, His1, Gly4, Phe6, Phe22, Val23, Trp25 и Leu26, где аминокислоты в указанных положениях проявляют идентичность, имеют консервативные замены или сходство боковых цепей аминокислот. В некоторых вариантах осуществления Q означает родственный глюкагону пептид, например глюкагон (SEQ ID NO:701), оксинтомодулин (SEQ ID NO:706), эксендин-4 (SEQ ID NO:718), глюкагон-подобный пептид-1 (GLP-1) (аминокислоты 7-37, представленные SEQ ID NO:703 и 707), глюкагон-подобный пептид-2 (GLP-2) (SEQ ID NO:708), GIP (SEQ ID NO:707) или их аналоги, производные и конъюгаты. В некоторых вариантах осуществления Q в качестве родственного глюкагону пептида содержит аминокислотную последовательность, которая по меньшей мере примерно на 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична соответствующей последовательности нативного глюкагона, нативного оксинтомодулина, нативного эксендина-4, нативного (7-37)GLP-1, нативного GLP-2 или нативного GIP по всей длине нативного пептида (или в положениях, которые соответствуют глюкагону, см., например, фиг.10). В других вариантах осуществления пептид глюкагонового надсемейства (Q) содержит аминокислотную последовательность нативного глюкагона, нативного эксендин-4, нативного (7-37)GLP-1, нативного GLP-2, нативного GHRH, нативного VIP, нативного PACAP-27, нативного PHM, нативного оксинтомодулина, нативного секретина или нативного GIP с 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными модификациями. В следующих вариантах осуществления Q содержит аминокислотную последовательность, которая представляет собой химеру двух или более последовательностей нативных родственных глюкагону пептидов. В некоторых вариантах осуществления Q содержит аминокислотную последовательность, по меньшей мере примерно на 50% идентичную нативному глюкагону (SEQ ID NO:701), которая сохраняет альфа-спиральную конформацию аминокислот, соответствующих аминокислотам 12-29 SEQ ID NO:701.
Q может быть любым из пептидов глюкагонового надсемейства, которые известны в данной области, включая, например, любые родственные глюкагону пептиды, которые известны в данной области, некоторые из которых описаны в настоящем описании в качестве неограничивающих примеров. В данной области известно множество аналогов GLP-1 и представляют собой родственный глюкагону пептид согласно настоящему изобретению, см., например, WO 2008023050, WO 2007030519, WO 2005058954, WO 2003011892, WO 2007046834, WO 2006134340, WO 2006124529, WO 2004022004, WO 2003018516, WO 2007124461, каждая из которых включена в настоящее описание посредством ссылки во всей своей полноте для каждого описания последовательностей или формул аналогов или производных GLP-1. В некоторых вариантах осуществления Q означает родственный глюкагону пептид класса 1, 2, 3, 4 или 5, который подробно описан в настоящем описании. В любом из вариантов осуществления, описанных в настоящем описании, Q означает любую из последовательностей SEQ ID NO:1-684, 701-742, 801-919, 1001-1262, 1301-1371, 1401-1518, 1701-1776 и 1801-1921.
Хотя дипептидное пролекарство, например A-B, может быть связано с Q в любом положении, которое препятствует активности Q, варианты осуществления, описанные в настоящем описании, иллюстрируют примеры положений, которые подходят для связывания A-B. Когда в настоящем описании указываются номера положений со ссылкой на положение нативной последовательности глюкагона (SEQ ID NO:701), соответствующее положение в аналогах глюкагона или в других пептидах глюкагонового надсемейства могут быть определены с помощью выравнивания. См., например, фиг.10, на которой показано выравнивание некоторых пептидов глюкагонового надсемейства. Например, положение 24 на основании нативного глюкагона соответствует положению 24 (7-37) GLP-1.
В некоторых вариантах осуществления пептид глюкагонового надсемейства может содержать C-конец или C-концевую аминокислотную последовательность, включая, но без ограничения: COOH, CONH2, GPSSGAPPPS (SEQ ID NO:710), GPSSGAPPPS-CONH2 (SEQ ID NO:711), удлинение карбоксильного конца оксинтомодулина, KRNRNNIA (SEQ ID NO:714) или KGKKNDWKHNITQ (SEQ ID NO:713). Дополнительные C-концевые аминокислотные последовательности пептидов глюкагонового надсемейства дополнительно описаны ниже.
В других аспектах Q содержит остеокальцин (SEQ ID NO:709) или аминокислотную последовательность, которая по меньшей мере примерно на 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична нативному остеокальцину по длине нативного пептида. Q может содержать аналог остеокальцина, имеющий до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 модификаций аминокислот по сравнению с нативным остеокальцином. В следующих аспектах Q содержит соматотропин-рилизинг-гормон (GHRH) (SEQ ID NO:719) или аминокислотную последовательность, которая по меньшей мере примерно на 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична нативному GHRH по длине нативного пептида. Q может содержать аналог GHRH, имеющий до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 модификаций аминокислот по сравнению с нативным GHRH. В некоторых вариантах осуществления Q может представлять собой любой аналог остеокальцина или GHRH, известный в данной области.
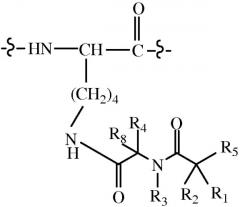
В следующих вариантах осуществления предлагается пролекарство, имеющее общую структуру A-B-Q, где Q означает пептид глюкагонового надсемейства остеокальцин или его аналог, производное или конъюгат, и A-B содержит общую структуру:
где R1 и R8 независимо выбраны из группы, состоящей из H и C1-C8алкила;
R2 и R4 независимо выбраны из группы, состоящей из H, C1-C8алкила, C2-C8алкенила, (C1-C4алкил)OH, (C1-C4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкила), (C0-C4алкил)(C6-C10арил)R7, CH2(C5-C9гетероарила), или R1 и R2 вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из C1-C8алкила, (C1-C4алкил)OH, (C1-C4алкил)NH2, (C1-C4алкил)SH, (C3-C6)циклоалкила, или R4 и R3 вместе с атомами, с которыми они связаны, образуют 5 или 6-членное гетероциклическое кольцо;
R5 означает NHR6 или OH;
R6 означает H, или R6 и R2 вместе с атомами, с которыми они связаны, образуют 5 или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из H и OH.
При условии, что когда R4 и R3 вместе с атомами, с которыми они связаны, образуют 5 или 6-членное гетероциклическое кольцо, оба R1 и R2 отличны от H.
В других вариантах осуществления предлагается пролекарство, имеющее общую структуру A-B-Q, где Q означает пептид глюкагонового надсемейства остеокальцин или его аналог, производное или конъюгат, и A-B содержит общую структуру:
где
R1 и R8 независимо означают H или C1-C8алкил;
R2 и R4 независимо выбраны из группы, состоящей из H, C1-C8алкила, C2-C8алкенила, (C1-C4алкил)OH, (C1-C4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкила), (C0-C4алкил)(C2-C5гетероцикла), (C0-C4алкил)(C6-C10арил)R7 и CH2(C3-C9гетероарила), или R1 и R2 вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил;
R3 выбран из группы, состоящей из C1-C8алкила, (C1-C4алкил)OH, (C1-C4алкил)NH2, (C1-C4алкил)SH, (C3-C6)циклоалкила, или R4 и R3 вместе с атомами, с которыми они связаны, образуют 5 или 6-членное гетероциклическое кольцо;
R5 означает NHR6 или OH;
R6 означает H, C1-C8алкил, или R6 и R2 вместе с атомами, с которыми они связаны, образуют 5 или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, C1-C18алкила, C2-C18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH, галогена, при условии, что когда R4 и R3 вместе с атомами, с которыми они связаны, образуют 5 или 6-членное гетероциклическое кольцо, оба R1 и R2 не являются H.
В некоторых вариантах осуществления Q означает пептид, выбранный из группы, состоящей из соматотропин-рилизинг-гормона (GHRH; SEQ ID NO:719), вазоактивного интестинального пептида (VIP; SEQ ID NO:720), полипептида 27, активирующего аденилатциклазу гипофиза, (PACAP-27; SEQ ID NO:721), пептид-гистидин-метионина (PHM; SEQ ID NO:722) или секретина (SEQ ID NO:723), глюкагона (SEQ ID NO:701), эксендина-4 (SEQ ID NO:718), глюкагон-подобного пептида-1 (GLP-1) (аминокислоты 7-37, представленные SEQ ID NO:703 и 704), глюкагон-подобного пептида-2 (GLP-2) (SEQ ID NO:708), GIP (SEQ ID NO:707) или их аналогов, производных и конъюгатов. В некоторых вариантах осуществления Q означает родственный глюкагону пептид.
В другом варианте осуществления предлагается аналог пролекарства пептида глюкагонового надсемейства или остеокальцина или его аналога, производного или конъюгата, в котором пролекарственный фрагмент (A-B) ковалентно связан с Q в одном или нескольких внутренних аминокислотных остатках в последовательности Q, например, в положении Q, соответствующем положению 12, 16, 17, 18, 20, 28 или 29 нативного глюкагона (SEQ ID NO:701). Например, в некоторых вариантах осуществления пролекарственный фрагмент (A-B) связан непосредственно или через линкер с замещенным Lys в положении 20 в Q. В таких вариантах осуществления Q может содержать в положении 20 (по сравнению с нативной последовательностью глюкагона) замещение, имеющее структуру:
В других вариантах осуществления пролекарственный фрагмент (A-B) связан непосредственно или через линкер с замещенным амино-Phe в положении 22. В таких вариантах осуществления Q может содержать в положении 22 (по сравнению с нативной последовательностью глюкагона), замещение, имеющее структуру:
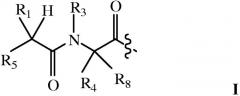
Альтернативно или дополнительно, пролекарственный фрагмент (A-B) связан непосредственно или через линкер с амино-концом Q, где A-B содержит структуру:
где R1 и R8 независимо выбраны из группы, состоящей из H и C1-C8алкила;
R2 и R4 независимо выбраны из группы, состоящей из H, C1-C8алкила, C2-C8алкенила, (C1-C4алкил)OH, (C1-C4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкила), (C0-C4алкил)(C6-C10арил)R7, CH2(C5-C9гетероарила), или R1 и R2 вместе с атомами, с которыми они связаны, образуют C3-C6циклоалкил;
R3 выбран из группы, состоящей из C1-C8алкила, (C1-C4алкил)OH, (C1-C4алкил)NH2, (C1-C4алкил)SH, (C3-C6)циклоалкила, или R4 и R3 вместе с атомами, с которыми они связаны, образуют 5 или 6-членное гетероциклическое кольцо;
R5 означает NHR6 или OH;
R6 означает H, или R6 и R2 вместе с атомами, с которыми они связаны, образуют 5 или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из H и OH,
при условии, что каждый из R1 и R2 отличен от H, когда R4 и R3 вместе с атомами, с которыми они связаны, образуют 5 или 6-членное гетероциклическое кольцо.
В других вариантах осуществления пролекарственный фрагмент (A-B) связан непосредственно или через линкер с амино-концом Q, где A-B содержит структуру:
где
R1 и R8 независимо означаю H или C1-C8алкил;
R2 и R4 независимо выбраны из группы, состоящей из H, C1-C8алкила, C2-C8алкенила, (C1-C4алкил)OH, (C1-C4алкил)SH, (C2-C3алкил)SCH3, (C1-C4алкил)CONH2, (C1-C4алкил)COOH, (C1-C4алкил)NH2, (C1-C4алкил)NHC(NH2 +)NH2, (C0-C4алкил)(C3-C6циклоалкила), (C0-C4алкил)(C2-C5гетероцикла), (C0-C4алкил)(C6-C10арил)R7 и CH2(C3-C9гетероарила), или R1 и R2 вместе с атомами, с которыми они связаны, образуют C3-C12циклоалкил;
R3 выбран из группы, состоящей из C1-C8алкила, (C1-C4алкил)OH, (C1-C4алкил)NH2, (C1-C4алкил)SH, (C3-C6)циклоалкила, или R4 и R3 вместе с атомами, с которыми они связаны, образуют 5 или 6-членное гетероциклическое кольцо;
R5 означает NHR6 или OH;
R6 означает H, C1-C8алкил, или R6 и R2 вместе с атомами, с которыми они связаны, образуют 5 или 6-членное гетероциклическое кольцо; и
R7 выбран из группы, состоящей из водорода, C1-C18алкила, C2-C18алкенила, (C0-C4алкил)CONH2, (C0-C4алкил)COOH, (C0-C4алкил)NH2, (C0-C4алкил)OH, галогена, при условии, что оба R1 и R2 не являются H, когда R4 и R3 вместе с атомами, с которыми они связаны, образуют 5 или 6-членное гетероциклическое кольцо.
В некоторых вариантах осуществления только один пролекарственный фрагмент связан с Q. Например, в таких вариантах осуществления, когда пролекарственный фрагмент (A-B) связан с Q на N-конце, нет пролекарственных фрагментов (A-B), связанных с внутренним аминокислотным остатком в последовательности Q, и наоборот. В некоторых вариантах осуществления два или три пролекарственных фрагмента связаны с Q, например, на N-конце и в одном или нескольких внутренних участках.
Краткое описание чертежей
Фиг.1 представляет собой график, показывающий изменение массы тела у мышей с индуцированным потреблением пищи ожирением (DIO), которым внутрибрюшинно инъецировали однократную недельную дозу 15 или 70 нмоль/кг аналога глюкагона. Мышей ежедневно взвешивали (N=8) после начальной инъекции следующих средств: только наполнителя ▼, пептида A глюкагонового надсемейства («пептида A») в дозе 15 нмоль/кг или 70 нмоль/кг или пролекарственного производного пептида A, в котором дипептид связан с N-концом пептида A амидной связью, где дипептид представляет собой Aib-1Pro0 (вводимый в дозе 15 нмоль/кг (○) или 70 нмоль/кг (●), Aib-1dPro0 (вводимый в дозе 70 нмоль/кг , Lys-1Sar0 (вводимый в дозе 70 нмоль/кг (♦), dAla-1Pro0 (вводимый в дозе 70 нмоль/кг или Ac-Aib-1Pro-1 (вводимый в дозе 70 нмоль/кг (■).
Фиг.2 представляет собой график, показывающий изменение массы тела у мышей с индуцированным потреблением пищи ожирением (DIO), которым внутрибрюшинно инъецировали однократную недельную дозу 0,5, 3, 15 или 70 нмоль/кг либо только наполнителя (♦), либо пептида A (в дозе 0,5 ▲, 3 , 15 ▼ или 70 нмоль/кг/сутки), либо Lys-1Sar0-пептида A (в дозе 0,5 , 3 , 15 или 70 нмоль/кг/сутки).
Фиг.3 является графиком уровней глюкозы в крови (мг/дл) у мышей DIO (N=8), которым инъецировали сначала родственный глюкагону пептид, а затем раствор глюкозы. Мышам во временной точке -60 минут внутрибрюшинно инъецировали только наполнитель (▲) или дозу 15 или 70 нмоль/кг одного из следующих соединений:
(A) пептид A (в дозе 15 или 70 нмоль/кг/сутки),
(B) Lys-1Sar0-пептид A (в дозе 15 или 70 нмоль/кг/сутки), или
(C) dLys-1Sar0-пептид A (в дозе 15 или 70 ■ нмоль/кг/сутки).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во временной точке 0 минут. Уровни глюкозы в крови измеряли во временных точках -60, 0, 15, 30, 60 и 120 минут.
Фиг.4 представляет собой график уровней глюкозы в крови (мг/дл) у мышей DIO (N=8), которым сначала инъецировали родственный глюкагону пептид, а затем раствор глюкозы. Мышам внутрибрюшинно во временной точке -15 минут инъецировали либо только наполнитель (▲), либо дозу 2 нмоль/кг одного из следующих соединений:
(A) Lys-1Sar0-пептид A (■),
(B) Lys-1(X),Sar0-пептид A (▲) (X означает цепь ПЭГ 1 кДа, связанную с боковой цепью Lys),
(C) Lys-1(Y),Sar0-пептид A (♦) (Y означает трет-бутилглицин, связанный с боковой цепью Lys),
(D) dLys-1Sar0-пептид A .
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во временной точке 0 минут. Уровни глюкозы в крови измеряли во временных точках -15, 0, 15, 30, 60 и 120 минут.
Фиг.5 представляет собой график уровней глюкозы в крови (мг/дл) у мышей DIO (N=8), которым сначала инъецировали родственный глюкагону пептид, а затем раствор глюкозы. Мышам внутрибрюшинно во временной точке -15 минут инъецировали либо наполнитель (▼), либо дозу 20 нмоль/кг dLys-1Sar0-пептида A , либо дозу 0,67 нмоль/кг одного из следующих соединений:
(A) Lys-1Sar0-пептид A (■),
(B) Lys-1(X),Sar0-пептид A (▼) (X означает цепь ПЭГ 1 кДа, связанную с боковой цепью Lys),
C) Lys-1(Y),Sar0-пептид A (♦) (Y означает трет-бутилглицин, связанный с боковой цепью Lys).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во временной точке 0 минут. Уровни глюкозы в крови измеряли во временных точках -15, 0, 15, 30, 60 и 120 минут.
Фиг.6 представляет собой график уровней глюкозы в крови (мг/дл) у мышей DIO (N=8), которым сначала инъецировали родственный глюкагону пептид, а затем раствор глюкозы. Мышам внутрибрюшинно во временной точке -60 минут инъецировали либо только наполнитель (▼), либо дозу 15 или 70 нмоль/кг одного из следующих соединений:
(A) пептид A (в дозе 15 или 70 ▲ нмоль/кг/сутки),
(B) dLys-1Sar0-пептид A (в дозе 15 или 70 ■ нмоль/кг/сутки), или
(C) Lys-1Sar0-пептид A (в дозе 15 или 70 нмоль/кг/сутки).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во временной точке 0 минут и спустя 24 часа (см. фиг.7). Указанные уровни глюкозы в крови измеряли во временных точках -60, 0, 15, 30, 60 и 120 минут от момента первого введения раствора глюкозы (т.е. с временной точкой 0 минут).
Фиг.7 представляет собой график уровней глюкозы в крови (мг/дл) у мышей DIO (N=8), которым внутрибрюшинно во временной точке -60 минут инъецировали либо только наполнитель (▼), либо дозу 15 или 70 нмоль/кг одного из следующих соединений:
(A) пептид A (в дозе 15 или 70 ▲ нмоль/кг/сутки),
(B) dLys-1Sar0-пептид A (в дозе 15 или 70 нмоль/кг/сутки), или
(C) Lys-1Sar0-пептид A (в дозе 15 ♦ или 70 ■ нмоль/кг/сутки).
Физиологический раствор, содержащий 25% (об./об.) глюкозы, инъецировали в дозе 1,5 г/кг массы тела во временной точке 0 минут и спустя 24 часа (см. фиг.7). Указанные уровни глюкозы в крови измеряли во временных точках 0, 15, 30, 60 и 120 минут от момента введения второго раствора глюкозы через 24 часа.
На фиг.8 представлены данные, показывающие потерю массы у мышей DIO (N=8), которым внутрибрюшинно инъецировали указанные соединения в дозе либо 15, либо 70 нмоль/кг. Указанные массы тела определяли через 7 суток после введения соединений.
На фиг.9A-B представлены графики уровней глюкозы в крови (BG) (мг/дл) у мышей DIO (n=8). Мышам внутрибрюшинно инъецировали только наполнитель или пролекарственный пептид в точках 24, 8, 4 или 1 час до стимуляции (как указано на фигуре) с использованием инъекции 25% глюкозы в физиологическом растворе в дозе 1,5 г/кг массы тела. Указанные уровни глюкозы в крови измеряли во временных точках 0, 15, 30, 60 и 120 минут от момента стимуляции раствором глюкозы. На фиг.9A показаны уровни глюкозы в крови после введения Lys-1Sar0-пептида A (т.е. содержащего пролекарственный элемент Lys-1Sar0). На фиг.9B показаны уров