Капсула авт-263
Иллюстрации
Показать всеИзобретение относится к фармацевтике, в частности описывается капсула, содержащая капсульную оболочку, включающую внутри себя инкапсулированный жидкий раствор N-(4-(4-((2-(4-хлорфенил)-5,5-диметил-1-циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)3-(морфолин-4-ил)-1-(фенилсульфанил)метил)пропил)-амино)-3-((трифторметил)сульфонил)бензолсульфонамида (АВТ-263) или его соли бис-гидрохлорида в неэтанольном носителе. В качестве наполнителей используются фосфолипид, солюбилизирующий агент для фосфолипида, выбранный из гликолей, гликолидов, глицеридов и их смесей, поверхностно-активное вещество нефосфолипидной природы и серусодержащий антиоксидант в количестве, эффективном для снижения окислительной деградации АВТ-263 при хранении. Серусодержащий антиоксидант выбран из сульфитов, бисульфитов, метабисульфитов и тиосульфатов и их смесей. Также раскрывается способ получения капсулы. Капсулу используют для лечения заболевания, характеризуемого сверхэкспрессией одного или нескольких противоапоптических белков семейства Bcl-2, например, рака. Изобретение обеспечивает длительный срок хранения для указанной капсулы. 2 н. и 31 з. п. ф-лы, 3 ил., 20 табл., 14 пр.
Реферат
Данная заявка испрашивает приоритет предварительной заявки на патент США сер. № 61/289289, поданной 22 декабря 2009, полное раскрытие которой включено в настоящее описание в виде ссылки.
Делается перекрестная ссылка на нижеследующие заявки на патент США, содержащие предмет изобретения, имеющий отношение к настоящей заявке: Сер. № 12/770122, озаглавленная "Липидная готовая лекарственная форма промотора апоптоза", поданная 29 апреля 2010 г; Сер. № 12/770174, озаглавленная "Стабилизированная липидная готовая лекарственная форма промотора апоптоза", поданная 29 апреля 2010 г; и Сер. № 12/770299, озаглавленная "Готовая лекарственная форма для перорального введения промотора апоптоза", поданная 29 апреля 2010 г.
Область техники
Настоящее изобретение относится к апоптоз-стимулирующему средству ABT-263, готовым лекарственным формам, содержащим ABT-263, и способам их использования для лечения заболеваний, характеризуемых сверхэкспрессией противоапоптических белков семейства Bcl-2. В частности, данное изобретение относится к инкапсулированным готовым лекарственным формам, используемым для перорального введения ABT-263 субъекту, нуждающемуся в таком введении.
Характеристика известного уровня техники
Уклонение от апоптоза является маркером злокачественного новообразования (Hanahan & Weinberg (2000) Cell 100:57-70). Раковые клетки должны преодолевать непрерывную бомбардировку клеточными стрессами, как например, повреждение ДНК, активация онкогенов, аномальное прогрессирование клеточного цикла и жесткие микросреды, которые могут вынудить нормальные клетки перейти в состояние апоптоза. Один из основных способов, благодаря которому раковым клеткам удается избежать апоптоза, заключается в позитивной регуляции противоапоптических белков семейства Bcl-2.
Соединения, которые оккупируют BH3 связывающий желобок белков Bcl-2, были описаны, например, Bruncko et al. (2007) J. Med. Chem. 50:641-662. Эти соединения включали N-(4-(4-((4'-хлор-(1,1'-бифенил)-2-ил)метил)пиперазин-1-ил)бензоил-4-(((1R)-3-(диметиламино)-1-((фенилсульфанил)метил)пропил)амино)-3-нитробензолсульфонамид, известный иначе как ABT-737, который имеет формулу:
ABT-737 связывается с высоким сродством (<1 нМ) с белками семейства Bcl-2 (в частности, Bcl-2, Bcl-XL и Bcl-w). Это соединение проявляет моноактивность в отношении мелкоклеточного рака легких (SCLC) и лимфонеоплазий, и потенцирует про-апоптические действия других химиотерапевтических средств. ABT-737 и родственные соединения и способы получения таких соединений раскрываются Bruncko et al. в публикации патентной заявки США № 2007/0072860.
Совсем недавно был идентифицирован дополнительный ряд соединений, обладающих высоким связывающим сродством к белкам семейства Bcl-2. Эти соединения и способы их получения раскрыты Bruncko и др. в публикации патентной заявки США № 2007/0027135 (в настоящем описании "'135 публикация"), включенной в настоящее описание в полном объеме в виде ссылки, и эти соединения, как можно видеть из их формулы, являются структурно родственными ABT-737.
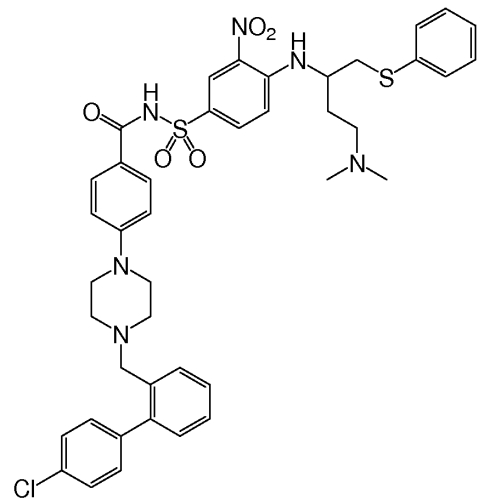
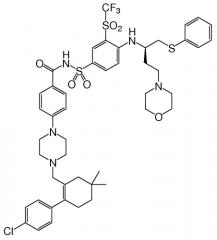
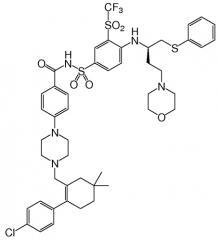
Одно соединение, идентифицированное в виде "Примера 1" в публикации '135, представляет собой N-(4-(4-((2-(4-хлорфенил)-5,5-диметил-1-циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)3-(морфолин-4-ил)-1-((фенилсульфанил)метил)пропил)-амино)-3-((трифторметил)сульфонил)бензолсульфонамид, известный иначе как ABT-263. Это соединение имеет молекулярную массу 974,6 г/моль и имеет формулу:
Имеются сообщения от Tse et al. (2008) Cancer Res. 68:3421-3428 и, кроме того, из дополнительных данных, доступных из Cancer Research в режиме онлайн (cancerres.aacrjournals.org/), о фармакокинетических исследованиях на животных ABT-263, синтезированного как описано в публикации '135. Лекарственное средство получали в виде раствора в 10% диметилсульфоксиде (DMSO) в полиэтиленгликоле (PEG) 400 или в смеси 10% этанол/30% PEG400/60% Phosal 50 PG™.
В публикации '135 не сообщается о биодоступности при пероральном введении препарата (выраженной, например, посредством AUC после перорального введения в виде процента AUC после внутривенного введения), однако, из этой публикации следует, что биодоступность при пероральном приеме существенно выше для ABT-263, чем для ABT-737. Тем не менее, дальнейшее повышение биодоступности при пероральном приеме было бы полезным. В данной области были предложены различные растворы для решения проблемы, связанной с низкой биодоступностью лекарственного средства при пероральном приеме. Например, Lacy et al. в патенте США 5645856 предлагают формулирование гидрофобного лекарственного средства с (a) маслом, (b) гидрофильным поверхностно-активным веществом и (c) липофильным поверхностно-активным веществом, которое в значительной степени снижает ингибирующее действие гидрофильного поверхностно-активного вещества на in vivo липолиз масла, а такой липолиз, как говорят, является фактором, стимулирующим биодоступность лекарственного средства. К многочисленным классам перечисленных гидрофильных поверхностно-активных веществ относятся фосфолипиды, такие как лецитины.
Патент США 6267985, Chen & Patel, направлен, среди прочего, на фармацевтическую композицию, содержащую (a) триглицерид, (b) носитель, включающий, по крайней мере, два поверхностно-активных вещества, один из которых является гидрофильным, и (c) терапевтическое средство, которое способно солюбизироваться в триглицериде, носителе или обоих. В патенте указывается, что триглицерид и поверхностно-активные вещества должны присутствовать в количествах, которые обеспечивают образование прозрачной водной дисперсии, когда композиция смешивается с водным раствором в определенных условиях. В числе экстенсивных отдельных перечней иллюстративных ингредиентов, здесь упоминается "глицерилтрикаприлат/капрат" в качестве триглицерида, и в качестве поверхностно-активных веществ фосфолипиды, включая фосфатидилхолин.
Patel & Chen в патенте США 6451339 указывают на недостатки присутствия триглицеридов в таких композициях, и предлагают другие подобные композиции, которые, по существу, не содержат триглицеридов, но которые также дают прозрачные водные дисперсии.
Patel & Chen в патенте США 6309663 предлагают фармацевтические композиции, содержащие комбинацию поверхностно-активных веществ, которая, как сообщается, усиливает биоабсорбцию гидрофильного терапевтического средства. Среди иллюстративных поверхностно-активных веществ снова перечисляются фосфолипиды, такой как фосфатидилхолин.
Fanara et al. в патенте США 6464987 предлагают жидкую фармацевтическую композицию, содержащую активное вещество, от 3% до 55% масс. фосфолипида, от 16% до 72% масс. растворителя, и от 4% до 52% масс. жирной кислоты. В частности, примерами служат композиции, содержащие Phosal 50 PG™ (в основном, включающий фосфатидилхолин и пропиленгликоль), в некоторых случаях вместе с Phosal 53 MCT™ (в основном, включающий фосфатидилхолин и среднецепочечные триглицериды). Такие композиции, как сообщают, обладают способностью к мгновенному гелеобразованию в присутствии водной фазы и делают возможным осуществление контролируемого высвобождения активного вещества.
Leonard et al. в патенте США 5538737 предлагают капсулу, содержащую эмульсию типа “вода в масле”, в которой водорастворимая соль лекарственного средства растворена в водной фазе эмульсии и в которой масляная фаза включает масло и эмульгирующий агент. К упоминаемым маслам относятся среднецепочечные триглицериды; среди упоминаемых эмульгирующих агентов фосфолипиды, такой как фосфатидилхолин. Согласно различным примерам, представленным в цитируемом документе, используют Phosal 53 MCT™, который содержит фосфатидилходин и среднецепочечные триглицериды.
Waranis & Leonard в патенте США 5536729 предлагают пероральный препарат, содержащий рапамицин, при концентрации от около 0,1 до около 50 мг/мл, в носителе, включающем в себя раствор фосфолипида. Установлено, что предпочтительную фармацевтическую композицию можно получить, используя Phosal 50 PG™ в виде раствора фосфолипида. Альтернативный упоминаемый раствор фосфолипида представляет собой Phosal 50 MCT™.
Harrison и др. в патенте США 5559121 предлагают пероральный препарат, содержащий рапамицин, при концентрации от около 0,1 до около 100 мг/мл, в носителе, включающем в себя N,N-диметилацетамид и раствор фосфолипида. Примерами более предпочтительных вариантов осуществления, как показано, являются те, которые получены, используя Phosal 50 PG™. Альтернативный упоминаемый раствор фосфолипида представляет собой Phosal 50 MCT™.
В публикации патентной заявки США № 2007/0104780 Lipari и др. раскрывают, что лекарственное средство, представленное небольшой молекулой (определенное в данном контексте как имеющее молекулярную массу, исключая противоионы в случае солей, не больше чем около 750 г/моль, обычно не больше чем около 500 г/моль), обладающее низкой растворимостью в воде, может быть составлено в фармацевтическую композицию, представляющую собой раствор, в, по существу, неводном носителе, включающем в себя, по крайней мере, один фосфолипид и фармацевтически приемлемое солюбилизирующее средство. Раствор, при смешении с водной фазой, как сообщают, образует нежелатинизирующую, по существу, непрозрачную жидкую [текучую] дисперсию. Иллюстративно, в данном контексте описаны фармацевтические композиции N-(4-(3-амино-1H-индазол-4-ил)фенил)-N'-(2-фтор-5-метилфенил)мочевины (ABT-869, ингибитор протеинтирозинкиназы), содержащие Phosal 53 MCT™ и другие ингредиенты.
Недавно клиническое исследование ABT-263 было раскрыто Krivoshik в публикации патентной заявки США № 2009/0149461, которая включена в настоящее описание в полном объеме в виде ссылки без признания того, что она составляет известный уровень техники для данного изобретения. Препарат, предназначенный для введения, описан в этом документе в виде "порошка для перорального раствора (2,0 грамм/флакон эквивалента основания, 25 мг/мл при смешении)", и разбавители для составления раствора идентифицированы как "Phosal® 53 среднецепочечный триглицерид (MCT), 120 грамм/флакон" и "спирт (этанол), дегидратированный, USP/EP/JP 200 proof [т.е., 100% чистый спирт]”.
Конкретным типом заболевания, для которого требуется разработка улучшенных методов лечения, является неходжинская лимфома (NHL). NHL является шестым наиболее распространенным типом нового злокачественного новообразования в США и встречается, в основном, у пациентов 60-70-летнего возраста. NHL не является отдельным заболеванием, а представляет собой семейство родственных болезней, которые классифицируют, исходя из некоторых характеристик, включая клинические характерные признаки и гистологию.
Один метод классификации размещает различные гистологические подтипы по двум основным категориям, исходя из патогенеза заболевания, т.е., из того, является ли данное заболевание вялотекущим или агрессивным. В общем, вялотекущие подтипы развиваются медленно и, как правило, являются неизлечимыми, тогда как агрессивные подтипы развиваются быстро и являются потенциально излечимыми. Фолликулярные лимфомы представляют собой наиболее распространенный вялотекущий подтип, и диффузные крупноклеточные лимфомы являются наиболее распространенным агрессивным подтипом. Онкобелок Bcl-2 первоначально был описан в связи с неходжинской В-клеточной лимфомой.
Лечение фолликулярной лимфомы обычно состоит из лечения, связанного с биологическим воздействием, или комбинированной химиотерапии. Традиционно используют комбинированное лечение ритуксимабом, циклофосфамидом, доксорубицином, винкристином и преднизоном (R-CHOP), равно как и комбинированное лечение ритуксимабом, циклофосфамидом, винкристином и преднизоном (RCVP). Кроме того, используют монотерапию ритуксимабом (таргетинг CD20, фосфопротеин, равномерно экспрессируемый на поверхности В-клеток) или флударабином. Добавление ритуксимаба в схемы лечения химическими препаратами может способствовать улучшению показателя отклика и увеличению периода ремиссии.
Для лечения рефрактерной или рецидивной неходжинской лимфомы могут быть использованы радиоиммунотерапевтические средства, химиотерапия с использованием препаратов высокой дозы и трансплантаты стволовых клеток. В настоящее время, не существует апробированной санкционированной лечебной схемы, которая бы обеспечивала лечение, и современные рекомендации предлагают пациентам лечение в условиях клинического испытания, даже при назначении лечения препаратом первого выбора.
Лечение препаратом первого выбора пациентов с агрессивной крупноклеточной [В-клеточной] лимфомой обычно состоит из ритуксимаба, циклофосфамида, доксорубицина, винкристина и преднизона (R-CHOP), или доза-регулируемого этопозида, преднизона, винкристина, циклофосфамида, доксорубицина и ритуксимаба (DA-EPOCH-R).
Большинство лимфом вначале реагирует на любое одно из этих лечений, однако, опухоли обычно рецидивируют и, в конечном счете, становятся рефрактерными. Поскольку количество курсов лечения у пациента возрастает, болезнь становится более резистентной к химиотерапии. Средний ответ на первый курс лечения составляет приблизительно 75%, на второй курс лечения 60%, на третий курс лечения 50%, и на четвертый курс лечения приблизительно 35-40%. Считают, что показатели отклика, достигающие 20% при монотерапии в случае многократных рецидивов, являются положительными и заслуживают дальнейшего исследования.
Другие новообразования, для которых требуется разработка улучшенных методов лечения, включают лейкозы, такие как хронический лимфоцитарный лейкоз (как NHL, B-клеточная лимфома) и острый лимфоцитарный лейкоз.
Хронический лимфоидный лейкоз (CLL) представляет собой наиболее распространенный тип лейкоза. CLL представляет собой, главным образом, болезнь взрослых, при этом больше чем 75% недавно диагностированных людей имеют возраст свыше 50 лет, однако, в редких случаях эта болезнь обнаружена и у детей. Комбинированные химиотерапии являются общепринятым лечением, например, флударабин с циклофосфамидом и/или ритуксимабом, или более ложные комбинации, такие как CHOP или R-CHOP.
Острый лимфоцитарный лейкоз, также известный как острый лимфобластный лейкоз (ALL), является, главным образом, детской болезнью, когда-то, по существу, с нулевой выживаемостью, но в настоящее время с выживаемостью вплоть до 75% благодаря комбинированным химиотерапиям, аналогичным тем, которые упомянуты выше. Тем не менее, по-прежнему существует потребность в разработке новых терапий, которые обеспечили бы дальнейшее улучшение показателей выживаемости.
Современные химиотерапевтические средства проявляют свою противоопухолевую активность, индуцируя апоптоз посредством целого ряда механизмов. Однако, многие опухоли, в конечном счете, становятся резистентными к этим средствам. Bcl-2 и Bc1-Xl, как было показано, придают резистентность к химиотерапии в испытаниях на краткосрочную выживаемость в условиях in vitro и, сосем недавно, в условиях in vivo. Это дает возможность предположить, что такая резистентность к химиотерапии могла бы быть успешно преодолена в случае разработки усовершенствованных способов лечения, направленных на подавление функционирования Bcl-2 и Bcl-XL.
Краткое изложение существа изобретения
До настоящего времени, в качестве препаратов ABT-263, которые могут быть использованы для перорального введения, были раскрыты только препараты ABT-263 в виде разбавленных жидкостей, включая, например, раствор ABT-263 в 10% ДМСО в PEG 400 или в смеси 10% этанол/30% PEG 400/60% Phosal 50 PG™, которые были применены для введения Tse и др. (2008), как упомянуто выше, или 25 мг/мл раствор ABT-263 в Phosal 53 MCT™ и этаноле, раскрытый в вышецитированной публикации патентной заявки № 2009/0149461 ("публикация '461").
Отдельная лекарственная форма, такая как капсула, имеет преимущества в сравнении с жидкостью в том смысле, что доза лекарственного средства является заранее строго определенной, такая лекарственная форма легче для введения, предоставляя возможность пациенту более строго соблюдать терапевтические рекомендации, и предполагает более длительный срок хранения. Кроме того, если активный ингредиент или какой-либо наполнитель имеет неприятный вкус, то инкапсуляция фармацевтической композиции позволяет избежать появления этого ощущения у пациента. Известно заключение жидких фармацевтических композиций, например, в желатиновые капсулы; однако, ABT-263 представляет в этом отношении некоторые проблемы.
Во-первых, типичные унифицированные дозы ABT-263 для большей части показаний являются относительно высокими (вплоть до около 500 мг или даже больше), что означает, что разбавленный раствор ABT-263, такой как 25 мг/мл раствор, рассматриваемый в публикации '461, не может быть представлен в форме капсулы удобным для применения образом. Даже для дозы 200 мг может потребоваться 8 больших (1 мл) капсул, каждая при этом содержащая 25 мг ABT-263. Плохая растворимость ABT-263 в большей части фармацевтически приемлемых растворителей объясняла невозможность до настоящего времени разработки более концентрированного раствора, демонстрирующего приемлемую стабильность при хранении.
Во-вторых, несмотря на то, что ABT-263 может быть растворен в продуктах на основе фосфолипида, таких как Phosal 50 PG™ и Phosal 53 MCT™, полученные растворы оказываются высоковязкими, если в них не добавляют понижающее вязкость средство, такое как этанол. Этанол и другие понижающие вязкость средства, такое как глицерин, несовместимы с большей частью материалов оболочки капсулы, в частности, материалами оболочки твердой капсулы, например, оболочки твердой желатиновой капсулы.
В-третьих, было установлено, что ABT-263 является чувствительным к окислению с образованием продуктов деградации, включая сульфоксиды. Это необязательно представляет серьезную проблему для препарата в жидкой форме, который может быть приготовлен для немедленного приема, однако для заранее изготовленной лекарственной формы, такой как капсула, окислительная деградация может означать недопустимо короткий срок хранения лекарственного средства. Поэтому важно включение антиоксиданта в жидкую фармацевтическую композицию ABT-263, предназначенную для инкапсуляции; однако, как показано в данном контексте, многие обычно используемые антиоксиданты являются неэффективными для предотвращения образования сульфоксидов в фармацевтических композициях ABT-263.
Итак, на данный момент было обнаружено, что в практике осуществления настоящего изобретения, описанного в данном контексте, можно столкнуться с рядом проблем, связанных с получением фармацевтически приемлемой готовой лекарственной формы ABT-263 в виде капсулы, наполненной жидким раствором лекарственного средства.
В одном варианте, настоящее изобретение предлагает фармацевтическую капсулу, содержащую капсульную оболочку, заключающую внутри себя инкапсулированный, в количестве не больше чем около 1000 мг на капсулу, жидкий раствор ABT-263 или его фармацевтически приемлемой соли при концентрации эквивалента свободного основания ABT-263, по крайней мере, около 40 мг/мл в, по существу, неэтанольном носителе, который включает в качестве фармацевтически приемлемых наполнителей:
по крайней мере, один фосфолипид,
по крайней мере, один солюбилизирующий агент для, по крайней мере, одного фосфолипида, выбранный из группы, состоящей мз гликолей, гликолидов, глицеридов и их смесей,
по крайней мере, одно поверхностно-активное вещество нефосфолипидной природы, и
по крайней мере, один серусодержащий антиоксидант в количестве, эффективном для снижения окислительной деградации ABT-263 при хранении.
В более конкретном варианте, ABT-263 присутствует в капсуле в форме свободного основания в отличие от солевой формы.
В другом более конкретном варианте, серусодержащий антиоксидант является плохо растворимым в липидах; поэтому, в результате введения антиоксиданта в виде водного исходного раствора, инкапсулированный жидкий раствор согласно этому варианту содержит воду. Присутствие слишком большего количества воды может представлять угрозу физической стабильности жидкого на основе липида раствора, и, кроме того, может способствовать возрастанию скорости образования сульфоксидов, отрицая пользу добавления антиоксиданта. Поэтому, важно, чтобы инкапсулированный жидкий раствор в соответствии с данным вариантом содержал не больше чем около 1% масс. воды.
Ограничение на количество серусодержащего антиоксиданта, налагаемое ограничением на содержание воды, создает дополнительные трудности. Типично, серусодержащие антиоксиданты снижают образование сульфоксидных побочных продуктов лекарственного средства, выступая в качестве конкурентных субстратов для веществ окислительного типа, таких как пероксиды; такой способ действия обычно требует, чтобы антиоксидант присутствовал в количестве, по крайней мере, приближающемся к молярной эквивалентности в отношении количества лекарственного средства. Неожиданно, авторами было обнаружено, что при молярных отношениях уже 1:20 или даже ниже относительно концентрации ABT-263, некоторые серусодержащие антиоксиданты проявляют заметную эффективность в снижении скорости образования сульфоксидов в различных условиях хранения. Подходящие серусодержащие антиоксиданты согласно настоящему варианту включают, без ограничения, сульфиты, бисульфиты, метабисульфиты и тиосульфаты.
Иллюстративно, прототипная капсула согласно настоящему варианту содержит оболочку твердой желатиновой капсулы размера 0, заключающую внутри себя жидкий раствор, который содержит:
около 50 мг свободного основания ABT-263,
около 150 мг фосфатидилхолина,
около 75 мг среднецепочечных триглицеридов,
около 90 мг среднецепочечных моно- и диглицеридов,
около 90 мг поверхностно-активного вещества, полисорбата 80,
около 0,25 мг метабисульфита натрия или калия,
около 0,025 мг EDTA (этилендиаминтетрауксусная кислота, хелатообразующий агент) или ее соли, и
около 2,5 мг воды.
В другом варианте, настоящее изобретение предлагает способ получения капсулы, описанной выше, включающий:
растворение API (активного фармацевтического ингредиента), который, в основном, состоит из ABT-263 или его соли в, по крайней мере, фосфолипиде и солюбилизирующем агенте с получением липидного раствора,
смешение поверхностно-активного вещества нефосфолипидной природы с солюбилизирующим агентом или липидным раствором,
растворение плохо растворимого в липиде серусодержащего антиоксиданта в воде с получением водного исходного раствора,
смешение водного исходного раствора с липидным раствором с получением жидкого раствора для инкапсуляции, и
инкапсуляцию жидкого раствора в оболочке капсулы.
В очередном варианте, настоящее изобретение предлагает способ лечения заболевания, характеризуемого нарушением регуляции апоптоза и/или сверхэкспрессией противоапоптического белка семейства Bcl-2, включающий пероральное введение субъекту, страдающему этим заболеванием, терапевтически эффективного количества ABT-263, находящегося в описанной в данном контексте капсуле в составе инкапсулированной внутри нее жидкости. Примеры такого заболевания включают многие новообразования, включая различные типы рака. Конкретным иллюстративным типом рака, который может быть лечим согласно настоящему способу, является неходжкинская лимфома. Другим конкретным иллюстративным типом рака, который может быть лечим согласно настоящему способу, является хронический лимфоцитарный лейкоз (CLL). Следующий конкретный иллюстративный тип рака, который может быть лечим согласно настоящему способу, представляет собой острый лимфоцитарный лейкоз (ALL), например у пациента-ребенка.
В очередном варианте, настоящее изобретение предлагает способ поддержания в кровотоке больного раком человека, например, пациента с неходжкинской лимфомой, CLL или ALL, терапевтически эффективной плазменной концентрации ABT-263 и/или одного или большего числа его метаболитов, включающий введение субъекту одной до некоторого множества капсул, содержащих ABT-263, полученных как описано в данном контексте, в дозированном количестве от около 50 до около 1000 мг ABT-263 в день, при среднем интервале между приемами лекарственного средства от около 3 часов до около 7 дней.
В соответствии с вышеупомянутыми способами, вводимая капсула может иллюстративно представлять собой прототипную капсулу, описанную выше, или другую капсулу по данному изобретению, которая перорально, по существу, биоэквивалентна вышеуказанной.
Дополнительные варианты изобретения, включая более конкретные аспекты вариантов, представленных выше, можно найти в, или становятся очевидными из нижеследующего подробного описания.
Краткое описание чертежей
Фиг. 1 - схематическая фазовая диаграмма растворов свободного основания ABT-263 в тройных "IPT" липидных системах, описанных в Примере 8. Заштрихованная часть диаграммы представляет собой область оптимизированного конечного состава композиции препарата.
Фиг. 2 - схематическая фазовая диаграмма растворов свободного основания ABT-263 в тройных "IST" липидных системах, описанных в Примере 8. Заштрихованная часть диаграммы представляет собой область оптимизированного конечного состава композиции препарата.
Фиг. 3 - график средней плазменной концентрации ABT-263 после введения людям, больным раком, капсулы с жидким раствором лекарственного средства по данному изобретению в сравнении с фармацевтической композицией, липидным раствором лекарственного средства, описанной в Примере 14.
Подробное описание изобретения
Настоящее изобретение предлагает готовую лекарственную форму ABT-263 или его соли в виде капсулы с жидким раствором лекарственного средства, которая является подходящей для перорального введения. Термины "пероральное введение" и "перорально введенный" в данном контексте относятся к введению субъекту внутрь (p.o.), т.е., введение, в результате которого композиция препарата тотчас же проглатывается, например, с помощью подходящего объема воды или другой подходящей для питья жидкости. "Пероральное введение" отличается в данном контексте от внутриротового введения, например, сублингвального или буккального введения, или местного нанесения на ткани полости рта, такие как периодонтальные ткани, которое не включает немедленное проглатывание композиции препарата.
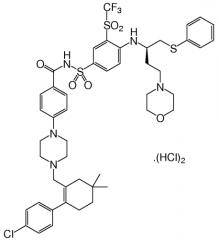
"ABT-263" в данном контексте относится к соединению, N-(4-(4-((2-(4-хлорфенил)-5,5-диметил-1-циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(морфолин-4-ил)-1-((фенилсульфанил)метил)пропил)амино)-3-((трифторметил)сульфонил)бензолсульфонамиду. В форме его родительского соединения, ABT-263 имеет формулу:
В некоторых вариантах, ABT-263 присутствует в препарате в форме его родительского соединения. Термин "свободное основание", который используют в данном контексте для удобства описания, относится к родительскому соединению, признавая, что родительское соединение представляет собой, строго говоря, цвиттер-ионное соединение и, поэтому, не всегда ведет себя как истинное основание.
ABT-263 могут образовывать аддитивные соли кислоты, аддитивные соли основания или цвиттер-ионы. Соли соединений Формулы I можно получить во время выделения или после очистки соединений. Аддитивные соли кислоты представляют собой соли, полученные в результате реакции ABT-263 с кислотой. Например, соли, включая ацетат-, адипат-, альгинат-, бикарбонат-, цитрат-, аспартат-, бензоат-, бензолсульфонат- (безилат), бисульфат-, бутират-, камфорат-, камфорсульфонат-, диглюконат-, формиат-, фумарат-, глицерофосфат-, глутамат-, гемисульфат-, гептаноат-, гексаноат-, гидрохлорид-, гидробромид-, гидроиодид-, лактобионат-, лактат-, малеат-, мезитиленсульфонат-, метансульфонат-, нафталинсульфонат-, никотинат-, оксалат-, памоат-, пектинат-, персульфат-, фосфат-, пикрат-, пропионат-, сукцинат-, тартрат-, тиоцианат-, трихлорацетат-, трифторацетат-, пара-толуолсульфонат- и ундеканоатные соли ABT-263 могут быть использованы в композиции препарата по данному изобретению. Аналогичным образом могут быть использованы аддитивные соли основания, включая соли, полученные в результате реакции ABT-263 с бикарбонатом, карбонатом, гидроксидом или фосфатом катионов, таких как литий, натрий, калий, кальций и магний.
ABT-263 имеет, по крайней мере, два протонируемых атомов азота и, следовательно, способно образовать аддитивные соли кислоты с больше чем одним, например, от около 1,2 до около 2, от около 1,5 до около 2 или от около 1,8 до около 2, эквивалентами кислоты на эквивалент ABT-263.
Иллюстративно, могут быть получены бис-соли ABT-263, включая, например, бис-гидрохлорид (бис-HCl) и бис-гидробромид (бис-HBr) соли.
Например, ABT-263 бис-HCl, представленную формулой
можно получить различными способами, например, способом, который может быть в общих чертах описан следующим образом.
Свободное основание ABT-263 получают, иллюстративно, как описано в Примере 1 вышецитированной публикации патентной заявки США № 2007/0027135, полное раскрытие которой включено в настоящее описание в виде ссылки. Подходящую массу свободного основания ABT-263 растворяют в этилацетате. Раствор хлороводородной кислоты в этаноле (например, около 4,3 кг HCl в 80 г EtOH) добавляют к раствору ABT-263 в количестве, обеспечивающем, по крайней мере, 2 моля HCl на моль ABT-263 и достаточное количество EtOH (по крайней мере, около 20 об.) для кристаллизации полученной ABT-263 бис-HCl соли. Раствор нагревают до около 45°C при перемешивании и добавляют затравку в виде взвеси в EtOH. Через приблизительно 6 часов, полученную взвесь охлаждают до около 20°C на протяжении приблизительно 1 часа и перемешивают при той же температуре в течение около 36 часов. Взвесь фильтруют, выделяя кристаллическое твердое вещество, которое представляет собой этанольный сольват ABT-263 бис-HCl. Сушка этого твердого вещества в вакууме и атмосфере азота при умеренном перемешивании в течение около 8 дней дает белые кристаллы десольватированного ABT-263 бис-HCl. Это вещество является подходящим для получения готовой лекарственной формы ABT-263 бис-HCl по данному изобретению.
Таким образом, капсула по данному изобретению содержит свободное основание ABT-263 или его фармацевтически приемлемую соль, например, ABT-263 бис-HCl. В более конкретном варианте, композиция препарата включает свободное основание ABT-263.
Как указывалось выше, свободное основание ABT-263 можно получить способом, описанным в Примере 1 вышецитированной публикации '135. Продукт этого способа является аморфным стеклообразным твердым веществом. Из этого продукта можно получить порошок, например, используя методы лиофильной сушки, сушки распылением или осаждения. Такой порошок может быть использован в качестве API для получения капсулы по данному изобретению; однако, в дальнейшем будет выявлена предпочтительность использования в качестве API кристаллической формы свободного основания ABT-263. Такие кристаллические формы включают сольваты и кристаллические формы, не содержащие в своей структуре растворителя.
Сольваты свободного основания ABT-263 можно получить, как описано ниже. Исходный продукт может быть любой формой в твердом состоянии свободного основания ABT-263, включая аморфную форму, полученную в соответствии с публикацией '135.
Измеренное количество свободного основания ABT-263 (как указано, может быть использована любая твердотельная форма) суспендируют в любом из ряда растворителей или смесей растворителей, включая, без ограничения, 2-пропанол, 1-пропанол, смесь этилацетат/этанол 1:3 об./об., смесь метилацетат/гексаны 1:1 об./об., хлороформ, метанол, смесь 1,4-диоксан/гексаны 1:2 об./об., толуол и бензол. Полученную суспензию перемешивают при температуре окружающей среды, защищая при этом ее от света. По истечении периода времени, достаточного для осуществления сольватации свободного основания ABT-263 в каждом случае, кристаллы собирают фильтрующим центрифугированием. Полученные сольваты могут быть охарактеризованы, используя дифракцию рентгеновских лучей с рентгеновской съемкой по методу порошка (PXRD), например, используя дифрактометр G3000 (Inel Corp., Artenay, France), оснащенный чувствительным к дифрагированным отражениям детектором и оптикой пучка параллельных лучей. На дифрактометре установлена трубка с медным анодом (1,5 кВт острый фокус), режим работы прибора 40 кВ и 30 ма. Монохроматическое излучение первичного пучка обеспечивается германиевым монохроматором. Дифрактометр калибруют, используя затухающий направленный луч в интервале одного градуса. Калибровку контролируют, используя положение линии эталона порошка кремния (NIST 640c). Прибор функционирует с помощью компьютера, используя программное обеспечение Symphonix (Inel Corp., Artenay, France), и данные анализируют, используя программное обеспечение Jade (версия 6,5, Materials Data, Inc., Livermore, CA). Образец загружают в алюминиевый объектодержатель и выравнивают предметным стеклом.
Десольватация этилацетат/этанольного сольвата, например, посредством сушки на воздухе, дает не содержащую растворитель, кристаллическую форму свободного основания ABT-263. Рефлексы PXRD для свободного основания ABT-263 Формы I перечислены в Таблице 1. Порошковая рентгенограмма, имеющая рефлексы, в основном такие, как указаны в настоящем описании, может быть использована для идентификации кристаллического свободного основания ABT-263, в частности, свободного основания ABT-263 Формы I. Выражение "в основном такие, как указаны" в настоящем контексте означает наличие рефлексов, которые сдвинуты не больше чем на около 0,2°2θ от указанного положения.
| Таблица 1 | |
| Перечень PXRD рефлексов: не содержащая растворителя кристаллическая полиморфная форма I свободного основания ABT-263 | |
| Положение рефлекса (°2θ) | |
| 6,21 | |
| 6,72 | |
| 9,66 | |
| 10,92 | |
| 11,34 | |
| 12,17 | |
| 14,28 | |
| 16,40 | |
| 16,95 | |
| 17,81 | |
| 18,03 | |
| 18,47 | |
| 19,32 | |
| 20,10 | |
| 21,87 |
Десольватация большей части сольватов, включая сольваты 1-пропанола, 2-пропанола, метанола, бензола, толуола, смеси диоксан/гексаны, смеси метилацетат/гексаны и хлороформа, дает не содержащую растворителя кристаллическую форму свободного основания ABT-263, которая, как показано посредством PXRD, является идентичной кристаллической форме, полученной десольватацией сольвата этилацетат/этанол.
Десольватация сольватов пиридина и анизола дает не содержащую растворителя кристаллическую форму свободного основания ABT-263, которая, как показано посредством PXRD, отличается от формы, полученной десольватацией этилацетат/этанольного сольвата. Кристаллическая форма, полученная в результате десольватации сольвата пиридина и анизола, обозначена Формой II. Рефлексы PXRD для Формы II свободного основания ABT-263 перечислены в Таблице 2. Порошковая рентгенограмма, имеющая пики, в основном такие, как указаны в данном контексте, могут быть использованы для идентификации кристаллического свободного основания ABT-263, в частности, Формы II свободного основания ABT-263.
| Таблица 2 | |
| Перечень рефлексов PXRD: не содержащая растворителя кристаллическая полиморфная форма II свободного основания ABT-263 | |
| Положение рефлекса (°2θ) | |
| 5,79 | |
| 8,60 | |
| 9,34 | |
| 10,79 | |
| 11,36 | |
| 11,59 | |
| 12,76 | |
| 13,23 | |
| 13,73 | |
| 14,01 | |
| 14,72 | |
| 15,00 | |
| 16,28 | |
| 17,07 | |
| 17,48 | |
| 18,75 | |
| 19,34 | |
| 19,71 | |
| 20,56 | |
| 21,35 |
Рефлексы PXRD, особенно характерные для Формы I свободного основания ABT-263, в частности, отличающие Форму I от Формы II, включают рефлексы при 6,21, 6,72, 12,17, 18,03 и 20,10°2θ, в каждом случае ±0,2°. В одном варианте, Форма I свободного основания ABT-263 характеризуется, по крайней мере, рефлексом в любом одном или большем числе из этих положений. В другом варианте, Форма I свободного основания ABT-263 характеризуется, по крайней мере, рефлексом в каждом из эт