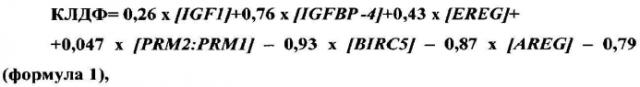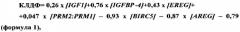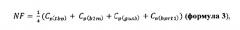Способ прогнозирования наступления беременности в программе экстракорпорального оплодотворения при селективном переносе эмбрионов путем оценки молекулярно-генетического профиля гамет с помощью пцр-рв
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к акушерству и гинекологии, репродуктологии, и может быть использовано для оптимизации программы экстракорпорального оплодотворения (ЭКО) с учетом молекулярно-генетических характеристик гамет при селективном переносе эмбрионов (ПЭ). Способ заключается в том, что на основании данных ПЦР-амплификации исследуемых и референсных генов, полученных в день трансвагинальной пункции яичников (ТВП) методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР), об уровне экспрессии мРНК генов факторов роста (AREG, EREG, IGF1, IGFBP4), ингибитора апоптоза (BIRC5) в клетках фолликулярной жидкости, соотношения уровня экспрессии мРНК протаминов (PRM2:PRM1) в сперме получают значения пороговых циклов (Ср) накопления продуктов реакции, вычисляют значение канонической линейной дискриминантной функции (КЛДФ) по формуле, и если значение КЛДФ>0,22, делают заключение о благоприятном прогнозе наступления беременности. Изобретение позволяет выбирать эмбрион, имеющий высокий потенциал к имплантации, с целью снижения частоты многоплодных беременностей, а также прогнозировать наступление беременности в программе ЭКО при селективном переносе эмбрионов. 1 пр., 3 ил.
Реферат
1. Область техники
Изобретение относится к медицине, а именно к акушерству и гинекологии, репродуктологии, и может быть использовано для оптимизации программы экстракорпорального оплодотворения (ЭКО) при селективном переносе эмбрионов (ПЭ), основываясь на данных о молекулярно-генетических характеристиках гамет.
2. Уровень техники
Внедрение в клиническую репродуктологию стратегии селективного переноса одного эмбриона (elective single embryo transfer, eSET) в сочетании с современными методами выбора эмбриона является одним из ведущих факторов успешного проведения лечения бесплодия методом ЭКО и ПЭ [2, 3, 5, 16, 20].
Задачей настоящего изобретения является оценка транскриптомного профиля гамет с целью оптимизации выбора эмбриона для селективного переноса и прогнозирования наступления беременности в программе экстракорпорального оплодотворения.
Эта задача решается путем дополнения морфологической оценки гамет и эмбрионов данными молекулярно-генетического исследования уровня экспрессии мРНК генов факторов роста (AREG, EREG, IGF1, IGFBP4), ингибитора апоптоза (BIRC5) в клетках фолликулярной жидкости, соотношения уровня экспрессии мРНК протаминов (PRM2:PRM1) в сперме, полученной в день трансвагинальной пункции яичников и использованной для оплодотворения, с применением метода полимеразной цепной реакции с обратной транскрипцией (ПЦР-ОТ), что позволяет неинвазивно и комплексно подходить к выбору эмбриона, имеющего максимальный шанс к имплантации в программе ЭКО и ПЭ, принимая во внимание исходный статус гамет и клинико-анамнестические данные супружеских пар с бесплодием.
Общепринятым способом определения качества гамет и эмбрионов в условиях in vitro является морфологическая оценка, которая, однако, не всегда позволяет объективно судить об их полноценности и прогнозе наступления беременности [1, 10, 11, 13]. С целью селективного переноса эмбрионов применяются следующие методы оценки качества эмбрионов: инвазивные (преимплантационная генетическая диагностика, скрининг); неинвазивные (системы непрерывного наблюдения за развитием эмбрионов (time-lapse embryo selection), протеомный и секретомный анализ сред культивирования эмбрионов [3, 4, 8, 12, 15, 21, 23].
Комплексная оценка женских и мужских гамет с целью селективного переноса эмбрионов ранее не выполнялась.
Ранее оценка ооцита проводилась только по морфологическим характеристикам или применялся инвазивный метод косвенной оценки по генетической диагностике полярных телец [1, 10].
Принимая во внимание актуальность описанной проблемы, необходимость выявления объективных маркеров качества эмбриона и гамет, в литературе имеются предшествующие данному исследованию аналоги. Так, в патенте группы авторов N.M. Orsi, N. Gopichandran, S. Barber, V. Sharma, J. J. Walker Британского Университета и Образовательного Госпиталя (Leeds (University of Leeds, The Leeds Teaching Hospitals NHSTrust) «Маркеры полноценности ооцита» (Markers of oocyte viability, №PCT/GB2009/050339, 07.04.2009) задекларировано использование иммуноферментного анализа для определения концентрации панели 50 цитокинов, вовлеченных в созревание ооцита, в индивидуальных образцах фолликулярной жидкости в программе ЭКО. Учитывая трудоемкость, большой объем необходимых исследований, высокую стоимость расходных материалов, предложенный нами метод имеет ряд преимуществ по сравнению с описанным аналогом.
В аналоге изобретения группы авторов М.-А. Sirard, A.-L. Nivet, A. Bunel, R. Labrecque Канадского Университета Laval (Universite Laval) «Яичниковые маркеры зрелости фолликула и их использование» (Ovarian markers of follicular maturity and uses thereof, №PCT/CA2012/000697, 24.07.2012) использовалась оценка уровня транскрипции нескольких, отличных от предложенных нами, молекул, связанных с процессом фолликулогенеза на разных стадиях созревания в программе IVM (in vitro maturation).
В запатентованном исследовании группы авторов S. Hammamah, S. Assou Французского Университета NSERM (Institute National De La Sante et De La Recherche Madicale) «Методы выбора полноценных ооцитов и эмбрионов с высоким имплантационным потенциалом» (Methods for selecting competent oocytes and competent embryos with high potential for pregnancy outcome, №PCT/EP2011/070990, 24.11.2011), использовалась оценка уровня экспрессии микро-РНК в кумулюсных клетках ооцита и эмбриона.
В исследовании соавторов М. Conti, A.M. Zamah, J.Chen Калифорнийского Университета (The Regents of the University of California) «Неинвазивные методы для оценки качества ооцита в программе ЭКО» (Noninvasive methods for assessing oocyte quality for in vitro fertilization, №PCT/US2012/071417, 21.12.2012) производилась оценка уровня экспрессии продуктов трансляции в средах для культивирования ооцита на моделях мышей с использованием методов оценки микроокружения, иммуноферментного анализа, что отличается от предлагаемого нами способа используемым методом протеомного анализа.
Во всех представленных аналогах не производился учет отцовского фактора (paternal contribution) [7, 14].
Диагностика качества сперматозоидов по критериям ВОЗ (2010 г.) или строгим критериям Крюгера, рекомендованным в 1999 г, не позволяет выявить ультраструктурные нарушения компактизации спермального хроматина, приводящие к нарушению оплодотворения или остановке развития эмбрионов на ранних этапах дробления или прерыванию беременности на ранних сроках [6, 17, 18, 19, 22].
Поиск предикторов качества спермы активно ведется в течение последних десятилетий. В 2006 г. исследователями D.D.J. Krawets, A. Stephen, D. Miller из Университета США Wayne State запатентован метод «Генетического тестирования для определения мужского фактора бесплодия» (Genetic testing for male factor infertility, №11357423, 21.02. 2006), в котором путем анализа микроокружения исследуются спермальные гены, ответственные за мужское бесплодие.
В качестве наиболее близкого аналога части нашего изобретения может быть представлено исследование группы авторов K. Steger, A. Paradowska, В. Barmann из Германского Университета Justus-Liebig-Universitat Gieben «Метод и быстрый тест для определния фертильности спермы» (Method and rapid test for determining the fertility of sperm, №PCT/EP2011/057942, 17.05.2011), в котором путем оценки концентрации протаминов и их соотношения оценивается качество спермы, при этом отсутствуют указания на прогнозирование наступления беременности, качество эмбриона, используется трудоемкий, длительный, дорогостоящий метод по сравнению с предлагаемым нами способом.
3. Описание изобретения
Предложен способ прогнозирования наступления беременности в программе ЭКО и селективном переносе эмбрионов путем комплексной оценки транскриптомного профиля гамет с помощью ПЦР в режиме реального времени (ПЦР-РВ) путем оценки уровня представленности транскриптов ряда генов в клетках фолликулярной жидкости и спермы: в частности генов ростовых факторов (AREG, EREG, IGF1, IGFBP4), маркера апоптоза (BIRC5) в клетках фолликулярной жидкости, полученных в день трансвагинальной пункции яичников, а также соотношения уровня экспрессии мРНК протаминов (PRM2:PRM1) в сперме, использованной для оплодотворения.
Для оценки уровня представленности транскриптов (мРНК) исследуемых генов в мазках используются методы обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР) с регистрацией накопления продуктов реакции в режиме «реального времени».
Изобретение получено на основании результатов лечения и статистического анализа 104 супружеских пар с трубно-перитонеальным и/или мужским фактором бесплодия, имеющих не более двух неэффективных циклов ЭКО и ПЭ в анамнезе, в которых возраст пациенток не превышал 35 лет, женщины имели нормальный овариальный резерв, фертильную и/или субфертильную сперму супруга.
В зависимости от исхода программы ЭКО все пациентки были разделены на 2 группы. К I группе, составившей группу контроля, были отнесены пациенты с благополучным результатом лечения бесплодия - рождением здорового ребенка (n=24). Среди II группы неуспешного завершения ЭКО и ПЭ было выделено три подгруппы. У пациентов IIа группы в результате применения ВРТ наступила беременность, но закончилась самопроизвольным прерыванием беременности ранних сроков (до 11 недель) (n=13). Группу IIb составили пациенты с биохимической беременностью, не подтвержденной далее ультразвуковыми данными, при которой на 14 день после переноса эмбрионов уровень β-субъединицы хорионического гонадотропина (β-ХГ) составлял не менее 30 мМЕ/мл, т.н. «преэмбрионические потери» (n=24). В IIс группу вошли женщины с отрицательным результатом, у которых уровень β-ХГ был менее 20 мМЕ/мл (n=43).
Представленные данные (фиг. 1) демонстрируют отличия между группами по уровню экспрессии мРНК генов изучаемых факторов в фолликулярной жидкости и сперме при различных исходах программы ЭКО и ПЭ.
На основании экспериментальных данных при сравнении групп женщин с наступившей беременностью и неблагоприятным завершением программы ЭКО и ПЭ были получены и проанализированы результаты с применением методов многофакторного статистического анализа (дискриминантный анализ), выбрана линейная функция, позволяющая прогнозировать наступление беременности для каждой супружеской пары.
Уравнение канонической линейной дискриминантной функции имеет вид:
где [IGF1], [IGFBP4], [EREG], [BIRC5], [AREG] - относительный уровень представленности мРНК соответствующих генов в клетках фолликулярной жидкости,
[PRM2:PRM1] - отношение уровней экспрессии мРНК соответствующих генов в сперме.
Относительный уровень экспрессии мРНК исследуемых генов вычисляется по формуле 2:
[I]=2^(NF-Cpi) (формула 2), где
где [1] - относительный уровень представленности мРНК исследуемого гена,
Cpi - значение порогового цикла соответствующего исследуемого гена в образце, определяемого автоматически программным обеспечением прибора;
NF - фактор нормировки, который вычисляется по формуле 3:
где Cp - значения пороговых циклов соответствующих референсных генов в образце, определяемых автоматически программным обеспечением прибора.
Отношение уровней экспрессии мРНК генов PRM2 и PRM1 в сперме вычисляется по формуле 4:
[PRM2:PRM1]=2^(Cp(prm1)-Cp(prm2) (формула 4), где
где Cp - значения пороговых циклов соответствующего протамина в образце.
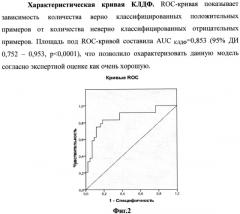
Диагностическая возможность предложенной модели оценивалась с использованием ROC-анализа. Согласно фиг. 2, площадь под кривой (AUC) составила AUC=0,853±0,051 (95% ДИ 0,752-0,953, p<0,0001), что позволило характеризовать данную модель согласно экспертной оценке как очень хорошую. В качестве порога отсечения (точка cut off) выбрано значение функции, соответствующее максимальной сумме чувствительности и специфичности. В результате апостериорной классификации 80,6% (КЛДФ) исходных сгруппированных наблюдений классифицировано правильно. Получены значения точки cut off для КЛДФ1 - 0,22 для разделения супружеских пар с положительным и отрицательным исходом ЭКО и ПЭ.
Превышение значения канонической линейной дискриминантной функции относительно точки cut off классифицировалось как наступление беременности в результате ЭКО и ПЭ. Чувствительность предложенной модели в области порогового значения составила 83,3%, специфичность 81,4%, положительная прогностическая ценность 80,0%, отрицательная прогностическая ценность 87,5%.
Ограничение метода
Из исследования были исключены женщины с противопоказаниями для проведения программы ЭКО и вынашивания беременности, наличием распространенных форм наружного генитального эндометриоза, синдрома поликистозных яичников, резекции яичников в анамнезе, хронического эндометрита, пациенты с выраженными изменениями спермограммы.
4. Реализация изобретения
В программе ЭКО у супружеских пар, сопоставимых между собой по клинико-анамнестическим, лабораторным параметрам после стимуляции суперовуляции в день трансвагинальной пункции яичников проводили аспирацию фолликулярной жидкости (n=104) индивидуально с промывкой иглы после каждого фолликула, в маркированные пробирки без гепарина. После идентификации и извлечения ооцит-кумулюсных комплексов образцов фолликулярной жидкости проводили выделение клеток путем центрифугирования при 6000 об/мин в течение 10 минут с последующим применением промывочных буферных растворов, что позволило снизить контаминацию клетками крови образцов фолликулярной жидкости. Далее в асептических условиях производилось ресуспендирование полученных клеток в 300 мкл 3 мМ раствора гуанидинтиацианата для сохранения рибонуклеиновой кислоты (РНК), выполнялось выделение РНК методом фенольной депротеинизации с последующим осаждением РНК изопропанолом и отмывками промывочными растворами. Объем образцов после выделения составлял 50 мкл. Реакцию обратной транскрипции (ОТ) ставили в объеме 40 мкл (для реакции брали 33 мкл образца РНК) в течение 30 минут при температуре 40°C с последующей инактивацией обратной транскриптазы при 95°C в течение 5 минут. Для увеличения объемов образцов после ОТ и с целью предотвращения деградации ДНК копии ДНК разводили в 5 раз в ТЕ-буфере (Tris (гидрокиметиламинометан) и Этилендиаминтетрауксусная кислота). Праймеры и зонды для полимеразной цепной реакции (ПЦР) были подобраны с учетом структуры генов таким образом, чтобы исключить отжиг на матрице геномной ДНК исследуемых и референсных генов. Реакции амплификации целевых и референсных генов ставили в разных пробирках в двух повторах. В качестве референсных генов использовались: ген гипоксантилфосфорибозилтрансферазы-1 (HPRT1), ген ТАТА-бокс-связывающего протеина (ТВР), ген глюкуронидазы бета (GUSB) и ген β-2 микроглобулина (В2М). Для повышения чувствительности и специфичности ПЦР был применен «горячий старт» с применением парафина. Амплификацию осуществляли в режиме «реального времени» в объеме 35 мкл по следующей программе: 1 цикл - 80°C 30 сек, 94°C 1 мин; 50 циклов - 94°C 10 сек, 64°C 20 сек, использовали прибор «ДТ-964» производства ООО «НПО ДНК-Технология». Измерение уровня флуоресценции проводили на каждом цикле при температуре 64°C. Уровень экспрессии мРНК измеряли в относительных единицах, определяемых методом сравнения индикаторных циклов (ΔΔCq) с нормировкой на экспрессию референсных генов и значение медианы (Me) в группе успешного исхода программы ВРТ. Аналогично описанной методике при помощи ОТ-ПЦР проводилось изучение уровня экспрессии мРНК генов протаминов {PRM-1, PRM-2) в 79 образцах спермы, полученных в день ТВП и использованных для оплодотворения.
Проводилась программа ЭКО и ПЭ со стимуляцией суперовуляции по стандартным протоколам. Оплодотворение проводилось методами стандартного ЭКО или с помощью ИКСИ (при наличии субфертильных отклонений спермограммы в день ТВП от нормы по критериям ВОЗ, 2010 г.) в равной доле (p=0,833) [22]. Культивирование эмбрионов осуществлялось в индивидуальных лунках четырехлуночного планшета в соответствии с номером образца фолликулярной жидкости. Выбор эмбриона осуществлялся на основании морфологической оценки. Большинство полученных эмбрионов имело хорошую морфологическую оценку (по D.K. Gardner, W.B. Schoolcraft, 1999), что позволило в половине случаев произвести селективный перенос одного или двух эмбрионов на стадии бластоцисты [9].
Пример использования изобретения
Производилась оценка транскриптомного профиля мужских и женских гамет, сформировавших в результате проведения оплодотворения in vitro 21 эмбрион. Выполнялась общепринятая морфологическая оценка полученных эмбрионов. Перенос эмбрионов производился на основании комплексной морфологической и предлагаемой нами молекулярно-генетической оценки гамет. Оценена эффективность программы ЭКО (фиг. 3).
Разработанная нами математическая модель позволяет с диагностической эффективностью выше 80,0% классифицировать супружеские пары по исходам ЭКО и ПЭ в зависимости от совокупных данных по молекулярно-генетическому профилю фолликулярной жидкости и спермы в день трансвагинальной пункции яичников (ТВП) и может быть использована в качестве дополнительного критерия объективной оценки качества гамет, что особенно важно при проведении селективного переноса одного эмбриона.
В данной работе была продемонстрирована важность комбинации не только морфологической и молекулярно-генетической оценки качества гамет и эмбрионов, но и сочетанного анализа «материнского» и «отцовского вклада» в развитие эмбриона. Нами произведена попытка объяснения дифференцировки качества ооцитов и сперматозоидов, реализующихся в изменении потенциала развития эмбрионов, с позиции функционирования системы ростовых факторов в ооцит-кумулюсном комплексе (для ооцита) и структурной целостности спермального хроматина за счет протаминов на основании оценки профиля мРНК генов, вовлеченных в эти механизмы.
Список литературы
1. Назаренко Т.А. Стимуляция функции яичников. - М.: Медпресс - информ, 2008. - 272 с.
2. Тишкевич О.Л. Эффективность ЭКО и частота многоплодной беременности в зависимости от числа и качества переносимых эмбрионов у женщин разного возраста. // Проблемы репродукции. - 2008. - Т. 2, N. 2. - С. 8-12.
3. Ярилин А.А. Система цитокинов и принципы ее функционирования в норме и при патологии // Иммунология. - 1997. - N 5. - с. 7-14.
4. Assou S. А non - invasive test for assessing embryo by gene expression profiles of human cells: a proof of concept study. // Molecular Hum. Reprod. 2008. - Vol. 14, N. 12. - P. 711-719.
5. Assisted reproductive technology in Europe, 2006: results generated fron European registers by ESHRE / J. de Mouzon [et al.] // Hum. Reprod. - 2010. - Vol. 25 - P. 1851-1862.
6. Dadoune J. - P. Spermatozoal RNAs: What About Their Functions? // Microscopy research and technique. - 2009. - Vol.72. - P. 536 -551.
7. Douglas Т. C, Hammoud S. S. The human sperm epigenome and its potential role in embryonic development // Molecular Hum. Reprod. - 2010. - Vol. 16, N. 1. - P. 37-47.
8. Follicular fluid content and oocyte quality: from single biochemical markers to metabolomics / A. Revelli [et al.] // Reproductive Biology and Endocrinology. - 2009. - Vol. 7, N. 40. - P. 1-13.
9. Gardner D.K., Schoolcraft W.B. In vitro culture of human blastocysts. - Jansen R., Mortimer D. (eds.) Towards Reproductive Certainty: Infertility and Genetics Beyond. - Carnforth: Parthenon Press, 1999. - P. 378-388.
10. Single embryo transfer / J.M.R. Gerris [et al.]. - Cambridge University Press, 2009. - 305p.
11. Huang Z., Wells D. The human oocyte and cumulus cells relationship: new insights from the cumulus cell transcriptome // Molecular Hum. Reprod. - 2010. -Vol. 16, N. 10. - P. 715-725.
12. Human cumulus cells as biomarkers for embryo and pregnancy outcomes / S. Assou [et al.] // Molecular Hum. Reprod. - 2010. - Vol. 16, N. 8. - P. 531-538.
13. Kempisty В., Jedrzejczak P., Jagodzinski P.P. Structure and role of protamines 1 and 2 in spermatogenesis and male infertility // Ginekol Pol. - 2006. - Vol. 77. - P. 238-245
14. Krawetz S.A. Paternal contribution: new insights and future challenges // Nature Reviews: Genetics. - 2005. - Vol. 6. - P. 633-642.
15. Lindeberg M. Molecular and morphological studies of folliculogenesis, oocyte maturation and embryogenesis in humans: thesis for doctoral degree (PhD). - KarolinskaInstitutet. - 2008. - P. 69.
16.Maheshwari A., Griffiths S., Bhattacharya S. Global variations in the uptake of single embryo transfer // Hum. Reprod. Update. - 2011. - Vol. 17, N. 1. - P. 107-120.
17. Miller D., Brinkworth M., lies D. Paternal DNA packaging in spermatozoa: more than the sum of its parts? // DNA, histones, protamines and epigenetics Reproduction. - 2010. - Vol. 139. -P. 287-301.
18. O′Flynn K.L., O′Brien B.A., Varghese A.C., and Agarwal A. The genetic causes of male factor infertility: A review // Fertil. Steril. - 2010. - Vol. 93, N. 1. - P. 1-12.
19. Carreau S. RNA dynamics of fertile and infertile spermatozoa. // Molecular Reproduction & Development. - 2010. - Vol. 77. - P.158-166.
20. Scott L. The biological basis of non - invasive strategies for selection of human oocytes and embryos / [et al.] // Hum. Reprod Update. - 2003. - Vol.9? N. 3. - P. 237-249.
21. The differential transcriptome and ontology profiles of floating and cumulus granulosa cells in stimulated human antral follicles / S. Koks [et al.] // Molecular Hum. Reprod. - 2010. - Vol. 16, N. 4. - P. 229-240.
22. World Health Organization reference values for human semen characteristics / T.G. Cooper [et al.] // Hum. Reprod. Update. - 2010. - Vol. 14, N. 5. - P. 431-446.
23. Youle R.J., Strasser A. The BCL-2 protein family: opposing activities that mediate cell death // Nat Rev Mol Cell Biol. - 2008. - Vol. 9, N. 1. - P.47-59.
Способ прогнозирования наступления беременности в программе экстракорпорального оплодотворения при селективном переносе эмбрионов путем оценки молекулярно-генетического профиля гамет с помощью ПЦР-РВ, отличающийся тем, что на основании данных ПЦР-амплификации исследуемых и референсных генов, полученных в день трансвагинальной пункции яичников (ТВП) методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР), об уровне экспрессии мРНК генов факторов роста (AREG, EREG, IGF1, IGFBP-4), ингибитора апоптоза (BIRC5) в клетках фолликулярной жидкости, соотношения уровня экспрессии мРНК протаминов (PRM2:PRM1) в сперме получают значения пороговых циклов (Ср) накопления продуктов реакции, вычисляют значение канонической линейной дискриминантной функции (КЛДФ) по формуле если значение КЛДФ>0,22, делают заключение о благоприятном прогнозе наступления беременности.