Модифицированный биотинсвязывающий белок (вариант), нуклеиновая кислота его кодирующая, вектор и носитель для связывания биотина
Иллюстрации
Показать всеПредставленные изобретения касаются модифицированного белка, нуклеиновой кислоты, кодирующей такой белок, вектора, содержащего нуклеиновую кислоту, и носителя для связывания биотина, на котором иммобилизован такой белок. Охарактеризованный модифицированный биотинсвязывающий белок получен введением мутации от одного до нескольких аминокислотных остатков в последовательность, представленную в SEQ ID NO:2, или аминокислотную последовательность, идентичную на 98% или более указанной последовательности, и наличием биотинсвязывающей активности, где по меньшей мере один остаток, выбранный из группы, состоящей из остатков от 1) до 4), представленных ниже, заменен остатком кислой аминокислоты или остатком нейтральной аминокислоты: 1) остатка аргинина в положении 104 SEQ ID NO: 2; 2) остатка лизина в положении 141 SEQ ID NO: 2; 3) остатка лизина в положении 26 SEQ ID NO: 2 и 4) остатка лизина в положении 73 SEQ ID NO: 2. Предложенные изобретения позволяют получить биотинсвязывающий белок и могут быть применимы для связывания биотина. 5 н. и 9 з.п. ф-лы, 6 ил., 11 табл., 3 пр.
Реферат
Область техники, к которой относится изобретение
По настоящей заявке испрашивается приоритет японской патентной заявки No. 2008-208766, зарегистрированной 13 августа 2008 г.
Настоящее изобретение относится к модифицированному биотинсвязывающему белку.
Известный уровень техники
Авидин представляет собой белок, происходящий из белка яйца, а стрептавидин является белком, происходящим из Streptomyces avidinii. Авидин и стрептавидин, каждый обладает очень высоким сродством (KD=от 10-16 до 10-14) к биотину (D-[(+)-цис-гексагидро-2-оксо-1H-тиено-(3,4)-имидазол-4-валерату]), и это сродство является одним из наиболее сильных взаимодействий между двумя биологическими молекулами. Их молекулярные массы составляют приблизительно 60 кДа. В настоящее время взаимодействие авидин/стрептавидин-биотин широко применяется в областях биохимии, молекулярной биологии и медицины (Green, (1975), Adv. Protein Chem., 29: 85-133; Green, (1990), Methods Enzymol., 184: 51-67). Авидин и стрептавидин, каждый образует тетрамер, и одна субъединица тетрамера связывается с одной молекулой биотина.
Проблемой в использовании авидина является его неспецифическое связывание. Авидин может не специфически связываться не только с клетками, но также с ДНК, белками и биологическим материалом, таким как мембраны. Например, при определении вещества с использованием связывания авидин-биотин авидин не специфически связывается с веществами, отличными от целевого вещества, предназначенного для определения, что увеличивает фон. Причины высокого неспецифического связывания авидина включают его высокую изоэлектрическую точку и цепи сахаров, содержащиеся в количестве приблизительно 10% от молекулярной массы. Авидин представляет собой сильно основной белок, обладающий высокой изоэлектрической точкой 10 или более, и в целом заряжен положительно. Соответственно, считается, что авидин легко связывается с биологическими веществами, которые во многих случаях заряжены отрицательно.
Кроме того, считается, что цепи сахаров на поверхности авидина легко связываются с биологическими веществами (Marttila et al., (2000) FEBS Lett, 467, 31-36). Для того чтобы снизить неспецифическое связывание авидина, исследовались, например, химически модифицированный нейтравидин, у которого цепи сахаров авидина удалены с помощью гликозидазы (Bayer, et al., (1995) Appl Biochem Biotechnol, 53(1), 1-9), и биосинтез авидина без приобретения модификации цепями сахаров в результате замещения аспарагинового остатка в положении 17 (мишени гликозилирования в авидине) на остаток изолейцина (Marttila, et al., (2000) FEBS Lett, 467, 31-36). Кроме того, существует исследование по снижению изоэлектрической точки авидина путем превращения остатка лизина или остатка аргинина в авидине в нейтральную аминокислоту или кислую аминокислоту с помощью генной инженерии (Marttila, et al., (1998) FEBS Lett, 441, 313-317).
Хотя эти модификации могут снизить неспецифическое связывание, например, ДНК и клеток к авидину, снижение неспецифического связывания с сыворотками человека, которые необходимо использовать в системах клинического тестирования, существенно не исследовалось. Кроме того, биосинтез мутантных авидинов требует экспрессионных систем насекомых. Соответственно, модификация последовательности авидина требует длительного времени культивирования и высока по стоимости, следовательно, до сих пор не вошла в использование на практике.
В соответствии с представленным исследованием относительно сродства между биотином и связывающим биотин белком, таким как авидин или стрептавидин, связывание с флуоресцентным биотином усиливается при существенной модификации структуры стрептавидина (Aslan, et al., (2005) Proc Natl Acad Sci U.S.A., 102, 8507-8512). К сожалению, биотинсвязывающая способность этого белка существенно снижается.
Изобретатели настоящего изобретения очистили белок, проявляющий антибактериальную активность против Magnaporthe grisea, из съедобного гриба Pleurotus cornucopiae. Как обнаружено, белок обладал биотинсвязывающей активностью и был назван тамавидином (тамавидин 1). В патенте WO 02/072817 раскрыта как аминокислотная последовательность белка тамавидина 1, так и нуклеотидная последовательность гена, кодирующего белок (SEQ ID NO: 1 и 2 в патенте WO 02/072817). Был также идентифицирован гомолог тамавидина 1 (тамавидин 2) из Pleurotus cornucopiae, и, как показано, он обладал сильной биотинсвязывающей активностью. Как обнаружено, белок обладал биотинсвязывающей активностью и был назван тамавидином (тамавидин 1). В патенте WO 02/072817 раскрыта как аминокислотная последовательность белка тамавидина 2, так и нуклеотидная последовательность гена, кодирующего белок (SEQ ID NO: 3 и 4 в патенте WO02/072817), и был успешно получен их рекомбинантный белок. Тамавидины 1 и 2 могут быть экспрессированы в Escherichia coli. В частности, тамавидин 2, который может быть легко получен путем очистки с использованием иминобиотиновой колонки и обладает более высокой устойчивостью к нагреванию по сравнению с стрептавидином, является прекрасным биотинсвязывающим белком. Однако, хотя неспецифическое связывание тамавидина 2 с нуклеиновыми кислотами и/или белками ниже, чем у существующего авидина, оно сравнимо со стрептавидином.
Перечень ссылок
Патентный документ
Патентный документ 1: WO02/072817 A1
Патентный документ 2: WO2008/081938 A1
Непатентный документ
Непатентный документ 1: Marttila, et al., (2000) FEBS Lett, 467, 31-36
Непатентный документ 2: Bayer, et al., (1995) Appl Biochem Biotechnol, 53(1), 1-9
Непатентный документ 3: Marttila, et al., (1998) FEBS Lett, 441, 313-317
Непатентный документ 4: Alon, et al., (1990) Biochem Biophys Res Commun, 170, 1236-1241
Непатентный документ 5: Aslan, et al., (2005) Proc Natl Acad Sci U.S.A., 102, 8507-8512
Непатентный документ 6: Weber, et al., (1989) Science, 243: 85-88
Непатентный документ 7: Livnah, et al., (1993) Proc. Natl. Acad. Sci. U.S.A., 90, 5076-5080
Непатентный документ 8: Qureshi, et al., (2001) J. Biol. Chem., 276(49), pp. 46422-46428
Краткое изложение сущности изобретения
Техническая задача
Целью настоящего изобретения является предоставление модифицированного биотинсвязывающего белка, который проявляет улучшенные характеристики, такие как пониженное неспецифическое связывание и/или дополнительно увеличенное сродство связывания биотина при сохранении специфических характеристик тамавидина, т.е. высокой биотинсвязывающей способности.
Решение технической задачи
В настоящем изобретении успешно улучшены характеристики тамавидина 2 (в настоящем описании далее может обозначаться как TM2) путем модификации аминокислотной последовательности (SEQ ID NO: 2) природного тамавидина 2.
Предпочтительные варианты осуществления настоящего изобретения
Настоящее изобретение предпочтительно включает следующие варианты осуществления:
Способ 1
Модифицированный биотинсвязывающий белок, включающий аминокислотную последовательность, представленную SEQ ID NO: 2, аминокислотную последовательность, обладающую от одной до нескольких мутаций аминокислот в последовательности, представленной SEQ ID NO: 2, или аминокислотную последовательность, идентичную последовательности, представленной SEQ ID NO: 2, на 80% или более, и обладающий биотинсвязывающей активностью, где
один или более остатков выбранные из
1) остатка аргинина в положении 104 SEQ ID NO: 2;
2) остатка лизина в положении 141 SEQ ID NO: 2;
3) остатка лизина в положении 26 SEQ ID NO: 2; и
4) остатка лизина в положении 73 SEQ ID NO: 2
заменены остатком кислой аминокислоты или остатком нейтральной аминокислоты;
Способ 2
Модифицированный биотинсвязывающий белок по способу 1, где аминокислотный остаток, выбранный из от 1) до 4) заменен аминокислотным остатком, обладающим индексом гидрофобности 2 или менее;
Способ 3
Модифицированный биотинсвязывающий белок по способу 1, где 1) остаток аргинина в положении 104 SEQ ID NO: 2 и/или 2) остаток лизина в положении 141 SEQ ID NO: 2 заменены кислым аминокислотным остатком или нейтральным аминокислотным остатком;
Способ 4
Модифицированный биотинсвязывающий белок по способу 3, где 1) остаток аргинина в положении 104 SEQ ID NO: 2 и/или 2) остаток лизина в положении 141 SEQ ID NO: 2 заменены кислым аминокислотным остатком;
Способ 5
Модифицированный биотинсвязывающий белок по способу 3 или 4, где 1) остаток аргинина в положении 104 SEQ ID NO: 2 и/или 2) остаток лизина в положении 141 SEQ ID NO: 2 заменены остатком глутаминовой кислоты;
Способ 6
Модифицированный биотинсвязывающий белок по любому из способов с 1 по 5, где остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина;
Способ 7
Модифицированный биотинсвязывающий белок по любому из способов с 1 по 6, который выбран из группы, состоящей из:
модифицированного биотинсвязывающего белка (R104E-K141E), в котором остаток аргинина в положении 104 SEQ ID NO: 2 заменен остатком глутаминовой кислоты, и остаток лизина в положении 141 заменен остатком глутаминовой кислоты;
модифицированного биотинсвязывающего белка (D40N-R104E), в котором остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина, и остаток аргинина в положении 104 заменен остатком глутаминовой кислоты;
модифицированного биотинсвязывающего белка (D40N-K141E), в котором остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина, и остаток лизина в положении 141 заменен остатком глутаминовой кислоты; и
модифицированного биотинсвязывающего белка (D40N-R104E-K141E), в котором остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина, остаток аргинина в положении 104 заменен остатком глутаминовой кислоты и остаток лизина в положении 141 заменен остатком глутаминовой кислоты;
Способ 8
Модифицированный биотинсвязывающий белок по любому из способов с 1 по 7, который удовлетворяет, по меньшей мере, одному требованию, выбранному из следующих требований от a) до l):
a) аспарагиновый остаток в положении 14 SEQ ID NO: 2 не модифицирован или заменен глутамином или аспарагиновой кислотой;
b) остаток серина в положении 18 SEQ ID NO: 2 не модифицирован или заменен треонином или тирозином;
c) остаток тирозина в положении 34 SEQ ID NO: 2 не модифицирован или заменен серином, треонином или фенилаланином;
d) остаток серина в положении 36 SEQ ID NO: 2 не модифицирован или заменен треонином или тирозином;
e) остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 не модифицирован или заменен аспарагином;
f) остаток триптофана в положении 69 SEQ ID NO: 2 не модифицирован;
g) остаток серина в положении 76 SEQ ID NO: 2 не модифицирован или заменен треонином или тирозином;
h) остаток треонина в положении 78 SEQ ID NO: 2 не модифицирован или заменен серином или тирозином;
i) остаток триптофана в положении 80 SEQ ID NO: 2 не модифицирован;
j) остаток триптофана в положении 96 SEQ ID NO: 2 не модифицирован;
k) остаток триптофана в положении 108 SEQ ID NO: 2 не модифицирован; и
l) остаток аспарагиновой кислоты в положении 116 SEQ ID NO: 2 не модифицирован или заменен глутаминовой кислотой или аспарагином;
Способ 9
Модифицированный биотинсвязывающий белок по способу 1, включающий аминокислотную последовательность, идентичную на 90% или более последовательности, представленной SEQ ID NO: 2;
Способ 10
Модифицированный биотинсвязывающий белок по любому из способов с 1 по 9, который удовлетворяет, по меньшей мере, одному свойству, выбранному из следующих свойств от i) до iv):
i) обладающий изоэлектрической точкой, более низкой, чем точка белка, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2;
ii) проявляющий более низкое неспецифическое связывание с нуклеиновыми кислотами и/или белками по сравнению с белком, состоящим из аминокислотной последовательности, представленной SEQ ID NO: 2;
iii) проявляющий более низкую фибронектинсвязывающую активность по сравнению с белком, состоящим из аминокислотной последовательности, представленной SEQ ID NO: 2; и
iv) проявляющий более высокую биотинсвязывающую активность по сравнению с белком, состоящим из аминокислотной последовательности, представленной SEQ ID NO: 2;
Способ 11
Модифицированный биотинсвязывающий белок, включающий аминокислотную последовательность, представленную SEQ ID NO: 2, аминокислотную последовательность, обладающую мутациями от одной до нескольких аминокислот в последовательности, представленной SEQ ID NO: 2, или аминокислотную последовательность, идентичную на 80% или более последовательности, представленной SEQ ID NO: 2, и обладающий биотинсвязывающей активностью, где остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина;
Способ 12
Модифицированный биотинсвязывающий белок по способу 11, где биотинсвязывающая активность является более высокой, чем у белка, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2;
Способ 13
Нуклеиновая кислота, кодирующая белок по любому из способов от 1 до 12;
Способ 14
Вектор, содержащий нуклеиновую кислоту по способу 13; и
Способ 15
Носитель, с которым иммобилизован белок по любому из способов с 1 по 12.
Предпочтительные варианты осуществления для выполнения настоящего изобретения будут описаны ниже.
Тамавидин
Тамавидины представляют собой новые биотинсвязывающие белки, которые обнаружены в съедобном грибе Pleurotus cornucopiae (патент WO 02/072817). В этом документе показано:
- что тамавидин 1 и тамавидин 2 характеризуются 65,5% гомологией аминокислот и прочно связываются с биотином;
- что тамавидин 2 в высокой степени экспрессируется в растворимых фракциях в Escherichia coli; и
- что, когда тамавидин 2 экспрессирован в Escherichia coli, 4,5-часовая культура дает очищенный рекомбинантный белок высокой степени чистоты в количестве от приблизительно 1 мг на 50 мл культуры; это очень высокая величина, даже более высокая, чем величины для авидина и стрептавидина, которые известны как биотинсвязывающие белки.
Применяемый в настоящем описании термин «тамавидин 2» обозначает тамавидин 2 или его варианты. В настоящем изобретении предлагается модифицированный TM2 путем модификации конкретного аминокислотного остатка TM2 или его вариантов, который демонстрирует неспецифическое связывание с нуклеиновыми кислотами и/или белками. В настоящем описании «тамавидин 2» и «TM2» относятся к TM2 дикого типа или к его вариантам, если конкретно не указано иначе. Однако эти термины могут быть использованы как родовое название, включающее модифицированный TM2 настоящего изобретения, TM2 дикого типа, вариантного типа и TM2 модифицированного типа, в зависимости от контекста. Кроме того, так как TM2 проявляет биотинсвязывающую активность, он может быть обозначен в настоящем описании как «биотинсвязывающий белок».
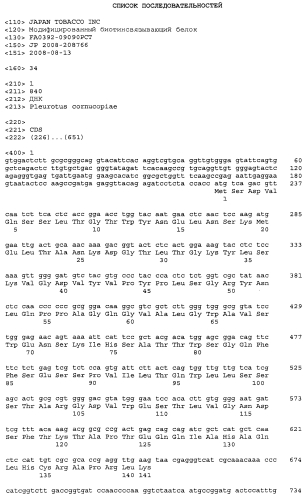
Конкретно, TM2 (дикого типа) обычно может представлять собой белок, включающий аминокислотную последовательность SEQ ID NO: 2 или белок, кодируемый нуклеиновой кислотой, включающей нуклеотидную последовательность SEQ ID NO: 1. Альтернативно, TM2 может представлять собой вариант белка, включающий аминокислотную последовательность SEQ ID NO: 2 или варианты белок, кодируемые нуклеиновой кислотой, включающей нуклеотидную последовательность SEQ ID NO: 1, где варианты обладают биотинсвязывающей активностью, эквивалентной активности тамавидина 2. Варианты TM2 могут представлять собой белок, включающий аминокислотную последовательность с делецией, заменой, вставкой и/или добавлением одной или более аминокислот в аминокислотной последовательности SEQ ID NO: 2, в которой биотинсвязывающая активность эквивалентна активности TM2. Замена может представлять собой консервативную замену, что означает замещение определенного аминокислотного остатка другим остатком, имеющим сходные физические и химические характеристики. Не ограничивающие примеры консервативной замены включают замену одного аминокислотного остатка, содержащего алифатическую группу (например, Ile, Val, Leu или Ala), другим и замену одного полярного остатка другим, как замены между Lys и Arg, или Glu и Asp, или Gln и Asn.
Варианты или мутанты в результате делеций, замен, вставок и/или добавления аминокислот могут быть получены из ДНК, кодирующей природный белок, путем применения хорошо известного способа, например, сайт-специфического мутагенеза (смотри, например, статью в Nucleic Acid Research, Vol. 10, No. 20, p. 6487-6500, 1982, включенную в настоящее описание в качестве ссылки в полном объеме). Применяемое в настоящем описании выражение «одна или более аминокислот» обозначает возможное количество аминокислот, которые могут быть удалены, заменены, вставлены или добавлены с помощью сайт-специфического мутагенеза. Необходимо также отметить, что применяемое в настоящем описании выражение «одна или более аминокислот» может иногда обозначать одну или несколько аминокислот.
Сайт-специфический мутагенез может быть осуществлен следующим образом с использованием синтетических олигонуклеотидных праймеров, которые комплементарны одноцепочечной ДНК фага, подвергаемой мутации, за исключением конкретной ошибки спаривания, которая соответствует желаемой мутации. Более конкретно, указанные выше синтетические олигонуклеотиды используются в качестве праймеров для синтеза цепи, комплементарной фагу, и клетка-хозяин трансформируется полученной двуспиральной ДНК. Культура трансформированной клетки высевается в агар, и из одиночных содержащих фаг клеток образуются бляшки. Затем, теоретически 50% новых колоний содержат фаги, обладающие мутацией в одной цепи, а оставшиеся 50% имеют исходную последовательность. Полученные бляшки гибридизуют с синтетическим зондом, меченным обработкой киназой, при температуре, которая позволяет гибридизоваться с теми колониями, которые характеризуются полным совпадением ДНК, обладающей указанной выше желаемой мутацией, но не позволяет гибридизоваться с теми колониями, которые имеют исходную цепь. Затем бляшки, которые гибридизуются с зондом, собирают и культивируют для получения ДНК.
Отмечается, что методы введения делеции, замены, вставки и/или добавления одной или более аминокислот в аминокислотную последовательность биологически активного пептида при сохранении его активности включают не только указанный выше сайт-специфический мутагенез, но также метод, который включает обработку гена мутагеном, а также метод, который включает селективное расщепление гена, затем удаление, замену, вставку или добавление выбранного нуклеотида и наконец, сшивку расщепленных фрагментов. Более конкретно, используемый в настоящем изобретении TM2 представляет собой белок, который состоит из аминокислотной последовательности с делецией, заменой, вставкой или добавлением от одной до десяти аминокислот в аминокислотную последовательность SEQ ID NO: 2, и который обладает биотинсвязывающей активностью.
Вариант или мутант TM2 может также представлять собой белок, который включает аминокислотную последовательность, идентичную, по меньшей мере, на 80%, предпочтительно идентичную, по меньшей мере, на 85%, идентичную, по меньшей мере, на 90%, идентичную, по меньшей мере, на 95%, идентичную, по меньшей мере, на 96%, идентичную, по меньшей мере, на 97%, идентичную, по меньшей мере, на 98%. или идентичную, по меньшей мере, на 99%, и более предпочтительно идентичную, по меньшей мере, на 99,3% аминокислотной последовательности SEQ ID NO: 2, и который обладает сходной с TM2 биотинсвязывающей активностью.
Процент идентичности между двумя аминокислотными последовательностями может быть определен с помощью визуального обследования и математического расчета. Альтернативно, процент идентичности двух белковых последовательностей может быть определен с помощью сравнения информации о последовательностях с использованием компьютерной программы GAP, которая основывается на алгоритме Needleman, S.B. and Wunsch, C.D. (J. Mol. Biol., 48: 443-453, 1970), и которая имеется в распоряжении University of Wisconsin Genetics Computer Group (UWGCG). Предпочтительные параметры по умолчанию для программы GAP включают: (1) матрицу подсчета очков blosum 62, как описано Henikoff, S. and Henikoff, J.G. (Proc. Natl. Acad. Sci. USA 89: 10915-10919, 1992); (2) 12 очков за пробел; (3) 4 очка за длину пробела; и (4) отсутствие штрафа за концевые пробелы.
Для сравнения последовательностей могут быть также использованы другие программы, применяемые специалистами в данной области техники. Процент идентичности может быть определен путем сравнения с информацией о последовательностях с использованием программы BLAST, описной, например, в Altschul et al. (Nucl. Acids. Res., 25, p. 3389-3402, 1997). Эта программа может быть доступна по интернету на вебсайте национального центра биотехнологической информации (NCBI) или из банка данных по ДНК Японии (DDBJ). Различные условия (параметры) для поиска идентичности с помощью программы BLAST подробно даны на этих вебсайтах, и часть установок может варьироваться подходящим образом, хотя поиск обычно осуществляют с использованием величин по умолчанию. Альтернативно, процент идентичности между двумя аминокислотными последовательностями может быть определен с помощью программы, такой как компьютерная программа обработки генетической информации GENETYX Ver. 7 (Genetyx) или алгоритма FASTA. В этом альтернативном случае поиск может быть осуществлен с использованием величин по умолчанию.
Процент идентичности между последовательностями двух нуклеиновых кислот может быть определен с помощью визуального обследования и математического расчета, или боле предпочтительно путем сравнения информации о последовательностях с использованием компьютерной программы. Обычной предпочтительной компьютерной программой является пакет Wisconsin, версия 10.0 программы GAP от Genetics Computer Group (GCG; Madison, State of Wisconsin) (Devereux et al., Nucl. Acids Res. 12: 387, 1984). При использовании этой программы GAP можно осуществить сравнение не только последовательностей двух нуклеиновых кислот, но также двух аминокислотных последовательностей и сравнение последовательности нуклеиновой кислоты и аминокислотной последовательности. В настоящем описании предпочтительные параметры по умолчанию для программы GAP включают: (1) использование программы GCG одинарной матрицы сравнения (содержащей величину 1 для идентичных и 0 для неидентичных) для нуклеотидов, и взвешенную матрицу сравнения аминокислот по Gribskov and Burgess, Nucl. Acids Res. 14: 6745, 1986, как описано Schwartz and Dayhoff, eds., Atlas of Polypeptide Sequence and Structure, National Biomedical Research Foundation, pp. 353-358, 1979, или другие применяемые матрицы сравнения; (2) штраф 30 за каждый аминокислотный пробел и дополнительный штраф 1 за каждый символ в каждом пробеле или штраф 50 за каждый пробел в нуклеотидной последовательности и дополнительный штраф 3 за каждый символ в каждом пробеле; (3) отсутствие штрафа за концевые пробелы; и (4) отсутствие максимального штрафа за длинные пробелы. Другие программы сравнения последовательностей, которые используются специалистами в данной области техники и которые могут быть использованы в настоящем изобретении, включают программу BLAST, версия 2.2.7, которая может быть загружена в вебсайта US National Library of Medicine (http://www.ncbi.nlm.nih.gov/blast/bl2seq/bls.html), или алгоритм UW-BLAST 2.0. Установки стандартных параметров по умолчанию для UW-BLAST 2.0 описаны на следующем вебсайте: http://blast.wustl.edu. Кроме того, в алгоритме BLAST используется матрица подсчета очков для аминокислот BLOSUM 62 и параметры отбора, которые могут применяться следующим образом: (A) включение фильтра для маскированных сегментов запрашиваемой последовательности, обладающей низкой композиционной сложностью (при определении с помощью программы SEG от Wootton and Federhen (Computers and Chemistry, 1993); смотри также Wootton and Federhen, “Analysis of compositionally biased regions in sequence databases” в Methods Enzymol., 266: 544-71, 1996) или для маскированных сегментов, включающих внутренние повторы короткой периодичности (при определении с помощью программы XNU от Claverie and States (Computers and Chemistry, 1993)); и (B) ожидаемые вероятности совпадения, которое ожидается найти только случайно в соответствии со статистической моделью порогов или E-множеств (Karlin and Altschul, 1990), статистически значимых различий для сообщения о совпадении с последовательностями базы данных (если статистически достоверное различие, обусловленное определенным совпадением выше, чем порог E-множества, о совпадении не сообщается); численная величина предпочтительного порога E-множества составляет либо 0,5, либо в возрастающем порядке предпочтения 0,25, 0,1, 0,05, 0,01, 0,001, 0,0001, 1e-5, 1e-10, 1e-15, 1e-20, 1e-25, 1e-30, 1e-40, 1e-50, 1e-75 или 1e-100.
Вариант или мутант TM2 может также представлять собой белок, который кодируется нуклеиновой кислотой, включающей нуклеотидную последовательность, которая гибридизуется с цепью, комплементарной нуклеотидной последовательности SEQ ID NO: 2 в жестких условиях, и который обладает такой же биотинсвязывающей активностью, что и TM2.
Применяемое в настоящем описании выражение «в жестких условиях» обозначает гибридизацию в условиях умеренной или высокой жесткости. Конкретно, условия умеренной жесткости могут быть легко определены специалистами в данной области техники на основе, например, длины ДНК. Основные условия сформулированы в книге Sambrook et al. Molecular Cloning: A Laboratory Manual, 3rd ed. Chapter 6, Cold Spring Harbor Laboratory Press, 2001, и включают использование: раствора для предварительной промывки 5×SSC, 0,5% SDS и 1,0 мМ ЭДТА (pH 8,0); условия гибридизации - приблизительно 50% формамид, 2×SSC-6×SSC, предпочтительно 5-6×SSC и 0,5% SDS, при приблизительно 42°C (или другие сходные условия гибридизации, такие как раствор Старка в приблизительно 50% формамиде при приблизительно 42°C); и условия промывки при приблизительно 50-68°C, 0,1-6×SSC и 0,1% SDS. Предпочтительно условия умеренной жесткости включают условия гибридизации (и условия промывки) приблизительно 50°C, 6×SSC и 0,5% SDS. Условия высокой жесткости также могут быть легко определены специалистом в данной области техники на основе, например, длины ДНК.
Обычно такие условия включают гибридизацию при более высоких температурах и/или при более низких концентрациях солей, чем при условиях умеренной жесткости (например, гибридизацию в присутствии приблизительно 0,5% SDS при приблизительно 65°C с от 6×SSC до 0,2×SSC, предпочтительно 6×SSC, более предпочтительно 2×SSC, даже более предпочтительно 0,2×SSC, или 0,1×SSC), и/или промывку, и они могут быть определены как условия гибридизации описанного выше типа и включают промывку при приблизительно 65-68°C в 0,2-0,1×SSC и 0,1% SDS. В буферном растворе для использования при гибридизации и промывки SSC (1×SSC состоит из 0,15М NaCl и 15 мМ цитрата натрия) может быть заменен на SSPE (1×SSPE состоит из 0,15М NaCl, 10 мМ NaH2PO4 и 1,25 мМ ЭДТА; pH 7,4), и промывка осуществляется в течение приблизительно от 15 минут до одного часа после завершения гибридизации.
Если это желательно, может быть использован коммерческий набор для гибридизации, в котором в качестве зонда не используется радиоактивное вещество. Конкретным примером является гибридизация, в которой применяется система ECL прямого промечивания и определения (продукт Amersham). Жесткая гибридизация может быть осуществлена при 42°С в течение 4 часов после добавления к буферу для гибридизации набора блокирующего агента и NaCl в количествах, соответствующих 5% (масс./об.) и 0,5М; промывка может быть осуществлена дважды в 0,4% SDS и 0,5×SSC в течение 20 минут каждая при 55°С, затем однократно в 2×SSC в течение 5 минут при комнатной температуре.
Биотинсвязывающая активность вариантов или мутантов TM2 может быть измерена с помощью любого из известных методов. Например, она может быть определена с помощью метода, основанного на флуоресцентном биотине, как описано в статье Kada et al. (Biochim. Biophys. Acta., 1427: 33-43 (1999)). Этот метод представляет собой тест-систему, в которой используется такая природа флуоресцентного биотина, что если он связывается с биотинсвязывающим сайтом в биотинсвязывающем белке, то интенсивность его флуоресценции затухает. Альтернативно, биотинсвязывающая активность вариантов или мутантных белков может быть также оценена с использованием сенсора, способного измерить связывание белка с биотином, такого как биосенсор, работающий по принципу поверхностного плазмонного резонанса.
В модифицированном тамавидине по настоящему изобретению аминокислотные остатки, которые желательно не подвергать модификации, будут описаны ниже.
Модифицированный тамавидин, в котором неспецифическое связывание понижено по настоящему изобретению
Модифицированный TM2 настоящего изобретения включает аминокислотную последовательность, представленную SEQ ID NO: 2, аминокислотную последовательность, обладающую от одной до нескольких аминокислотных мутаций в последовательности, представленной SEQ ID NO: 2, или аминокислотную последовательность, идентичную последовательности, представленной SEQ ID NO: 2, на 80% или более, и обладающий биотинсвязывающей активностью, и отличается тем, что модифицированный TM2 представляет собой белок (TM2 дикого типа и вариантный тип TM2), в котором один или более остатков, выбранные из группы, состоящей из:
1) остатка аргинина в положении 104 SEQ ID NO: 2;
2) остатка лизина в положении 141 SEQ ID NO: 2;
3) остатка лизина в положении 26 SEQ ID NO: 2; и
4) остатка лизина в положении 73 SEQ ID NO: 2
заменены остатком кислой аминокислоты или остатком нейтральной аминокислоты.
Изоэлектрическая точка (pI) TM2 дикого типа, рассчитанная на основе его первичной структуры, составляет приблизительно 7,4, тогда как действительно измеренная величина составляет приблизительно от 8,2 до 8,6. Таким образом, TM2 дикого типа представляет собой белок с pI от нейтральной до слабокислой. Степень неспецифического связывания TM2 намного меньше, чем у авидина, и приблизительно равна таковой у стрептавидина, который является нейтральным белком.
Изобретатели настоящего изобретения провели исследования по дальнейшему снижению неспецифического связывания TM2. Они включают эксперименты с использованием TM2, в котором остаток основной аминокислоты модифицирован в остаток кислой или нейтральной аминокислоты, они были проведены на основе предположения о том, что даже в белке с pI от нейтральной до слабокислой, таком как TM2, неспецифическое связывание может быть дополнительно снижено путем снижения его pI.
Известно, что сродство связывания стрептавидина или авидина с биотином снижается в некоторых случаях в результате замены одной или нескольких аминокислот. Соответственно, в экспериментах выполнена модификация аминокислотных остатков, в то же время проведенная проверка, описанная ниже, показала, что не только снижается изоэлектрическая точка, но также не ослабляются прекрасные характеристики, т.е. высокая биотинсвязывающая способность TM2.
В результате интенсивных исследований изобретатели настоящего изобретения нашли, что модифицированный белок TM2, обладающий мутациями одного или более остатков, выбранных из группы, состоящей из:
1) остатка аргинина (R104) в положении 104 SEQ ID NO: 2;
2) остатка лизина (K141) в положении 141 SEQ ID NO: 2;
3) остатка лизина (K26) в положении 26 SEQ ID NO: 2; и
4) остатка лизина (K73) в положении 73 SEQ ID NO: 2,
удовлетворяет указанным выше требованиям как TM2 модифицированного типа настоящего изобретения, обладающий низкой pI. Таким образом, изобретение было выполнено.
Аминокислота после мутации представляет собой остаток кислой аминокислоты (аспарагиновой кислоты или глутаминовой кислоты) или остаток нейтральной аминокислоты (аспарагина, серина, глутамина, треонина, глицина, тирозина, триптофана, цистеина, метионина, пролина, фенилаланина, аланина, валина, лейцина или изолейцина).
Кроме того, так как неполярная аминокислота может вести к неспецифическому связыванию, обусловленному гидрофобному взаимодействию, остаток кислой или нейтральной аминокислоты предпочтительно обладает индексом гидрофобности 2 или менее. Индекс гидрофобности определяет степень гидрофобности каждого аминокислотного остатка, что описано, например, в статье Kyte and Doolittle, J. Mol. Biol., 157, 105-132 (1982), и хорошо известно специалистам в данной области техники. «Остатки кислых аминокислот или остатки нейтральных аминокислот, обладающие индексом гидрофобности 2 или менее» представляют собой аспарагиновую кислоту и глутаминовую кислоту, которые являются остатками кислых аминокислот, или аспарагин, серин, глутамин, треонин, глицин, тирозин, триптофан, метионин, пролин и аланин, которые являются остатками нейтральных аминокислот.
Более предпочтительно 1) остаток аргинина в положении 104 SEQ ID NO: 2 и/или 2) остаток лизина в положении 141 SEQ ID NO: 2 заменены кислым аминокислотным остатком или нейтральным аминокислотным остатком. Более предпочтительно 1) остаток аргинина в положении 104 SEQ ID NO: 2 и/или 2) остаток лизина в положении 141 SEQ ID NO: 2 заменены кислым аминокислотным остатком.
K26 предпочтительно заменен A (аланином), K73 предпочтительно заменен Q (глутамином), R104 предпочтительно заменен E (глутаминовой кислотой) или D (аспарагиновой кислотой), и K141 предпочтительно заменен E (глутаминовой кислотой) или D (аспарагиновой кислотой); и R104 более предпочтительно заменен E, и K141 более предпочтительно заменен E.
Модифицированный TM2 настоящего изобретения, обладающий низкой pI, имеет изоэлектрическую точку, которая существенно ниже, чем у TM2 дикого типа. Конкретно, в пунктах 1-8) примера 1 выявлено, что изоэлектрическая точка каждого модифицированного TM2, обладающего мутацией, снижена на 1 или более по сравнению с изоэлектрической точкой TM2 дикого типа.
Результаты показывают, что модифицированный белок TM2 настоящего изобретения характеризуется более низким неспецифическим связыванием с нуклеиновыми кислотами и/или белками по сравнению со связыванием белка TM2 дикого типа или мутантного типа. Конкретно, в пунктах 1-11) примера 1 выявлено снижение неспецифического связывания с ДНК. Более того, в пунктах 1-9) примера 1 выявлено снижение неспецифической адсорбции сывороточного белка. Неспецифическое связывание и адсорбция оба снижаются до приблизительно 60% от связывания TM2 дикого типа в результате мутации K26, K73 или K141. В R104-K141 (оба R104 и K141 мутированы) неспецифическое связывание и адсорбция оба снижаются до уровня, близкого к 20% от связывания TM2. Напротив, хотя сообщалось о снижении неспецифического связывания с ДНК или клетками авидина с мутантными основными аминокислотами (Marttila, et al., (2000) FEBS, 467, pp. 31-36), о таком большом снижении неспецифического связывания с сывороточным белком не сообщалось.
Исследование связывания модифицированного TM2 настоящего изобретения, обладающего низкой pI, с фибронектином выявило существенное снижение связывания фибронектина. Фибронектин представляет собой молекулу клеточной адгезии, присутствующую во внеклеточном матриксе, и вызывает фоновый шум особенно при определении белка в плазме или сыворотке. Таким образом, более низкое связывание с фибронектином является предпочтительным. Как показано в пунктах 1-10) примера 1, уровень связывания фибронектина снижен у всех мутантов по сравнению с TM2. В частности, уровни связывания фибронектина с K141 и R104-K141 оба существенно снижаются до от 10 до 20% от уровня связывания TM2 дикого типа. Не было известно никакой взаимосвязи между величиной pI и фибронектинсвязывающей способностью, и действительно не наблюдалось никакой четкой корреляции между величиной pI и степенью снижения связывания фибронектина. В этом отношении снижение уровней связывания фибронектина с мутантами K141 и R104-K141 является непредсказуемо очень большим.
В одном предпочтительном модифицированном TM2 настоящего изобретения, у которого снижено связывание с фибронектином, лизин в положении 141 в аминокислотной последовательности TM2 модифицирован в кислую аминокислоту или нейтральную аминокислоту, более предпочтительно модифицирован в кислую аминокислоту или нейтральную аминокислоту, обладающую индексом гидрофобности 2 или менее, более предпочтительно модифицирован в E (глутаминовую кислоту) или D (аспарагиновую кислоту) и наиболее предпочтительно в E.
Альтернативно, в другом модифицированном TM2, у которого снижено связывание с фибронектином, R104 и K141, каждый модифицирован в кислую аминокислоту или нейтральную аминокислоту, более предпочтительно каждый модифицирован в кислую аминокислоту или нейтральную аминокислоту, обладающую индексом гидрофобности 2 или менее, более предпочтительно модифицирован в E (глутаминовую кислоту) или D (аспарагиновую кислоту) и наиболее предпочтительно в E.
Модифицированный тамавидин, обладающий улучшенной биотинсвязывающей способностью
TM2 очень прочно связывается с биотином с константой скорости ассоциации (ka) 9,19×105 (М-1 сек-1), константой скорости диссоциации (kd) 6,83×10-6 (сек-1) и константой диссоциации (KD) 7,43×10-12 (М). ka, kd и KD стрептавидина, другого биотинсвязывающего белка, из