Инактивация вируса при очистке антител
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и иммунологии. Описывается способ получения препарата антитела или его антигенсвязывающей части со сниженным содержанием белка клетки-хозяина (HCP). Способ предусматривает снижение в образце значения рН до примерно 3,8 путем добавления лимонной или фосфорной кислоты, последующее ловедение рН до уровня 5.0, нанесение образца на ионообменную смолу, сбор образца после ионного обмена, нанесение образца на смолу для проведения хроматографии гидрофобного взаимодействия и сбор препарата антитела после хроматографии. Способ позволяет получать препарат антитела, который содержит сниженное число вирусных частиц или обладает сниженной вирусной активностью. Изобретение может быть использовано в медицине. 21 з.п.ф-лы, 5 ил., 11 табл.
Реферат
ИНАКТИВАЦИЯ ВИРУСА ПРИ ОЧИСТКЕ АНТИТЕЛ
Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки на патент США, серийный No. 61/196754, поданной 20 октября 2008 года, которая включена в настоящее описание полностью в качестве ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
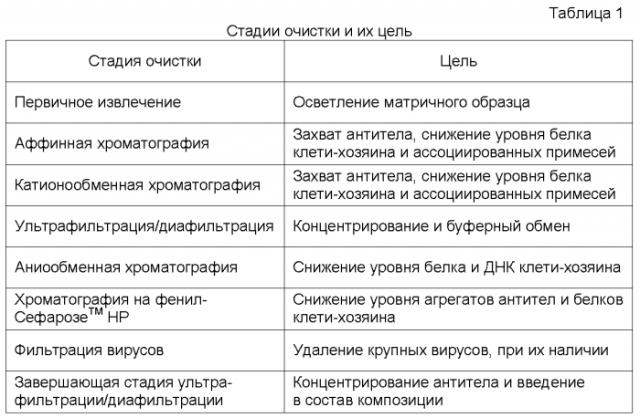
Процедуры очистки с целью получения моноклональных антител фармацевтической чистоты, образуемых в ферментационной культуре, в типичном случае охватывают четыре основных стадии. Указанные стадии включают: (1) сбор/осветление - выделение штамма-хозяина из ферментационной среды; (2) захват - отделение антитела от большей части компонентов в осветленной среде; (3) тонкую очистку - удаление оставшихся загрязнений в виде клеток-хозяев и агрегатов; и (4) создание композиции - внесение антитела в соответствующий носитель для достижения максимальной стабильности и максимального срока годности.
Однако, часто эти стадии, хотя и необязательно, оставляют некоторое вирусное загрязнение. Таким образом, в настоящее время имеется потребность в способах получения и очистки нужного антитела, подходящего для клинического применения, которые включают снижение и/или инактивацию загрязняющих вредных вирусов. Настоящее изобретение удовлетворяет эту потребность.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам выделения и очистки антител из матричного образца. В одном аспекте, настоящее изобретение относится к инактивации вируса в образцах, полученных на разных стадиях очистки антител. В одном конкретном аспекте, описываемые в настоящем изобретении способы включают стадию кислотной инактивации, за которой следуют одна или несколько стадий хроматографической очистки. Стадии хроматографической очистки могут включать одну или несколько указанных ниже хроматографических процедур, таких как ионообменная хроматография, аффинная хроматография и хроматография гидрофобного взаимодействия. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим одно или несколько антител, полученных и очищенных способом по настоящему изобретению.
В одном варианте, настоящее изобретение относится к способу очистки антитела и его антиген-связывающей части из матричного образца, так что полученная композиция антитела по существу не содержит белков клетки-хозяина (“HCP”). В одном аспекте, матричный образец (или просто «образец») включает собранные клетки из клеточной линии, где указанная клеточная линия используется для продукции специфических антител по настоящему изобретению. В конкретном аспекте, матричный образец получают из клеточной линии, используемой для продукции анти-IL-12 антител; в другом аспекте, матричный образец получают из клеточной линии, используемой для продукции анти-TNF антител; и еще в одном аспекте указанный матричный образец получают из клеточной линии, используемой для продукции анти-IL-18 антител.
Один способ осуществления настоящего изобретения относится к матричному образцу, включающему заданное нужное антитело или его антиген-связывающую часть, где указанное антитело или его часть подвергают коррекции по значению рН. В одном аспекте, значение рН доводят до кислого рН. Примером подходящего рН является значение рН от примерно 3 до примерно 5, предпочтительно примерно 3,5. Указанную обработку проводят, частично, для снижения или инактивации рН-чувствительных вирусов. Кроме снижения количества вирусов и/или их инактивации, создаваемые кислые условия облегчают удаление клеток и клеточных осколков, что приводит к формированию образца первичного извлечения. По прошествии некоторого периода времени, значение рН может быть доведено до более нейтрального или щелочного рН, и в некоторых вариантах, указанный образец подвергают одной или нескольким стадиям хроматографии, включающим, без ограничения, аффинную хроматографию, ионообменную хроматографию и хроматографию гидрофобного взаимодействия.
В одном варианте, стадия аффинной хроматографии включает нанесение образца первичного извлечения на колонку, которая включает подходящий для хроматографии аффинный носитель. Неограничивающие примеры таких хроматографических носителей включают, без ограничения, смолу с белком А, смолу с белком G, аффинные носители, включающие антиген, против которого образуется нужное антитело, и аффинные подложки, включающие Fc-связывающий белок. Смола с белком А используется для аффинной очистки и выделения антител (IgG). В одном аспекте, колонку с белком А уравновешивают подходящим буфером перед нанесением образца. Примером подходящего буфера является Tрис/NaCl буфер с рН примерно 7,2. После уравновешивания, образец может быть нанесен на колонку. После нанесения образца на колонку, колонку промывают один или несколько раз с использованием, например, уравновешивающего буфера. Другие промывки, включающие разные буферы, могут применяться до элюции образца с колонки. Колонка с белком А может быть подвергнута элюции с использованием подходящего элюирующего буфера. Примером подходящего элюирующего буфера является буфер на основе уксусной кислоты/NaCl, рН примерно 3,5. Полученный элюат далее анализируют с использованием методик, известных специалистам в данной области. Так, например, может определяться поглощение при длине волны 280. После элюции может быть получена одна или несколько представляющих интерес фракций, для дальнейшей обработки.
В некоторых вариантах осуществления настоящего изобретения, указанный образец подвергают одной или нескольким дополнительным процедурам хроматографического разделения. В одном аспекте, образец первичного извлечения подвергают ионообменной хроматографии. В рамках этого варианта, стадия ионного обмена может представлять собой хроматографию на основе катионного или анионного обмена или их сочетание. Указанная стадия может включать множество стадий ионного обмена, например, стадия катионного обмена может предшествовать стадии анионного обмена или наоборот. В одном аспекте, стадия ионного обмена включает двухстадийный ионообменный процесс. В конкретном аспекте, за первой стадией катионного обмена следует вторая стадия анионного обмена. Подходящая катионообменная колонка представляет собой колонку, в которой стационарная фаза включает анионные группы. Примером такой колонки является колонка с Fractogel SO3 -. Указанная стадия хроматографии, включающая ионообменный захват, облегчает выделение представляющего интерес антитела из образца первичного извлечения. Подходящая анионообменная колонка представляет собой колонку, в которой стационарная фаза включает катионные группы. Примером такой колонки является колонка с Q-СефарозойТМ (SepharoseTM). Используемые для очистки одна или несколько ионообменных стадий позволяют улучшить выделение антител за счет снижения количества примесей, таких как белки и ДНК клетки-хозяина и, где это применимо, от белка аффинной матрицы. Указанная анионообменная процедура представляет собой способ проточной хроматографии (в отличие от процедуры катионного обмена), где антитела не взаимодействуют или не связываются с анионообменной смолой (или с твердой фазой). Однако, многие примеси взаимодействуют с анионообменной смолой и связываются с ней.
В другом варианте осуществления настоящего изобретения, образец, полученный после стадии ионного обмена, подвергают следующей процедуре хроматографии. В одном аспекте, следующая стадия хроматографии включает использование хроматографии гидрофобного взаимодействия (“HIC”). В этом случае, используется колонка, в которой стационарная фаза включает гидрофобные группы. Примером такой колонки является колонка с фенил-СефарозойТМ. Вполне возможно, что антитела содержат агрегаты, образованные в ходе выделения/очистки. И, в этой связи, стадия хроматографии гидрофобного взаимодействия облегчает удаление таких агрегатов. Она также помогает удалять примеси. В данной процедуре используется буфер с высоким содержанием соли, что облегчает взаимодействие антител (или их агрегатов) с гидрофобной колонкой. Элюцию с колонки проводят с использованием низких концентраций соли.
В одном варианте, первая и вторая стадии ионного обмена проводятся после первичного извлечения. В этом варианте, образец после ионного обмена подвергают промежуточной стадии фильтрования. В одном аспекте, стадия фильтрования включает захват в ходе ультрафильтрации/диафильтрации (“UF/DF”). Указанная стадия фильтрования облегчает очистку, в частности, за счет концентрирования антител и их антиген-связывающих частиц.
В другом варианте, элюат после очистки на стадии хроматографии гидрофобного взаимодействия (HIC) фильтруют через фильтр для удаления вирусов, такой как фильтр Ultipor DV50TM. Эта процедура позволяет отделить вирусные частицы от фенильного элюата для снижения количества вируса (если он присутствует) до безопасных уровней. Любые фильтры, известные специалистам в данной области, могут использоваться в этом варианте осуществления настоящего изобретения.
Чистота моноклональных антител в образце полученного продукта может быть проанализирована с использованием методов, известных специалистам в данной области, например, в рамках вестерн-блот-анализа.
В еще одном варианте, настоящее изобретение относится к одной или нескольким фармацевтическим композициям, содержащим выделенное моноклональное антитело или его антиген-связывающую часть и подходящий носитель. В другом аспекте, указанная композиция также включает один или несколько фармацевтических агентов.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фиг.1 приведены последовательности тяжелой и легкой цепи вариабельного участка для взятого в качестве неограничивающего примера анти-IL-12 антитела (АВТ-847).
На фиг.2 приведены последовательности тяжелой и легкой цепи для взятого в качестве неограничивающего примера анти-IL-18 антитела (АВТ-325).
На фиг.3 приведены последовательности тяжелой и легкой цепи для взятого в качестве неограничивающего примера анти-TNFα антитела (АВТ-847) (Adalimumab).
На фиг.4 приведена, в варианте неограничивающего примера, схема очистки по настоящему изобретению.
На фиг.5 показана фотография, иллюстрирующая электрофорез в полиакриламидном геле, где видно, что подлежащая очистке молекула антитела остается в растворе при снижении рН в осветленной культуральной среде.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам выделения и очистки антител из матричного образца. Один аспект настоящего изобретения относится к вирусной инактивации в образцах, полученных на различных стадиях очистки антитела. В конкретном аспекте, описываемые в настоящем изобретении способы включают стадию кислотной инактивации, за которой следует одна или несколько стадий хроматографии. Cтадии хроматографии могут включать одну или несколько приведенных ниже хроматографических процедур: ионообменную хроматографию, аффинную хроматографию и хроматографию гидрофобного взаимодействия. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим одно или несколько антител, полученных и очищенных способом по настоящему изобретению.
Для ясности, но не с целью ограничения, приведенное ниже подробное описание будет разделено на несколько подразделов:
1. Определения;
2. Образование антитела;
3. Продукция антитела;
4. Очистка антитела;
5. Способы оценки чистоты образца;
6. Дополнительные модификации;
7. Фармацевтические композиции; и
8. Применение антител.
1. Определения
Для лучшего пояснения настоящего изобретения ниже приводятся определения некоторых используемых в нем терминов.
Термин «антитело» включает молекулу иммуноглобулина, состоящую из четырех полипептидных цепей, двух тяжелых (Н) и двух легких (L) цепей, связанных дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой в описании как HCVR или VH) и константной области тяжелой цепи (СН). Константная область тяжелой цепи состоит из трех доменов, CH1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой в описании как LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. VH и VL области, в свою очередь, могут быть разделены на области гипервариабельности, так называемые определяющие комплементарность области (CDR), между которыми располагаются более консервативные зоны, известные как каркасные области (FR). Каждая из областей VH и VL состоит из трех CDR и четырех FR, сгруппированных в следующем порядке, начиная от амино-конца к карбоксильному концу: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Термин «антиген-связывающая часть» антитела (или просто «часть антитела») обозначает фрагмент антитела, который сохраняет способность специфически связываться с антигеном (например, hIL-12, hTNFa или hIL-18). Было показано, что антиген-связывающая функция антитела может осуществляться фрагментами антитела полной длины. Примеры связывающихся фрагментов, охватываемых термином «антиген-связывающая часть», включают (i) Fab фрагмент, одновалентный фрагмент, включающий VL, VH, CL и CH1 домены; (ii) F(ab')2, фрагмент, двухвалентный фрагмент, включающий два Fab фрагмента, соединенных дисульфидной связью в шарнирной области; (iii) Fd фрагмент, включающий VH и CH1 домены; (iv) Fv фрагмент, включающий VL и VH домены одного плеча антитела; (v) dAb фрагмент (Ward et al., (1989) Nature 341:544-546, где полное описание данной работы включено в настоящую заявку в качестве ссылки), который включает VH домен; и (vi) выделенная определяющая комплементарность область (CDR). Кроме того, несмотря на то, что два домена Fv фрагмента, VL и VH, кодируются разными генами, они могут быть соединены в рамках рекомбинантных методов через синтетический линкер, который позволяет получать из них одну белковую цепь, в которой VL и VH области спариваются с образованием одновалентных молекул (известных как одноцепочечной Fv (scFv); см. также. Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883, полное описание которых включено в настоящую работу в качестве ссылки). Такие одноцепочечные молекулы также охватываются термином «антиген-связывающая часть» антитела. Другие формы одноцепочечных антител, такие как диатела, также охватываются настоящим термином. Диатела представляют собой двухвалентные, биспецифические антитела, в которых VH и VL домены экспрессируются на одной полипептидной цепи, но с использованием линкера, который слишком короток для того, чтобы обеспечить спаривание между двумя доменами на одной цепи, что заставляет домены спариваться с комплементарными доменами на другой цепи с образованием двух антиген-связывающих сайтов (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448; Poljak, R. J., et al. (1994) Structure 2:1121-1123, полное описание которых включено в настоящую работу в качестве ссылки). Кроме того, антитело или его антиген-связывающая часть может представлять собой часть более крупной молекулы иммуноадгезии, образуемой за счет ковалентной или нековалентной ассоциации антитела или части антитела с одним или несколькими другими белками или пептидами. Примеры использования таких молекул иммуноадгезии включают создание тетрамерной scFv молекулы с помощью ядерного участка стрептавидина (Kipriyanov, S. M., et al. (1995) Human Antibodies and Hybridomas 6:93-101, где полное описание данной работы включено в настоящую заявку в качестве ссылки) и использование цистеинового остатка, маркерного пептида и C-концевой полигистидиновой метки для создания бивалентных и биотинилированных scFv молекул (Kipriyanov, S. M., et al. (1994) Mol. Immunol. 31:1047-1058, где полное описание данной работы включено в настоящую заявку в качестве ссылки). Части антител, такие как Fab и F(ab')2, могут быть получены из полных антител с использованием стандартных методик, таких как расщепление полноразмерных антител папаином или пепсином, соответственно. Кроме того, антитела, части антител и молекулы иммуноадгезии могут быть получены с использованием стандартных методик рекомбинантных ДНК, приведенных в настоящем описании. В одном аспекте, антиген-связывающие части представляют собой полные домены или пары полных доменов.
Фраза «человеческий интерлейкин 12» (сокращенно обозначаемый как hIL-12 или IL-12) в контексте настоящего описания обозначает человеческий цитокин, который секретируется преимущественно макрофагами и дендритными клетками. Данный термин включает гетеродимерный белок, содержащий субъединицу размером 35 кДа (p35) и субъединицу размером 40 кДа (p40), которые соединены через дисульфидный мостик. Указанный гетеродимерный белок обозначается в настоящем описании как «субъединица р70». Структура человеческого IL-12 описана также в других работах, например, Kobayashi, et al. (1989) J. Exp Med. 170:827-845; Seder, et al. (1993) Proc. Natl. Acad. Sci. 90:10188-10192; Ling, et al. (1995) J. Exp Med. 154:116-127; Podlaski, et al. (1992) Arch. Biochem. Biophys. 294:230-237, полное описание которых включено в настоящую работу в качестве ссылки. Нуклеиновая кислота, кодирующая IL-12, доступна от GenBank с номером доступа No. NM_000882 и полипептидная последовательность доступна от GenBank с номером доступа No. NP_000873.2. Термин человеческий IL-12 в контексте настоящего описания включает рекомбинантный человеческий IL-12 (rh IL-12), который может быть получен стандартными методами рекомбинантной экспрессии.
Фраза «человеческий интерлейкин 18» (сокращенно обозначаемый в настоящем описании как hIL-18 или IL-18) в контексте настоящего описания обозначает человеческий цитокин, который вначале синтезируется как биологически неактивный белок-предшественник из 193 аминокислот, а также зрелый белок, состоящий из 156 аминокислот, образуемый, например, без ограничения, путем расщепления белка-предшественника, в частности, каспазой-1 или каспазой-4, которые обладает биологической активностью, включающей костимуляцию Т-клеточной пролиферации, усиление цитотоксической активности NK-клеток, индукцию образования IFN-γ Т-клетками и NK-клетками и потенцирование дифференцировки Т-хелперов типа 1 (Th1). Нуклеиновая кислота, кодирующая IL-18, доступна от GenBank с номером доступа No. NM_001562 и полипептидная последовательность доступна от GenBank с номером доступа No. NP_001553. Термин человеческий IL-18, в контексте настоящего описания, включает рекомбинантный человеческий IL-18 (rh IL-18), который может быть получен стандартными методами рекомбинантной экспрессии.
Фраза «человеческий фактор-α некроза опухолевых клеток» (обозначаемый в настоящем описании как hTNFα или TNFα) представляет собой полифункциональный провоспалительный цитокин, секретируемый преимущественно моноцитами/макрофагами, который оказывает эффект на липидный метаболизм, коагуляцию, инсулинорезистентность и функцию эндотелия. TNFα предсталяет собой растворимый гомотример, состоящий из белковых субъединиц размером 17 кДа. Существует также связанная с мембраной форма предшественника TNFα размером 26 кДа. Она была обнаружена в синовиальных клетках и макрофагах в тканях. Клетки, отличные от моноцитов или макрофагов, также продуцируют TNFα. Так, например, человеческие линии опухолевых клеток не моноцитарного типа продуцируют TNFα, а также CD4+ и CD8+ Т лимфоциты периферической крови и некоторые культуры Т- и В-клеточных линий продуцируют TNFα. Нуклеиновая кислота, кодирующая TNFα, доступна от GenBank с номером доступа No. X02910 и полипептидная последовательность доступна от GenBank с номером доступа No. CAA26669. Термин человеческий TNFα в контексте настоящего описания включает рекомбинантный человеческий TNFα (rh TNFa), который может быть получен стандартными методами рекомбинантной экспрессии.
Термины «нумерация по Кабату», «определение по Кабату» и «обозначение по Кабату» используются в настоящем описании взаимозаменяемо. Данные термины, известные в настоящей области, относятся в системе нумерации аминокислотных остатков, которые являются более вариабельными (в частности, гипервариабельными), чем другие аминокислотные остатки в вариабельных областях тяжелой и легкой цепи антитела или его антиген-связывающей части (Kabat et al. (1971) Ann. NY Acad, Sci. 190:382-391 and, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, где полное описание данной работы включено в настоящую заявку в качестве ссылки). В случае вариабельной области тяжелой цепи, гипервариабельная область простирается на участке аминокислот 31-35 для CDR1, на участке аминокислот 50-65 для CDR2 и на участке аминокислот 95-102 для CDR3. В случае вариабельной области легкой цепи, гипервариабельная область располагается на участке аминокислот 24-34 в CDR1, на участке аминокислот 50-56 в CDR2 и на участке аминокислот 89-97 в CDR3.
Термин «человеческое антитело» включает антитела, содержащие вариабельные и константные области, которые соответствуют последовательностям человеческих зародышевых иммуноглобулинов, как это описано в работе Kabat et al. (см. Kabat, et al. (1991) Sequences of proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Человеческие антитела по настоящему изобретению могут включать аминокислотные остатки, которые не кодируются последовательностями иммуноглобулина человеческой зародышевой линии (т.е. имеются мутации, введенные путем случайного или сайт-специфического мутагенеза in vitro или за счет соматической мутации in vivo), например, в CDR и в перинуклеарных CDR3. Указанные мутации могут быть введены с использованием «стратегии селективного мутагенеза». Человеческое антитело может иметь, по меньшей мере, одно положение, замещенное аминокислотным остатком, например, аминокислотным остатком, повышающим активность, где указанный остаток не кодируется последовательностью иммуноглобулина зародышевой линии человека. Человеческое антитело может содержать до двадцати положений, замещенных аминокислотными остатками, которые не являются частью последовательности иммуноглобулина человеческой зародышевой линии. В других вариантах, может быть замещено до десяти, до пяти, до трех или до двух положений. В одном варианте, указанные замещения осуществляются в пределах областей CDR. Однако, термин «человеческое антитело» в контексте настоящего описания не включает те антитела, в которых CDR последовательности, полученные из зародышевой линии других материнского вида млекопитающего, такого как мышь, были перенесены на каркасные последовательности человеческой молекулы.
Фраза «стратегия селективного мутагенеза» включает способ повышения активности антитела за счет выбора и введения мутаций в отдельные аминокислоты в области CDR, по меньшей мере, в одном положении, подходящем для селективного мутагенеза, гипермутации, и/или в контактное положение. «Селективно мутированное» человеческое антитело представляет собой антитело, которое включает мутацию в положении, выбранном с использованием стратегии селективного мутагенеза. В другом аспекте, стратегия селективного мутагенеза представляет собой способ предпочтительного мутирования выбранных индивидуальных аминокислотных остатков в CDR1, CDR2 или CDR3 в вариабельной области тяжелой цепи (далее обозначаемых как H1, H2 и H3, соответственно) или в CDR1, CDR2 или CDR3 в вариабельной области легкой цепи (далее обозначаемых как L1, L2 и L3, соответственно) антитела. Аминокислотные остатки могут быть выбраны из подходящих для селективного мутагенеза положений, контактных положений или гипермутированных положений. Индивидуальные аминокислоты выбирают на основании их положения в вариабельной области легкой или тяжелой цепи. Следует понимать, что положение гипермутации может также представлять собой контактное положение. В одном аспекте, стратегия селективного мутагенеза представляет собой «направленную стратегию». Термин «направленная стратегия» включает способ мутации индивидуальных аминокислотных остатков в CDR1, CDR2 или CDR3 в вариабельной области тяжелой цепи или в CDR1, CDR2 или CDR3 в вариабельной области легкой цепи антитела заданным образом, т.е. представляет собой «стратегию групповой направленности» или «стратегию CDR-направленности». В рамках «стратегии групповой направленности» индивидуальные аминокислотные остатки в определенных группах являются мишенью для селективных мутаций, включающих группы 1 (включая L3 и H3), II (включая H2 и L1) и III (включая L2 и H1), где указанные группы были перечислены в порядке их предпочтительности для воздействия на них в качестве мишеней. В рамках «стратегии CDR-направленности», индивидуальные аминокислотные остатки в определенных CDR являются мишенью для селективных мутаций, где порядке их предпочтительности в качестве мишеней описан ниже: H3, L3, H2, L1, H1 и L2. В выбранные аминокислотные остатки вводят мутации, например, по меньшей мере, до двух других аминокислотных остатков, и определяют эффект созданной мутации на активность антитела. Активность оценивают как изменение в специфичности/аффинности связывания антитела и/или в нейтрализующей способности антитела. Следует понимать, что стратегия селективного мутагенеза может использоваться для оптимизации любого антитела, полученного из любого источника, включая фаговый дисплей, трансгенных животных с генами зародышевых линий человеческого IgG, человеческие антитела, выделенные из человеческих B-клеток. Стратегия селективного мутагенеза может использоваться применительно к антителам, которые не могут быть оптимизированы в достаточной мере с использованием методики фагового дисплея. Следует понимать, что антитела из любого источника, включая фаговый дисплей, трансгенных животных с генами зародышевой линии человеческого IgG, человеческие антитела, выделенные из B-клеток, могут быть подвергнуты обратной мутации (back-мутации) до или после осуществления стратегии селективного мутагенеза.
Фраза «рекомбинантное человеческое антитело» включает человеческие антитела, которые получают, экспрессируют, создают или выделяют методами рекомбинантной технологии, такие как антитела, экспрессированные с использованием вектора рекомбинантной экспрессии, трансфицированного в клетку-хозяин, антитела, выделенные из библиотеки рекомбинантных, комбинаторных человеческих антител, антитела, выделенные из животного (например, мыши), которые являются трансгенными для генов человеческого иммуноглобулина (см., например, Taylor, L. D., et al. (1992) Nucl. Acids Res. 20:6287-6295, где полное описание работы включено в настоящую заявку в качестве ссылки), или антитела, полученные, экспрессированные, созданные или выделенные с использованием любых других способов, которые включают сплайсинг последовательностей гена человеческого иммуноглобулина с образованием других последовательностей ДНК. Такие рекомбинантные человеческие антитела содержат вариабельные и константные области, полученные из последовательностей зародышевой линии человеческого иммуноглобулина (см., Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). В некоторых вариантах осуществления настоящего изобретения, такие рекомбинантные человеческие антитела подвергают мутагенезу in vitro (или, в том случае, когда используют последовательности животного, трансгенные для последовательностей человеческого Ig, соматическому мутагенезу in vivo) и, в этой связи, аминокислотные последовательности VH и VL областей рекомбинантных антител представляют собой последовательности, которые, будучи полученными из зародышевой линии человеческих VH и VL или связанными с ними, могут в природных условиях не встречаться в репертуаре зародышевой линии человеческих антител in vivo. В некоторых вариантах осуществления настоящего изобретения, такие рекомбинантные антитела представляют собой результат селективного мутагенеза или back-мутации (обратной мутации) или обеих этих стратегий.
Термин «выделенное антитело» обозначает антитело, которое по существу не содержит других антител, обладающих другими антигенными специфичностями (например, выделенное антитело, которое специфически связывается с hIL-12, по существу не содержит антител, которые специфически связываются с антигенами, отличными от hIL-12). Выделенное антитело, которое специфически связывается с hIL-12, может связываться с молекулами IL-12 из другого вида. Кроме того, выделенное антитело может по существу не содержать другого клеточного материала и/или других химических веществ. Подходящие анти-IL-12, которые могут быть получены и очищены в рамках настоящего изобретения, описаны в патенте США No. 6914128 (который включен в настоящее описание полностью в качестве ссылки), где указанные антитела включают, без ограничения, анти-IL-12 антитело, которое было описано в указанном патенте как J695 и которое впоследствии было идентифицировано как ABT-874. Подходящие анти-IL-18 антитела, которые могут быть получены, очищены и выделены в рамках настоящего изобретения, описаны в патентах США NoNo. 09/780035 и 10/988360, которые включают антитело, впоследствии идентифицированное как ABT-325. Соответствующее анти-TNFα антитело представляет Адалимумаб (Adalimumab (Abbott Laboratories)).
Термин «нейтрализующее антитело» (или «антитело, которое нейтрализует активность hIL-12») обозначает антитело, которое, связываясь с hIL-12, приводит к ингибированию биологической активности hIL-12. Такое ингибирование биологической активности hIL-12 можно оценить при измерении одного или нескольких показателей биологической активности hIL-12, например, в тесте на ингибирование пролиферации человеческих бластных клеток, образующих фитогемагглютинин (PHA), или в тесте на ингибирование связывания рецептора в тесте на связывание рецептора человеческого IL-12. Указанные показатели биологической активности могут быть оценены с использованием одного или нескольких стандартных тестов in vitro или in vivo, известных в данной области.
Термин «нейтрализующее антитело» (или «антитело, которое нейтрализует активность hIL-18») обозначает антитело, которое, связываясь с hIL-18, приводит к ингибированию биологической активности hIL-18. Такое ингибирование биологической активности hIL-18 можно оценить при измерении одного или нескольких показателей биологической активности hIL-18, например, по индукции образования IFNγ T-клетками или NK-клетками или по ингибированию связывания рецептора IL-18 в тесте на связывание человеческого рецептора IL-18. Указанные показатели биологической активности hIL-18 могут быть оценены с использованием одного или нескольких стандартных тестов in vitro или in vivo, известных в данной области.
Термин «активность» обозначает активность, такую как специфичность/аффинность антитела в отношении антигена, например, анти-hIL-12 антитела, которое связывается с антигеном IL-12, и/или обозначает нейтрализующую способность антитела, например, анти-hIL-12 антитела, которое при связывании с hIL-12, ингибирует биологическую активность hIL-12, например, ингибирует бластную пролиферацию в РНА тесте или ингибирует связывание рецептора в тесте на связывание рецептора человеческого IL-12. Термин «активность» также обозначает активность, такую как специфичность /аффинность анти-IL-18 антитела в отношении своего антигена, например, анти-hIL-18 антитела, которое связывается с антигеном IL-18, и/или обозначает нейтрализующую способность антитела, такого как анти-hIL-18 антитело, которое при связывании с антигеном hIL-18 ингибирует биологическую активность hIL-18. Термин «активность» также обозначает другие виды активности, такие как специфичность/аффинность анти-TNFα антитела в отношении своего антигена, например, анти-TNFα антитела, которое связывается с антигеном TNFα, и/или обозначает нейтрализующую способность антитела, например, анти-TNFα антитела, которое, связываясь с hTNFα, ингибирует биологическую активность hTNFα.
Фраза «поверхностный плазмонный резонанс» обозначает оптическое явление, которое позволяет проводить анализ биоспецифических взаимодействий в масштабе реального времени путем выявления изменений в концентрации белка в биосенсорной матрице, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, N.J.). Более подробное объяснение дано в работах Jonsson, U., et al. (1993) Ann. Biol. Clin. 51:19-20; Jonsson, U., et al. (1991) Biotechniques 11:620-627; Johnsson, В., el al. (1995) J. Mol. Recognit. 8:125-131; и Johnnson, В., et al. (1991) Anal. Biochem. 198:268-277, полное описание которых включено в настоящую заявку.
Термин «Koff» в контексте настоящего описания обозначает скорость диссоциации антитела из комплекса антитело/антиген.
Термин «Kd» в контексте настоящего описания обозначает константу диссоциации для случая конкретного взаимодействия антитело-антиген.
Фраза «молекула нуклеиновой кислоты» обозначает молекулу ДНК и молекулу РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но в одном аспекте это двухцепочечная ДНК.
Фраза «выделенная молекула нуклеиновой кислоты» в контексте настоящего описания относится к нуклеиновым кислотам, кодирующим антитела или части антител (например, VH, VL, CDR3), например, такие, которые связываются с hIL-12, hTNFa и hIL-18, и включают молекулу нуклеиновой кислоты, в которой нуклеотидная последовательность, кодирующая антитело или часть антитела, не содержит других нуклеотидных последовательностей, кодирующих антитела или части антител, которые связываются с антигенами, отличными от hIL-12, hTNFa или hIL-18, и где другие последовательности могут в природном состоянии фланкировать молекулу нуклеиновой кислоты в ДНК человеческого генома. Таким образом, например, выделенная нуклеиновая кислота по настоящему изобретению, кодирующая VH область анти-IL-12h, анти-TNFα или анти-hIL-18 антитела, не содержит других последовательностей, кодирующих другие VH области, которые связываются с антигенами, отличными, например, от IL-12, hTNFα или hIL-18. Фраза «выделенная молекула нуклеиновой кислоты» также обозначает последовательности, кодирующие бивалентные, биспецифические антитела, такие как антитела, в которых VH и VL области не содержат других последовательностей, отличных от последовательностей данного диатела.
Фраза «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин») обозначает клетку, в которую был встроен рекомбинантный вектор экспрессии. Следует понимать, что такие термины относятся не только к конкретной рассматриваемой клетке, но и к потомству такой клетки. Поскольку в последующих поколениях могут возникать определенные модификации, связанные с мутацией или влиянием окружающей среды, то такое потомство фактически может быть неидентичным исходной клетке, но оно также охватывается термином «клетка-хозяин».
Термин «модификация» в контексте настоящего описания относится к изменению одной или нескольких аминокислот в антителах или их антиген-связывающих частях. Указанное изменение может быть получено за счет добавления, замещения или делеции аминокислоты в одном или нескольких положениях. Такое изменение может быть создано с использованием известных методик, таких как мутагенез в рамках ПЦР.
Термин «примерно» в контексте настоящего описания относится к диапазонам, который примерно на 10-20% больше или меньше указанного значения. В некоторых случаях, как это очевидно специалистам в данной области, в связи с природой указанного значения, термин «примерно» может означать большую или меньшую величину отклонения, чем 10-20% от приведенной величины.
Фраза «снижение/инактивация вируса» в контексте настоящего описания относится к снижению числа вирусных частиц в конкретном образце («снижение»), а также к снижению активности, в частности, без ограничения, к снижению инфекционности или способности к репликации вирусных частиц в конкретном образце («инактивация»). Такое снижение числа и/или активности вирусных частиц может достигать величин от примерно 1% до примерно 99%, предпочтительно от примерно 20% до примерно 99%, более предпочтительно от примерно 30% до примерно 99%, боле предпочтительно от примерно 40% до примерно 99%, еще более предпочтительно от примерно 50% до примерно 99%, еще более предпочтительно от примерно 60% до примерно 99%, и еще более предпочтительно от примерно 70% до примерно 99%, и еще более предпочтительно от примерно 80% до 99%, и еще более предпочтительно от примерно 90% до примерно 99%. В некоторых неограничивающих вариантах, количество вируса, если он присутствует, в очищенном антителе будет меньше, чем величина ID50 (количество вируса, которое будет инфицировать 50 процентов целевой популяции) для данного вируса, предпочтительно, по меньш