Фосфорорганические соединения, каталитические системы, содержащие эти соединения, и способы гидроцианирования или гидроформилирования с применением этих каталитических систем
Иллюстрации
Показать всеИзобретение относится к каталитическим системам на основе фосфорорганических соединений, образующих комплекс, пригодных для гидроцианирования и гидроформилирования алкенов формул
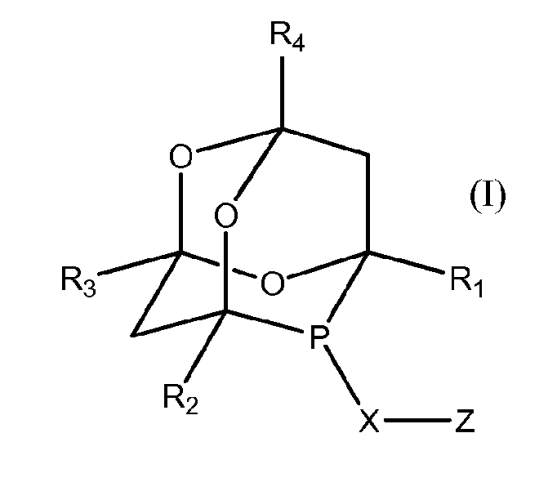
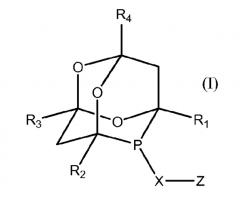
где M - переходный металл, t - число от 1 до 10, n - число от 1 до 4, Lf обозначает фосфорорганический лиганд формул:
или
где R1, R2, R3, R4, R5, R7, Z означают атом водорода, С1-12алкил, фенил, необязательно замещенный 1-3 заместителями, выбранными из С1-6-алкила и гидрокси-С1-6-алкила, или С1-12галогеналкил; X, Х1 и Х2 означают О или S, R6 означает ковалентную связь, С6-арил или несколько связанных С6-ароматических циклов, n и n1, означают валентность X1, Х2, уменьшенную на 2. Предложены новые эффективные катализаторы гидроцианирования и гидроформилирования. 4 н. и 9 з.п. ф-лы, 30 пр., 2 табл.
Реферат
Настоящее изобретение относится к фосфорорганическим соединениям, их применению в каталитических системах и способам синтеза органических соединений с применением этих каталитических систем, в частности способам гидроцианирования этиленненасыщенных органических соединений до соединений, содержащих по меньшей мере одну нитрильную функциональную группу, и способам гидроформилирования ненасыщенных соединений для получения альдегидов.
Реакция гидроцианирования описана, например, во французском патенте 1599761, относящемся к способу получения нитрилов путем введения цианистоводородной кислоты в органические соединения, содержащие по меньшей мере одну двойную связь этиленового типа в присутствии катализатора, содержащего никель и фосфорорганический лиганд, триарилфосфит. Эту реакцию можно осуществлять в присутствии или в отсутствие растворителя.
Если используется растворитель, речь предпочтительно идет об углеводороде, таком как бензол или ксилолы, или о нитриле, таком как ацетонитрил.
Используемый катализатор является органическим комплексом никеля, содержащим лиганды, такие как фосфины, арсины, стибины, фосфиты, арсениты или антимониты.
В этом патенте предусмотрено также присутствие промотера для активации катализатора, такого как соединение бора или соль металла, главным образом кислоты Льюиса.
Предлагалось также множество других каталитических систем, содержащих главным образом фосфорорганические соединения, относящиеся к семейству фосфитов, фосфонитов, фосфинитов и фосфинов. Эти фосфорорганические соединения могут содержать один атом фосфора на молекулу и считаются монодентатными лигандами или несколько атомов фосфора на молекулы, тогда их называют полидентатными лигандами. Более конкретно в ряде патентов описывалось множество лигандов, содержащих два атома фосфора на молекулу (бидентатный лиганд).
Тем не менее, поиск новых каталитических систем, более эффективных как с точки зрения каталитической активности, так и устойчивости, по-прежнему актуален с целью повышения общей экономичности способа.
Реакция гидроформилирования, которая заключается во взаимодействии олефинового соединения со смесью оксида углерода и водорода под давлением для получения альдегида, также описана во многих документах. Можно, например, иметь общее представление о гидроформилировании олефинов из B. Cornils and W.A. Herrmann (Eds.), Applied Homogeneous Catalysis with Organometallic Compounds. Vol.1 et 2, Weinheim, 1996 и из статьи E.Kuntz, опубликованной в энциклопедии “Les Techniques de l'Ingénieur” J 5750-1, издание 2002 года. Каталитические системы, используемые в этой реакции, содержат главным образом карбонилированные гидриды кобальта или родия, которые могут образовывать комплекс с орагнофосфорным лигандом, в частности органофосфинами, такими как трифенилфосфин, или орагнофосфитами. Общее описание каталитических ситсем, используемых в гидроформилировании алкенов приведено в патенте US7495133. Как и в отношении гидроцианирования новые каталитические системы требуются для улучшения свойств способа как на уровне эффективности катализатора, так и для упрощения способа.
Одна из целей настоящего изобретения заключается в том, чтобы предложить новое семейство лигандов, которое позволяет получать при помощи переходных металлов каталитические системы, обладающие хорошей каталитической активностью, в частности, в реакциях гидроцианирования и гидроформилирования.
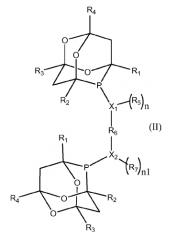
С этой целью настоящим изобретением предлагаются фосфорорганические соединения, отличающиеся тем, что эти фосфорорганические соединения соответствуют одной из общих формул (I) и (II):
в которых:
- R1, R2, R3, R4, R5, R7 и Z, одинаковые или разные, обозначают атом водорода, линейный или разветвленный алкильный радикал, содержащий от 1 до 12 атомов углерода, который может содержать гетероатомы, радикал, содержащий ароматический или циклоалифатический замещенный или незамещенный радикал, который может содержать гетероатомы, карбонил, алкоксикарбонил или алкокси, атом галогена, нитрильную группу или галогеналкильную группу, содержащую от 1 до 12 атомов углерода,
- Х, Х1 и Х2, одинаковые или разные, обозначают атом кислорода, азота, серы, углерода или кремния,
- R6 обозначает ковалентную связь, алифатический линейный или разветвленный радикал, радикал, содержащий замещенный или незамещенный ароматический или циклоалифатический цикл или несколько ароматических циклов, конденсированных или соединенных между собой связью,
- n и n1, одинаковые или разные, обозначают целые числа, соответственно равные валентности элементов Х1, Х2, уменьшенной на 2.
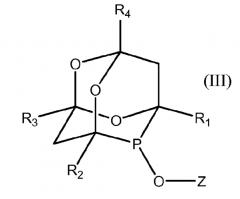
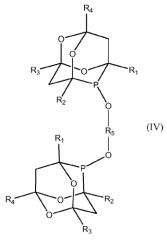
В соответствии с частным вариантом осуществления изобретения фосфорорганические соединения относятся к семейству органофосфинитов и соответствуют одной из общих формул (III) и (IV):
в которых:
- R1, R2, R3, R4, одинаковые или разные, обозначают атом водорода, линейный или разветвленный алкильный радикал, содержащий от 1 до 12 атомов углерода, который может содержать гетероатомы,
- Z обозначает ароматический или циклоалифатический замещенный или незамещенный радикал, который может содержать гетероатомы, карбонил, алкоксикарбонил или алкокси, атом галогена, нитрильную группу или галогеналкильную группу, содержащую от 1 до 12 атомов углерода
- R5 обозначает ковалентную связь, алифатический линейный или разветвленный радикал, радикал, содержащий замещенный или незамещенный ароматический или циклоалифатический цикл или несколько ароматических циклов, конденсированных или соединенных между собой связью.
В качестве предпочтительных соединений общей формулы (I), (II), (III) или (IV) по изобретению можно назвать соединения следующих общих формул:
Эти соединения можно получить из соединений, называемых ниже CgPH следующей формулы:
Эти соединения CgPH описаны в научной статье, опубликованной в журнале Organometallics, том 27, N 13, стр.3215-3224, 2008 г.: ”General Routes to Alkyl Phosphotrioadamante Ligands” Joanne H. Downing et al., а также способ их синтеза.
Соединения CgPH превращают в соединения CgPX, в которых Х обозначает атом галогена, предпочтительно брома, путем взаимодействия с молекулярным галогеном в растворителе, таком как дихлорметан.
Соединения CgPX затем вводят во взаимодействие, например, с соединением, полученным путем взаимодействия гидроксилированного соединения, соответствующего остатку Z или R5 общих формул III и IV, с органощелочным соединением, предпочтительно органолитием, в растворителе, таком как тетрагидрофуран.
Подробности и дополнительная информация о способах получения соединений формул I и II даны в нижеследующих примерах.
В соответствии с другим объектом изобретения фосфорорганические соединения формул (I), (II), (III) или (IV) применяют для получения каталитической системы путем комбинации с металлическим элементом для образования комплекса. В целом состав этих каталитических систем может быть выражен общей формулой (V) или (VI) (эти формулы не соответствуют структуре соединений и комплексов, присутствующих в каталитической системе):
в которой:
М обозначает переходный металл,
Lf обозначает по меньшей мере один фосфорорганический лиганд формулы (I), (II), (III) или (IV),
t обозначает число от 1 до 10 (включая предельные значения),
n обозначает число от 1 до 4 (включая предельные значения).
Комплексообразующими металлами М являются по существу все переходные металлы групп 1b, 2b, 3b, 4b, 5b, 6b, 7b и 8 периодической системы элементов, которая опубликована в “Handbook of Chemistry and Physics, 51st Edition (1970-1971)” The Chemical Rubber Company.
Более конкретно из этих металлов можно назвать металлы, которые можно использовать в качестве катализаторов в реакциях гидроцианирования и гидроформилирования. Так, в качестве неограничивающих примеров можно назвать никель, кобальт, железо, рутений, родий, палладий, осмий, иридий, платину, медь, серебро, золото, цинк, кадмий, ртуть. Никель является предпочтительным элементом для гидроцианирования ненасыщенных олефинов и нитрилов, а кобальт или родий - для гидроформилирования, в частности, алкенов.
Получение каталитических систем, содержащих соединения общей формулы (I), (II), (III) или (IV), можно осуществлять путем приведения в контакт раствора соединения выбранного металла, например, никеля или родия, с раствором фосфорорганического соединения по изобретению.
Соединение металла можно растворять в растворителе. Металл может находиться в составе применяемого соединения либо со степенью окисления, которую он будет иметь в органометаллическом комплексе, либо с более высокой степенью окисления.
В качестве примера можно указать, что в органометаллических комплексах по изобретению родий имеет степень окисления (I), рутений - степень окисления (II), платина - степень окисления (0), палладий - степень окисления (0), осмий - степень окисления (II), иридий - степень окисления (I), никель - степень окисления (0).
Если при получении органометаллического комплекса используется металл с более высокой степенью окисления, ее можно понизить in situ.
Из соединений металлов М, пригодных для получения органометаллических комплексов, в частности, если металлом является никель, можно назвать в качестве неограничивающих примеров следующие соединения никеля:
- соединения, в которых никель имеет нулевую степень окисления, например, тетрацианоникелят калия К4[Ni(CN)4], бис(акрилонитрил)никеля с нулевой степенью, бис(циклооктадиен-1,5) никеля (называемый также Ni(cod)2) и производные, содержащие лиганды, например, тетракис(трифенилфосфин) никеля с нулевой степенью,
- соединения никеля, такие как карбоксилаты (в частности, ацетат), карбонат, бикарбонат, борат, бромид, хлорид, цитрат, тиоцианат, цианид, формиат, гидроксид, гидрофосфит, фосфит, фосфат и производные, йодид, нитрат, сульфат, сульфит, арил- и алкилсульфонаты.
Если используемое соединение никеля находится в состоянии окисления никеля больше 0, в реакционную среду вводят восстановитель никеля, предпочтительно взаимодействующий с последним в реакционных условиях. Этот восстановитель может быть органическим или минеральным. В качестве неограничивающих примеров можно, например, назвать борогидриды, такие как BH4Na, BH4K, порошок Zn, магний или водород.
Если используемое соединение никеля соответствует нулевой степени окисления никеля, можно также ввести восстановитель типа указанных выше, но эта добавка не является обязательной.
Если используют соединение железа, пригодными являются те же восстановители. В случае палладия восстановителями, кроме того, могут являться элементы реакционной среды (фосфин, растворитель, олефин).
Если используемым металлом является родий, то для получения каталитических систем, содержащих соединения общей формулы (I), (II), (III) или (IV), можно получать комплексы с использованием в качестве соединений родия соединений формулы (асас)Rh(CO)2 или (асас)Rh(COD), в которых:
- асас обозначает ацетилацетонат,
- COD обозначает циклооктадиен.
Объектом настоящего изобретения является также способ гидроцианирования олефинов, более конкретно диолефинов, для получения нитрильных соединений, более конкретно динитрильных соединений.
Органические соединения, содержащие по меньшей мере одну двойную этиленовую связь, более конкретно применяемые в настоящем способе, являются диолефинами, такими как бутадиен, изопрен, гексадиен-1,5, циклооктадиен-1,5, алифатические нитрилы с этиленовой ненасыщенной связью, в частности, линейные пентеннитрилы, такие как пентен-3-нитрил, пентен-4-нитрил, а также моноолефинами, такими как стирол, метилстирол, винилнафталин, циклогексен, метилциклогексен, а также смеси нескольких из этих соединений.
Пентеннитрилы могут содержать кроме пентен-3-нитрила и пентен-4-нитрила главным образом незначительные количества других соединений, таких как метил-2-бутен-3-нитрил, метил-2-бутен-2-нитрил, пентен-2-нитрил, валеронитрил, адипонитрил, метил-2-глютаронитрил, этил-2-сукцинонитрил или бутадиен, полученные, например, предшествующей реакцией гидроцианирования бутадиена до ненасыщенных нитрилов.
Действительно в процессе гидроцианирования бутадиена с линейными пентеннитрилами образуются существенные количества метил-2-бутен-3-нитрила и метил-2-бутен-2-нитрила.
Каталитическую систему, используемую для гидроцианирования, способом по изобретению можно получать до ее введения в реакционную зону, например, путем добавления в соединение общей формулы (I), (II), (III) или (IV) как таковое или растворенное в растворителе соответствующего количества выбранного соединения переходного металла и возможно восстановителя. Можно также получать каталитическую систему “in situ” путем простого введения соединения формулы (I), (II), (III) или (IV) и соединения переходного металла в реакционную среду гидроцианирования до или после введения соединения, подлежащего гидроцианированию.
Используемое количество соединения никеля или другого переходного металла выбирают так, чтобы получить молярную концентрацию переходного металла на моль органических соединений, подлежащих гидроцианированию или изомеризации, составляющую от 10-4 и 1 и предпочтительно от 0,005 до 0,5 моля никеля или другого используемого переходного металла.
Количество соединения формулы (I), (II), (III) или (IV), используемое для получения катализатора, выбирают так, чтобы число молей этого соединения, отнесенное к 1 молю переходного металла составляло от 0,5 до 100 и предпочтительно от 2 до 50.
Несмотря на то что взаимодействие проводят главным образом без растворителя, предпочтительным является добавление инертного органического растворителя. Растворителем может являться растворитель катализатора, смешиваемый с фазой, содержащей соединение, подлежащее гидроцианированию при температуре гидроцианирования. В качестве примеров таких растворителей можно назвать ароматические, алифатические или циклоалифатические углеводороды.
Реакцию гидроцианирования главным образом проводят при температуре от 10°С до 200°С и предпочтительно от 30°С до 120°С. Ее можно проводить в однофазной среде.
Способ гидроцианирования по изобретению можно осуществлять непрерывно или периодически.
Используемый цианид водорода можно получить из цианидов металлов, в частности цианида натрия или циангидринов, таких как ацетонциангидрин, или любым другим известным способом синтеза, таким как способ Андруссова, заключающийся в приведении во взаимодействие метана с аммиаком и воздухом.
Цианид водорода, не содержащий воды, вводят в реактор в газообразной форме или в жидкой форме. Его можно также предварительно растворить в органическом растворителе.
В рамках периодического осуществления способа на практике можно загружать в реактор, предварительно продутый инертным газом (таким как азот, аргон), либо раствор, содержащий все или часть различных компонентов, таких как соединение формулы (I), (II), (III) или (IV), соединение переходного металла (никель), возможные восстановитель и растворитель, либо указанные компоненты по отдельности. Главным образом реактор в этом случае нагревают до выбранной температуры, затем вводят соединение, подлежащее гидроцианированию. В этом случае вводят цианид водорода, предпочтительно непрерывно и равномерно.
По окончании реакции (течение которой можно наблюдать путем титрования взятых проб) реакционную смесь выводят после охлаждения и продукты реакции извлекают и разделяют, например, путем перегонки.
Преимущественно синтез динитрилов таких, как адипонитрил, полученных из диолефинов (бутадиен), получают в две последовательные стадии. Первая стадия заключается в гидроцианировании двойной связи диолефина для получения ненасыщенного мононитрила. Вторая стадия заключается в гидроцианировании ненасыщенной связи мононитрила для получения одного или нескольких соответствующих динитрилов. Эти обе стадии осуществляют главным образом с использованием каталитической системы, содержащей органометаллическое соединение той же природы. Однако соотношения фосфорорганическое соединение/металлический элемент и содержание катализатора могут быть разными. Кроме того, на второй стадии предпочтительно ассоциировать с каталитической системой сокатализатор или промотер. Этот сокатализатор или промотер главным образом представляет собой кислоту Льюиса.
Кислота Льюиса, используемая в качестве сокатализатора, позволяет, в частности, в случае гидроцианирования алифатических нитрилов с ненасыщенной этиленовой связью улучшать линейность полученных динитрилов, т.е. процентное содержание линейного динитрила по отношению к общему количеству образовавшихся динитрилов, и/или повышать активность и продолжительность жизни катализатора.
Под кислотой Льюиса в настоящем тексте в соответствии с принятым определением понимают соединения-акцепторы электронных пар.
Можно, в частности, использовать кислоты Льюиса, упомянутые в работе, опубликованной G.A.OLAH “Friedel-Crafts and related Reactions”, том 1, стр.191-197 (1963).
Кислоты Льюиса, которые можно использовать в качестве сокатализаторов в настоящем способе, выбирают из соединений элементов групп Ib, IIb, IIIa, IIIb, IVa, IVb, Va, Vb, VIb, VIIb и VIII Периодической системы элементов. Эти соединения наиболее часто являются солями, в частности, галогенидами, как, например, хлориды или бромиды, сульфаты, сульфонаты, галогеносульфонаты, пергалогеноалкилсульфонаты, в частности фторалкилсульфонаты или перфторалкилсульфонаты, карбоксилаты и фосфаты.
В качестве неограничивающих примеров таких кислот Льюиса можно назвать хлорид цинка, бромид цинка, йодид цинка, хлорид магния, бромид магния, хлорид кадмия, бромид кадмия, хлорид олова (II), бромид олова(II), сульфат олова(II), тартрат олова(II), трифторметилсульфонат индия, хлориды или бромиды редкоземельных элементов, таких как лантан, церий, празеодим, неодим, самарий, европий, гадолиний, тербий, диспрозий, гафний, эрбий, таллий, иттербий и лютеций, хлорид кобальта, хлорид железа(II), хлорид иттрия.
В качестве кислоты Льюиса можно также использовать металлоорганические соединения, такие как трифенилборан, изопропилат титана или соединения, описанные в неопубликованной французской заявке на патент, поданной 25 января 2008 г. под N 0800381.
Можно, конечно, использовать смеси нескольких кислот Льюиса.
Из кислот Льюиса особенно предпочтительными являются хлорид цинка, бромид цинка, хлорид олова(II), бромид олова(II), трифенилборан и смеси хлорид цинка/хлорид олова(II).
Используемая в качестве сокатализатора кислота Льюиса главным образом составляет от 0,01 до 50 молей на моль соединения переходного металла, более конкретно соединения никеля и предпочтительно от 1 до 10 молей на моль.
Ненасыщенные мононитрилы, используемые на этой второй стадии, преимущественно являются линейными пентен-нитрилами, такими как пентен-3-нитрил, пентен-4-нитрил, и их смесями.
Эти пентен-нитрилы могут содержать количества, главным образом незначительные, других соединений, таких как метил-2-бутен-3-нитрил, метил-2-бутен-2-нитрил, пентен-2-нитрил.
Каталитический раствор, используемый для гидроцианирования в присутствии кислоты Льюиса, можно получить до его введения в реакционную зону, например, путем введения в соединение формулы (I), (II), (III) или (IV) соответствующего количества выбранного соединения переходного металла, кислоты Льюиса и возможно восстановителя. Можно также получать каталитический раствор “in situ” путем простого введения этих различных компонентов в реакционную среду.
Можно также в этих условиях способа гидроцианирования по настоящему изобретению и, в частности, осуществляя его в присутствии описанной выше каталитической системы, содержащей соединение формулы (I), (II), (III) или (IV) и по меньшей мере одно соединение переходного металла, осуществлять в отсутствие цианида водорода изомеризацию метил-2-бутен-3-нитрила до пентен-нитрилов и в более широком смысле ненасыщенных разветвленных нитрилов до ненасыщенных линейных нитрилов.
Метил-2-бутен-3-нитрил, подвергаемый изомеризации по изобретению, можно использовать индивидуально или в смеси с другими соединениями. Так можно вводить метил-2-бутен-3-нитрил в смеси с метил-2-бутен-2-нитрилом, пентен-4-нитрилом, пентен-3-нитрилом, пентен-2-нитрилом, бутадиеном.
Интерес представляет обработка реакционной смеси, полученной гидроцианированием бутадиена при помощи HCN в присутствии по меньшей мере одного соединения формулы (I), (II), (III) или (IV) и по меньшей мере одного соединения переходного металла, более предпочтительно соединения никеля с 0 степенью окисления, такого как определен выше. В рамках этого предпочтительно варианта, в котором каталитическая система уже присутствовала в реакции гидроцианирования бутадиена, достаточно остановить введение цианида водорода для запуска реакции изомеризации.
В случае необходимости можно в этом варианте немного продуть реактор инертным газом, таким как азот или аргон, например, с тем, чтобы удалить цианистоводородную кислоту, которая могла бы еще присутствовать.
Реакцию изомеризации проводят главным образом при температуре от 10°С до 200°С и более предпочтительно от 60°С до 140°С.
В предпочтительном случае изомеризации, следующей непосредственно за реакцией гидроцианирования бутадиена, предпочтительно проводить реакцию при температуре, при которой проводилось гидроцианирование или, при несколько более высокой температуре.
Как в способе гидроцианирования соединений с ненасыщенной этиленовой связью каталитическую систему, используемую для изомеризации, можно получить до ее введения в реакционную зону, например, путем смешивания соединения формулы (I), (II), (III) или (IV), соответствующего количества выбранного соединения переходного металла и возможно восстановителя. Можно также получить каталитическую систему “in situ” путем простого введения этих различных компонентов в реакционную среду. Используемое количество соединения переходного металла и более конкретно никеля, а также количество соединения формулы (I), (II), (III) или (IV), являются теми же, что в реакции гидроцианирования.
Несмотря на то, что реакцию изомеризации проводят главным образом в растворителе, может быть желательно вводить инертный органический растворитель, который можно будет в дальнейшем использовать в качестве растворителя для экстракции. Это более конкретно относится к случаю, когда такой растворитель применялся в реакции гидроцианирования бутадиена, использовавшегося для получения среды, подвергаемой реакции изомеризации. Такие растворители можно выбирать из тех, которые упоминались выше в отношении гидроцианирования.
Тем не менее, получение динитрильных соединений путем гидроцианирования олефина, такого как бутадиен, можно осуществлять с использованием каталитической системы по изобретению на стадиях образования ненасыщенных нитрилов и на стадии изомеризации, указанной выше, причем реакцию гидроцианирования ненасыщенных нитрилов до динитрилов можно осуществлять с использованием каталитической системы по изобретению или любой другой каталитической системы, использование которой в этой реакции уже известно.
Также реакцию гидроцианирования олефина до ненасыщенных нитрилов и изомеризацию последних можно проводить с использованием каталитической системы, отличающейся от каталитической системы по изобретению, при этом стадию гидроцианирования ненасыщенных нитрилов до динитрилов осуществляют с использованием каталитической системы по изобретению.
Объектом изобретения также является способ гидроформилирования алкенов для синтеза олефинов.
В качестве примеров алкенов, используемых в настоящем способе, можно указать линейные олефины, такие как этилен, пропен, 1-бутен, 1-пентен, 1-гексен, 1-октен.
Реакция гидроцианирования в присутствии катализатора на основе комплексов родия и фосфорорганических соединений описана, например, в статье J.Falbe, “New synteses with carbon monoxide”, Springer Verlag, Berlin, Heidelberg, New York, стр. 95 и последующие (1980). Олефины взаимодействуют со смесью СО/Н2 (синтезированный газ) в присутствии катализатора. Реакцию проводят в температурных пределах от 40 до 180°С, предпочтительно от 60°С до 140°С при давлении от 1 до 300 бар, предпочтительно от 10 до 70 бар. Смесь СО/Н2 (синтезированный газ) имеет соотношение по объему водород/монооксид углерода от 1 до 1,25. Катализатор и лиганд растворяют в среде гидроформилирования, которая может содержать растворитель.
Другие подробности, преимущества изобретения иллюстрируют примеры, приведенные ниже исключительно для сведения и не имеющие ограничивающего характера.
ПРИМЕРЫ
Используемые аббревиатуры:
- Ph: фенильный радикал
- Cod: циклооктадиен
- Ni(Cod)2: бис(1,5-циклооктадиен)никель
- Rh(acac)(CO)2: родий дикарбонил-ацетилацетонат
- 3PN: 3-пентеннитрил
- AdN: адипонитрил
- ESN: этилсукцинонитрил
- MGN: метилглутаронитрил
- DN: динитрильные соединения (AdN, MGN или ESN)
- TIBAO: тетраизобутилдиалюминоксан
- ТТ(Y): степень превращения продукта Y, подлежащего превращению, соответствующая отношению числа превращенных молей Y к числу первоначальных молей Y,
- RR(DN): реальный выход динитрилов, соответствующий отношению числа образовавшихся молей динитрилов к числу молей 3PN, вступившего в реакцию,
- линейность(L): отношение числа образовавшихся молей AdN к числу образовавшихся молей динитрилов (сумма молей AdN, ESN и MGN).
Следующие соединения: 3PN, Ni(Cod)2, ZnCl2, TIBAO, BPh3, дифенилборный ангидрид (Ph2BOPh2), Rh(acac)(CO)2 являются известными и коммерчески доступными продуктами.
Примеры 1-10: Получение лигандов 1-10
На первой стадии раствор Br2 (3,5158 г, 0,022 моля) в CH2Cl2 (30 мл) вводят в течение 30 минут в раствор CgPH (4,3243г, 0,02 моля) в 60 мл дихлорметана (CH2Cl2) при 0°С и перемешивают при этой температуре в течение 30 минут, затем в течение часа при комнатной температуре. Растворитель выпаривают и получают твердое вещество светло-желтого цвета (CgPBr). ЯМР 31Р δ 53,5 (в CH2Cl2):
Соединение CgPBr
Получение лиганда 1:
Получение. Раствор бутиллития (BuLi) в гексане (1,6 М, 0,02 моля, 12,5 мл) медленно вводят в раствор фенола (1,8822 г, 0,02 моля) в тетрагидрофуране (ТГФ) (20 мл) при 0°С. Смесь встряхивают в течение 1 часа при комнатной температуре, затем вводят в течение 30 минут в раствор CgPBr (5,9022 г, 0,02 моля) в ТГФ (60 мл) при 0°С. Полученную суспензию встряхивают в течение одной ночи перед выпариванием растворителя. Раствор необработанного лиганда в CH2Cl2 фильтруют через кремнезем и растворитель выпаривают. Лиганд очищают хроматографией на колонке силикагеля, используя в качестве растворителя смесь CH2Cl2/Пентан (1/3 по объему) под давлением азота.
Полученное количество: 4,33 г (выход 70%)
ЯМР 31Р δ 79,5 (в CDCl2)
Получение лиганда 2:
Раствор BuLi в гексане (1,6 М, 0,02 моля, 12,5 мл) медленно вводят в раствор 2,4,6-триметилфенола (2,7238 г, 0,02 моля) в ТГФ (20 мл) при 0°С. Смесь встряхивают в течение 1 часа при комнатной температуре, затем вводят в течение 30 минут в раствор CgPBr (5,9022 г, 0,02 моля) в ТГФ (60 мл) при 0°С. Полученную суспензию встряхивают в течение одной ночи перед выпариванием растворителя. Необработанный лиганд растворяют в CH2Cl2 (60 мл) и вводят 50 мл воды. Водную фазу экстрагируют при помощи CH2Cl2 (50 мл) и все органические фазы сушат над Na2SO4, фильтруют и выпаривают растворитель. Лиганд очищают хроматографией на колонке силикагеля, используя в качестве растворителя смесь CH2Cl2/Пентан (1/3 по объему) под давлением азота.
Полученное количество: 4,21 г (60%)
ЯМР 31Р δ 82,0 (в CDCl2)
Получение лиганда 3:
Раствор BuLi в гексане (1,6 М, 0,02 моля, 12,5 мл) медленно вводят в раствор 2-метилфенола (2,1628 г, 0,02 моля) в ТГФ (20 мл) при 0°С. Смесь встряхивают в течение 1 часа при комнатной температуре, затем вводят в течение 30 минут в раствор CgPBr (5,9022 г, 0,02 моля) в ТГФ (60 мл) при 0°С. Полученную суспензию встряхивают в течение одной ночи перед выпариванием растворителя. Необработанный лиганд растворяют в CH2Cl2 (60 мл) и вводят 50 мл воды. Водную фазу экстрагируют при помощи CH2Cl2 (50 мл) и все органические фазы сушат над Na2SO4, фильтруют и выпаривают растворитель. Лиганд очищают хроматографией на колонке силикагеля, используя в качестве растворителя смесь CH2Cl2/Пентан (1/3 по объему) под давлением азота.
Полученное количество: 5,01 г (выход 78%)
ЯМР 31Р δ 76,0 (в CDCl2)
Получение лиганда 4:
Раствор BuLi в гексане (1,6 М, 0,02 моля, 12,5 мл) медленно вводят в раствор 2,4-дитретбутилфенола (4,125 г, 0,02 моля) в ТГФ (20 мл) при 0°С. Смесь встряхивают в течение 1 часа при комнатной температуре, затем вводят в течение 30 минут в раствор CgPBr (5,9022 г, 0,02 моля) в ТГФ (60 мл) при 0°С. Полученную суспензию встряхивают в течение одной ночи перед выпариванием растворителя. Необработанный лиганд растворяют в CH2Cl2 (60 мл) и вводят 50 мл воды. Водную фазу экстрагируют при помощи CH2Cl2 (50 мл) и все органические фазы сушат над Na2SO4, фильтруют и выпаривают растворитель. Лиганд очищают хроматографией на колонке силикагеля, используя в качестве растворителя смесь CH2Cl2/Пентан (1/3 по объему) под давлением азота.
Полученное количество: 6,24 г (74%)
ЯМР 31Р δ 68,8 (в CDCl2)
Получение лиганда 5:
Раствор BuLi в гексане (1,6 М, 0,02 моля, 12,5 мл) медленно вводят в раствор дифенола (1,8621 г, 0,01 моля) в ТГФ (20 мл) при 0°С. Смесь встряхивают в течение 1 часа при комнатной температуре, затем вводят в течение 30 минут в раствор CgPBr (5,9022 г, 0,02 моля) в ТГФ (60 мл) при 0°С. Полученную суспензию встряхивают в течение одной ночи перед выпариванием растворителя. Необработанный лиганд растворяют в CH2Cl2 (60 мл) и вводят 50 мл воды. Водную фазу экстрагируют при помощи CH2Cl2 (50 мл) и все органические фазы сушат над Na2SO4, фильтруют и выпаривают растворитель. Лиганд 5 очищают перекристаллизацией в смеси CH2Cl2/Пентан (1/5 по объему) под давлением азота.
Полученное количество: 3,0 г (выход 49%)
ЯМР 31Р δ 82,8 (в CDCl2)
Получение лиганда 6:
Раствор BuLi в гексане (1,6 М, 0,02 моля, 12,5 мл) медленно вводят в раствор метанола (0,5768 г, 0,018 моля) в ТГФ (20 мл) при 0°С. Смесь встряхивают в течение 1 часа при комнатной температуре, затем вводят в течение 30 минут в раствор CgPBr (5,9022 г, 0,02 моля) в ТГФ (60 мл) при 0°С. Полученную суспензию встряхивают в течение одной ночи перед выпариванием растворителя. Необработанный лиганд растворяют в CH2Cl2 (60 мл) и вводят 50 мл воды. Водную фазу экстрагируют при помощи CH2Cl2 (50 мл) и все органические фазы сушат над Na2SO4, фильтруют и выпаривают растворитель. Лиганд очищают хроматографией на колонке силикагеля, используя в качестве растворителя смесь CH2Cl2/Пентан (1/3 по объему) под давлением азота.
Полученное количество: 3,11 г (70%)
ЯМР 31Р δ 88,5 (в CDCl2)
Получение лиганда 7:
Раствор BuLi в гексане (1,6 М, 0,02 моля, 12,5 мл) медленно вводят в раствор 1,2-бензолдиметанола (1,2711 г, 0,00092 моля) в ТГФ (20 мл) при 0°С. Смесь встряхивают в течение 1 часа при комнатной температуре, затем вводят в течение 30 минут в раствор CgPBr (5,9022 г, 0,02 моля) в ТГФ (60 мл) при 0°С. Полученную суспензию встряхивают в течение одной ночи перед выпариванием растворителя. Необработанный лиганд растворяют в CH2Cl2 (60 мл) и вводят 50 мл воды. Водную фазу экстрагируют при помощи CH2Cl2 (50 мл) и все органические фазы сушат над Na2SO4, фильтруют и выпаривают растворитель. Лиганд очищают хроматографией на колонке силикагеля, используя в качестве растворителя смесь этилацетат/гексан (1/6 по объему) под давлением азота.
Полученное количество: 3,87 г (выход 74%)
ЯМР31Рδ 85,9 и 86,0 (в CDCl2)
Получение лиганда 8:
Раствор BuLi в гексане (1,6 М, 0,02 моля, 12,5 мл) медленно вводят в раствор трифторэтанола (2,0008 г, 0,02 моля) в ТГФ (20 мл) при 0°С. Смесь встряхивают в течение 1 часа при комнатной температуре, затем вводят в течение 30 минут в раствор CgPBr (5,9022 г, 0,02 моля) в ТГФ (60 мл) при 0°С. Полученную суспензию встряхивают в течение одной ночи перед выпариванием растворителя. Лиганд очищают хроматографией на колонке силикагеля, используя в качестве растворителя смесь CH2Cl2/Пентан (1/3 по объему) под давлением азота.
Полученное количество: 4,81 г (77%)
ЯМР 31Р δ 97,2, 4JP,F 7,4 Гц (в CDCl2)
ЯМР 31F δ-75,1, 4JF,P,≈3JF,H 7,3 Гц (в CDCl2)
Получение лиганда 9:
Раствор BuLi в гексане (1,6 М, 0,01 моля, 6,25 мл) медленно вводят в раствор 1,2-бензол(диметанола) (2,0725 г, 0,015 моля) в ТГФ (50 мл) при 0°С. Температуру смеси медленно доводят до комнатной температуры и встряхивают в течение 1 часа. Затем раствор CgPBr (2,9511 г, 0,01 моля) в ТГФ (50 мл) медленно вводят в указанную выше суспензию при 0°С в течение 30 минут и смесь встряхивают в течение 3 часов при комнатной температуре. Растворитель выпаривают, полученное твердое вещество растворяют в CH2Cl2 (50 мл) и вводят 50 мл воды. Водную фазу экстрагируют при помощи 50 мл CH2Cl2 и все органические фазы сушат над Na2SO4, фильтруют и выпаривают растворитель. Соединение очищают хроматографией на колонке силикагеля, используя в качестве растворителя смесь этилацетат/гептан (1/6 по объему) под давлением азота.
Полученное количество: 2,89 г (выход 82%)
ЯМР 31Р δ 87,9 (CDCl2)
Получение лиганда 10:
Раствор бутиллития (BuLi) в гексане (1,6 М, 0,01 моля, 6,25 мл) медленно вводят в раствор тиофенола (1,11 г, 0,01 моля) в тетрагидрофуране (ТГФ) (15 мл) при 0°С. Смесь встряхивают в течение 1 часа при комнатной температуре, затем вводят в течение 30 минут в раствор CgPBr (2,95 г, 0,01 моля) в ТГФ (50 мл) при 0°С. Полученную суспензию встряхивают в течение одной ночи перед выпариванием растворителя. Лиганд очищают хроматографией на колонке силикагеля, используя в качестве растворителя смесь CH2Cl2/Пентан (1/3 по объему) под давлением азота.
Полученное количество: 2,76 г (85%)
ЯМР 31Р δ 21,5 (CDCl3)
Примеры 11-15: Гидроформилирование 1-гексана
Используется следующий порядок проведения опыта:
В инертной атмосфере загружают в автоклав Rh(acac)(CO)2 (6,2 мг, 0,024 ммоля) лиганд по изобретению, природа и количество которого указаны в таблице 1, и 5 мл толуола. Затем в реакторе при помощи смеси Н2/СО (1:1, молярное отношение) создают давление 20 бар и в течение 1 часа нагревают до 60°С, затем реактор охлаждают до комнатной температуры, сбрасывают давление и продувают азотом. Затем вводят 1,2 мл 1-гексена и в автоклаве снова создают давление при помощи смеси Н2/СО (1:1, молярное отношение) 20 бар и в течение 1 часа нагревают до 60°С. Затем реактор охлаждают до комнатной температуры, сбрасывают давление и продувают азотом. Полученный продукт подвергают анализу при помощи ЯМР 1Н (анализ методом ядерного магнитного резонанса). Полученный продукт представляет собой смесь, содержащую продукты гидроформилирования, такие как: гептанал (линейный продукт) и 2-метилгексанал (разветвленный продукт).
Результаты приведены в следующей таблице 1:
| Таблица 1Примеры 11-15 | ||||
| пример | лиганд | лиганд/Rh (молярное) | ТТ(1-гексен) | продукт линейный/ разветвленный (%мол.) |
| 11 | 1 | 4,5 | 100 | 60/40 |
| 12 | 2 | 4,5 | 100 | 65/35 |
| 13 | 3 | 4,5 | 100 | 62/38 |
| 14 | 4 | 4,5 | 100 | 66/34 |
| 15 | 6 | 4,5 | 63 | 59/41 |
Примеры 16-30: Гидроцианирование 3-PN до AdN
Используется следующий порядок проведения опыта:
В атмосфере аргона в стеклянную к