Способ иммобилизации химотрипсина на наночастицах селена или серебра
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, биохимии и медицины. Предложен способ иммобилизации химотрипсина на наночастицах селена или серебра. К раствору химотрипсина с концентрацией от 1·10-3 до 1 мас.% добавляют раствор селенистой кислоты в интервале концентраций 1,3·10-4 - 1,5 мас.% или нитрата серебра в интервале концентраций 1·10-4 - 1 мас.%. Затем в реакционную среду вводят аскорбиновую кислоту в концентрации от 1·10-3 - 0,7 мас.% или раствор борогидрида натрия в концентрации от 0,01 до 0,6 мас.%. Раствор перемешивают и оставляют для завершения реакции. Процесс ведут при температуре от 0 до 50°C. Способ позволяет получить устойчивый фермент-коллоидный комплекс и сохранить в нем более 90% активности химотрипсина в широком диапазоне рН, а в определенных интервалах рН повысить каталитическую активность нанокомплесов выше активности нативного химотрипсина в точке оптимума. 3 табл., 3 пр.
Реферат
Изобретение относится к области биоорганической химии, биотехнологии и нанохимии, конкретно к разработке способов иммобилизации ферментов, обеспечивающих сохранение стабильности их молекул, а также повышение специфической ферментативной активности.
Иммобилизованные ферменты обладают рядом преимуществ перед нативными: непрерывность проведения ферментативного процесса с возможностью регулирования скорости катализируемой реакции и выхода продукта; направленное изменение свойств фермента (специфичность, зависимость каталитической активности от рН и других параметров среды, стабильность к денатурирующим воздействиям); возможность регулирования каталитической активности иммобилизованных ферментов путем изменения свойств носителя.
В данной области известно большое число технических решений, среди которых наибольшее распространение получили химические и физические способы иммобилизации.
Химический способ иммобилизации заключатся в ковалентном связывании биомолекул с предварительно активированным носителем, модифицированным реакционно-способными функциональными группами (амино-, азидо-, карбоксильные, гидроксильные и др.).
Физический способ иммобилизации заключается в адсорбции фермента на твердом носителе (чаще всего полимерном) за счет физических сил (ион-ионных, гидрофобных, водородных связей и т.д).
Известен также способ получения иммобилизованного протеолитического фермента (RU №1041567, МПК C12N 11/10, 15.09.1983), предусматривающий растворение содержащего альдегидные группы носителя в буферном растворе и последующее присоединение протеолитического фермента. В качестве носителя используют ксилоуронид, растворенный в 0,1 М трисоксиметиламинометановом буфере (рН 8,5), а присоединение фермента осуществляют при соотношении носитель-фермент 1:1. К основным недостаткам данного способа относятся следующие: дефицитный и дорогостоящий носитель - ксилоуронид, низкая стабильность целевого продукта, необходимость хранения препарата при низкой температуре (0-4°C).
Известен также физический способ иммобилизации ферментов (RU 2167197, МПК C12N 11/14, С12Р 19/02, 20.05.2001), описывающий композит для осахаривания крахмала, включающий фермент глюкоамилазу и твердый носитель, на поверхности которого иммобилизована глюкоамилаза, носителем является зауглероженный алюмосиликат, который имеет удельную поверхность не менее 2 м2/г и выполнен в форме гранул, сотовых монолитов или пеноматериала. При этом носитель готовят способом, который позволяет усилить адсорбционные свойства зауглероженного алюмосиликата. При приготовлении носителя на исходный алюмосиликат с удельной поверхностью 0,1-24 м2/г наносят никель. Затем проводят пиролиз пропан-бутановой смеси в присутствии данного носителя, в результате чего получают зауглероженный алюмосиликат, удельная поверхность которого в несколько раз превышает удельную поверхность исходного алюмосиликата. Приготовленный таким образом носитель имеет структуру, содержащую большое количество мезопор, пригодных по размеру для сорбции в них молекул фермента. Иммобилизация глюкоамилазы заключается в проведении процесса ее физической адсорбции на поверхности полученного носителя. Физическая адсорбция осуществляется путем погружения носителя в водный раствор фермента и выдерживания его в течение 6 часов при периодическом перемешивании.
Недостатки данного изобретения связаны с многостадийностью технологического процесса, с использованием пиролиза для нанесения слоя пористого углерода на поверхность носителя, что связано с высокими энергетическими затратами и большим расходом органических веществ (пропан-бутан). Кроме того, в результате сорбции иммобилизованный фермент имеет невысокую активность -50-80%(от активности свободного фермента).
Наиболее близким техническим решением является способ иммобилизации L-фенилалани-аммоний-лиазы на магнитных наночастицах (см. пат. РФ №RU 2460790, МПК С12Р 19/04, B01D 15/38, С07С 31/10, 10.09.2012), заключающийся в использования в качестве носителя для иммобилизации магнитных наночастиц, представляющих собой оксиды металлов. Иммобилизация фермента на наночастицах реализуется через предварительную модификацию их поверхности. На первом этапе осуществляется получение магнитных наночастиц, содержащих на поверхности электрофильные сложноэфирные группы, путем взаимодействия полиметилметакрилата, соответствующего хлорида металла и диэтиленгликоля. Вторая стадия заключается в формировании на поверхности наночастиц слоя аминопропилтриэтоксисисилана за счет протекания реакции аминолиза электрофильных фрагментов носителя. Полученные наночастицы служат для последующей иммобилизации ферментов с использованием 1-этил-3-(3-диметиламинопропил) карбодиимида.
Существенными и очевидными недостатками описанного способа являются многостадийность, необходимость в ресуспензировании наночастиц, полученных на первой стадии, проведение дополнительной модификации поверхности и последующей химической иммобилизации фермента на поверхность наночастиц, что подразумевает использование дополнительных реагентов и усложняет процесс. Кроме того, химическая иммобилизация существенно влияет на конформацию фермента, что понижает его каталитическую активность. Иммобилизованный фермент сохранял лишь от 64% до 75% от его активности в свободном состоянии в узком интервале рН от 7,5 до 9,0.
Технической задачей и положительным результатом заявляемого изобретения является разработка одностадийного способа иммобилизации различных ферментов на наночастицах различной природы, результатом которого является получение стабильного во времени коллоидного раствора нанокомплекса, ферментативная активность которого сравнима или превышает активность свободного фермента в широком диапазоне рН и не обладающего недостатками заявленного прототипа.
Сущность изобретения заключается в разработке способа иммобилизации ферментов (в частности, химотрипсина) на наночастицах биогенных элементов (например - селена и серебра).
Указанная задача и результат в изобретении достигается проведением окислительно-восстановительной реакции в присутствии раствора фермента, предназначенного для иммобилизации, например - химотрипсина, в ходе которой образуются наночастицы с адсорбированным ферментом. К раствору фермента, концентрация которого может варьироваться от 0,001 до 1 масс.% добавляют раствор окислителя, например, селенистой кислоты (H2SeO3) в интервале концентраций 1,3·10-4-1,5 масс.% или нитрата серебра (AgNO3) в интервале концентраций 1·10-4-1 масс.%. Затем в реакционную среду вводят восстановители, например, аскорбиновую кислоту (от 1·10-3-0,7 масс.%) или раствор борогидрида натрия (от 0,01 до 0,6 масс.%). Процесс ведут при температуре от 0 до 50°C. Растворы перемешивают и оставляют для завершения реакции. По окончанию реакции получаются стабильные растворы наночастиц с иммобилизованными на их поверхности ферментами за счет сил физической адсорбции.
Отличительными признаками предлагаемого способа являются указанные выше; предлагаемый способ иммобилизации ферментов имеет очевидные преимущества перед прототипом.
Анализ известного уровня техники не позволил найти опубликованные решения, в которых была бы использована вся совокупность существенных признаков заявленного способа. Это свидетельствует о соответствии способа изобретению по условиям патентоспособности как «новизна» и «изобретательский уровень».
При выявлении существенности новизны признаков было получено следующее.
Каталитическая активность фермент-коллоидного комплекса сохраняется практически на уровне свободного фермента или превышает таковую.
Иммобилизованный таким способом фермент проявляет более высокую каталитическую активность в более широком диапазоне рН, в том числе и в неоптимальных интервалах для нативного фермента, в отличие от прототипа.
Способ позволяет иммобилизовать фермент на наночастицах различной природы, совмещая в одном препарате как каталитические свойства фермента, так и собственную биологическую активность матрицы-носителя.
Предложенный способ иммобилизации - одностадийный и легко реализуем в технологическом отношении.
Способ иммобилизации фермента по своей природе физический и не требует траты дополнительных химических агентов или предварительной модификации поверхности частицы.
Нанокомплексы проявляют стабильность до 1 года.
Выбранные интервалы концентраций прекурсоров и восстановителей обусловлены тем, что при больших значениях концентраций реагирующих веществ (более 1,5 масс.% H2SeO3 и 1 масс.% AgNO3) образуются агрегативно неустойчивые растворы нанокомплексов с низкой ферментативной активностью. При низких значениях концентрации (менее 1,3·10-4 масс.% H2SeO3 и 1·10-4 масс.%) AgNO3) остается большое количество свободного фермента и повышения ферментативной активности не наблюдается.
Изменением соотношения концентрации фермента и наночастиц можно регулировать их размер и ферментативную активность.
Изменяя количество восстановителя можно менять размеры получаемых нанокомплексов.
Полученный нанокомплекс позволяет комбинировать в одном препарате различные свойства, связанные как с природой наночастиц (антимикробные, антиоксидантные, противовоспалительные, антиканцерогенные, детоксицирующие), так и со свойствами ферментов (каталитическая активность, субстратная специфичность, сопряженные ферментативные реакции).
Иммобилизованный фермент показывает более высокую протеолитическую активность или во всем диапазоне рН или на отдельных участках рН профиля.
Для доказательства соответствия заявленного решения условию патентоспособности «промышленная применимость» и для лучшего понимания сущности заявленного изобретения приводятся примеры конкретного исполнения для химотрипсина на наночастицах селена и серебра.
Пример 1. Для иммобилизации химотрипсина на наночастицах селена
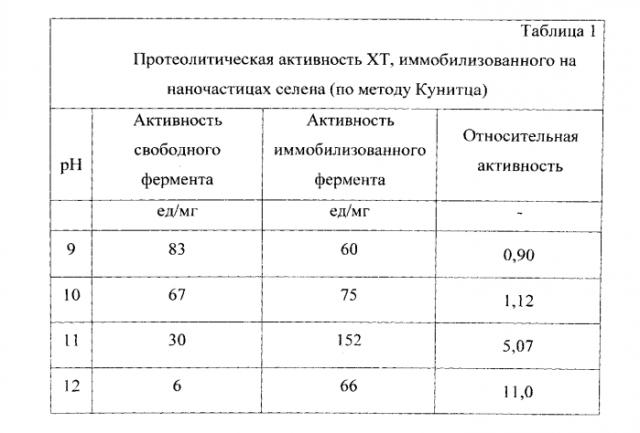
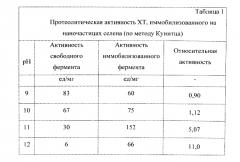
В плоскодонную колбу на 30 мл помещают 0,5 мл 0,2% раствора химотрипсина (XT), прибавляют 7,5 мл дистиллированной воды, затем при перемешивании на магнитной мешалке добавляют 1 мл 0,013М селенистой кислоты (H2SeO3) и после перемешивания в течение 10 мин добавляют в качестве восстановителя аскорбиновую кислоту (C6H8O6) 1 мл 0,025М. Продолжают перемешивать еще 5 мин и затем оставляют до завершения реакции (24 часа) при комнатной температуре. Полученный молекулярный раствор имеет характерный красновато-оранжевый цвет, рН раствора 3,2. Раствор устойчив до 1 года. Нанокомплекс селен-химотрипсин показывает более высокую протеолитическую активность по сравнению с чистым ферментом в широком диапазоне рН.
Пример 2. Для иммобилизации химотрипсина на наночастицах серебра
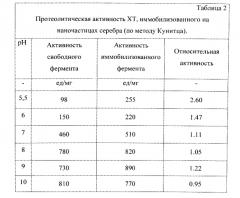
В плоскодонную колбу на 30 мл помещают навеску боргидрида натрия (NaBH4) 0,011 г, помещают колбу и добавляют 10 мл дистиллированной воды. Растворенный NaBH4 выдерживается 30-40 мин. Одновременно в колбу на 50 мл вводится 5 мл 0,1% раствора XT и 1 мл 0,02% раствора азотнокислого серебра (AgNO3). Смесь перемешивается круговыми движениями колбы в кристаллизаторе со льдом и остается в нем 30-40 минут. После выравнивания температуры в колбу с XT и азотнокислым серебром вводится 4 мл приготовленного раствора. Начинается бурная реакция, реакционная колба остается во льду в течении 1 часа, а затем помещается в холодильник на 18-24 часа. В результате реакции получается раствор черного цвета, рН которого 10,4. Раствор стабилен от 1 месяца до 1 года.
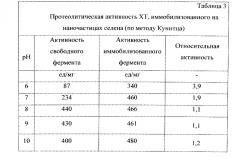
В результате применения способа получают препараты, позволяющие эффективно сохранить каталитические свойства фермента - более 90% или значительно их превысить по сравнению со свободным ферментом. Фермент-коллоидный комплекс проявляет высокую активность в широком диапазоне рН. Способ позволяет проводить иммобилизацию на наночастицах, обладающих собственной биологической активностью и различных по природе. Весь процесс одностадийный и легко реализуем в технологическом отношении.
Пример
Для иммобилизации химотрипсина на наночастицах селена при 50°C в плоскодонную колбу на 30 мл помещают 0,5 мл 0,2% раствора химотрипсина (XT), прибавляют 7,5 мл дистиллированной воды, затем при перемешивании на магнитной мешалке добавляют 1 мл 0,013М селенистой кислоты (H2SeO3) и после перемешивания в течении 10 мин колбу помещают в термостат, нагретый до 50°C, или на водяную баню при той же температуре. После выдерживания реакционной колбы в термостате в течение 30-45 мин (когда температура в ней станет равна 50°C) добавляют в качестве восстановителя аскорбиновую кислоту (C6H8O6) 1 мл 0,025М. Продолжают перемешивать еще 5 мин и затем оставляют до завершения реакции (24 часа) в термостате при температуре 50°C. Полученный молекулярный раствор имеет характерный красный цвет, рН раствора 3,2. Раствор устойчив до 1 года. Нанокомплекс селен-химотрипсин показывает более высокую протеолитическую активность по сравнению с чистым ферментом в широком диапазоне рН.
Способ иммобилизации химотрипсина на наночастицах селена или серебра, характеризующийся тем, что ведут образование нанокомплексов окислительно-восстановительной реакцией в присутствии раствора фермента следующим образом: к раствору фермента - химотрипсина с концентрацией от 1·10-3 до 1 мас.% добавляют раствор селенистой кислоты (H2SeO3) в интервале концентраций 1,3·10-4 - 1,5 мас.% или нитрата серебра (AgNO3) в интервале концентраций 1·10-4 - 1 мас.%; затем в реакционную среду вводят восстановители: аскорбиновую кислоту в концентрации от 1·10-3 - 0,7 мас.% или раствор борогидрида натрия в концентрации от 0,01 до 0,6 мас.%; процесс ведут при температуре от 0 до 50°C, раствор перемешивают и оставляют для завершения реакции.