Производные трициклического индола в качестве лигандов pbr
Иллюстрации
Показать всеИзобретение относится к радиоиндикатору для PET, который обладает улучшенными свойствами в отношении визуализации периферических бензодиазепиновых рецепторов (PBR) по сравнению с известными радиоиндикаторами для PET. Согласно настоящему изобретению предложены также соединение-предшественник для получения радиоиндикатора для PET по изобретению и способы получения указанного соединения-предшественника и указанного радиоиндикатора для PET. Также предложена радиофармацевтическая композиция, содержащая радиоиндикатор для PET по изобретению и способы для применения радиоиндикатора для PET и радиофармацевтической композиции. 9 н. и 14 з.п. ф-лы, 8 ил., 12 пр.
Реферат
Техническая область изобретения
Настоящее изобретение относится к визуализации in vivo, в частности к визуализации методом позитронно-эмиссионной томографии (PET) периферических бензодиазепиновых рецепторов (PBR). Предложен радиоиндикатор для PET на основе индола, который связывается с PBR с высокой аффинностью, имеет хорошее всасывание в головной мозг после введения, и который обладает способностью превосходного селективного связывания с PBR. Согласно настоящему изобретению предложено также соединение-предшественник, полезное в синтезе радиоиндикатора для PET по изобретению, а также способ синтеза указанного соединения-предшественника. В других аспектах данного изобретения предложен способ синтеза радиоиндикатора для PET по изобретению, включающий использование соединения-предшественника по изобретению, набор для осуществления указанного способа и кассету для проведения автоматизированного варианта указанного способа. Кроме того, согласно изобретению предложена радиофармацевтическая композиция, содержащая радиоиндикатор для PET по изобретению, а также способы применения указанного радиоиндикатора для PET.
Описание предшествующего уровня техники
Известно, что периферические бензодиазепиновые рецепторы (PBR) в основном локализованы в периферических тканях и глиальных клетках, но их физиологическая функция остается не до конца выясненной. PBR также называют белками-транслокаторами (TSPO). Известно, что внутриклеточно PBR локализуются на внешней митохондриальной мембране, что указывает на их потенциальную роль в модулировании митохондриальной функции и в иммунной системе. Считается также, что PBR вовлечены в клеточную пролиферацию, стероидогенез, транспорт кальция и клеточное дыхание.
Аномальная экспрессия PBR связана с воспалительными болезненными состояниями центральной нервной системы (ЦНС), включая рассеянный склероз (Banati et al., 2001 Neuroreport, 12(16): 3439-42; Debruyne et al., 2002 Acta Neurol Belg, 102(3):127-35), энцефалит Расмуссена (Banati et al., 1999 Neurology, 53(9):2199-203) церебральный васкулит (Goerres et al., 2001 Am J Roentgenol, 176(4):1016-8), герпетический энцефалит (Cagnin et al., 2001 Brain, 124(Pt 10): 2014-27) и СПИД-ассоциированную деменцию (Hammoud et al., 2005 J Neurovirol; 11(4):346-55).
Кроме того, в ЦНС связь с PBR была документально подтверждена при дегенеративных заболеваниях, таких как болезнь Паркинсона (Gerhard et al., 2006 Neurobiol Dis, 21(2):404-12; Ouchi et al., 2005 Ann Neurol, 57(2):161-2), кортикобазальная дегенерация (Gerhard et al., 2004 Mov Disord, 19(10): 1221-6), прогрессирующий надъядерный паралич (Gerhard et al., 2006 Neurobiol Dis, 21(2): 404-12), множественная системная атрофия (Gerhard et al., 2003 Neurology, 61(5):686-9), болезнь Гентингтона (Pavese et al., 2006 Neurology, 66(11):1638-43; Tai et al., 2007 Brain Res Bui,; 72(2-3):148-51), амиотрофический боковой склероз (Turner et al., 2004 Neurobiol Dis, 15(3):601-9) и болезнь Альцгеймера (Cagnin et al., 2001 Lancet, 358(9283):766; Yasuno et al., 2008 Biol Psychiatry, 64(10):835-41).
Было показано, что с аномальной экспрессией PBR связан целый ряд ишемических состояний ЦНС, в том числе ишемический инсульт (Gerhard et al., 2005 Neuroimage, 24(2): 591-5), повреждение периферических нервов (Banati et al., 2001 Neuroreport, 12(16):3439-42), эпилепсия (Sauvageau, 2002 Metab Brain Dis, 17(1):3-11; Kumar et al., 2008 Pediatr Neurol, 38(6)). Считают, что PBR является биомаркером для определения степени повреждения при травме головного мозга (Toyama et al., 2008 Ann Nucl Med, 22(5):417-24), и сообщают об увеличении экспрессии PBR в животной модели травматического повреждения головного мозга (Venneti et al., 2007 Exp Neurol, 207(1): 118-27). Интересно, что острый стресс коррелируется с увеличением экспрессии PBR в головном мозге, тогда как хронический стресс коррелируется с понижающей регуляцией PBR (Lehmann et al., 1999 Brain Res, 851(1-2):141-7). Было сообщение о возможности определения формы и размеров глиомы с использованием [11С]PK11195 для визуализации PBR (Junck et al., 1989 Ann Neurol, 26(6):752-8). PBR могут быть также ассоциированы с невропатической болью; Tsuda et al наблюдали активированную микроглию у субъектов с невропатической болью (2005 TINS 28(2) рр101-7).
На периферии экспрессия PBR связана с воспалением легких (Branley et al., 2008 Nucl. Med. Biol, 35(8):901-9), хроническим обструктивным заболеванием легких и астмой (Jones et al., 2003 Eur Respir J, 21(4):567-73), воспалительным заболеванием кишечника (Ostuni et al., 2010 Inflamm Bowel Dis, 16(9):1476-1487), ревматоидным артритом (van der Laken et al., 2008 Arthritis Rheum, 58(11): 3350-5), первичной фибромиалгией (Faggioli et al., 2004 Rheumatology, 43(10):1224-1225), повреждением нерва (Durrenberger et al., 2004 J Peripher Nerv Syst, 9(1):15-25), атеросклерозом (Fujimura et al., 2008 Atherosclerosis, 201(1):108-111), раком ободочной кишки, предстательной железы и молочной железы (Deane et al., 2007 Mol Cancer Res, 5(4):341-9; Miettinen et al., 1995 Cancer Res, 55(12):2691-5; Han et al., 2003 J Recept Signal Transduct Res, 23(2-3): 225-38), воспалением почек (Tarn et al., 1999 Nephrol Dial Transplant, 14(7): 1658-66; Cook et al., 1999 Kidney Int, 55(4):1319-26) и ишемическим реперфузионным повреждением (Zhang et al., 2006 J Am Coll Surg, 203(3):353-64).
Визуализация методом позитронно-эмиссионной томографии (PET) с использованием селективного лиганда PBR, (R)-[11C]PK11195, предусматривает использование наиболее широко распространенного индикатора воспаления центральной нервной системы (ЦНС). Однако известно, что (R)-[11C]PK11195 обладает высокой степенью связывания белка и низкой специфичностью к неспецифическому связыванию. К тому же, роль его метаболитов, меченных радиоизотопом, неизвестна, и количественное определение связывания требует сложного моделирования. Поэтому были предприняты усилия по разработке агента визуализации для PBR in vivo, который не имеет этих проблем. Одним таким агентом визуализации in vivo является производное трициклического индола, описанное в WO 2010/109007, которое обладает хорошей аффинностью к PBR, превосходным поглощением в головном мозге и специфичностью в отношении PBR, и высокая доля радиоактивности присутствует в головном мозге через 60 минут после инъекции родительского агента визуализации in vivo. В WO 2010/109007 раскрыто, что особенно предпочтительным агентом визуализации in vivo является следующее 18F-меченое соединение:
Существуют возможности для дополнительного улучшения визуализирующего агента для визуализации PBR in vivo.
Краткое изложение сущности изобретения
Согласно настоящему изобретению предложен радиоиндикатор для PET, который сохраняет преимущественные свойства известного радиоиндикатора для PET на основе трициклического индола, а также обладает целым рядом улучшенных свойств. Было продемонстрировано, что по сравнению с известным трициклическим радиоиндикатором для PET радиоиндикатор для PET по изобретению обладает улучшенной аффинностью связывания с PBR, слегка улучшенным профилем метаболизма с высокой долей активности через 60 минут после инъекции, представляющей собой активность в головном мозге, и значительно улучшенной специфичностью связывания с PBR-экспрессирующими тканями. Согласно настоящему изобретению также предложено соединение-предшественник, полезное в получении радиоиндикатора для PET по изобретению, а также способы получения указанного соединения-предшественника и указанного радиоиндикатора для PET. Согласно настоящему изобретению также предложена радиофармацевтическая композиция, содержащая радиоиндикатор для PET по изобретению. Способы применения радиоиндикатора для PET и радиофармацевтической композиции также предложены.
Подробное описание изобретения
Радиоиндикатор для PET
В одном аспекте настоящего изобретения предложен радиоиндикатор для позитронно-эмиссионной томографии (PET), имеющий следующую химическую структуру:
,
где хиральный центр имеет (S) конфигурацию.
"Радиоиндикатор для PET" представляет собой химическое соединение, которое содержит позитрон-испускающий изотоп, причем данное химическое соединение предназначено для нацеливания на конкретную физиологию или патофизиологию в биологической системе. Присутствие позитрон-испускающего изотопа дает возможность детектировать радиоиндикатор для PET после введения в биологическую систему и тем самым способствовать обнаружению конкретной физиологии или патофизиологии.
Было показано, что радиоиндикатор для PET по изобретению обладает аффинностью, почти в 5 раз более высокой, чем аффинность его альтернативного энантиомера, и почти в два раза выше, чем аффинность рацемической смеси. Было также обнаружено, что радиоиндикатор для PET по изобретению лучше функционирует in vivo по сравнению с его альтернативным энантиомером. Радиоиндикатор для PET по изобретению также лучше функционирует in vivo по сравнению с рацемической смесью, содержащей указанный радиоиндикатор для PET и его альтернативный энантиомер.
Альтернативный энантиомер радиоиндикатора для PET по изобретению имеет следующую структуру:
,
где хиральный центр имеет (R) конфигурацию.
Используемый в настоящем изобретении термин "энантиомер" относится к энантиочистому соединению, т.е. к одной из двух зеркально противоположных форм оптически активной молекулы. Таким образом, энантиомер является соединением, имеющим только одну хиральность, где термин "хиральность" относится к такому свойству соединения, в силу которого он не имеет внутренней плоскости симметрии и не совмещается со своим зеркальным отражением. Признаком, который наиболее часто обусловливает хиральность в химических соединениях, является наличие асимметрического атома углерода. Эквимолярная смесь пары энантиомеров называется "рацематом" или "рацемической смесью".
В эксперименте по биораспределению, описанному в Примере 9, показано, что радиоиндикатор для PET по изобретению имеет улучшенное связывание с PBR-богатой тканью в головном мозге (т.е. в обонятельной луковице) по сравнению и с его альтернативным энантиомером и с рацемической смесью. Результаты эксперимента in vivo по блокированию, который описан в Примере 11, подтверждают эти данные. Результаты эксперимента, который описан в Примере 10, демонстрируют, что активность в головном мозге через 60 минут, обусловленная родительским соединением, улучшена в пользу радиоиндикатора для PET по изобретению по сравнению с рацемической смесью радиоиндикатора для PET и его альтернативного энантиомера. Более того, в эксперименте по авторадиографии, который описан в Примере 12, продемонстрировано, что радиоиндикатор для PET по изобретению в более высокой степени избирательно связывается с участками нейровоспаления по сравнению с рацемической смесью, содержащей указанный радиоиндикатор для PET и его альтернативный энантиомер. Было также установлено, что радиоиндикатор для PET по изобретению не подвергается рацемизации после инкубирования в плазме крови человека или во фракции S9 крысы в течение длительных периодов времени, как описано в Примере 8 ниже.
Соединение-предшественник
Радиоиндикатор для PET по изобретению может быть получен через подходящее соединение-предшественник. Поэтому в еще одном аспекте настоящего изобретения предложено соединение-предшественник для получения радиоиндикатора для PET по изобретению, где указанное соединение-предшественник представляет собой соединение формулы I:
,
где R1 представляет собой гидроксил или уходящую группу.
"Соединение-предшественник" содержит нерадиоактивное производное радиоиндикатора для PET по изобретению, рассчитанное на то, чтобы химическая реакция с удобной химической формой 18F происходила сайт-специфично, могла быть проведена в минимальное количество стадий (в идеале в одну стадию) и без необходимости в значительной очистке (в идеале без дополнительной очистки) с получением радиоиндикатора для PET по изобретению. Такие соединения-предшественники являются синтетическими и легко могут быть получены с хорошей химической чистотой.
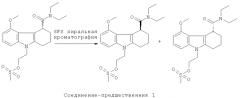
"Уходящая группа" в контексте настоящего изобретения относится к атому или группе атомов, который(ая) удаляется как стабильный вид радикала в ходе реакции радиофторирования с замещением или заменой. Примерами подходящих уходящих групп являются галогеновые группы хлоро, бромо и йодо и сульфонатные эфирные группы мезилат, тозилат нозилат и трифлат. Предпочтительно указанная уходящая группа выбрана из мезилата, тозилата и трифлата и наиболее предпочтительно представляет собой мезилат. В тех случаях, когда уходящая группа представляет собой мезилат, соединение-предшественник в данном описании называется "соединением-предшественником 1".
Получение соединения-предшественника
Соединение-предшественник по изобретению может быть получено различными путями, каждый из которых составляет отдельный аспект настоящего изобретения.
Соответственно согласно настоящему изобретению предложен первый способ получения соединения-предшественника формулы I, как оно определено в данном описании, включающий:
(1) приготовление рацемической смеси указанного соединения-предшественника формулы I, как оно определено в данном описании, и соединения формулы II:
,
где R2 такой, как определено выше для R1, и R1 и R2 одинаковые;
(2) отделение указанного соединения-предшественника формулы I от указанного соединения формулы II.
Стадию "отделения" указанного соединения-предшественника формулы I от указанного соединения формулы II проводят методом разделения энантиомеров. Подходящие методы разделения энантиомеров включают высокоэффективную жидкостную хроматографию (HPLC), сверхкритическую флюидную хроматографию (SFC), хроматографию в моделированном слое (SBC). Подробную оценку различных методов, которые могут быть использованы для разделения энантиомеров, можно найти в "Chiral Separation Techniques: a Practical Approach" (2007 Wiley; Subramanian, Ed.).
Схема 1
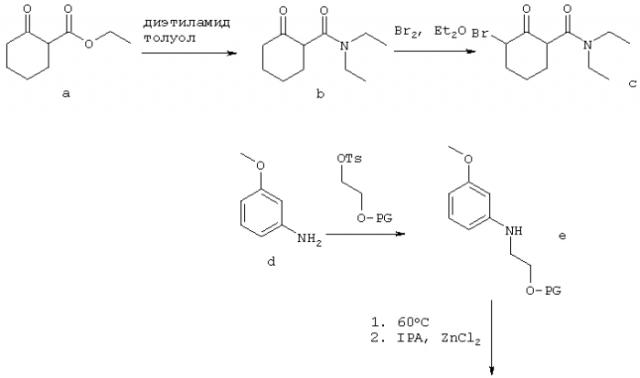
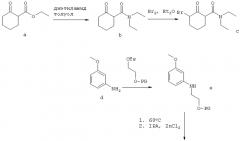
Схема 1, приведенная выше, иллюстрирует один способ получения рацемической смеси соединения-предшественника формулы I и соединения формулы II. На Схеме 1 PG означает защитную группу для гидроксильной группы; LG означает уходящую группу, как она определена в данном описании; OTs означает уходящую группу тозилат; и IPA означает изопропиловый спирт. Соединение g представляет собой соединение-предшественник по изобретению, где R1 представляет собой гидроксил. Подходящие защитные группы гидроксильной группы общеизвестны в данной области и включают ацетил, бензил, бензоил, силиловые эфиры, алкиловые эфиры и алкоксиметиловые эфиры. Защитные группы более подробно рассмотрены в Theorodora W. Greene and Peter G.M. Wuts, "Protective Groups in Organic Synthesis" (Fourth Edition, John Wiley & Sons, 2007). В контексте настоящего изобретения предпочтительной защитной группой для гидроксильной группы является бензил. Схема 1, приведенная выше, основана на способах получения сходных соединений, описанных в Napper et al., J Med Chem 2005, 48: 8045-54, и Davies et al., J Med Chem 1998, 41: 451-467.
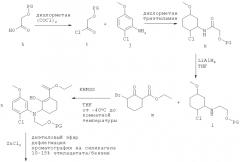
Схема 2
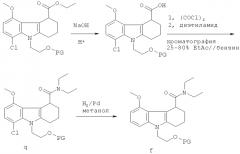
Схема 2 (продолжение)
Альтернативный способ получения рацемической смеси соединения-предшественника формулы I и соединения формулы II иллюстрируется на Схеме 2, приведенной выше. На Схеме 2 PG означает защитную группу для гидроксильной группы, как она определена выше, THF означает тетрагидрофуран, KHMDS означает бис(триметилсилил)амид калия. Начиная с соединения f, Схема 2 продолжается, как показано на Схеме 1, от соединения f до получения в результате рацемической смеси. Схема 2 основана на способе, раскрытом в WO 2003/014082. Согласно этому пути синтеза хлор в нижнем положении с левой стороны кольца заставляет протекать циклизацию только одним способом. Однако когда авторы настоящего изобретения напрямую применили методы из WO 2003/014082 для получения рацемической смеси соединения-предшественника формулы I и соединения формулы II, выход оказался низким. Эта проблема была решена путем замены системы растворителей, используемой для стадии циклизации. В WO 2003/014082 стадию циклизации проводят в толуоле, тогда как авторы настоящего изобретения обнаружили, что оптимальные выходы достигаются при использовании диэтилового эфира вместо толуола. Продукт стадии циклизации растворяется в диэтиловом эфире, а не подвергшееся циклизации исходное соединение не растворяется. Не подвергшееся циклизации исходное соединение поэтому остается вместе с ZnCl2 на дне реакционного сосуда, а циклизованный продукт перемещается в диэтиловый эфир в верхней части реакционного сосуда.
Второй способ получения соединения-предшественника формулы I включает:
(1) приготовление соединения формулы III:
,
где PG1 представляет собой защитную группу для гидроксильной группы;
(2) превращение указанного соединения формулы III в его соответствующий хлорангидрид;
(3) взаимодействие хлорангидрида, полученного на стадии (2), с диэтиламидом с получением соединения формулы IV:
,
где PG2 представляет собой защитную группу для гидроксильной группы и является такой же, как PG1;
(4) удаление защитной группы с соединения формулы IV, полученного на стадии (3), с получением гидроксильного производного;
(5) возможно присоединение уходящей группы, как она определена в данном описании.
Обе стадии (4) и (5), т.е. стадия (4), где R1 формулы I представляет собой гидроксил, и стадия (5), где R1 в формуле I представляет собой уходящую группу, приводят к образованию соединения-предшественника формулы I, как оно определено в данном описании.
Стадия (2) "превращения" указанного соединения формулы III в хлорангидрид может быть проведена с использованием реагента, выбранного из оксалилхлорида, тионилхлорида, трихлорида фосфора или пентахлорида фосфора. Оксалилхлорид является предпочтительным.
Стадия "удаления защитной группы" относится к удалению защитной группы для гидроксильной группы и может быть осуществлена способами, общеизвестными специалистам в данной области. Защитная группа PG1 для гидроксильной группы является такой, как определено выше для PG на Схеме 1. Используемый способ предназначен специально для конкретной защитной группы для гидроксильной группы. Типичные стратегии для удаления защитных групп для гидроксильной группы включают гидрогенолиз и обработку кислотой или основанием.
Стадия "присоединения" уходящей группы может быть осуществлена путем взаимодействия соединения g, указанного на приведенной выше Схеме 1, с галогенидным производным желаемой уходящей группы в подходящих реакционных условиях. Например, для присоединения мезилата соединение g, указанное на приведенной выше Схеме 1, может быть подвергнуто взаимодействию с метансульфонилхлоридом в присутствии основания, например аминного основания, такого кактриэтиламин.
На стадии (1) указанного второго способа получения соединения-предшественника формулы I соединение формулы III может быть приготовлено различными путями, например путем осуществления способа, включающего:
(а) приготовление рацемической смеси соединения формулы V и соединения формулы VI:
где:
R1 представляет собой хиральный спирт; и
PG3 и PG4 одинаковые, и каждая представляет собой защитную группу для гидроксильной группы;
(б) отделение соединения формулы V от соединения формулы VI;
(в) удаление R1 из отделенного соединения формулы V в кислотных условиях с получением указанного соединения формулы III.
Определение термина "рацемическая смесь" приведено в данном описании выше. Термин "хиральный спирт" относится к энантиомеру оптически активного спирта, и определение термина "энантиомер" приведено в данном описании выше. Термин "спирт" относится к органическому соединению, которое содержит гидроксильную группу, присоединенную к атому углерода. Предпочтительными хиральными спиртами для использования в описанном выше способе являются ментол и борнеол.
Хиральный спирт отщепляют от отделенного соединения формулы V кислотным гидролизом. Подходящие кислоты для использования на этой стадии включают соляную кислоту или серную кислоту, предпочтительно 2-молярную соляную кислоту или 1-молярную серную кислоту.
В альтернативном аспекте соединение формулы III может быть приготовлено с использованием способа, включающего:
(а) приготовление рацемической смеси указанного соединения формулы III и соединения формулы VIII:
,
где PG5 представляет собой защитную группу для гидроксильной группы и является такой же, как PG1, которая определена выше для соединения формулы III;
(б) взаимодействие смеси, которая определена в стадии (а), с оптически активным амином для отделения указанного соединения формулы III от указанного соединения формулы VIII.
Рацемическая смесь указанного соединения формулы III и указанного соединения формулы VIII может быть получена согласно способу, проиллюстрированному на Схеме 2 выше, где желаемая рацемическая смесь представляет собой соединение р, которое там проиллюстрировано.
Подходящий оптически активный амин для использования в описанном выше способе может быть выбран из S-альфа-метилбензиламина, R-(+)-N-(1- нафтилметил)-альфа-бензиламина, N-(2-гидрокси)этил-альфа-метилбензиламина и 1-(пара-толил)-этиламина. Другие оптически активные амины, подходящие для использования в описанном выше способе, легкодоступны из коммерческих источников, например от химической компании Aldrich.
В результате осуществления стадии (б) взаимодействия смеси со стадии (а) с оптически активным амином для отделения указанного соединения формулы III от указанного соединения формулы IV вначале образуются две диастереоизомерные соли. Эти диастереоизомерные соли разделяют путем кристаллизации из подходящего растворителя, такого как ацетон или этилацетат.Разделенные соли обрабатывают минеральной кислотой, такой как 2 н. соляная кислота или 1М серная кислота, для восстановления указанного соединения формулы III, отделенного от указанного энантиомера формулы VIII. Соединение формулы III затем выделяют экстракцией в этилацетат, отделяют от водного слоя и концентрируют в вакууме с получением энантиомера формулы III.
В еще одном варианте соединение формулы III может быть получено способом, включающим:
(а) приготовление рацемической смеси соединения формулы IX и соединения формулы X:
,
где PG6 и PG7 одинаковые, и каждая представляет собой защитную группу для гидроксильной группы;
(б) взаимодействие смеси, которая определена в стадии (а), со стереоселективным ферментом с получением указанного соединения формулы III, где указанный стереоселективный фермент осуществляет гидролиз соединения формулы IX с расщеплением сложноэфирной связи.
Рацемическая смесь указанного соединения формулы IX и указанного соединения формулы X может быть получена способом, проиллюстрированным на Схеме 2, где желаемая рацемическая смесь представляет собой соединение о, которое там изображено.
Подходящий стереоселективный фермент для использования в описанном выше способе может быть выбран из липазы В Candida antarctica, эстеразы свиной печени, липазы свиной поджелудочной железы или других известных стереоселективных ферментов, которые действуют подобным образом.
Получение радиоиндикатора для PET
В следующем аспекте настоящего изобретения предложен способ получения радиоиндикатора для PET по изобретению, включающий взаимодействие соединения-предшественника формулы I с подходящим источником 18F. Реакция с 18F может быть осуществлена путем нуклеофильного замещения уходящей группы, присутствующей в положении R1 соединения-предшественника формулы I. Введение метки в соединение-предшественник может быть осуществлено в одну стадию в результате взаимодействия с подходящим источником [18F]-фторид-иона (18F-), который обычно получают в виде водного раствора, образующегося в результате ядерной реакции 18O(p,n)18F, и активируют путем добавления катионного противоиона и последующего удаления воды. Подходящие катионные противоионы должны иметь достаточную растворимость в безводном реакционном растворителе для поддержания растворимости 18F- . Поэтому противоионы, которые были использованы, включают большие, но мягкие ионы металлов, таких как рубидий и цезий, калия в виде комплекса с криптандом, таким как Kryptofix™, или тетраалкиламмониевые соли.
Предпочтительным противоионом является калий в виде комплекса с криптандом, таким как Kryptofix™, ввиду его хорошей растворимости в безводных растворителях и повышенной реакционной способности в отношении 18F-. 18F может быть также введен путем О-алкилирования гидроксильной группы в положении R1 в соединении-предшественнике соединением 18F(CH2)3-LG, где LG представляет собой уходящую группу, как она определена выше.
Более подробное обсуждение общеизвестных методов 18F-мечения можно найти в Главе 6 справочника "Handbook of Radiopharmaceuticals" (2003; John Wiley and Sons: M.J. Welch and C.S. Redvanly, Eds.).
В предпочтительном воплощении способ получения радиоиндикатора для PET по изобретению является автоматизированным. [18F]-радиоактивные индикаторы легко могут быть получены в автоматическом режиме при помощи автоматизированного аппарата для синтеза радиоактивных веществ. Есть несколько примеров таких аппаратов, которые коммерчески доступны, в том числе TRACERlab™ и FASTlab™ (оба коммерчески доступны от отделения GE Healthcare компании General Electric Company). Такой аппарат обычно содержит "кассету", часто одноразовую, в которой осуществляется радиохимический процесс, которая сопряжена с аппаратом для синтеза радиоактивных веществ. Кассета обычно включает в себя магистрали для текучей среды, реакционный сосуд и каналы для установки виал с реагентами, а также любые картриджи для твердофазной экстракции, используемые на стадиях очистки после синтеза радиоактивного вещества.
Таким образом, в другом аспекте настоящего изобретения предложена кассета для автоматизированного синтеза радиоиндикатора для PET, как он определен в данном описании, содержащая:
1) сосуд, содержащий соединение-предшественник формулы I, как он определен в данном описании; и
2) средства для элюирования сосуда стадии (1) подходящим источником 18F, как он определен в данном описании.
Для кассеты по изобретению подходящие и предпочтительные воплощения соединения-предшественника формулы I и подходящего источника 18F являются такими, как определено в данном описании выше.
Кассета дополнительно может содержать:
3) ионообменный картридж для удаления избытка 1SF.
Радиофармацевтическая композиция
В еще одном аспекте настоящего изобретения предложена радиофармацевтическая композиция, содержащая радиоиндикатор для PET, как он определен в данном описании, вместе с биосовместимым носителем, подходящим для введения млекопитающим.
"Биосовместимый носитель" представляет собой текучую среду, в частности жидкость, в которой радиоиндикатор для PET по изобретению суспендируют или растворяют, чтобы радиофармацевтическая композиция была физиологически переносимой, например чтобы ее можно было вводить в организм млекопитающего без токсического эффекта или чрезмерного дискомфорта. Биосовместимый носитель представляет собой соответственно инъецируемый носитель-жидкость, такой как стерильная, апирогенная вода для инъекций; водный раствор, такой как физиологический раствор (который предпочтительно может быть сбалансирован таким образом, чтобы конечный продукт для инъекций был либо изотоническим, либо негипотоническим); водный раствор одного или более регулирующих тоничность веществ (например, солей катионов плазмы с биосовместимыми противоионами), сахара (например, глюкозу или сахарозу), сахарные спирты (например, сорбит или маннит), гликоли (например, глицерин) или неионные полиолы (например, полиэтиленгликоли, пропиленгликоли и тому подобное). Биосовместимый носитель может также содержать биосовместимые органические растворители, такие как этанол. Такие органические растворители полезны для солюбилизации более липофильных соединений или композиций. Предпочтительно биосовместимый носитель представляет собой апирогенную воду для инъекций, изотонический физиологический раствор или водно-этанольный раствор. Подходящее значение рН биосовместимого носителя для внутривенных инъекций составляет от 4,0 до 10,5.
Радиофармацевтическую композицию можно вводить парентерально, т.е. инъекцией, и наиболее предпочтительно в виде водного раствора. Такая композиция возможно может содержать дополнительные ингредиенты, такие как буферные агенты; фармацевтически приемлемые солюбилизаторы (например, циклодекстрины или поверхностно-активные вещества, такие как Pluronic, Tween или фосфолипиды); фармацевтически приемлемые стабилизаторы или антиоксиданты (такие как этанол, аскорбиновая кислота, гентизиновая кислота или лара-аминобензойная кислота). В тех случаях, когда радиоиндикатор для PET по изобретению предоставляют в виде радиофармацевтической композиции, способ получения указанного радиоиндикатора для PET может дополнительно включать стадии, необходимые для получения радиофармацевтической композиции, например удаление органического растворителя, добавление биосовместимого буферного агента и любых возможных дополнительных ингредиентов. Для парентерального введения также необходимы стадии, обеспечивающие стерильность и апирогенность радиофармацевтической композиции. Такие стадии общеизвестны специалистам в данной области.
Способ визуализации методом PET
Радиоиндикатор для PET по изобретению полезен для детектирования in vivo экспрессии рецепторов PBR у субъекта. Поэтому в другом аспекте настоящего изобретения предложен способ визуализации методом PET для определения распределения и/или степени экспрессии PBR у субъекта, включающий:
1) введение указанному субъекту радиоиндикатора для PET, как он определен в данном описании;
2) предоставление возможности указанному радиоактивному индикатору для PET связаться с PBR у указанного субъекта;
3) детектирование сигналов, испускаемых 18F, который содержится в указанном связанном радиоиндикаторе для PET;
4) формирование изображения, отображающего локализацию и/или количество указанных сигналов; и
5) определение распределения и степени экспрессии PBR у указанного субъекта, где указанная экспрессия находится в прямой корреляции с указанными сигналами.
Стадию "введения" радиоиндикатора для PET предпочтительно проводят парентерально и наиболее предпочтительно внутривенно. Внутривенный путь введения является наиболее эффективным путем доставки радиоиндикатора для PET по всему организму субъекта и, следовательно, также через гематоэнцефалический барьер (ВВВ) и в контакт с PBR, экспрессированными в центральной нервной системе (ЦНС) указанного субъекта. Внутривенное введение не является существенным физическим вмешательством и не подвергает здоровье субъекта существенному риску. Радиоиндикатор для PET по изобретению предпочтительно вводят в виде радиофармацевтической композиции по изобретению, как она определена в данном документе. Стадия введения не является необходимой для полного определения способа визуализации методом PET по изобретению. Как таковой, способ визуализации методом PET по изобретению можно также рассматривать, как включающий определенные выше стадии (2)-(5), где указанный субъект стадии (2) является субъектом, которому предварительно был введен радиоиндикатор для PET по изобретению.
После стадии введения и перед стадией детектирования радиоиндикатору для PET предоставляют возможность связаться с PBR. Например, когда субъектом является интактное млекопитающее, радиоиндикатор для PET будет динамично продвигаться через организм млекопитающего, вступая в контакт с различными тканями в нем. Как только радиоиндикатор для PET вступает в контакт с PBR, происходит специфическое взаимодействие, так что клиренс радиоиндикатора для PET из ткани с PBR занимает больше времени, чем из ткани без PBR или с меньшим количеством PBR. Будет достигаться некоторая точка во времени, когда появляется возможность детектировать радиоиндикатор для PET, специфически связанный с PBR, как результат соотношения между радиоиндикатором для PET, связавшимся с PBR, и индикатором, который связался в ткани без PBR или в ткани с меньшим количеством PBR.
Стадия "детектирования" способа по изобретению включает детектирование сигналов, испускаемых 18F, который содержится в радиоиндикаторе для PET, с помощью детектора, чувствительного к указанным сигналам, т.е. РЕТ-камеры. Эту стадию детектирования можно также рассматривать как получение параметров сигналов.
Стадию "формирования" способа по изобретению проводят с помощью компьютера, который применяет алгоритм преобразования к полученным параметрам сигналов с получением набора данных. Этот набор данных затем обрабатывается для формирования изображений, показывающих локализацию и/или количество сигналов, испускаемых 18F. Испускаемые сигналы находятся в прямой корреляции с экспрессией PBR, так что стадия "определения" может быть выполнена путем оценки сформированного изображения.
"Субъектом" по изобретению может быть любой субъект-человек или субъект-животное. Предпочтительно субъектом по изобретению является млекопитающее. Наиболее предпочтительно указанный субъект представляет собой интактный организм млекопитающего in vivo. В особенно предпочтительном воплощении субъектом по изобретению является человек. Способ визуализации in vivo может быть использован для исследования PBR у здоровых субъектов или у субъектов, у которых, как известно или предполагается, имеется патологическое состояние, ассоциированное с аномальной экспрессией PBR (здесь далее "PBR-ассоциированное состояние"). Предпочтительно, указанный способ относится к визуализации in vivo субъекта, который, как известно или предполагается, имеет PBR-ассоциированное состояние и, следовательно, применим в способе диагностики указанного состояния.
Примеры таких PBR-ассоциированных состояний, когда может быть использована визуализация in vivo, включают рассеянный склероз, энцефалит Расмуссена, церебральный васкулит, герпетический энцефалит, СПИД-ассоциированную деменцию, болезнь Паркинсона, кортикобазальную дегенерацию, прогрессирующий надъядерный паралич, множественную системную атрофию, болезнь Гентингтона, амиотрофический боковой склероз, болезнь Альцгеймера, ишемический инсульт, повреждение периферического нерва, эпилепсию, травматическое повреждение головного мозга, острый стресс, хронический стресс, невропатическую боль, воспаление легких, хроническое обструктивное заболевание легких, астму, воспалительное заболевание кишечника, ревматоидный артрит, первичную фибромиалгию, повреждение нерва, атеросклероз, воспаление почек, ишемическое реперфузионное повреждение и рак, в частности рак ободочной кишки, предстательной железы или молочной железы. Радиоиндикатор для PET по изобретению благодаря его хорошему всасыванию в головном мозге пригоден, в частности, для визуализации ЦНС in vivo.
В альтернативном воплощении способ визуализации методом PET по изобретению можно проводить неоднократно во время осуществления схемы лечения указанного субъекта, причем указанная схема включает введение лекарственного средства для противодействия PBR-ассоциированному состоянию. Например, способ визуализации методом PET по изобретению можно проводить до, во время и после лечения лекарственным средством для противодействия PBR-ассоциированному состоянию. Таким способом эффект указанного лечения можно отслеживать во времени. PET особенно хорошо подходит для такого применения, поскольку этот метод имеет превосходные чувствительность и разрешение, так что даже относительно небольшие изменения в поражении можно наблюдать во времени, что особенно предпочтительно для мониторинга лечения.
В дополнительном аспекте настоящего изобретения предложен способ диагностики состояния, при котором имеет место повышающая регуляция PBR, включающий способ визуализ