Способ получения водорода
Иллюстрации
Показать всеИзобретение относится к способу получения водорода низкого давления для последующего сжигания и получения водяного пара с помощью низковольтного электролиза щелочного электролита раствора солей галогенводородных кислот и их смесей постоянным током, с помощью алюминиевых электродов, с дальнейшим извлечением кислорода в отдельный накопитель из образовавшихся алюминиевых комплексов, с поддержанием состава электролита и контролем температуры и давления в электрохимической ячейке. Использование настоящего способа позволяет снизить опасность при проведении процесса за счет того, что кислород, образующийся в результате реакции, связывается в комплексы и может быть затем утилизирован. 3 ил.
Реферат
Область техники
Заявленное изобретение относится к электрическим способам получения водорода для последующего его сжигания с образованием тепла и может быть использовано в теплоэнергетике, а также в других отраслях промышленности.
Уровень техники
Водород является одним из наиболее легкодоступных и широко распространенных материалов, но он, в основном, находится в виде соединений и больше всего его - в воде. Сегодня технологии, связанные с водородом, в частности производство отопительных систем, интенсивно развиваются. При использовании водорода в качестве источника тепла отпадет необходимость в ископаемых ресурсах. Использование водорода для отопления одновременно решает и проблему загрязнения окружающей среды. Вполне возможно, что этот революционный энергоноситель, чистый и существующий практически в неограниченном количестве, вместе с возобновляемыми природными энергоресурсами в самом ближайшем будущем освободят общество от постоянной добычи ископаемых видов топлива. Это безусловно благоприятно скажется на окружающей среде, климате, а также на экологической ситуации в мире. Таким образом, получение водорода в качестве источника тепла является перспективным направлением в настоящее время.
Известно множество способов получения водорода, в том числе и электрохимические. Из патента США №3703358, опубл. 13.12.1972, известен способ получения водорода электролизом растворов электролитов с использованием растворимых электродов. В качестве растворимого электрода применяют анод из магния или магниевых сплавов, электролиз проводят постоянным током. Недостатками этого способа является использование дорогих и дефицитных анодов из магния, а также сложность технологической схемы.
Из патента РФ №2089670, опубл. 10.09.1997, известен способ получения водорода электролизом водного раствора переменным током с использованием в качестве анода и катода алюминия и его сплавов, при этом процесс ведут при давлениях водорода 0,1-5,0 МПа. Недостатком данного способа является тот факт, что водород получают при низких давлениях и для его транспортировки или наполнения емкостей необходимо наличие в системе компрессорной установки, что увеличивает энергозатраты и усложняет конструкцию.
Также известны способы получения водорода из воды путем реакции расщепления воды (патент США №6440385, опубл. 27.08.2002, и патент США №6582676, опубл. 24.06.2003). В этих патентах алюминий был использован для получения водорода из воды, но указанные способы недостаточно эффективны.
Есть большое количество патентов для генерации водорода из воды с использованием металлического алюминия в качестве основного расходуемого компонента. Однако большинство из них связаны с использованием других химических веществ (активаторов) в воде, которые реагируют с алюминием, чтобы генерировать водород.
Однако в предшествующем уровне техники все методы имеют некоторые недостатки, такие как использование экологически неблагоприятных химических веществ, высокая стоимость, невозможность контролировать скорость выработки водорода, повышенная опасность и т.д.
Наиболее близкой по технической сущности является система для генерации газообразного водорода, описанная в патенте США №20060249393, опубл. 09.11.2006. Изобретение описывает систему для генерации газообразного водорода в водном растворе на основе электролитического или гальванического элемента, в котором катод выполнен из алюминия или алюминиевого сплава. Недостатком данного способа является относительно невысокий выход водорода, повышенная опасность проведения процесса за счет выделения больших количеств свободного кислорода, повышенные энергетические затраты.
Раскрытие изобретения
Таким образом, целью настоящего изобретения является устранение недостатков известного уровня техники, в частности создание контролируемого (т.е. по требованию) способа получения водорода электролизом, который характеризуется высоким выходом водорода, пониженной опасностью при проведении процесса, снижением энергетических затрат, простотой выполнения, а также расширение ассортимента средств для получения водорода.
Цель настоящего изобретения достигается за счет способа получения водорода низкого давления для последующего сжигания и получения водяного пара с помощью низковольтного электролиза щелочного электролита раствора солей галогенводородных кислот и их смесей постоянным током, с помощью алюминиевых электродов, с дальнейшим извлечением кислорода в отдельный накопитель из образовавшихся алюминиевых комплексов, с поддержанием состава электролита и контролем температуры и давления в электрохимической ячейке.
Техническим результатом при осуществлении способа является повышение выхода водорода за счет использования других электролитов, которые позволяют получать растворимые комплексы на основе Al, понижение опасности при проведении процесса за счет того, что кислород, образующийся в результате реакции в больших количествах, связывается в комплексы, снижение энергетических затрат, поскольку протекает низковольтный электролиз, простота выполнения, а также расширение ассортимента средств для получения водорода. Впоследствии связанный кислород может быть извлечен из комплексов и направлен на утилизацию.
В заявленном техническом решении под низковольтным электролизом понимается электролиз, протекающий при потенциале от 1,358 В до 12 В. Под водородом низкого давления понимается водород с давлением от 100 мм водяного столба до давления, не превышающего 1 атмосферу.
Краткое описание чертежей
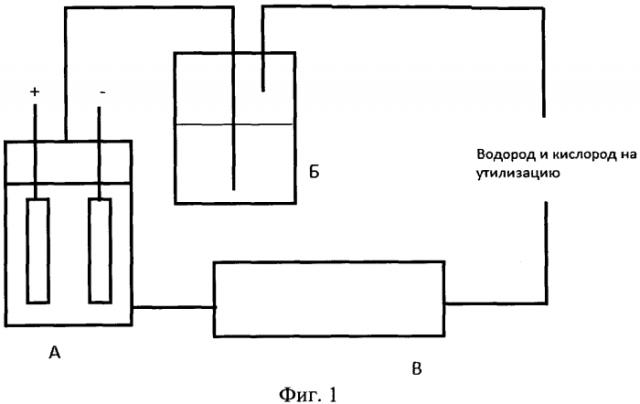
На фиг.1 изображена общая схема устройства для получения водорода.
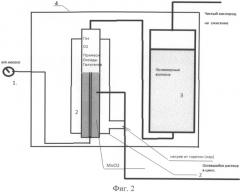
На фиг.2 изображена конструкция емкости В.
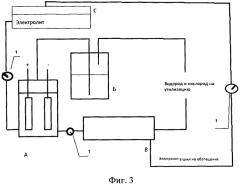
На фиг.3 изображен другой вариант схемы устройства для получения водорода, содержащей емкость С.
Пример осуществления изобретения
На алюминиевые электроды, расположенные в емкости А, которая собственно и представляет собой электрохимическую ячейку, подается потенциал ~4,5 В, в емкости А находится (поступает из внешней емкости) электролит (рН 11), состоящий из щелочного раствора солей галогенводородных кислот, предпочтительно из смеси 1 М растворов NH4Cl и NaCl, доведенных NaOH до pH 11. Также могут быть использованы другие соли других галогенводородных кислот. Выделившийся водород поступает в емкость Б (водяной затвор) во избежание воспламенения полученного водорода. Из емкости Б водород поступает на сжигание.
Одновременно из емкости А в емкость В с помощью насоса (1) поступают полученные в результате реакции растворимые комплексы алюминия для нагревания на катализаторе (около 200°C) и отделения растворенного кислорода (в виде газа), который в свою очередь направляется в отдельный накопитель и затем на утилизацию. Таким образом, в результате реакции образуется водород с давлением 100-300 мм вод.ст., с температурой, близкой к температуре окружающей среды (предусмотрено дополнительное нагревание ячейки, но не выше Т=35°C).
Катализатор в емкости В может представлять собой любой подходящий катализатор, способный разлагать алюминиевые комплексы, например, MnO2. Следует отметить, что без катализатора температура разложения алюминиевых комплексов составляет около 480°C, на катализаторе температура разложения намного меньше.
Завершающей частью является горелка (на чертеже не показана), т.е. устройство утилизации (сжигания) водорода для получения тепла или электрохимическая ячейка для получения электрического тока.
Водород из емкости А поступает в горелку через водяной затвор (емкость Б), шланги внутри снабжены защитной сеткой для безопасности (рассечения ударной волны по принципу дифракционной решетки) и с помощью извлеченного в емкости В кислорода сгорает, образуя водяной пар определенной температуры, который направляется на утилизацию.
Емкость В содержит и фильтр-отсекатель (4) для поддержания состава электролита и извлечения кислорода из указанных комплексов (фиг.2).
Фильтр-отсекатель (4) содержит нагреватель (2) и отсекатель (3). В отсекателе (3) предусмотрены поглотители на основе полимерных волокон для хемсорбции оксидов галогенов. Оксиды хлора (брома и т.д.) выделяются при термической деструкции комплексов в фильтре на MnO2 или оксидах некоторых других металлов. Поглотители применяются для доочистки кислорода, выделяющегося при термической деструкции, образовавшихся алюминиевых комплексов.
Принцип работы следующий: в фильтр-отсекатель (4) посредством насоса (1) (преимущественно перистальтического) перекачивается электролит, обогащенный вышеуказанным алюминиевыми комплексами, нагревается нагревателем (2), в результате термического разложения освобождается кислород (в виде газа), содержащий некоторое количество примесей. Во избежание попадания оксидов галогенов в область горения, а затем в воздух примеси улавливаются отсекателем (3), состоящим из оболочки, заполненной полимерными волокнами, с которыми вступают в необратимую химическую реакцию, в результате чего в горелку на утилизацию (сжигание) поступает кислород, освобожденный от алюминиевых комплексов, без опасных примесей.
Оставшаяся окись алюминия Al2O3, нерастворима в воде и указанных электролитах и остается в фильтре до очистки. Электролиты, оставшиеся после нагревания и охлаждения, поступают в емкость (С) (см. фиг.3) с обогащенным электролитом, где по плотности раствора (ареометром) поддерживается заданная концентрация электролита и pH-метром заданная указанная выше pH. Характеристики электролита поддерживаются либо вручную в емкости С, либо применяется простая автоматизация (на основе кондуктометрического метода).
Контроль давления для безопасности представляет собой пробку с отверстием внутри, через которую герметично пропущен электрический провод от источника тока, в случае хлопка, указанная пробка вылетает наружу, выпуская пар, так как давление значительно возрастает и разрывает электрическую цепь, прекращая выделение водорода и все химические реакции.
Контроль температуры в ячейке, во избежание взрыва, осуществляется термопарой, при нагревании которой выше заданных параметров, электромагнитное реле разрывает электрическую цепь, подача электричества прекращается, вместе с этим прекращаются химические реакции в электрохимической ячейке.
Следует отметить, что во всех вышеуказанных работах не учтена возможность комплексообразования солей Al, в результате чего появляется возможность значительного увеличения количественного выхода генерируемого по требованию водорода, а также в описанных работах в качестве электролита используются не самые оптимальные смеси солей галогенводородных кислот.
В результате использования традиционных растворов KCL, NaCl, KOH, NaOH, алюминий приходит к виду, описываемому реакцией
2Al+4Н2О→2A1OOH+3Н2. (1)
В данной работе предлагается использование смесей солей галогенводородных кислот, например NH4Cl и NaCl, в щелочной среде NaOH, в результате чего в растворе образуются растворимые комплексы вида: (NH4)2[Al(ClO4)5], а также (NH4)3[Al(ClO4)6], по уравнению реакции
6NH4Cl+11NaCl+NaOH+13Al+87H2O→Na2[Al(ClO4)5]+2(NH4)3[Al(ClO4)6]+10NaAlO2+87H2↑. (2)
Анод и катод изготавливаются из алюминия, электрическая схема предусматривает равномерное расходование анода и катода посредством переключения электрического потенциала. Водород получают по мере надобности (т.е. по требованию), а в остальное время в электрохимической ячейке, отключенной от источника постоянного электричества, находятся щелочной раствор и алюминиевые электроды, которые практически не реагируют друг с другом.
Процессы, происходящие на электродах:
на катоде:
оставшиеся в растворе ионы натрия Na+образуют с ионами ОН- раствор гидроксида натрия ОН-+Na+→NaOH;
на аноде:
происходит образование хлора по реакции
и дальнейшее его окисление кислородом до вида лиганд ClO4 -
φO2(ОН-)=+0,82 V; φCl2=+1,32 V.
Таким образом, на каждый израсходованный кг-моль Al выделяется 20-24 кг-молей водорода, что является крайне существенным количеством, если учесть, что при сжигании 1 кг водорода выделяется 285 МДж тепла, что почти в 5 раз больше, чем при сжигании 1 кг метана. Образовавшиеся в результате реакции комплексы Na2[Al(ClO4)5], (NH4)3[Al(ClO4)6] могут быть подвержены термическому разложению с целью выделения кислорода для сжигания полученного водорода, только после этого образуется соединение вида AlOOH (или Al2O3), которое так же, как и в вышеуказанных случаях, может быть направлено на заводскую переработку.
Способ получения водорода низкого давления для последующего сжигания и получения водяного пара с помощью низковольтного электролиза щелочного электролита раствора солей галогенводородных кислот и их смесей постоянным током, с помощью алюминиевых электродов, с дальнейшим извлечением кислорода в отдельный накопитель из образовавшихся алюминиевых комплексов, с поддержанием состава электролита и контролем температуры и давления в электрохимической ячейке.