Способы, поверхностно-модифицированные носители и композиции для иммобилизации, культивирования и открепления клеток
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Описан способ закрепления плюрипотентных стволовых клеток человека на плоском носителе. Способ предусматривает получение суспензии плюрипотентных стволовых клеток и добавление к суспензии соединения, способного ингибировать активность Rho-киназы. Изобретение может быть использовано в медицине. 7 з.п.ф-лы, 46 ил., 14 табл., 26 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящая заявка притязает на приоритет по предварительной заявке за номером 61/030544, поданной 21 февраля 2008 года.
Настоящее изобретение относится к области культивирования клеток млекопитающих и описывает способы и композиции для иммобилизации клеток и культивирования клеток на поверхности твердой подложки, а также открепления клеток от нее, причем данная поверхность подложки содержит от по меньшей мере 0,5% N с суммарным содержанием O и N выше или равно 17,2% и с углом смачивания по меньшей мере приблизительно 13,9 градуса, и не имеет слоя питающих клеток и адгезивного слоя. В одном из осуществлений настоящего изобретения культивируемые клетки обрабатывают соединением, способным ингибировать активность Rho-киназы. В другом осуществлении клетки обрабатывают соединением, способным ингибировать активность Rho.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Культивирование клеток млекопитающих является одним из многих процессов в медико-биологических науках. Для культивирования и анализа опорнозависимых клеток млекопитающих часто используют сосуды из стекла или пластика, например, полистирола, что нередко требует дополнительной обработки поверхности, обеспечивающей закрепление клеток на поверхности сосуда. Подобная обработка может включать нанесение на поверхности адгезивного слоя, например, путем адсорбции, плазмостимулированной полимеризации или привитой сополимеризации. Альтернативно, обработка поверхности может заключаться в химической модификации самой поверхности сосуда, что может быть достигнуто обработкой с использованием коронного разряда в атмосфере, радиочастотной плазменной обработки в вакууме, тлеющего разряда постоянного тока и микроволновой плазменной обработки. Такая обработка приводит к изменению элементного и химического состава поверхности. Протекающие при этом определенные химические процессы зависят от выбранного способа обработки поверхности, энергии и продолжительности обработки, а также газового состава среды, в которой проводится обработка.
Например, в заявке на патент US5449383 описывается подложка из массивного полимерного материала; и тонкого полимерного слоя, способного поддерживать рост клеток, представляющего собой реориентационно-устойчивый полимер, который состоит из полимеризованных в плазме амидных мономеров, предоставляющих свои амидные группы для иммобилизации клеток. При этом указанный амидный мономер выбирают из группы, включающей диметилформамид и амиды с формулой R1-CO-N(R2)R3, где R1 - алифатическая, алициклическая или ароматическая группа, каждая из которых может дополнительно нести в качестве заместителей атомы галогена или гидроксильные группы, а R2 и R3 независимо выбирают из атома водорода или алкильной группы, и указанный тонкий полимерный слой способствует закреплению и пролиферации указанных клеток.
В другом примере, в заявке на патент EP0348969A1 описан способ эндотелиализации полимерной поверхности, который заключается в приведении поверхности полимера в контакт с плазмой, образующейся из азотсодержащего газообразного материала, в результате чего указанная полимерная поверхность модифицируется с появлением поверхностных аминогрупп; затем на указанную модифицированную поверхность наносятся эндотелиальные клетки в количестве, достаточном для образования конфлюэнтного слоя клеток на указанной поверхности, содержащей аминогруппы, причем пролиферация клеток необязательна.
В другом примере, в заявке на патент EP0092302A2 описан способ влияния на рост клеточной культуры в ростовой среде на подложке, которая характеризуется тем, что химическая структура поверхности подложки модифицируется путем обработки поверхности подложки плазмой, образующейся из углерода, водорода, кислорода, азота, серы, фосфора, одного из галогенов, либо соединения любых из перечисленных элементов.
В другом примере, в заявке на патент US 6617152B2 описано устройство для обработки поверхности полимерной подложки, состоящей из следующих компонентов: (а) система подачи газа, микроволновой источник энергии и смесительная камера для подготовки плазменной смеси, причем смесительная камера имеет газовый контакт как с системой подачи газа, так и с микроволновым источником энергии; (b) двухкамерная рабочая область для проведения обработки поверхности, состоящая из внутренней рабочей камеры, находящейся внутри внешней рабочей камеры, причем в указанной внутренней рабочей камере имеется отверстие, обеспечивающее газовый контакт с указанной внешней камерой; (c) указанная смесительная камера для подготовки плазменной смеси через апертуру приводится в газовый контакт с указанной внешней рабочей камерой; (d) система подключения к вакуумной линии, соединенная с указанной внешней камерой; и (e) где указанное отверстие в указанной внутренней рабочей камере ориентировано соосно с указанной апертурой, причем указанное отверстие находится от указанной апертуры на заранее определенном расстоянии.
В одном примере, в заявке на патент US2003/0180903A1 описана полимерная подложка с рабочей поверхностью для культивирования клеток, причем, по данным электронной микроскопии, содержание поверхностного кислорода составляет по меньшей мере 25% для химического анализа на глубине приблизительно 50 Ангстрем.
В одном примере, в заявке на патент WO2006114098 описан микроструктурированный биосовместимый материал для хирургических имплантов и поверхностей тканевых культур, направляющих клетки. Микроструктуру поверхности биоматериала выбирают для стимулирования роста недифференцированных эмбриональных стволовых клеток; стимулирования нейрональной дифференцировки эмбриональных стволовых клеток; или стимулирования дифференцировки эмбриональных стволовых клеток.
В другом примере, в работе Bigdeli et al. (J. Biotechnol. 133:146-153, 2008), описан способ адаптации и/или отбора эмбриональных стволовых клеток человека для культивирования без дифференцировки в условиях отсутствия питающих клеток и без предварительной обработки поверхности твердой подложки белком внеклеточного матрикса. Описанный способ включает следующие этапы: (i) замена культуральной среды, кондиционируемой диплоидными эмбриональными фибробластами из легкого человека, на среду, кондиционируемую неонатальными хондроцитами; (ii) затем ферментативное пассирование клеток с питательного слоя мышиных эмбриональных клеток на обработанные препаратом MatrigelTM носители, затем на носители CostarTM, и, наконец, на носители PrimariaTM; и (iii) снова возврат к первоначально использовавшейся среде. Лишь очень немногие из обработанных таким образом эмбриональных стволовых клеток человека породили устойчивые клеточные линии, что указывает на то, что описанный способ включает отбор эмбриональных стволовых клеток человека по условиям культивирования.
Способы обработки поверхности, которые изменяют элементный и химический состав самой поверхности, успешно применялись для подготовки твердых полимерных подложек для культивирования многих типов клеток млекопитающих. Однако имеются существенные ограничения в отношении неудовлетворительной иммобилизации и/или культивирования при использовании определенных типов клеток млекопитающих, например, плюрипотентных стволовых клеток или клеток мезонефроса человека HEK293.
В работе Graham et al., (J. Gen. Virol. 36:59-72, 1977) описывается происхождение линии клеток HEK293.
Эффективность закрепления клеток линии HEK293 может быть повышена путем нанесения на поверхность твердой подложки адгезивного слоя с помощью, например, белков внеклеточного матрикса, полилизина, полиорнитина или полиэтиленимина перед внесением клеток HEK293 в культуральный сосуд. Однако подготовка адгезивного слоя требует значительного времени и, как правило, приводит к получению нестерильной твердой подложки с меньшим сроком хранения по сравнению с необработанной исходной твердой подложкой. Таким образом, существует значительная потребность в разработке способов и материалов для повышения эффективности закрепления клеток HEK293 на твердой подложке без нанесения адгезивного слоя.
Существующие на сегодня способы культивирования плюрипотентных стволовых клеток, в частности, эмбриональных стволовых клеток (ЭСК), требуют сложных условий культивирования, таких как, например, культивирование эмбриональных стволовых клеток на поверхности твердой подложки с нанесенным слоем питающих клеток или на поверхности твердой подложки с нанесенным адгезивным слоем белка внеклеточного матрикса. В использующих эти способы системах для культивирования нередко применяются питающие клетки или белки внеклеточного матрикса, полученные из организма другого вида по отношению к организму, чьи стволовые клетки культивируются (ксеногенный материал). Для культивирования эмбриональных стволовых клеток могут применяться среды, полученные при введении питающих клеток, то есть, среды, кондиционируемые клетками, отличными от недифференцированных эмбриональных стволовых клеток, причем в эти среды может дополнительно вводиться сыворотка животных.
Например, в работах Reubinoff et al. (Nature Biotechnol. 18:399-404, 2000) и Thompson et al. (Science 282:1145-1147, 1998) описывается способ культивирования линий эмбриональных стволовых клеток из бластоцистов человека с использованием питающего клеточного слоя из мышиных эмбриональных фибробластов.
В другом примере, в работе Xu et al. (Nature Biotechnology 19:971-974, 2001) описывается использование препарата MatrigelTM и ламинина для обработки поверхности твердой подложки перед культивированием эмбриональных стволовых клеток человека без дифференцировки, причем культивирование ведется без использования питающих клеток.
В другом примере, в работе Vallier et al. (J. Cell Sci. 118:4495-4509, 2005) описывается использование эмбриональной бычьей сыворотки для обработки поверхности твердой подложки перед культивированием эмбриональных стволовых клеток человека без дифференцировки, причем культивирование ведется без использования питающих клеток.
В другом примере, в заявке на патент WO2005014799, описывается кондиционированная среда для поддержания, пролиферации и дифференцировки клеток млекопитающих. Заявка на патент US20050244962 гласит: “Приготовленная в соответствии с настоящим изобретением культуральная среда кондиционируется за счет секреторной активности мышиных клеток, в частности, дифференцированных и иммортализованных трансгенных гепатоцитов под названием MMH (Met Murine Hepatocyte).”
В другом примере, в работе Wanatabe et al. (Nature Biotechnol. 35:681-686, 2007), отмечается, что “ингибитор Rho-ассоциированной киназы (ингибитор ROCK) позволяет добиться выживания диссоциированных эмбриональных стволовых клеток человека”, и демонстрируется снижение апоптоза, вызванного диссоциацией, повышение эффективности клонирования (от приблизительно 1% до приблизительно 27%) и облегчение субклонирования после переноса генов при использовании мышиных эмбриональных фибробластов в качестве питающих клеток, коллагена и MatrigelTM в качестве белка внеклеточного матрикса, и Y-27632 или Fasudil в качестве ингибитора ROCK. Более того, диссоциированные эмбриональные стволовые клетки человека, обработанные Y-27632, оказались защищены от апоптоза в несодержащей сыворотки суспензионной культуре.
В другом примере, в работе Peerani et al. (EMBO Journal 26:4744-4755, 2007), отмечается: “Сложность пространственной организации культур эмбриональных стволовых клеток человека (ЭСК) создает гетерогенные микроокружения (ниши), которые определяют дальнейшую судьбу ЭСК. Настоящее исследование демонстрирует, что скорость и траекторию дифференцировки ЭСК можно контролировать путем создания ниш стволовых клеток с заданными свойствами. Размер и состав ниши регулируют соотношение между индуцирующими и ингибирующими дифференцировку факторами. С точки зрения механизма такой регулировки, в результате антагонистических взаимодействий между ЭСК и производной от ЭСК внеэмбриональной энтодермы (ExE) создается пространственный градиент сигнального каскада Smad1, зависящий от размеров ниши. Эти взаимодействия опосредуются локализованной секрецией костного морфогенетического белка BMP2 из ExE и его антагониста, фактора дифференцировки роста GDF3 из ЭСК. Микроструктурирование ЭСК, обработанных малыми интерферирующими РНК против GDF3, BMP2 и Smad1, а также обработка ингибитором Rho-ассоциированной киназы (ROCK) демонстрируют, что независимый контроль активации Smad1 может спасти зависящую от размера колонии дифференцировку ЭСК. Наши результаты впервые показывают роль Smad1 в интеграции пространственной информации и в контроле самообновления и дифференцировки ЭСК в зависимости от размера ниши”.
В другом примере, в работе Koyanagi, M et al (J Neurosci Res. 2007 Sep 7 [Epub ahead of print]), отмечается: “Участие Rho-ГТФазы предполагалось в апоптозе многих типов клеток, включая нейроны, но механизм ее действия до сих пор полностью не выяснен. В настоящей работе мы исследуем роли Rho и ROCK в апоптозе в процессе трансплантации нейронных клеток-предшественников, происходящих от эмбриональных стволовых клеток. Мы обнаружили, что диссоциация предшественников нейронов приводит к активации Rho и индуцирует апоптоз. Обработка ингибитором Rho, внеклеточным ферментом C3, и/или ингибитором ROCK Y-27632 снижает степень апоптоза (аноикоза), вызванного диссоциацией, на 20-30%. Ингибирование ROCK также снижает пузырение мембраны - ранний морфологический признак апоптоза; расщепление каспазы-3 и высвобождение цитохорма C из митохондрий. Полученные результаты дают основание полагать, что диссоциация нейронных клеток-предшественников активирует внутренний каскад смерти клетки, который по меньшей мере частично опосредуется через каскад Rho/ROCK. Более того, в экспериментальной модели трансплантации на животном ингибирование Rho и/или ROCK приводит к подавлению острого апоптоза клеток-трансплантов. После трансплантации вокруг транспланта наблюдается ярко выраженное действие фактора некроза опухоли альфа и профактора роста нервов. Ингибирование ROCK также подавляет апоптоз, которому способствуют эти воспалительные цитокины. В совокупности полученные результаты указывают, что ингибирование каскада Rho/ROCK может повысить выживаемость клеток-трансплантов в заместительной клеточной терапии”.
В другом примере, в работе Yoneda et al (J. Cell Biol. 170: 443-453, August 3, 2005), отмечается: “Гомологичные Rho-киназы млекопитающих (ROCK I и II) считаются функционально избыточными, исходя в основном из сверхэкспрессии киназных конструкций. В качестве нижележащих эффекторов Rho-ГТФаз их основными субстратами являются легкая цепь миозина и миозинфосфатаза. Предполагается участие обеих киназ в сборке пучков микрофиламент и сократительной способности гладких мышц. В настоящей работе анализ адгезии фибробластов к фибронектину показал, что, хотя ROCK II присутствовала в большем количестве, ее активность всегда была ниже, чем активность ROCK I. Специфическое восстановление ROCK I малой интерферирующей РНК приводило к потере тонофибрилл и фокальных адгезий, несмотря на сохранение ROCK II и связанного с гуанинтрифосфатом RhoA. Напротив, при отрицательной модуляции ROCK II наблюдалось усиление микрофиламентного цитоскелета. Поглощение фагоцитов покрытыми бионектином гранулами значительно подавлялось в клетках с удаленной ROCK II, но не в клетках с удаленной ROCK I. Эти эффекты частично обусловлены специфичными липид-связывающими предпочтениями гомологичных доменов с плекстрином ROCK. Киназа ROCK II связывала фосфатидилинозитол 3,4,5P3 и оказалась чувствительной к его уровню, что не наблюдалось в случае киназы ROCK I. Таким образом, эндогенные Rho-ассоциированные киназы специфично регулируются и, в свою очередь, ассоциированы с различными миозиновыми структурами”.
В другом примере, в работе Harb et al (PloS ONE 3(8): e3001. oi:10.1371/journal.pone.0003001, August 2008) описана существенная роль сигнальной оси Rho-Rock-Миозин в регуляции базовых каналов межклеточной коммуникации для эмбриональных стволовых клеток как мыши, так и человека, которая может использоваться для дальнейшего развития [так!] технологии пригодных для медицинских целей свободных от ксенобиотиков сред для плюрипотентных стволовых клеток человека.
Использование ксеногенных материалов может оказаться недопустимым в ряде применений, связанных с использованием плюрипотентных стволовых клеток. В таких случаях можно использовать альтернативные материалы. Например, в работе Stojkovic et al. (Stem Cells 23:895-902, 2005) описано применение сыворотки человека для обработки поверхности твердой подложки перед культивированием эмбриональных стволовых клеток человека без дифференцировки, причем культивирование ведется без использования питающих клеток.
В альтернативной культуральной системе используется не содержащая сыворотки среда с добавлением факторов роста, способных стимулировать пролиферацию эмбриональных стволовых клеток.
Например, в работе Cheon et al. (BioReprod DOI:10.1095/biolreprod.105.046870; 19 Oct 2005) описана не содержащая ни питающих клеток, ни сыворотки культуральная система, в которой эмбриональные стволовые клетки поддерживаются в некондиционированной замещающей сыворотку среде с добавкой различных факторов роста, способных инициировать самообновление эмбриональных стволовых клеток.
В другом примере, в работе Levenstein et al. (Stem Cells 24:568-574, 2006), описаны способы долговременного культивирования эмбриональных стволовых клеток человека в отсутствие фибробластов или кондиционированной среды с использованием среды с добавкой базового фактора роста фибробластов FGF.
В другом примере, в заявке на патент US20050148070, описан способ культивирования эмбриональных стволовых клеток человека в среде с определенной композицией, не содержащей сыворотки и не содержащей питающих клеток - фибробластов. Данный способ заключается в культивировании стволовых клеток в культуральной среде, содержащей альбумин, аминокислоты, витамины, минеральные вещества по меньшей мере один трансферрин или заместитель трансферрина по меньшей мере один инсулин или заместитель инсулина, причем указанная культуральная среда существенно свободна от эмбриональной сыворотки млекопитающих и содержит по меньшей мере приблизительно 100 нг/мл FGF, способного активировать FGF-сигнальный рецептор, где указанный фактор роста поступает из источника, отличного от просто питающего слоя фибробластов, данная среда поддерживает пролиферацию стволовых клеток в недифференцированном состоянии в отсутствие питающих клеток или кондиционированной среды.
В другом примере, в заявке на патент US20050233446, описывается среда с определенной композицией, которая может быть использована при культивировании стволовых клеток, включая недифференцированные зародышевые стволовые клетки приматов. В растворе среда является существенно изотонической относительно культивируемых стволовых клеток. Для каждой культуры конкретно используемая среда состоит из основной среды с добавкой базового FGF, инсулина и аскорбиновой кислоты, необходимых для поддержания существенно недифференцированного роста зародышевых стволовых клеток.
В другом примере, в заявке на патент US6800480, отмечается: “В одном варианте осуществления предлагается культуральная среда для выращивания зародышевых стволовых клеток приматов в существенно недифференцированном состоянии, включающая основную среду с низким содержанием эндотоксина и низким осмотическим давлением, которая эффективно поддерживает рост зародышевых стволовых клеток приматов. Основная среда объединяется с питательной сывороткой, способной эффективно поддерживать рост зародышевых стволовых клеток приматов, и с субстратом, выбранным из группы, включающей питающие клетки и компонент внеклеточного матрикса, полученный из питающих клеток. Указанная среда также включает заменимые аминокислоты, антиоксидант и первый фактор роста, выбранный из группы, включающей нуклеозиды и соль-пируват”.
В другом примере, в заявке на патент US20050244962, отмечается: “В одном аспекте в изобретении предлагается способ культивирования эмбриональных стволовых клеток приматов. Стволовые клетки культивируются в культуре, существенно свободной от эмбриональной сыворотки млекопитающих (предпочтительно также существенно свободной от сыворотки любых животных) и в присутствии фактора роста фибробластов, полученного из источника, иного чем просто питающие клетки-фибробласты. В предпочтительной форме слой питающих фибробластов, ранее необходимый для поддержания культуры стволовых клеток, становится необязательным вследствие добавления достаточного количества фактора роста фибробластов”.
В другом примере, в заявке на патент WO2005065354, описана существенно свободная от питающих клеток и сыворотки изотоническая культуральная среда с определенное композицией, которая включает в себя: а. основную среду; b. базовый фактор роста фибробластов в количестве, достаточном для поддержания роста существенно недифференцированных стволовых клеток млекопитающих; c. инсулин в количестве, достаточном для поддержания роста существенно недифференцированных стволовых клеток млекопитающих; и d. аскорбиновую кислоту в количестве, достаточном для поддержания роста существенно недифференцированных стволовых клеток млекопитающих.
В другом примере, в заявке на патент WO2005086845, описан способ поддержания недифференцированных стволовых клеток, включающий воздействие на стволовые клетки одним из членов семейства белков трансформирующего ростового фактора-бета (TGFβ), одним из членов семейства белков фактора роста фибробластов (FGF) или никотинамидом (NIC) в количестве, достаточном для поддержания клеток в недифференцированном состоянии в течение периода времени, достаточного для получения желаемого результата.
Плюрипотентные стволовые клетки обладают большим потенциалом для научно-исследовательской работы и скрининга лекарственных препаратов. В настоящее время крупномасштабное культивирование линий эмбриональных стволовых клеток человека представляет большие проблемы и сталкивается с существенными трудностями. Возможные пути преодоления этих трудностей заключаются в пассировании и культивировании эмбриональных стволовых клеток человека в виде одиночных клеток. Одиночные клетки более удобны для применения стандартных методик культивирования тканей, таких как, например, подсчет клеток, трансфицирование и т.д.
Например, в работе Nicolas et al. описан способ получения и наработки линий эмбриональных стволовых клеток человека из одиночных клеток, изолированных с помощью флюоресцентной сортировки после генетической модификации с использованием лентивирусных векторов (Stem Cells Dev. 16:109-118, 2007).
В другом примере, в заявке на патент США US2005158852, описан способ “улучшения роста и выживаемости одиночных эмбриональных стволовых клеток человека. Способ включает этапы получения одиночной недифференцированной эмбриональной стволовой клетки человека; смешивания указанной одиночной недифференцированной клетки с внеклеточным матриксом для обволакивания клетки и посева полученной смеси на питающие клетки с питательной средой в ростовом окружении”.
В другом примере, в работе Sidhu et al. (Stem Cells Dev. 15:61-69, 2006), впервые сообщается о трех клонах эмбриональных стволовых клеток человека, hES 3.1, 3.2 и 3.3, полученных из родительской линии hES3 путем сортировки одноклеточных препаратов на проточном цитометре.
Однако пассирование и культивирование эмбриональных стволовых клеток человека в виде одиночных клеток приводит к генетическим аберрациям и к потере плюрипотентности. Для поддержания плюрипотентности и генетической устойчивости большое значение имеют условия культивирования. Как правило, пассирование линий эмбриональных стволовых клеток человека выполняется вручную или с использованием ферментативных агентов, таких как коллагеназа, либераза или диспаза.
Например, в работе Draper et al. отмечается наличие “кариотипических изменений, включающих амплификацию 17q плеча в трех независимых линиях эмбриональных стволовых клеток человека в пяти независимых случаях”. (Nature Biotechnol. 22:53-54, 2004).
В другом примере, в работе Buzzard et al. отмечается: “Мы зафиксировали лишь одно изменение кариотипа... что может быть обусловлено используемыми нами способами культивирования, поскольку наши способы разительно отличаются от способов, используемых большинством других групп. Как правило, мы пассируем эмбриональные стволовые клетки человека через семь дней, сначала подсекая колонию краем разломленной пипетки... При таком способе пассирования не используются никакие ферментативные или химические способы диссоциации клеток. Мы считаем, что именно с этим может быть связана относительная генетическая устойчивость эмбриональных стволовых клеток человека в наших руках”. (Nature Biotechnol. 22:381-382, 2004).
В другом примере, в работе Mitalipova et al., отмечается: “Способы группового пассирования... могут зафиксировать популяции анэуплоидных клеток после многократного пассирования в культуре, но могут применяться на более коротких промежутках времени (по меньшей мере до 15 пассажа) без угрозы изменения кариотипа... возможно удастся поддерживать нормальный кариотип эмбриональных стволовых клеток человека в условиях продолжительного ручного ведения с последующим ограниченным числом групповых пассажей в экспериментах, требующих больших количеств эмбриональных стволовых клеток человека, чем могут обеспечить только способы ручного пассирования”. (Nature Biotechnol. 23:19-20, 2005).
В другом примере, в работе Heng et al., отмечается: “Полученные результаты показали, что второй протокол (трипсинизация с умеренным пипетированием) наносят гораздо меньший ущерб жизнеспособности клеток по сравнению с первым протоколом (обработка коллагеназой и соскребание). Это, в свою очередь, выливается в большую вероятность выживания клеток в циклах заморозки/разморозки”. (Biotechnology and Applied Biochemistry 47:33-37, 2007).
В другом примере, в работе Hasegawa et al., отмечается: “Мы вывели сублинии эмбриональных стволовых клеток человека, переносящих полную диссоциацию. Эти клетки имеют высокую эффективность пересева и высокую эффективность клонирования, при этом они сохраняют свою способность дифференцировки в клетки всех трех зародышевых листков”. (Stem Cells 24:2649-2660, 2006).
Таким образом, существует значительная потребность в способах и композициях для культивирования клеток млекопитающих, включая культивирование плюрипотентных стволовых клеток в отсутствие питающего слоя и адгезивного слоя при сохранении плюрипотентности культивируемых клеток.
КРАТКОЕ ОПИСАНИЕ
В одном осуществлении настоящее изобретение предлагает способы и композиции для иммобилизации клеток и культивирования клеток на поверхности твердой подложки и открепления клеток от нее, причем указанная поверхность подложки содержит от по меньшей мере приблизительно 0,5% N, с суммарным содержанием O и N выше или равно 17,2% и с углом смачивания по меньшей мере приблизительно 13,9 градуса; не имеет слоя питающих клеток и не имеет адгезивного слоя.
В одном осуществлении настоящее изобретение предлагает способ повышения иммобилизации клеток на поверхности, которая содержит от по меньшей мере приблизительно 0,5% N, с суммарным содержанием O и N выше или равно 17,2% и с углом смачивания по меньшей мере приблизительно 13,9 градуса, не имеет слоя питающих клеток и адгезивного слоя, включающий стадии:
а. получения суспензии клеток,
b. обработки суспензии клеток по меньшей мере одним соединением, выбранным из группы, состоящей из: соединения, способного ингибировать активность Rho-киназы, и соединения, способного ингибировать активность Rho, и
c. нанесения обработанной суспензии клеток на поверхность, где они закрепляются.
В одном осуществлении после закрепления на поверхности клетки продолжают поддерживаться в той же культуральной среде. В альтернативном осуществлении по меньшей мере одно из указанных соединений удаляется из культуральной среды.
В одном осуществлении закрепленные клетки снимаются с поверхности путем удаления по меньшей мере одного из указанных соединений из культуральной среды.
В одном осуществлении указанная суспензия клеток представляет собой суспензию кластеров клеток. В альтернативном осуществлении указанная суспензия клеток представляет собой суспензию одиночных клеток.
В одном осуществлении клетки представляют собой плюрипотентные стволовые клетки. В альтернативном осуществлении клетки представляют собой стволовые клетки.
В одном осуществлении настоящее изобретение предлагает способ повышения иммобилизации клеток на поверхности, которая содержит от по меньшей мере приблизительно 0,9% N, с суммарным содержанием O и N выше или равно 22,3% и с углом смачивания по меньшей мере приблизительно 13,9 градуса, не имеет слоя питающих клеток и не имеет адгезивного слоя, включающий стадии:
a. получения суспензии клеток, и
b. нанесения суспензии клеток на поверхность, где они закрепляются.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1 приведены фазоконтрастные микрофотографии (4×) клеток линии эмбриональных стволовых клеток человека H1, дважды пассированных как кластеры с использованием ферментативной смеси LIBERASE на поверхностно-модифицированных носителях 2, 3 и 4. На фигуре также приведены изображения клеток линии эмбриональных стволовых клеток человека H1, культивируемых на носителе с поверхностью, обработанной раствором препарата MatrigelTM в соотношении 1:30, и носителе, обработанном по технологии Nunclon DeltaTM.
На фиг.2 показано влияние добавления 10 мкМ Y-27632 на эффективность закрепления эмбриональных стволовых клеток человека на поверхностно-модифицированных носителях. На фигуре приведены фазоконтрастные микрофотографии (4×) клеток линии эмбриональных стволовых клеток человека H1, дважды пассированных как кластеры на поверхностно-модифицированных носителях 3 и 4. Затем клетки пассировали на поверхностно-модифицированные носители 2, 3 и 4 в среде, кондиционированной мышиными эмбриональными фибробластами (MEF) и содержащей 10 мкМ Y-27632. Перед фотографированием клетки культивировали в течение четырех дней. В качестве контроля использовались клетки, культивируемые в отсутствие Y-27632.
На фиг.3 показана динамика обработки различными соединениями эмбриональных стволовых клеток человека, культивируемых на поверхностно-модифицированных носителях, составляющих предмет настоящего изобретения. Клетки линии эмбриональных стволовых клеток человека H1 четырежды пассировали как кластеры с использованием ферментативной смеси LIBERASE на поверхностно-модифицированных носителях 3 и 4 и культивировали в кондиционированной MEF среде. В течение первых двух дней после пассирования клетки обрабатывали либо 10 мкМ ингибитора Rho-киназы Y-27632, либо 0,5 нг/мл ингибитора Rho - проникающей в клетку формы внеклеточного фермента C3 трансферазы. Клетки, которые обрабатывали ингибитором Rho-киназы Y-27632 и затем в течение первых двух дней после каждого пассажа обрабатывали Y-27632 на поверхностно-модифицированном носителе 3, обозначены как “7s”. Клетки, которые обрабатывали ингибитором Rho-киназы Y-27632 и затем в течение первых двух дней после каждого пассажа обрабатывали Y-27632 на поверхностно-модифицированном носителе 4, обозначены как “3s”. Клетки, которые в течение двух дней обрабатывали ингибитором Rho, затем в течение первых двух дней после каждого пассажа обрабатывали ингибитором Rho-киназы Y-27632 и затем в течение первых двух дней после пассажа обрабатывали Y-27632 на поверхностно-модифицированном носителе 3, обозначены как “5s”. Клетки, которые в течение двух дней обрабатывали ингибитором Rho, затем в течение первых двух дней после каждого пассажа обрабатывали ингибитором Rho-киназы Y-27632 и затем в течение первых двух дней после пассажа обрабатывали Y-27632 на поверхностно-модифицированном носителе 4, обозначены как “1s”.
На фиг.4 показаны определенные способом qRT-PCR уровни экспрессии маркеров, ассоциированных с плюрипотентностью и дифференцировкой в эмбриональных стволовых клетках человека, обработанных в соответствии с указанным на фиг.6 протоколом.
На фиг.5 показаны определенные способом проточной цитометрии уровни экспрессии маркеров плюрипотентности в клетках линии эмбриональных стволовых клеток человека H1 на пассаже 4 (p4), пассаже 9 (p9) и затем на пассаже 10, 11 или 12 (p10, p11 или p12).
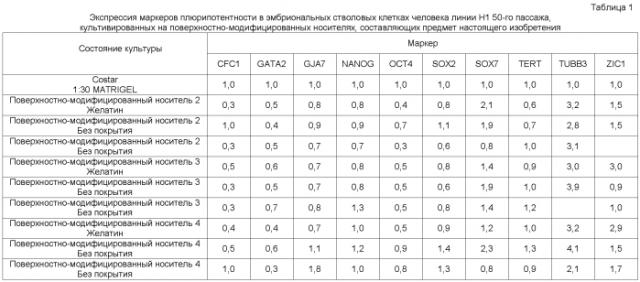
На фиг.6 приведены иммуно-флюоресцентные фотографии клеток линии эмбриональных стволовых клеток человека H1, которые последовательно пассировали как кластеры с использованием ферментативной смеси LIBERASE на поверхностно-модифицированном носителе 4 и культивировали в среде, кондиционированной MEF. Уровни экспрессии белков, ассоциированных с маркерами плюрипотентности, определялись для клеток, культивированных в течение 11 пассажей на поверхностно-модифицированном носителе 4. Клетки обрабатывали 10 мкМ Y-27632 в течение двух дней после каждого пассажа.
На фиг.7 показана способность эмбриональных стволовых клеток человека образовывать дефинитивную эндодерму после культивирования на поверхностно-модифицированных носителях. Клетки линии эмбриональных стволовых клеток человека H1 пассировали 11 раз как кластеры с использованием ферментативной смеси LIBERASE на поверхностно-модифицированных носителях 3 и 4 и культивировали в среде, кондиционированной MEF. На пассаже 8 (p8) и затем снова на пассаже 10 или 11 (p10-11) клетки в течение двух дней обрабатывали средой DMEM:F12, содержащей 0,5% FBS, 100 нг/мл активина A и 20 нг/мл Wnt3a, и затем обрабатывали средой DMEM:F12, содержащей 2% FBS и 100 нг/мл активина A, в течение еще трех дней. Вертикальная ось на фигуре показывает процент CXCR4-положительных клеток по данным проточной цитометрии. Смотрите также таблицу 5.
На фиг.8 показана способность эмбриональных стволовых клеток человека образовывать панкреатическую эндодерму после культивирования на поверхностно-модифицированных носителях. Клетки линии эмбриональных стволовых клеток человека H1 пассировали восемь раз как кластеры с использованием ферментативной смеси LIBERASE на поверхностно-модифицированных носителях 3 и 4 и культивировали в среде, кондиционированной MEF. На пассаже 8 (p8) клетки дифференцировали в клетки дефинитивной эндодермы путем обработки в течение двух дней средой DMEM:F12, содержащей 0,5% FBS, 100 нг/мл активина A и 20 нг/мл Wnt3a, и затем обработки средой DMEM:F12, содержащей 2% FBS и 100 нг/мл активина A, в течение еще трех дней. Затем клетки дифференцировали далее в клетки зародышевой передней кишки путем обработки в течение четырех дней средой DMEM:F12, содержащей 2% FBS, 100 нг/мл FGF-10 и 1 мкМ циклопамин-KAAD. Затем клетки дифференцировали в клетки панкреатической эндодермы путем обработки в течение четырех дней средой DMEM:F12, содержащей 1% B-27, 100 нг/мл FGF-10, 1 мкМ циклопамин-KAAD и 2 мкМ ретиноевой кислоты. Было проведено иммунофлюоресцентное окрашивание клеток по PDX-1 (зеленый) и E-кадгерину (красный); полное число клеток определяли с помощью красителя Хехст (синий).
На фиг.9 показана способность эмбриональных стволовых клеток человека образовывать эмбриоидные тельца после культивирования на поверхностно-модифицированных носителях.
На фиг.10 показан кариотип эмбриональных стволовых клеток человека, культивированных на поверхностно-модифицированном носителе 4.
На фиг.11 показано влияние обработки ингибиторами Rho-киназы (Y-27632 от компании EMD biosciences, Y-27632 от компании Sigma, Fasudil и Hydroxyfasudil) на эффективность закрепления эмбриональных стволовых клеток человека на поверхностно-модифицированных носителях. Клетки в течение трех дней культивировали в содержащих указанные соединения средах при указанных концентрациях. Затем клетки окрашивали кристаллическим фиолетовым и фотографировали.
На фиг.12 показана зависимость эффективности закрепления эмбриональных стволовых клеток человека на поверхностно-модифицированных носителях от концентрации вводимого в среду Y-27632. На первый день в культуральные среды вводился ингибитор Rho-киназы Y-27632 в указанных концентрациях (0, 1, 2, 4 или 10 мкМ Y-27632). Начиная со второго дня, в течение пяти дней клетки поддерживали в среде, содержащей 10 мкМ Y-27632, ежедневно заменяя среду. На пятый день с носителей удаляли культуральную среду, клетки окрашивали 0,5% кристаллическим фиолетовым и фотографировали.
На фиг.13 показано образование коло