Экспрессионный плазмидный вектор моноцистронной экспрессии рекомбинантных белков в клетках млекопитающих, линия клеток млекопитающих-продуцентов рекомбинантного белка, способ получения рекомбинантного белка
Иллюстрации
Показать всеИзобретение относится к биотехнологии и генетической инженерии. Предложен экспрессионный плазмидный вектор для моноцистронной гетерологичной экспрессии рекомбинантных белков в клетках яичника китайского хомячка (СНО), обладающий свойством высокочастотной интеграции экспрессионной кассеты в указанных клетках, в следующей последовательности содержащий область начала репликации плазмиды pUC с функциональным геном устойчивости к ампициллину; участок терминального повтора вируса Эпштейн-Барр человека (EBVTR); функциональный промотор гена фактора элонгации 1 альфа китайского хомячка, фланкированный 5′ нетранслируемой областью этого гена; участок для клонирования открытой рамки считывания рекомбинантного белка (полилинкер); функциональный терминатор гена фактора элонгации 1 альфа китайского хомячка, фланкированный 3′ нетранслируемой областью этого гена; промотор, функционирующий в клетках млекопитающих; ген устойчивости к антибиотику; и функциональный терминатор гена устойчивости к антибиотику. Также предложена линия клеток - продуцентов рекомбинантного белка и способ получения рекомбинантного белка с использованием указанных клеток. Изобретение позволяет увеличить стабильность и продуктивность систем экспрессии рекомбинантных белков. 3 н. и 10 з.п. ф-лы, 7 ил., 6 табл., 8 пр.
Реферат
Область техники
Изобретение относится к области биотехнологии, а именно к технологии получения биологически активных веществ (БАВ) методами генной инженерии, точнее к методам получения рекомбинантных белков в культивируемых клетках млекопитающих.
Предшествующий уровень техники
Рекомбинантные белки, полученные в культивируемых клетках млекопитающих, используются для производства не менее 50% лекарственных средств биологического происхождения, существенной части вакцин, препаратов для ветеринарии и реагентов для клинической диагностики. Наибольшее распространение среди линий клеток млекопитающих, используемых в биофармацевтическом производстве, получила линия клеток яичника китайского хомячка (Cricetulus griseus) СНО (Chinese hamster ovary cells) и ее производные. Очевидным ограничением продуктивности клетки-продуцента является уровень мРНК целевого гена. Традиционно для создания высокопродуктивных промышленно-пригодных клеток-продуцентов используют амплификацию в геноме клеток интегрированных генетических конструкций, кодирующих открытые рамки считывания целевых белков. При использовании сублиний СНО с инактивированным геном дигидрофолатредуктазы (DHFR), в частности, сублинии CHO-DG44, не содержащей активных аллелей DHFR и описанной в работах (Uriaub G, Chasm LA. Isolation of Chinese hamster cell mutants deficient in dihydrofolate reductase activity. Proc Natl Acad Sci USA. 1980 Jul; 77(7):4216-4220; Derouazi M et al., Genetic characterization of СНО production host DG44 and derivative recombinant cell lines. Biochem Biophys Res Commun. 2006 Feb 24; 340(4):1069-1077), амплификацию введенных в геном клетки генетических конструкций, содержащих открытую рамку считывания DHFR, можно вести путем продолжительного культивирования трансфицированных клеток в присутствии возрастающих концентраций ингибиторов DHFR, в качестве которых обычно используют метотрексат (МТХ).
Для существенной части фармацевтически значимых целевых белков достижение высокой концентрации их мРНК в клетках-продуцентах не приводит к экономически приемлемому уровню секреции зрелых форм целевых белков в культуральную среду либо приводит к секреции смеси корректной формы целевого белка и пассивных примесей - непроцессированных вариантов целевого белка или отдельных цепей гетеродимерных белков. Разделение корректной формы целевого белка и его остальных форм представляет собой сложную техническую проблему и в некоторых случаях технически неосуществимо. Например, избыточный уровень биосинтеза тяжелой цепи иммуноглобулинов G при экспрессии рекомбинантных антител приводит к появлению в культуральной среде димеров тяжелых цепей IgG, которые соочищаются с корректными молекулами IgG при аффинной хроматографии (Gonzalez R., В.A. Andrews, et al. (2002). "Kinetic model of BiP- and PDI-mediated protein folding and assembly." J. Theor. Biol. 214:529-537).
При экспрессии гена фактора свертывания крови IX человека в клетках линии СНО не менее 90% секретируемого целевого белка содержит неотделенный пропептид, такие молекулы фактора IX не обладают прокоагуляционной активностью и могут быть отделены от полностью процессированных молекул только при помощи псевдоаффинной хроматографии (Kaufman R.J., L.C. Wasley, B.C. Furie, B. Furie, and C.B. Shoemaker //J Biol Chem. 261(21): p.9622-8). Уровень процессинга пропептида фактора IX может быть увеличен до 70-80% при введении в геном клеток-продуцентов гена сигнальной протеиназы PACE/furin (Wasley L.C., A. Rehemtulla, J.A. Bristol, and R.J. Kaufman //J Biol Chem. 268(12): p.8458-65). Таким образом, обеспечение ко-экспрессии генов "вспомогательных" белков или независимой экспрессии генов цепей гетеромультимерных белков является важной технической задачей при создании клеточных линий-продуцентов.
Как правило, оптимальные уровни биосинтеза вспомогательных белков должны быть существенно ниже, чем уровни биосинтеза целевого белка. Например, эффективная система биосинтеза протромбина человека в клетках линии СНО требует присутствия в геноме клеток-продуцентов гена гамма-глютамил карбоксилазы человека (GGCX), при этом уровень секреции корректно модифицированного протромбина человека максимален при отношении уровней экспрессии целевого гена и гена GGCX от 10:1 до 100:1 (патент США 7,842,477).
Существуют три общих метода, позволяющих вести одновременную экспрессию нескольких трансгенов в культивируемых клетках - включение нескольких генов в состав одной плазмиды, одновременная трансфекция нескольких плазмид и последовательная трансфекция плазмид, кодирующих целевой белок и вспомогательные белки. Во всех случаях носителями генов могут выступать не только плазмиды, но и рекомбинантные вирусы, псевдовирусные частицы и так далее. При использовании в качестве носителей генетической информации плазмид второй и третий способы требуют использования различных совместимых между собой систем селекции стабильно трансфицированных клеток. Первый метод ко-экспрессии позволяет получать клетки-продуценты максимально быстро, однако относительные уровни экспрессии основного и вспомогательного гена, определяемые активностью их промоторов, будут одинаковыми для всех клонов; изменение отношения уровня экспрессии этих генов потребует модификации плазмиды и повторной трансфекции. При одновременной трансфекции нескольких плазмид и последующей селекции стабильно трансфицированных клеток, несущих в геноме все трансфицированные гены, возможно получение клонов клеток-продуцентов с различными отношениями уровня экспрессии трансфицированных генов в результате выполнения одной процедуры трансфекции, селекции и клонирования, в то же время популяция получаемых клеток-продуцентов будет иметь небольшие размеры из-за низкой вероятности инсерции в геном одной клетки нескольких плазмид. Последовательная трансфекция нескольких плазмид позволяет получать клональные линии-продуценты с практически произвольным отношением уровней экспрессии основного и вспомогательных генов, однако занимает более продолжительное время.
В случае использования системы селекции клеток-продуцентов, включающей ген дигидрофолатредуктазы, для отбора продуцентов "основного" белка, плазмиды, кодирующие гены "вспомогательных" белков, могут иметь селекционные маркеры устойчивости к действию антибиотиков, либо "амплифицируемые" селекционные маркеры устойчивости к отсутствию незаменимых аминокислот или предшественников нуклеотидов (глутамин-синтазу, аденозин-деаминазу). Поскольку "амплифицируемые" селекционные маркеры предполагают продолжительное культивирование поликлональной популяции трансфицированных клеток в селекционной среде до достижения максимального уровня экспрессии целевого гена, последовательный отбор популяции продуцентов "основного" и "вспомогательного" генов может занимать более 6 месяцев и приводить к исчерпанию пролиферативного потенциала клеток и потере/инактивации копий целевого гена, интегрированного в геном продуцентов при первой трансфекции.
Подробное описание настоящего изобретения
Технической задачей, решаемой авторами, являлось создание семейства совместимых векторов для получения высокопродуктивных и стабильных систем экспрессии рекомбинантных белков в культивируемых клетках млекопитающих, в частности в клетках СНО или клетках человека HEK-293, а также предоставление линии клеток млекопитающего, трансфицированных векторами данного семейства, - продуцентов рекомбинантных белков, в частности различных ферментов посттрансляционной модификации или определенных цепей гетеромультимерных белков. Указанная линия клеток млекопитающего может быть со-продуцентом двух и более рекомбинантных белков, экспрессирующихся независимо в составе двух и более различных векторов, при этом один из рекомбинантных белков является ферментом посттрансляционной модификации второго рекомбинантного белка, либо указанные разные рекомбинантные белки являются цепями гетеромультимерного рекомбинантного белка. Следующей технической задачей является предоставление способа получения рекомбинантного белка.
Так, при использовании векторов одного типа для введения в геном клеток-продуцентов "основного" и "вспомогательных" генов предпочтительными маркерами устойчивости для плазмид, кодирующих "вспомогательные" гены, будут являться гены ферментов, обеспечивающих устойчивость клеток к действию антибиотиков. Такие селекционные маркеры обычно являются взаимно совместимыми, в частности, гены устойчивости к действию антибиотиков G418 (неомицина), зеоцина, гигромицина, не защищают клетки от действия других антибиотиков и не сообщают клеткам преимуществ при селекции на устойчивость к метотрексату. Избирательность ферментов устойчивости к действию антибиотиков G418 (неомицина), зеоцина, гигромицина достаточна высока для последовательной или одновременной трансфекции плазмид, кодирующих эти гены устойчивости и отбора популяций клеток, одновременно экспрессирующих несколько целевых генов (презентация компании ChanTest, http://www.chantest.com/media/cms/pdf/4_Cell_biology_support_for_drug_discovery_03092012.pdf, "Cell Biology Support for Drug Discovery", 10.03.2012).
Ранее авторы настоящего изобретения показали (патентная заявка РФ 2011146243), что использование амплифицируемого селекционного маркера, такого, как ген DHFR, обычно позволяет увеличить уровень экспрессии целевого гена приблизительно в 10 раз при продолжительном культивировании стабильно трансфицированных клеток в присутствии возрастающих концентраций селекционного агента, таким образом, последующая трансфекция "вспомогательных" генов в векторах того же типа может позволить получить относительный уровень экспрессии "вспомогательных" генов около 1:10 по отношению к "основному" гену без использования процедур амплификации "вспомогательных" трансгенов. Одновременно с этим, фактический уровень экспрессии вспомогательных генов может зависеть не только от силы использованного промотора и числа копий интегрированной в геном клеток экспрессионной кассеты, но и от эффективности транскрипции, трансляции и пост-трансляционного процессинга использованных "вспомогательных" белков.
При получении линий-продуцентов с использованием амплифицируемых в геноме генетических конструкций предпочтительным вариантом относительного расположения целевого гена и гена селекционного маркера является их объединение в бицистронный транскрипиционный элемент, что обеспечивает минимизацию вероятности инактивации целевого гена и сохранения гена селекционного маркера. В то же время при использовании "неамплифицируемых" селекционных маркеров устойчивости к действию антибиотиков наилучшим вариантом взаимного расположения целевых генов и генов селекционных маркеров может являться использование отдельного "слабого" промотора и терминатора транскрипции для селекционного маркера и вынесение гена селекционного маркера из контекста транскрипционной единицы целевого гена. Такое расположение функциональных элементов экспрессионной плазмиды может позволить провести одностадийную селекцию клонов, несущих только множественные копии интегрированной в геном экспрессионной плазмиды, находящиеся в эухроматинизированных (т.е. транскрипционно активных) областях генома.
Технический результат достигался путем конструирования новой экспрессионной плазмидной ДНК р1.2 Mono, содержащей регуляторные элементы для гетерологичной экспрессии рекомбинантных белков в клетках млекопитающих, и создания на ее основе семейства взаимно совместимых векторов с различными селекционными маркерами.
В основе технического решения лежит разработанное авторами семейство плазмидных ДНК векторов, содержащих функциональные промотор и терминатор гена фактора элонгации 1 альфа китайского хомячка, обеспечивающие конститутивную экспрессию целевого гена, кодирующего рекомбинантный белок, в клетках СНО, фланкированного 5' и 3' НТО указанного гена фактора элонгации 1 альфа китайского хомячка, обеспечивающими эухроматинизацию сайтов интеграции экспрессионной кассеты в геном СНО; участок для клонирования открытых рамок считывания целевых белков; участок терминального повтора вируса Эпштейн-Барр человека (EBVTR), обеспечивающий повышенный уровень интеграции кассет в геном клеток СНО и последовательность, содержащую ген устойчивости к антибиотику и регуляторные элементы для его экспрессии в клетках млекопитающего, обеспечивающую дозозависимую устойчивость стабильно трансфицированных клеток к антибиотику, что позволяет вести направленную селекцию клонов с множественными копиями экспрессионной кассеты в геноме СНО.
Использование указанных векторов позволяет создавать высокопродуктивные и стабильные системы экспрессии рекомбинантных белков в клетках млекопитающих, в частности в клетках СНО или клетках человека HEK-293, и получать стабильные линии продуцентов и со-продуцентов рекомбинантных белков.
Термин «экспрессионный вектор» означает плазмидную ДНК, содержащую все необходимые генетические элементы для экспрессии внедренного в нее целевого гена, например, промотор и терминатор, и элементы для амплификации экспрессионной кассеты и отбора клонов с множественными копиями экспрессионной кассеты в геноме.
Термин «совместимые векторы» означает набор таких экспрессионных векторов, которые могут быть использованы для одновременной или последовательной трансфекции культивируемых клеток млекопитающих и последующей селекции стабильно трансфицированных клеток. Необходимым условием совместимости векторов является наличие в их составе различных генов устойчивости к действию селекционных агентов, сообщающих трансфицированным клеток устойчивость к действию только одного из нескольких используемых селекционных агентов.
Примерами наборов совместимых векторов являются наборы, состоящие из вектора p1.1, сообщающего устойчивость к действию метотрексата, и вектора p1.2-Neo, сообщающего устойчивость к действию неомицина, набора, состоящего из вектора p1.1, сообщающего устойчивость к действию метотрексата, и вектора p1.2-Zeo, сообщающего устойчивость к действию зеоцина, набора, состоящего из вектора p1.1, сообщающего устойчивость к действию метотрексата, и вектора p1.2-Hygro, сообщающего устойчивость к действию гигромицина, а также другие наборы, состоящие из вектора, отличного от p1.1, сообщающего устойчивость к действию метотрексата, и вектора семейства р1.2, сообщающего устойчивость к действию антибиотика, но не ограничивается ими.
Вектор p1.1 (SEQ ID NO:6) был разработан авторами настоящего изобретения ранее (патентная заявка РФ 2011146243) и содержит функциональные промотор и терминатор гена фактора элонгации 1 альфа китайского хомячка, обеспечивающие конститутивную экспрессию целевого гена в клетках СНО, фланкированные 5' и 3' НТО этого гена, обеспечивающими эухроматинизацию сайтов интеграции экспрессионной кассеты в геном СНО; участок для клонирования открытых рамок считывания целевых белков; внутренний сайт связывания рибосом вируса энцефаломиокардита (EMCV IRES), обеспечивающий реинициацию трансляции на бицистронной мРНК в клетках млекопитающих и полное генетическое сцепление уровней продукции целевого белка и DHFR; OPC DHFR мыши, экспрессирующуюся в составе бицистронной мРНК вместе с целевым геном (IRES DHFR) и обеспечивающую устойчивость стабильно трансфицированных клеток к отсутствию в среде тимидина и дозозависимую устойчивость к воздействию метотрексата (МТХ), что позволяет вести направленную селекцию высокопродуктивных клонов с множественными копиями экспрессионной кассеты в геноме СНО; участок терминального повтора вируса Эпштейн-Барр человека (EBVTR), обеспечивающий повышенный уровень интеграции кассет в геном клеток СНО и ускорение процесса амплификации целевого гена в геноме под действием МТХ.
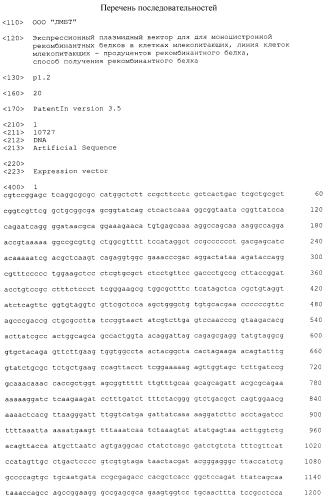
Последовательность вектора р1.2 Mono для моноцистронной экспрессии с конститутивным промотором и элементом, обеспечивающим множественную интеграцию в геном клеток, представлена в Перечне последовательностей под номером SEQ ID NO:1. Карта вектора представлена на Фиг.2.
Примерами совместимых векторов для моноцистронной экспрессии с конститутивным промотором и элементом, обеспечивающим множественную интеграцию в геном клеток с различными селекционными маркерами, могут служить векторы р1.2 Hygro, р1.2 Neo и р1.2 Zeo. Последовательности векторов р1.2 Hygro, р1.2 Neo и р1.2 Zeo представлены в Перечне последовательностей под номерами SEQ ID NO:2-4, соответственно. Карты векторов представлены на Фиг.3-5, соответственно.
Конкретным примером генетических элементов согласно настоящему изобретению для экспрессии рекомбинантного белка являются промотор и терминатор фактора элонгации 1 альфа китайского хомячка, но не ограничиваются ими.
Примером последовательности промотора гена фактора элонгации 1 альфа китайского хомячка, фланкированного 5' НТО этого гена, является последовательность, соответствующая нуклеотидам с 2373 по 6443 в последовательностях SEQ ID NO:1-4.
Примером последовательности терминатора гена фактора элонгации 1 альфа китайского хомячка, фланкированного 3' НТО этого гена, является последовательность, соответствующая нуклеотидам с 6467 по 10723 в последовательностях SEQ ID NO:1-4.
Нетранслируемая область (НТО, UTR - untranslated region) согласно настоящему изобретению представляет собой участок ДНК, не кодирующий открытых рамок считывания (ОРС), который при этом может содержать функциональные регуляторные элементы. Размер указанной нетранслируемой области варьируется в широких пределах и составляет 150 до 10000 нуклеотидов, предпочтительно 4000-5000 нуклеотидов, необходимых для обеспечения инициации и терминации транскрипции, процессинга транскрибируемой РНК, а также для эухроматинизации сайтов интеграции экспрессионной кассеты в геном СНО.
Последовательность участка для клонирования открытых рамок считывания целевых белков (полилинкер) может представлять, например, последовательность, соответствующую нуклеотидам с 6443 по 6467 в последовательностях SEQ ID NO:1-4. Указанный полилинкер содержит уникальные сайты узнавания эндонуклеазами рестрикции: AbsI (6446), XhoI (6446), SciII (6448), SnaBI (6455), NruI (6461), NheI (6467).
Фрагментом ДНК, кодирующим элемент для множественной интеграции и амплификации экспрессионной кассеты согласно настоящему изобретению, может являться, например, фрагмент конкатемера терминального повтора вируса Эпштейн-Барр человека (EBVTR). Последовательность участка фрагмента конкатемера терминального повтора вируса Эпштейн-Барр человека (EBVTR) представляет собой, например, последовательность, соответствующую нуклеотидам с 1960 по 2361 в последовательностях SEQ ID NO:1-4.
Генетическим элементом (кассетой, обеспечивающей экспрессию селекционного маркера) для селекции культивируемых клеток, содержащих хромосомную инсерцию генетического вектора согласно настоящему изобретению, являются гены устойчивости к антибиотикам, находящиеся под контролем генетических элементов для экспрессии в клетках млекопитающего.
Конкретным примером генов устойчивости к антибиотикам согласно настоящему изобретению являются гены устойчивости к действию гигромицина, неомицина, зеоцина, но не ограничиваются ими.
Конкретным примером генетических элементов для экспрессии генов устойчивости к антибиотикам согласно настоящему изобретению являются область промотора и терминатора вируса Simian vacuolating virus 40 (SV40), но не ограничиваются ими.
Примером последовательности генов устойчивости к антибиотикам являются последовательности, соответствующие нуклеотидам с 11135 по 12160 в последовательности SEQ ID NO:2; с 11153 по 11947 в последовательности SEQ ID NO:3; с 11200 по 11574 в последовательности SEQ ID NO:4.
Примером последовательности области промотора и терминатора вируса SV40 являются последовательности, соответствующие нуклеотидам с 10758 по 11038 и с 12293 по 12412 в последовательности SEQ ID NO:2; с 10748 по 11117 и с 12121 по 12251 в последовательности SEQ ID NO:3; с 10748 по 11117 и с 11704 по 11834 в последовательности SEQ ID NO:4, соответственно.
Конкретным воплощением экспрессионного вектора согласно настоящему изобретению являются плазмиды семейства р1.2, представленные в Перечне последовательностей под номерами SEQ ID NO:1-4. Структура плазмид приведена на Фиг.2-5.
Плазмиды данного семейства состоят из
1) 1-1960 участка, включающего
а. 150-823 (674 по) область начала репликации плазмиды pUC,
b. 964-1824 (861 по) открытую рамку считывания бета-лактамазы, обеспечивающей устойчивость к ампициллину;
2) 1960-2361 (402 по) участка фрагмента конкатемера терминального повтора вируса Эпштейн-Барр человека (EBVTR);
3) 2373-6443 (4071 по) участка, содержащего функциональный промотор гена фактора элонгации 1 альфа китайского хомячка, фланкированный 5' НТО этого гена;
4) 6443-6467 (25 по) участка для клонирования вставок целевых ОРС (полилинкер);
5) 6467-10723 участка, содержащего сигнал полиаденилирования и функциональный терминатор гена фактора элонгации 1 альфа китайского хомячка, фланкированный 3' НТО этого гена;
6) и участка, обеспечивающего экспрессию селекционного маркера, в частности
10758-12412 участка в последовательности вектора р1.2 Hygro (SEQ ID NO:2);
10748-12251 участка в последовательности вектора р1.2 Neo (SEQ ID NO:3);
10748-11834 участка в последовательности вектора р1.2 Zeo (SEQ ID NO:4).
Векторы получали с использованием стандартных методов генной инженерии, коммерчески доступных плазмид и химически синтезированных олигонуклеотидов (Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning. 2nd ed. New York, NY: Cold Spring Harbor Laboratory Press; 1989).
Элементы вектора перечислены в порядке их расположения. Взаимный порядок расположения функциональных элементов является существенным для эффективной работы вектора.
В качестве рекомбинантной плазмиды согласно настоящему изобретению могут использоваться различные плазмиды, обладающие способностью к интеграции в геном клетки-реципиента после трансфекции, содержащие конститутивный эукариотический промотор, экспрессионную бицистронную кассету и области, обеспечивающие эухроматинизацию района интеграции экспрессионный кассеты.
Предпочтительно, чтобы экспрессионный плазмидный вектор согласно настоящему изобретению дополнительно содержал консенсусную последовательность Козак. Последовательность Козак располагается вокруг старт-кодона целевого гена и способствует инициации трансляции мРНК целевого гена.
Фрагменты ДНК, которые кодируют по существу те же регуляторные элементы, могут быть получены, например, путем модификации нуклеотидной последовательности фрагмента ДНК (SEQ ID NO:1), например, посредством метода сайт-направленного мутагенеза, так, что один или несколько нуклеотидов в определенном сайте будут делегированы, заменены, вставлены или добавлены. Фрагменты ДНК, модифицированные, как описано выше, могут быть получены с помощью традиционных методов обработки с целью получения мутации.
В качестве клеток млекопитающего могут быть использованы любые традиционно применяемые линии культивируемых клеток. Предпочтительно использование клеток эпителия яичника китайского хомячка (СНО), клеток человека HEK-293 или А-293.
При использовании плазмиды p1.1 или подобной ей для экспрессии "основного" белка, в качестве клеток млекопитающего, не содержащих активные аллели дегидрофолатредуктазы, могут быть использованы любые традиционно применяемые линии клеток с инактивируемой дигидрофолатредуктазой. Предпочтительно использование клеток эпителия яичника китайского хомячка (СНО), нокаутных по гену дигидрофолатредуктазы (dhfr-/-), линия DG-44 (Invitrogen, США).
В качестве клеток млекопитающего, продуцентов биофармацевтически значимых белков, подвергающихся метаболическому инжинирингу путем введения в геном дополнительных генов, могут быть использованы любые продуценты. Предпочтительно использование клеток эпителия яичника китайского хомячка (СНО), нокаутных по гену дигидрофолатредуктазы (dhfr-/-), линия DG-44 (Invitrogen, США), содержащих в геноме кассету с геном целевого биофармацевтически значимого белка, внутренний участок связывания рибосом (IRES) и миниген дигидрофолатредуктазы как селекционный маркер.
Целевым рекомбинантным белком согласно настоящему изобретению может быть любой белок, представляющий интерес в данной области техники. Примером таких белков является, например, зеленый флуоресцентный белок eGFP, использованный в настоящем изобретении в иллюстративных целях, но не ограничиваются ими.
Примерами фермента посттрансляционной модификации другого рекомбинантного белка являются, например, сигнальная протеиназа PACE/furin, гамма-глютамил карбоксилаза человека (GGCX), альфа-2,6-сиалилтрансфераза (ST6GalI), альфа-2,3-сиалилтрансфераза (ST3GalIII), бета-1,4-галактозилтрансфераза, но не ограничиваются ими.
Примерами гетеромультимерного рекомбинантного белка, состоящего из различных пептидных цепей, являются, например, иммуноглобулины класса G, фолликулостимулирующий гормон, лютеинизирующий гормон, хорионический гонадотропин, тромбоцитарный фактор роста АВ, но не ограничиваются ими.
Также целью настоящего изобретения является предоставление способа получения рекомбинантных белков в клетках млекопитающих, включающего культивирование в питательной среде описанных выше клеток млекопитающих - продуцентов целевого рекомбинантного белка, и выделение полученного целевого рекомбинантного белка из культуральной жидкости.
Выращивание клеток, выделение и очистка целевого белка из культуральной или подобной ей жидкости могут быть осуществлены способом, подобным традиционным способам культивирования, в которых рекомбинантный белок продуцируется с использованием клеток млекопитающих.
Питательная среда, используемая для культивирования, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста клеток. В качестве источника углерода могут использоваться различные углеводы, такие как глюкоза или сахароза и другие органические кислоты. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин, дрожжевой экстракт и т.п.
Выращивание может осуществляться в аэробных условиях, предпочтительно с повышенным содержанием CO2 (8%), таких как перемешивание культуральной жидкости в колбах, при температуре в пределах от 20 до 40°С, предпочтительно в пределах от 30 до 38°С. Обычно, выращивание в течение от 12 часов до 4 дней приводит к накоплению целевого рекомбинантного белка в культуральной среде или в цитоплазме клетки.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования, а затем целевой белок может быть выделен и очищен методами хроматографии и/или концентрирования.
Особенности вектора и результаты его практического применения приведены на следующих Фигурах.
Краткое описание Фигур
На Фигуре 1 показана схема получения плазмид р1.2 mono, p1.2 Hygro, p1.2 Neo, р1.2 Zeo. Обозначения: пунктирной линией обозначены стадии ПЦР, сплошной линией обозначены стадии рестрикции-лигирования, эндонуклеазы рестрикции, использовавшиеся для клонирования, указаны под названиями плазмид.
На Фигуре 2 показана карта экспрессионной плазмиды p1.2 mono (длина 10727 пар оснований). Используются следующие обозначения: pUC origin - область начала репликации плазмиды pUC; bla - открытая рамка считывания бета-лактамазы, обеспечивающей устойчивость к ампициллину; bla promoter - прокариотический промотер гена bla; EBVTR - участок терминального повтора вируса Эпштейн-Барр человека (EBVTR); 5CHEF - функциональный промотор гена фактора элонгации 1 альфа китайского хомячка, фланкированный 5' НТО этого гена; 3CHEF - функциональный терминатор и сигнал полиаденилирования гена фактора элонгации 1 альфа китайского хомячка, фланкированный 3' НТО этого гена. Стрелками указаны направления транскрипции генов, в скобках указаны номера первого и последнего нуклеотидов фрагментов. Курсивом выделены сайты узнавания эндонуклеаз рестрикции, в скобках указаны номера нуклеотидов в точках разрезания.
На Фигуре 3 показана карта экспрессионной плазмиды p1.2 Hygro (длина 12424 пар оснований). Обозначения аналогично фигуре 2; SV40 promoter - область промотора вируса SV40; SV40pA,terminator - терминатор и сигнал полиаденилирования вируса SV40; hygroB - ген устойчивости к гигромицину.
На Фигуре 4 показана карта экспрессионной плазмиды р1.2 Neo (длина 12255 пар оснований). Обозначения аналогично фигуре 3; neoR - ген устойчивости к неомицину.
На Фигуре 5 показана карта экспрессионной плазмиды р1.2 Zeo (длина 11838 пар оснований). Обозначения аналогично фигуре 3; zeoR - ген устойчивости к зеоцину.
На Фигуре 6 показана карта экспрессионной плазмиды р 1.1 (длина 11909 пар оснований). Обозначения аналогично фигуре 2; 5'CHEF-1 UTR функциональный промотор гена фактора элонгации 1 альфа китайского хомячка, фланкированный 5' НТО этого гена; EMCV IRES - внутренний сайт связывания рибосом вируса энцефаломиокардита (EMCV); DHFR - открытая рамка считывания дигидрофолатредуктазы мыши для селективного отбора и амплификации в эукариотических клетках; 3'CHEF-1 UTR - функциональный терминатор и сигнал полиаденилирования (7920-7925) гена фактора элонгации 1 альфа китайского хомячка, фланкированный 3'НТО этого гена.
На Фигуре 7 показана схема получения плазмид p1.2-Hygro-eGFP, p1.2-Neo-eGFP, p1.2-Zeo-eGFP. Обозначения: пунктирной линией обозначены стадии ПЦР, сплошной линией обозначены стадии рестрикции-лигирования, эндонуклеазы рестрикции, использовавшиеся для клонирования, указаны под названиями плазмид.
Существо настоящего изобретения и его промышленная применимость в биотехнологии иллюстрируются следующими примерами.
ПРИМЕРЫ
Пример 1. Получение плазмиды р1.2 Mono для моноцистронной экспрессии
Для получения плазмид р1.2 Mono проводили рестрикцию донорной плазмиды pAL-3CHEF123 SEQ ID NO:5 эндонуклеазами AgeI u NheI и лигировали полученный рестриктный фрагмент с акцепторным фрагментом, полученным при рестрикции AgeI и NheI и дефосформилировании реципиентной плазмиды p1.1 (SEQ ID NO:6; карта плазмиды представлена на рис.6).
Рестрикцию донорной плазмиды вели 2 часа при 37°С, после чего продукты реакции рестрикции разделяли в 1% агарозном геле и выделяли с помощью набора реактивов Wizard SV Gel&PCR Clean-Up System по методике производителя. Реципиентную плазмиду p1.1 рестрицировали, инактивировали эндонуклеазы рестрикции прогреванием при 65°С в течение 20 минут и проводили дефосфорилирование щелочной фосфатазой («Fermentas», Литва) по протоколу производителя. Щелочную фосфатазу инактивировали прогреванием до 85°С в течение 20 минут. Рестрицированную и дефосфорилированную плазмиду переосаждали 3 объемами этанола, центрифугировали 10 минут на скорости 13200 об/мин при комнатной температуре, промывали осадок 70% спиртом, растворяли в воде и использовали для постановки реакции лигирования в рабочей концентрации 10-2 мкг/мкл. Очищенный донорный фрагмент и реципиентную плазмиду лигировали с использованием ДНК-лигазы фага Т4 и стандартного буферного раствора («Fermentas», Литва). Лигирование вели в объеме 10 мкл при молярном соотношении вектора и вставки 1:10, в течение 18 часов при комнатной температуре. Полученными лигазными смесями трансформировали клетки Е.coli штамма DH5α, с генотипом F-φ80lacZΔM15 Δ(lacZYA-argF) U169 recA1 endA1 hsdR17 (rk-, mk+)phoA supE44 λ- thi-1 gyrA96 relA1. Для этого к 200 мкл замороженной суспензии клеток Е.coli добавляли 5 мкл лигазной смеси, инкубировали на льду 20 минут для сорбции плазмидной ДНК, нагревали до 42°С в течение 45 секунд и инкубировали на льду в течение 5 минут. После чего добавляли 800 мкл питательного бульона SOB и инкубировали при 37°С в течение 60 минут. Затем переносили суспензию на чашку Петри с твердой агаризованной средой, содержащей ампициллин в концентрации 100 мкг/1 мл агара, и помещали в термостат на 18 часов при 37°С. Колонии Е.coli анализировали методом ПЦР с клонов с праймеров AD-3CHEF1-R (SEQ ID NO:7) и SQ-5CH6-F (SEQ ID NO:8). Отобранные клоны наращивали в 5 мл питательного бульона 2xYT-Amp, проводили выделение плазмидной ДНК с набором «Wizard Plus SV Minipreps». Нуклеотидную последовательность верифицировали при помощи ПЦР-секвенирования с праймеров AD-3CHEF1-R (SEQ ID NO:7) и SQ-5CH6-F (SEQ ID NO:8).
Пример 2. Получение плазмид pAL-Hygro, pAL-Neo и pAL-Zeo, содержащих гены устойчивости к антибиотиками и элементы для их экспрессии в животных клетках
Для получения плазмид pAL-Hygro, pAL-Neo и pAL-Zeo проводили ПЦР, используя адапторные праймеры AD-HYG-AscIF(SEQ ID NO:9) и AD-HYG-AscIR(SEQ ID NO:10), и плазмиды pcDNA3.1/Hygro, pcDNA3.1(+), pcDNA4/HisMax-TOPO в качестве матриц соответственно.
ПЦР проводили при помощи смеси Encyclo PCR Kit по (ЗАО «Евроген») инструкции производителя на приборе РТС-100 Thermal Cycler («MJ Reseach», США). Режим амплификации: 1) 95°С - 3 мин и 18 циклов: 95°С - 20 сек/градиент 52-65°С - 20 сек/72°С - 1 мин, финальная элонгация 72°С - 5 мин. Продукты ПЦР, размером 1707, 1538 и 1121 п.о. соответственно, выделяли из 1% агарозного геля, используя набор реактивов «Wizard SV Gel and PCR Clean-Up System» («Promega», США) по протоколу производителя, после чего лигировали в Т-вектор pAL-TA («Евроген», Россия), и трансформировали клетки E.coli полученной лигазной смесью, как описано в примере 1. Трансформантов высевали на чашки Петри с твердой агаризованной средой, содержащей ампициллин, X-Gal и IPTG, и помещали в термостат на 18 часов при 37°С. Колонии Е.coli, отобранные в результате бело-голубого скрининга, анализировали методом ПЦР с клонов с праймеров SP6 (SEQ ID NO:11)и T7prom (SEQ ID NO:12). Отобранные клоны наращивали в 5 мл питательного бульона 2xYT-Amp и проводили выделение плазмидной ДНК набором реактивов «Wizard Plus SV Minipreps» («Promega», США) по протоколу производителя, первичную нуклеотидную последовательность области вставки полученных плазмид pAL-Hygro, pAL-Neo и pAL-Zeo определяли методом ПЦР-секвенирования с использованием праймеров SP6 (SEQ ID NO:11)и T7prom (SEQ ID NO:12).
Пример 3. Получение плазмид р1.2 Hygro, p1.2 Neo и р1.2 Zeo для моноцистронной экспрессии
Для получения плазмид р1.2 Hygro, р1.2 Neo и р1.2 Zeo проводили рестрикцию плазмид pAL-Hygro, pAL-Neo и pAL-Zeo соответственно эндонуклеазой AscI и лигировали с акцепторным фрагментом, полученным при рестрикции AscI и дефосформилировании реципиентной плазмиды р1.2 Mono (карта плазмиды представлена на рис.2, последовательность SEQ ID NO:1). Рестрикцию донорных плазмид эндонуклеазой AscI вели 2 часа при 37°С, после чего продукты реакции рестрикции разделяли в 1% агарозном геле и выделяли с помощью набора реактивов Wizard SV Gel&PCR Clean-Up System no методике производителя. Реципиентную плазмиду p1.2 Mono рестрицировали 2 часа при 37°С, затем фермент инактивировали прогреванием при 65°С в течение 20 минут и проводили дефосфорилирование щелочной фосфатазой («Fermentas», Литва) по протоколу производителя. Щелочную фосфатазу инактивировали прогреванием до 85°С в течение 20 минут. Рестрицированную и дефосфорилированную плазмиду переосаждали 3 объемами этанола, центрифугировали 10 минут на скорости 13200 об/мин при комнатной температуре, промывали осадок 70% спиртом, растворяли в воде и использовали для постановки реакции лигирования в рабочей концентрации 10-2 мкг/мкл. Реакцию лигирования очищенных донорных фрагментов и реципиентной плазмиды и трансформацию лигатами клеток Е.coli штамма DHSa вели, как описано в примере 1. Колонии Е.coli анализировали методом ПЦР с клонов с праймеров AD-HYG-AscIR (SEQ ID NO:9) и 3CHEF6-F (SEQ ID NO:13), селектируя клоны с плазмидной ДНК, содержащие целевую вставку в нужной ориентации (отбирали клоны с сонаправленными промоторами генов селекционного маркера и целевого белка). Отобранные клоны наращивали в 5 мл питательного бульона 2xYT-Amp, проводили выделение плазмидной ДНК с набором «Wizard Plus SV Minipreps». Нуклеотидную последовательность верифицировали при помощи ПЦР-секвенирования с праймеров AD-HYG-AscIF(SEQ ID NO:9) и AD-HYG-AscIR(SEQ ID NO:10).
Плазмидные ДНК р1.2 Hygro, p1.2 Neo и р1.2 Zeo для трансфекции нарабатывали в клетках Escherichia coli (штамм Stb14, #11635018 «Invitrogen»), трансформированных экспрессионными конструкциями. Клетки культивировали в 0,5 л среды ТВ-Амп в течение 18 ч, и выделяли плазмиды с использованием набора EndoFree Plasmid MaxiKit («Qiagen», США) по протоколу фирмы-производителя.
Пример 4. Получение экспрессионных конструкций, кодирующих зеленый флуоресцентный белок eGFP
При помощи праймеров AD-EG-AbsF(SEQ ID 14) и AD-EG-NheR (SEQ ID 15) и pEGFP-c2 (Clontech, США) в качестве матрицы получили ПЦР-продукт eGFP PCR (SEQ ID 16), содержащий ОРС зеленого флуоресцентного белка (аминокислотная последовательн