Биомаркер для отбора пациентов и связанные с ним способы
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к способу анализа еx-vivo, будет ли больной раком субъект отвечать терапевтически на способ лечения. Для этого от пациента получают биологический образец, выбранный из группы, состоящей из образца общей крови, плазмы или сыворотки. Измеряют уровень IL10 и IFNγ в указанном биологическом образце, причем эти уровни определяются при использовании антител, специфических для IL10 и INFγ, соответственно. Проводят подсчеты соотношения IL10/IFNγ и сравнивают указанное соотношение IL10/IFNγ с пороговым уровнем. Соотношение IL10/IFNγ ниже 4 свидетельствует о том, что пациент будет развивать профилактический или терапевтический ответ на иммуногенную композицию. Группа изобретений относится также к применению IL10 и INFγ в качестве биомаркеров и набору для анализа вышеуказанного способа. Использование данного способа позволяет прогнозировать чувствительность больного раком к терапевтическому лечению, а также получить алгоритм для модификации лечения для улучшения ответа пациента на лечение. 4 н. и 8 з.п. ф-лы, 2 ил., 1 пр.
Реферат
Настоящее изобретение относится к области иммунологии и, в частности, к иммунотерапии пациентов против заболеваний, вызванных инфекцией или различными видами рака. Более конкретно, изобретение относится к способам для прогнозирования, является или не является ли пациент чувствительным к развитию профилактического или терапевтического ответа, предпочтительно иммунного ответа, после такой иммунотерапии. Настоящее изобретение относится к способам и композициям для повышения коэффициента выживания пациентов, которых подвергают лечению с помощью иммуногенной композиции, в частности терапевтической вакцины.
Традиционные методики вакцинации, вовлекающие введение в систему животного антигена (например, пептидов, белков), который может индуцировать иммунный ответ и, таким образом, защищать указанное животное, например, от инфекции, являются известными в течение многих лет. Такие методики дополнительно включают разработку как живых, так и инактивированных вакцин. Живые вакцины типично представляют собой аттенуированные непатогенные варианты инфекционного агента, которые являются способными стимулировать иммунный ответ, направленный против патогенного варианта инфекционного агента.
Многочисленные исследовательские группы также исследовали применение вакцин в качестве потенциального терапевтического средства при различных видах рака. Этот тип стратегии вакцинации обычно называется иммунотерапией.
В последние годы были достигнуты успехи в разработке рекомбинантных вакцин, в частности рекомбинантных живых вакцин, в которых чужеродные антигены, представляющие интерес, кодируются и экспрессируются из вектора. Среди них векторы на основе рекомбинантных вирусов были продемонстрированы как многообещающие и такие, которые играют важную роль в разработке вакцин. Многие вирусы были исследованы на их способность экспрессировать белки из чужеродных патогенов или опухолевой ткани, а также индуцировать специфические иммунологические ответы против этих антигенов in vivo. В общем случае, такие основанные на генах вакцины могут стимулировать мощные гуморальный и клеточный иммунные ответы, вирусные векторы могут также представлять собой эффективную стратегию как для доставки генов, кодирующих антиген, так и для того, чтобы способствовать и усиливать презентацию антигена. Для того чтобы использоваться в качестве носителя вакцины, идеальный вирусный вектор должен быть безопасным и позволять осуществлять эффективную презентацию необходимых специфических для патогена антигенов иммунной системе. Кроме того, векторная система должна соответствовать критерию, который позволяет осуществлять ее воспроизведение на промышленной основе. Таким образом, на сегодняшний день было получено несколько вирусных вакцинных векторов, все они обладают относительными преимуществами и ограничениями в зависимости от предложенного применения (для обзора рекомбинантных вирусных вакцин смотри, например, Harrop и Carroll, 2006, Front Biosci., 11, 804-817; Yokoyama и др., 1997, J Vet Med Sci., 59, 311-322).
В соответствии с наблюдением, сделанным в ранние 1990-е, которое заключается в том, что векторы на основе плазмидной ДНК могут непосредственно трансфицировать клетки животных in vivo, значительные усилия исследователей были направлены на разработку методик иммунотерапии, которые основываются на применении ДНК плазмид для индукции иммунного ответа, путем непосредственного введения в животных ДНК, которая кодирует антигены. Такие методики, которые также упоминаются как ДНК вакцинация или ДНК иммунотерапия, сейчас используются для того, чтобы вызвать защитный иммунный ответ в большом количестве моделей болезней. Для обзора ДНК вакцин смотри Reyes-Sandoval и Ertl, 2001 (Current Molecular Medicine, 1, 217-243).
Однако общая проблема в области вакцин представляла собой идентификацию средств для индукции достаточно сильного иммунного ответа у вакцинированных индивидуумов для защиты и/или лечения их от инфекции и заболевания, и, таким образом, продления выживания пациента, имеющего смертельное заболевание, например рак.
Таким образом, например, основное усилие в последние годы было направлено на открытие новых лекарственных соединений, которые действуют путем стимуляции определенных ключевых аспектов иммунной системы и которые будут служить для повышения иммунного ответа, индуцированного вакцинами. Большинство из этих соединений, называемых модификаторами иммунного ответа (IRM) или адъювантами, как выяснилось, оказывают воздействие посредством основных механизмов иммунной системы с помощью Toll-подобных рецепторов (TLR) для индукции биосинтеза различных важных цитокинов (например, интерферонов, интерлейкинов, фактора некроза опухоли и т.д., смотри, например, Schiller и др., 2006, Exp Dermatol., 15, 331-341). Эти соединения были продемонстрированы как такие, которые стимулируют быстрое высвобождение определенных цитокинов, имеющих происхождение от дендритных клеток, моноцитов/макрофагов, а также являются способными стимулировать В-клетки для секреции антител, которые играют важную роль в антивирусной и противоопухолевой активности IRM соединений.
Альтернативно, были предложены стратегии вакцинации, большинство из которых являются основанными на режиме вакцинации "примирования-повторной иммунизации". В соответствии с этими прописями вакцинации "примирования-повторной иммунизации" иммунная система сначала подвергается индукции путем введения пациенту примирующей композиции, а потом подвергается стимуляции путем введения второй композиции для повторной вакцинации (смотри, например, EP 1411974 или US 20030191076).
Кроме того, было продемонстрировано, что в контексте здравоохранения одна обработка может быть эффективной только в специфической группе пациентов. Таким образом, является желательным обеспечить врачей средствами и способами, которые будут позволять им сократить оптимальные персонализированные способы терапии пациента, то есть, назначать правильную терапию правильному пациенту в правильное время для обеспечения более высокого успеха лечения, для мониторинга ответа на такое лечение, для повышения эффективности лекарственного средства и безопасности, для устранения лечения, не являющегося необходимым в случае пациентов, для которых терапия не является приемлемой, для того чтобы уберечь пациента от токсичности, не являющейся необходимой, а также побочных эффектов, для снижения затрат пациентов и страховых агентств на не являющееся необходимым или опасное неэффективное лечение, а также для повышения качества жизни пациентов, в конечном счете, сделав рак контролируемым заболеванием, путем последовательного осуществления анализов в зависимости от необходимости.
В этой связи в литературе предлагаются различные средства и способы, такие, как например:
- Фармакогенетика, которая заключается в исследовании индивидуального ответа на лекарственные средства в качестве функции генетических различий. Эти ответы относятся к тому, как лекарственное средство функционирует у какого-либо данного индивидуума, как оно метаболизируется, его токсичности и необходимым дозировкам. С исследованиями в области генома человека фармакогенетика развилась в фармакогеномику. Фармакогеномика выходит за рамки фармакогенетики и имеет потенциал для обнаружения применений от открытия лекарственного средства, разработки, выявления цели и апробации до клинических испытаний;
- Метаболомика может также применяться в области предсказательной медицины. В отличие от фармакогенетики, которая является ограниченной генетическими факторами, фармакометаболомика является способной предсказать ответ индивидуума на лекарственное средство, основываясь не только на генетических факторах, но также и на негенетических факторах, таких, как другие лекарственные средства в организме пациента, состояние здоровья пациента в данный момент времени и т.д.
- Роль биомаркеров становится все более важной в клинической разработке терапевтических средств. Биомаркер может представлять собой индикатор нормальных биологических процессов, процессов заболевания или фармакологических ответов на терапевтическое вмешательство. Их роль колеблется от разделения популяции пациентов в отношении оказания помощи для идентификации пациентов, которые отвечают на лечение, против пациентов, не отвечающих на лечение, для определения эффективности терапевтического средства. Биомаркеры могут быть ценным средством в принятии лучших решений, которые будут снижать затраты на разработку лекарственного средства и позволят терапевтическим методам достичь правильной популяции пациентов быстрее.
Изобретение обеспечивает материалы и способы для прогнозирования эффективности лечения, вовлекающего введение иммуногенной композиции пациенту (то есть, иммунотерапевтическое лечение) при использовании биологических маркеров (биомаркеров), которые были определены как существенно надежная характеристика, которая коррелирует с желаемым иммунным ответом. Биомаркеры являются присутствующими в биологических образцах, полученных от пациента перед лечением с помощью указанной иммуногенной композиции. Способность прогнозирования клинического выхода лечения перед его началом позволит клиническим врачам и пациентам идентифицировать неэффективную терапию, принимать основанные на достоверной информации решения, относящиеся к курсу лечения, включая, стоит ли отказаться от или позволить осуществлять альтернативное терапевтическое вмешательство.
В настоящее время заявитель идентифицировал новое средство и стратегию вакцинации. В частности, настоящее изобретение относится к применению соотношения интерлейкин-10/интерферон гамма (IL10/IFNγ) в качестве биомаркера для прогнозирования, будет ли или нет пациент чувствительным к развитию профилактического или терапевтического ответа, предпочтительно иммунного ответа, путем введения иммуногенной композиции. Альтеранативно, соотношение интерферон гамма/интерлейкин-10 (IFNγ/IL10) может использоваться в качестве биомаркера в соответствии с настоящим изобретением, однако в этом случае выводы будут модифицированы.
Van den Boogaardt и др., 2006 (Transplantation, 82, 844-848), показали, что соотношение интерферон гамма/интерлейкин-10 (IFNγ/IL10) представляет собой ценное средство для различения между пациентами, отторгающими трансплантат, и пациентами, не отторгающими его, при пересадках почки.
Jamal и др., 2007 (Tuberculosis, 87, 279-287), продемонстрировали, что при легочной и внелегочной форме туберкулеза существует непосредственная взаимосвязь между соотношением интерферон гамма/интерлейкин-10 (IFNγ/IL10) и классификацией тяжести заболевания.
Подобно этому, Gomes-Silva и др., 2007, (Clinical and Experimental Immunology, 149, 440-444), показали, что высокий уровень IFNγ и низкий уровень IL10 ассоциируются с тяжестью лейшманиоза слизистой оболочки.
В соответствии с первым воплощением настоящее изобретение относится к способу лечения пациента от заболевания человека путем введения иммуногенной композиции, где указанный пациент является выбранным из популяции пациентов, которая состоит из пациентов, которые имеют низкое соотношение IL10/IFNγ.
Настоящее изобретение, таким образом, относится к способу лечения пациента от заболевания человека путем введения иммуногенной композиции, где указанный способ включает следующие этапы:
- отбора одного пациента из популяции пациентов, которая состоит из пациентов, имеющих низкое соотношение IL10/IFNγ,
- введения указанному выбранному пациенту указанной иммуногенной композиции.
В соответствии с другим воплощением настоящее изобретение относится к способу прогнозирования, является ли или нет пациент чувствительным к развитию профилактического или терапевтического ответа, предпочтительно иммунного ответа, путем введения иммуногенной композиции, где указанный способ включает следующие этапы:
- получения образца крови от указанного пациента;
- измерения уровней IL10 и IFNγ в указанном образце крови, и
- подсчета соотношения IL10/IFNγ, где низкое соотношение IL10/IFNγ свидетельствует о том, что пациент прогнозируется как такой, который имеет повышенную чувствительность к развитию профилактического или терапевтического ответа, предпочтительно иммунного ответа.
В соответствии с другим воплощением настоящее изобретение относится к способу отбора пациента, чувствительного к развитию профилактического или терапевтического ответа, предпочтительно иммунного ответа, путем введения иммуногенной композиции, при этом указанный способ включает следующие этапы:
- получения образца крови от указанного пациента;
- измерения уровней IL10 и IFNγ в указанном образце крови, и
- подсчета соотношения IL10/IFNγ, где низкое соотношение IL10/IFNγ свидетельствует о том, что пациент имеет повышенную чувствительность к развитию профилактического или терапевтического ответа, предпочтительно иммунного ответа.
В соответствии с другим воплощением настоящее изобретение относится к способу прогнозирования, будет ли или нет пациент чувствительным к тому, чтобы позитивно отвечать на лечение, включающее введение иммуногенной композиции, при этом указанный способ включает следующие этапы:
- получения образца крови от указанного пациента;
- измерения уровней IL10 и IFNγ в указанном образце крови, и
- подсчета соотношения IL10/IFNγ, где низкое соотношение IL10/IFNγ свидетельствует о том, что пациент прогнозируется как такой, который имеет повышенную чувствительность к развитию профилактического или терапевтического ответа, предпочтительно иммунного ответа.
В соответствии с другим воплощением настоящее изобретение относится к способу отбора пациента, чувствительного к тому, чтобы позитивно отвечать на лечение, включающее введение иммуногенной композиции, при этом указанный способ включает следующие этапы:
- получения образца крови от указанного пациента;
- измерения уровней IL10 и IFNγ в указанном образце крови, и
- подсчета соотношения IL10/IFNγ, где низкое соотношение IL10/IFNγ свидетельствует о том, что пациент имеет повышенную чувствительность к развитию профилактического или терапевтического ответа, предпочтительно иммунного ответа.
В соответствии с другим воплощением настоящее изобретение относится к ex-vivo способу анализа, будет ли пациент отвечать терапевтически на способ лечения, включающий введение иммуногенной композиции, где указанный способ анализа включает этапы:
- получения образца крови от указанного пациента;
- измерения уровней IL10 и IFNγ в указанном образце крови, и
- подсчета соотношения IL10/IFNγ, где низкое соотношение IL10/IFNγ свидетельствует о том, что пациент будет развивать профилактический или терапевтический ответ, предпочтительно иммунный ответ, на иммуногенную композицию.
В соответствии с другим воплощением настоящее изобретение относится к ex-vivo способу анализа, будет ли пациент отвечать терапевтически на способ лечения рака, путем введения иммуногенной композиции, где указанный способ анализа включает этапы:
- получения образца крови от указанного пациента;
- измерения уровней IL10 и IFNγ в указанном образце крови, и
- подсчета соотношения IL10/IFNγ, где низкое соотношение IL10/IFNγ свидетельствует о том, что пациент будет отвечать терапевтически на способ лечения рака.
Настоящее изобретение дополнительно относится к ex vivo способу лечения, включающему введение иммуногенной композиции, где способ анализа включает этап измерения уровней IL10 и INFγ в биологическом образце, в частности образце крови, полученном от пациента, подсчет соотношения IL10/IFNγ, где низкое соотношение IL10/IFNγ свидетельствует о том, что пациент будет развивать профилактический или терапевтический ответ, в частности иммунный ответ, на иммуногенную композицию.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный пациент является выбранным из популяции пациентов, которая состоит из пациентов, имеющих низкое соотношение IL10/IFNγ.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа, по крайней мере, на один антиген (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный пациент является выбранным из популяции пациентов, которая состоит из пациентов, имеющих низкое соотношение IL10/IFNγ.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный пациент является выбранным из популяции пациентов, которая состоит из пациентов, имеющих низкое соотношение IL10/IFNγ, и где указанный повышенный иммунный ответ представляет собой врожденный иммунный ответ. Врожденный иммунный является исходной иммунной защитой организма от патогенов и вызывается разнообразием клеток, включая клетки, презентирующие антиген, или "АРС". Эти клетки экспрессируют поверхностные и цитоплазматические рецепторы, которые узнают молекулы, имеющее чужеродное происхождение (например, бактериальные и вирусные нуклеиновые кислоты, белки, углеводы). При определении таких сигналов дендритные клетки и макрофаги вызывают защитный ответ, который включает высвобождение цитокинов (включая интерфероны, TNF-альфа и IL-12) и хемокинов, которые служат для привлечения клеток, таких, как незрелые дендритные клетки, макрофаги, NK клетки и гранулоциты, к сайту заражения. Врожденный иммунный ответ, таким образом, обеспечивает неспецифическую защиту, в то время как организм генерирует адаптивный ответ.
Настоящее изобретение, таким образом, относится к способу индукции иммунного ответа (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный способ включает следующие этапы:
- отбора одного пациента из популяции пациентов, которая состоит из пациентов, имеющих низкое соотношение IL10/IFNγ,
- введения указанному выбранному пациенту указанной иммуногенной композиции.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа, по крайней мере, на один антиген (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный способ включает следующие этапы:
- отбора одного пациента из популяции пациентов, которая состоит из пациентов, имеющих низкое соотношение IL10/IFNγ,
- введения указанному выбранному пациенту указанной иммуногенной композиции.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный повышенный иммунный ответ представляет собой врожденный иммунный ответ, при этом указанный способ включает следующие этапы:
- отбора пациента из популяции пациентов, которая состоит из пациентов, имеющих низкое соотношение IL10/IFNγ,
- введения указанным выбранным пациентам указанной иммуногенной композиции.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный способ включает следующие этапы:
- измерения у пациента уровней IL10 и IFNγ,
- подсчета соотношения IL10/IFNγ, и
- введения пациенту указанной иммуногенной композиции, если указанный пациент имеет низкое соотношение композиции IL10/IFNγ.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа, по крайней мере, на один антиген (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный способ включает следующие этапы:
- измерения у пациента уровней IL10 и IFNγ,
- подсчета соотношения IL10/IFNγ, и
- введения пациенту указанной иммуногенной композии, если указанный пациент имеет низкое соотношение IL10/IFNγ.
В соответствии с другим воплощением настоящее изобретение относится к способу индукции иммунного ответа (то есть, повышенного иммунного ответа) у пациента для лечения заболевания человека путем введения иммуногенной композиции, где указанный повышенный иммунный ответ представляет собой врожденный иммунный ответ, при этом указанный способ включает следующие этапы:
- измерения у пациента уровней IL10 и IFNγ,
- подсчета соотношения IL10/IFNγ, и
- введения пациенту указанной иммуногенной композиции, если указанный пациент имеет низкое соотношение IL10/IFNγ.
Как используется в данном случае по всей заявке, термины "любой" или "какой-либо" используются в смысле того, что они означают "по крайней мере, один", "по крайней мере, первый", "один или более" или "множество" из указанных соединений или этапов, если в контексте не указывается иное. Например, термин "клетка" включает множество клеток, включая их смеси. В частности, "по крайней мере, один" и "один или более" означает количество, которое составляет один или более одного, с особым предпочтением для одного, двух или трех.
Термин "и/или" при использовании где-либо в данной заявке включает значение "и", "или" и "все или какая-либо другая комбинация элементов, связанных с указанным термином".
Термин "приблизительно" или "около", как используется в данной заявке, имеет значение в пределах 20%, предпочтительно в пределах 10% и более предпочтительно в пределах 5%. Для обеспечения ясности, следует добавить, что "приблизительно х" является таким, которое включает указанное значение x.
Термины "пациент", "субъект" относятся к позвоночному животному, в частности представителю видов млекопитающих, и включают, но без ограничения, домашних животных, спортивных животных, приматов, включая людей.
Как используется в данной заявке, термин "лечение" или "процесс лечения" охватывает профилактику и/или терапию. В соответствии с этим иммуногенные композиции или способы настоящего изобретения не являются ограниченными терапевтическими применениями и могут использоваться с профилактической целью. Это охватывается в данной заявке термином "для развития профилактического или терапевтического иммунного ответа". "Профилактика" не является ограниченной предотвращением немедленного заболевания (например, инфекционного заболевания), этот термин дополнительно охватывает предотвращение долгосрочных последствий этих инфекций, таких, как цирроз или рак.
"Эффективное количество" или "достаточное количество" активного соединения представляет собой количество, достаточное для достижения выгодных или желательных результатов, включая клинические результаты. Эффективное количество может вводиться в один или более приемов. "Терапевтически эффективное количество" представляет собой количество, достаточное для достижения выгодных клинических результатов, включая, но без ограничения, ослабление одного или более симптомов, ассоциированных с развитием опухоли, вирусной инфекцией, а также предотвращение заболевания (например, предотвращение одного или более симптомов инфекции).
Термины "пациент, выбранный из популяции пациентов, которая состоит из пациентов, имеющих низкое соотношение IL10/IFNγ" будет пониматься как значение пациента, для которого уровни интерлейкина-10 и интерферона гамма были измерены так, как описано в данной заявке, и который имеет низкое соотношение IL10/IFNγ. Когда количество исследуемых пациентов больше 1, то указанные пациенты образуют популяцию пациентов.
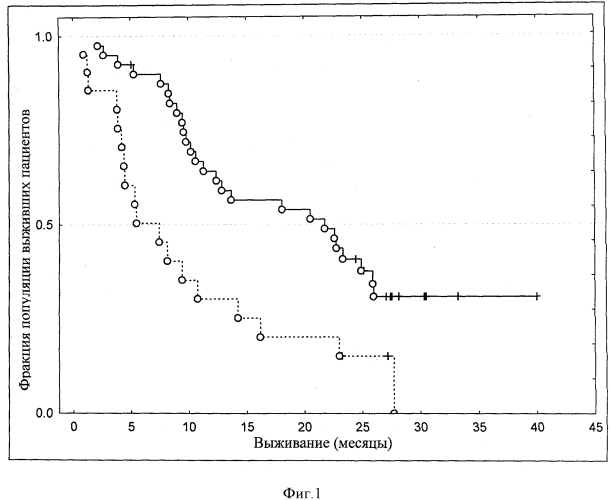
В соответствии со специальными воплощениями термины "пациент будет отвечать терапевтически" или "пациент будет позитивно отвечать на лечение" означает, что указанный пациент имеет повышение коэффициента выживания (смотри раздел примеров).
В предпочтительном воплощении изобретения способ в соответствии с изобретением включает начальный этап, который состоит в измерении уровней интерлейкина-10 и интерферона гамма в биологических образцах, полученных от пациента, перед введением иммуногенной композиции.
В соответствии с настоящим изобретением уровни интерлейкина-10 и интерферона гамма измеряются в биологическом образце, полученном от пациента. Биологические образцы включают, но не являются ограниченными таковыми, кровь и другие жидкие образцы биологического происхождения, твердые образцы тканей, такие, как кусочки биопсии. В предпочтительном воплощении биологический образец представляет собой кровь, плазму или сыворотку, в случае которых получение образцов от пациента представляет собой относительно простую и неинвазивную процедуру. Способы получения крови или сыворотки являются хорошо известными в области техники и не являются частью изобретения.
Кроме того, являются известными многочисленные способы для определения и количественной оценки полипептидов, включая биомаркеры, в соответствии с настоящим изобретением. Такие способы включают, но без ограничения, способы при использовании антител, в частности способы на основе моноклональных антител. Частные способы для определения и количественной оценки биомаркеров не являются важными для данного изобретения. Например, материалы и способы настоящего изобретения могут использоваться с методикой Luminex (Luminex Corporation, Austin, Тех.) или иммуносорбентными ферментными анализами (ELISA, многочисленные наборы ELISA являются коммерчески доступными, например, от CliniScience, Diaclone, Biosource).
В соответствии с одним воплощением изобретения уровни интерлейкина-10 и интерферона гамма определяются при использовании антител.
В соответствии с одним специфическим воплощением изобретения указанное(ые) антитело(антитела) представляет(ют) собой специфические для IL10 или INFγ.
В соответствии с одним специфическим воплощением изобретения указанные антитела являются моноклональными антителами.
В соответствии с одним специфическим воплощением изобретения указанные антитела являются меченными, например, с помощью флуоресценции, радиометки, фермента, биотина или с помощью других способов, предназначенных для обеспечения клеток, меченных с помощью указанных антител. Эти методики широко используются и являются известными в области техники.
В связанных с этим аспектах способ включает определение уровней интерлейкина-10 и интерферона гамма у пациента перед введением иммуногенной композиции пациенту; подсчет соотношения IL10/IFNγ; сравнение указанного соотношения IL10/IFNγ с пороговым значением; и предсказание эффективности иммунотерапевтического лечения, основываясь на уровнях соотношения IL10/IFNγ по сравнению с пороговым значением.
В соответствии со специальным воплощением указанное пороговое значение составляет приблизительно 5, предпочтительно приблизительно 4, более предпочтительно приблизительно 3 и, в частности, приблизительно 2. В соответствии с одним предпочтительным воплощением указанное пороговое значение составляет приблизительно 3,7, и более предпочтительно составляет 3,7. В соответствии с предпочтительным воплощением "низкое соотношение IL10/IFNγ" в соответствии с настоящим изобретением определяется сооношениями IL10/IFNγ, которые ниже приблизительно 5, предпочтительно ниже приблизительно 4 и более предпочтительно ниже приблизительно 3 и, в частности, ниже приблизительно 2. В соответствии с одним предпочтительным воплощением указанное "низкое соотношение IL10/IFNγ" в соответствии с настоящим изобретением определяется соотношениями IL10/IFNγ ниже приблизительно 3,7, и более предпочтительно ниже 3,7. В соответствии с предпочтительным воплощением уровни интерлейкина-10 и интерферона гамма измеряются с помощью твердофазного иммуноферментного анализа (ELISA), с помощью Luminex® анализа, с помощью лабораторной системы на чипах, с помощью радиоиммунного анализа или с помощью других систем, которые основываются на специфическом молекулярном узнавании IL10 и IFNγ при использовании антител или других специфических молекул.
Как используется в данной заявке, термины "иммуногенная композиция", "вакцинная композиция", "вакцина" или подобные термины могут использоваться попеременно и означают агент, приемлемый для стимуляции/индукции/усиления иммунной системы субъекта для облегчения существующего состояния или для защиты от, или для снижения настоящего или будущего вреда или инфекций (включая вирусные, бактериальные, паразитарные инфекции), например сниженную пролиферацию опухолевых клеток или выживание, сниженную репликацию патогена или распространение в организме субъекта или способное к определению снижение нежелательного(ых) симптома(ов), ассоциированного(ых) с состоянием, продление выживания пациента. Указанная иммуногенная композиция может содержать (i) весь или часть, по крайней мере, одного целевого антигена и/или (ii) по крайней мере, один рекомбинантный вектор, экспрессирующий in vivo всю или часть, по крайней мере, одной гетерологичной нуклеотидной последовательности, в частности гетерологичной нуклеотидной последовательности, кодирующей весь или часть, по крайней мере, одного целевого антигена. В соответствии с альтернативным воплощением иммуногенная композиция в соответствии с изобретением включает (iii) по крайней мере, один модификатор иммунного ответа, самостоятельно или в комбинации с (i) и/или (ii). Примеры таких модификаторов иммунного ответа (IRM) включают CpG олигонуклеотиды (смотри US 6,194,388; US 2006094683; WO 2004039829, например), липополисахариды, комплексы полиинозиновой:полицитидиловой кислоты (Kadowaki и др., 2001, J. Immunol. 166, 2291-2295), полипептиды и белки, известные для индукции продукции цитокинов дендритными клетками и/или моноцитами/макрофагами. Другие примеры таких модификаторов иммунного ответа (IRM) представляют собой малые органические молекулы, такие, как имидазохинолинамины, имидазопиридинамины, 6,7-слитые циклоалкилимидазопиридинамины, имидазонафтиридинамины, оксазолхинолинамины, тиазолхинолинамины и 1,2-соединенные мостиковой связью имидазолхинолинамины (смотри, например, US 4,689,338; US 5,389,640; US 6,110,929 и US 6,331,539).
В другом воплощении иммуногенная композиция включает клетки, которые стимулируют иммунный ответ пациента для лечения заболевания, такого, как рак. Указанные клетки могут представлять собой клетки, презентирующие антиген, такие, как дендритные клетки, объединенные с антигенной композицией (например, Provenge, разработанный Dendreon Corporation), опухолевыми клетками (например, GVAX, разработанный Cell Genesis) или лимфоцитами.
Как используется в данной заявке, термин "антиген" относится к любому веществу, включая комплексные антигены (например, опухолевых клеток, инфицированных вирусом клеток и т.д.), которые являются способными быть мишенью для иммунного ответа. Антиген может быть мишенью, например, для клеточного и/или гуморального иммунного ответа, возникающего у пациента. Термин "антиген" охватывает, например, все или часть вирусных антигенов, специфические для опухоли или связанные с опухолью антигены, бактериальные антигены, паразитарные антигены, аллергены и подобные им:
- Вирусные антигены включают, например антигены из вирусов гепатита A, B, C, D и E, ВИЧ, вирусов герпеса, цитомегаловируса, вируса ветряной оспы, папилломавирусов, вирусв Эпштейна-Барра, вирусов гриппа, вирусов парагриппа, аденовирусов, вирусов коксаки, пикорнавирусов, ротавирусов, респираторно-синцйтиальных вирусов, вирусов оспы, риновирусов, вируса краснухи, паповавируса, вируса эпидемического паротита, вируса кори; некоторые неограничивающие примеры известных вирусных антигенов включают следующие: антигены, имеющие происхождение от ВИЧ-1, такие, как tat, nef, gp120 или gp160, gp40, p24, gag, env, vif, vpr, vpu, rev или их часть и/или комбинации; антигены, имеющие происхождение от вирусов герпеса человека, такие, как gH, gL gM gB gC gK gE или gD или их часть и/или комбинации или предранний белок, такой, как asICP27, ICP47, ICP4, ICP36 из HSV1 или HSV2; антигены, имеющие происхождение от цитомегаловируса, в частности, цитомегаловируса человека, такие, как gB или его производные; антигены, имеющие происхождение от вируса Эпштейна-Барра, такие, как gp350 или его производные; антигены, имеющие происхождение от вируса ветряной оспы, такие, как gpl, 11, 111 и IE63; антигены, имеющие происхождение от вируса гепатита, такие, как антиген вируса гепатита В, гепатита С или гепатита E (например, env белок Е1 или Е2, сердцевинный белок, NS2, NS3, NS4a, NS4b, NS5a, NS5b, p7, или их части и/или комбинации HCV); антигены, имеющие происхождение от папилломавирусов человека (например, HPV6, 11, 16, 18, например L1, L2, E1, Е2, Е3, Е4, Е5, Е6, Е7, или их части и/или комбинации); антигены, имеющие происхождение от других вирусных патогенов, таких, как респираторно-синцитиальный вирус (например, F и G белки или их производные), вируса парагриппа, вируса кори, вируса эпидемического паротита, флавивирусов (например, вируса желтой лихорадки, вируса Денге, вируса клещевого энцефалита, вируса японского энцефалита) или вируса гриппа (например, НА, NP, NA или М белки, или их части и/или комбинации);
- Специфические для опухоли или родственные антигены включают, но без ограничения, такие карциномы, лимфомы, бластомы, саркомы и лейкемии. В частности, примеры видов рака включают рак молочной железы, рак предстательной железы, рак толстого кишечника, рак чешуйчатых клеток, мелкоклеточный рак легких, немелкоклеточный рак легких, желудочно-кишечный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак желчного пузыря, гепатому, колоректальный рак, эндометриальную карциному, карциному слюнных желез, рак почки, рак печени, рак женских наружных половых органов, рак щитовидной железы, печеночную карциному и различные виды рака головы и шеи, ренальный рак, злокачественную меланому, ларингеальный рак, рак предстательной железы. Раковые антигены представляют собой антигены, которые могут потенциально стимулировать очевидные специфические для опухоли иммунные ответы. Некоторые из этих антигенов кодируются, несмотря на то, что с необходимостью не экспрессируются, нормальными клетками. Эти антигены могут характеризоваться как такие, которые в норме являются молчащими (то есть, не экспрессируются) в нормальных клетках, такими, которые экспрессируются только на низких уровнях или на определенных стадиях дифференциации, и те, которые экспрессируются временно, такие, как эмбриогенные и фетальные антигены. Другие раковые антигены кодируются мутантными клеточными генами, такими, как онкогены (например, активированный ras онкоген), супрессорные гены (например, мутант р53), слитые белки, возникающие в результате внутренних делеций или хромосомных транслокаций. Другие раковые антигены могут кодироваться вирусными генами, например, такие, как те, которые имеют происхождение от РНК и ДНК опухолевых вирусов. Некоторые неограничивающие примеры специфических для опухоли или связанных с опухолью антигенов включают MART-1/Melan-A, gp100, дипептидилпептидазу IV (DPPIV), белок, связывающий аденозиндезаминазу (ADAbp), циклофилин b, колоректальный ассоциированный антиген (CRC)-C017-1 A/GA733, карциноэмбриональный антиген (СЕА) и его иммуногенные эпитопы САР-1 и САР-2, etv6, aml1, специфический антиген простаты (PSA) и его иммуногенные эпитопы PSA-1, PSA-2, и PSA-3, специфический мембранный антиген простаты (PSMA), Т-клеточный рецептор/СБ3-дзета цепь, MAGE-семейство опухолевых антигенов (например, MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-A10, MAGE-A11, MAGE-A12, MAGE-Xp2 (MAGE-B2), MAGE-Хр3 (MAGE-B3), MAGE-Xp4 (MAGE-B4), MAGE-C1, MAGE-C2, MAGE-C3, MAGE-C4, MAGE-C5), GAGE-семейство опухолевых антигенов (например, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7, GAGE-8, GAGE-9), BAGE, RAGE, LAGE-1, NAG, GnT-V, MUM-1, CDK4, тирозиназа, р53, MUC семейство (например, MUC-1), HER2/neu, p21ras, RCAS1, альфа-фетобелок, Е-кадгерин, альфа-катенин, бета-катенин и гамма-катенин, pl20ctn, gpl00.sup.Pmel117, PRAME, NY-ESO-1, cdc27, белок, характерный для аденоматозного полипоза толстой кишки (АРС), фодрин, коннексин 37, Ig-идиотип, р15, gp75, GM2 и GD2 ганглиозиды, вирусные продукты, такие, как белки вируса папилломы человека, Smad семейство опухолевых антигенов, lmp-1, P1A, кодируемый