Способ определения тиосульфата натрия в растворах
Иллюстрации
Показать всеИзобретение относится к аналитической химии и может быть использовано в системе контроля за содержанием тиосульфата натрия в растворах. Способ определения тиосульфата натрия в растворах характеризуется введением анализируемой пробы в реакционный сосуд, содержащий соответствующее количество фотогенерированного йода, полученного путем продувания 1-2 минуты воздухом и облучения стабилизированным источником света реакционной смеси, состоящей из 0,5 М раствора йодида калия, ацетатного буферного раствора с pH 5,6 и сенсибилизатора эозината натрия, фиксированием изменения тока в ячейке и по достижении его постоянства повторным продуванием реакционной смеси воздухом в течение 2-3 минут и повторным ее облучением стабилизированным источником света до достижения исходного количества йода в сосуде, фиксированием времени генерации йода, затраченного на восполнение его убыли, определением количества тиосульфата натрия по градуировочному графику по изменению силы тока и времени генерации. Изобретение обеспечивает упрощение способа определения тиосульфата натрия в растворах, а также отсутствие дорогостоящего оборудования. 10 табл., 5 ил.
Реферат
Изобретение относится к аналитической химии и может быть использовано в системе контроля за содержанием тиосульфата натрия в растворах.
Вопросы контроля качества и стандартизации лекарственных средств (ЛС) усиливают свою актуальность в настоящее время в связи с общим увеличением числа зарегистрированных в России лекарственных средств: за последние пять лет с 3,5 тысяч до 13,5 тысяч, поступающих, как правило, от разных производителей [Е.В. Дегтерев Анализ лекарственных средств в исследованиях, производстве и контроле качества / Дегтерев Е.В. / Рос. хим. ж. - 2002. - Т. XLVI, №4. - С.43-51].
Контроль доброкачественности ЛС, согласно правилам GLP, проводится по трем направлениям: установление подлинности, анализ чистоты и количественное определение действующего вещества. Для аналитического контроля доброкачественности ЛС на этапе производства целесообразно использовать простые, но надежные и производительные экспрессные методики анализа. Несмотря на то, что в настоящее время для определения действующего вещества в ЛС набольшее применение получили инструментальные методы, не утратили своего значения и титриметрические (объемные), достоинствами которых является простота исполнения, возможность введения новых титрантов и индикаторов, а также разработка новых приемов определения. Согласно Государственной Фармакопеи (ГФ), для определения тиосульфата натрия наибольшее применение получил йодометрический метод [Арзамасцев А.П. Анализ лекарственных смесей / А.П. Арзамасцев, В.М. Печенников, В.Л. Дорофеев, Э.Н. Аксенова / М: Компания спутник +. - 2000. - 275 с.], основным недостатком которого является необходимость стандартизации титранта, затруднения его хранения и проведение рутинного анализа. Устранить данные недостатки позволяет применение инструментальных способов определения тиосульфата натрия.
Известен фотометрический способ определения тиосульфата натрия, основанный на восстановлении его боргидридом калия до сульфида, взаимодействие последнего с N,N-диметил-n-фенилендиамином в присутствии солей трехвалентного железа [ГОСТ 25063.1-81 Материалы фотографические. Метод определения тиосульфата Государственный комитет СССР по стандартам. Москва. - 1982. - С.7].
Образуемая фотометрируемая форма нестабильна и способна разрушаться под действием кислорода воздуха, что в конечном итоге приводит к уменьшению воспроизводимости полученных результатов.
Известен способ количественного определения тиосульфата натрия йодометрическим методом, в основу которого положена реакция его взаимодействия с йодом [Г.А. Мелентьева, Л.А. Антонова. Фармацевтическая химия. М.: Медицина. - 1986. - с.91, Международная фармакопея (третье издание). - Т.3. Спецификация для контроля качества фармацевтических препаратов. Всемирная организация здравоохранения. Женева. - 1990. - с.236].
Основным недостатком предложенного метода является необходимость стандартизации титранта, строгое соблюдение условий его хранения.
Известен способ определения тиосульфата натрия в проявляюще-фиксирующем растворе, включающий введение в анализируемую пробу при pH=8,1-8,3 формалина, подкисление раствора, введение йода и последующее титрование избытка йода стандартным раствором тиосульфата натрия, при этом с целью повышения точности анализа в присутствии сульфита натрия, едкого натра, гидрохинона и метилфенидона, формалин вводят в соотношении с пробой, равном 0,7-0,9:1, и подкисление проводят серной кислотой до pH=1,1-1,3. SU 548808 МПК Кл.2 G01N 31/16, C01B 17/64, опубл. 28.02.77.
Однако данный способ используется для определения тиосульфата натрия в проявляюще-фиксирующем растворе, а при определении в лекарственных препаратах он не применяется. Основным недостатком метода является необходимость стандартизации титранта и применение рутинного анализа.
Наиболее близким к заявленному изобретению является кулонометрический способ определения натрия тиосульфата, основанный на взаимодействии электрогенерированного йода при pH 1,2 с определяемым веществом [Абуллина С.Г. Новые аспекты применения гальваностатической кулонометрии в фармацевтическом анализе. Автореферат диссертации на соискание ученой степени доктора фармацевтических наук. - Москва, Всероссийской научно-исследовательской институт лекарственных и ароматических растений (ВИЛАР)РАСХН, 2012. - 49 с.].
Недостатком рассмотренного способа определения является сложность аппаратурного оформления.
Задачей настоящего изобретения является разработка экспрессного и достоверного способа определения тиосульфата натрия в растворах.
Технический результат заявленного изобретения состоит:
- в упрощении способа определения за счет применения в качестве титранта фотогенерированного йода, при сохранении точности и предела обнаружения;
- отсутствие дорогостоящего оборудования.
Это достигается тем, способ определения тиосульфата натрия в растворах, характеризующийся введением анализируемой пробы в реакционный сосуд, содержащий соответствующее количество фотогенерированного йода, полученного путем продувания 1-2 минуты воздухом и облучения стабилизированным источником света реакционной смеси, состоящей из 0,5 М раствора йодида калия, ацетатного буферного раствора с pH 5, 6 и сенсибилизатора эозината натрия, фиксированием изменения тока в ячейке и по достижении его постоянства повторным продуванием реакционной смеси воздухом в течение 2-3 минут и повторным ее облучением стабилизированным источником света до достижения исходного количества йода в сосуде, фиксированием времени генерации йода, затраченного на восполнение его убыли, определением количества тиосульфата натрия по градуировочному графику по изменению силы тока и времени генерации.
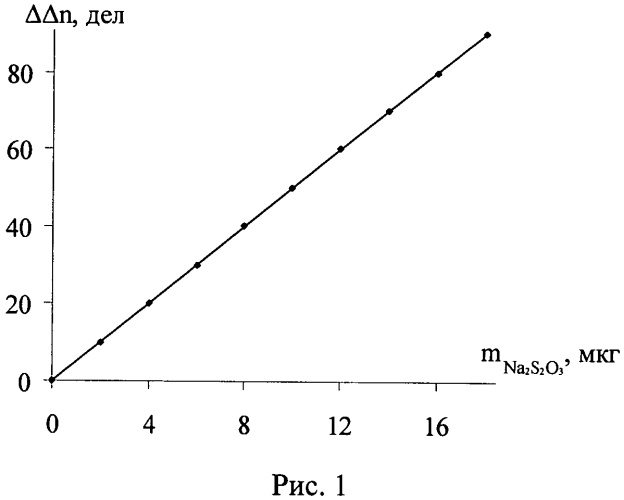
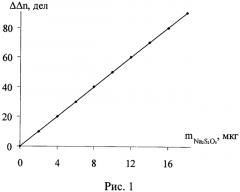
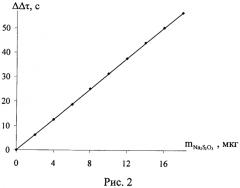
Сущность заявленного изобретения состоит в том, что в ячейке происходит изменение количества йода в результате химического взаимодействия натрия тиосульфата с титрантом, что приводит к уменьшению силы тока в амперометрической цепи. После достижения постоянства силы тока в амперометрической цепи поглотительный раствор вновь продували воздухом в течение 1-2 мин, повторно облучали светом до достижения исходного количества йода в сосуде и измеряли время генерации, пошедшее на восполнение убыли йода. Поглотительный раствор в ячейке заменяли после выполнения 20-30 анализов. Количество натрия тиосульфата в образце определяли по градуировочным графикам. См. рис. 1, 2. Результаты определения приведены в таблицах 1, 2. Достоверность полученных результатов подтверждали методами добавок и йодометрическим методом, рекомендованным ГОС фармацией [Международная фармакопея (третье издание). - Т.3. Спецификация для контроля качества фармацевтических препаратов. Всемирная организация здравоохранения. Женева.- 1990. - с. 236].
Способ, рекомендованный ГОС фармацией, - объемный, требует большего количества препарата, необходимость стандартизации титранта, визуального фиксирования точки эквивалентности и, как следствие, приводит к увеличению времени единичного определения и низкой воспроизводимости результатов. Предложенный метод автоматизирован, что исключает наличие визуальной ошибки, не требует дорогостоящего оборудования, что позволяет использовать его в условиях обычной контрольно-аналитической лаборатории.
Осуществления способа приведено в примере 1.
Пример 1. Для осуществления способа использовали раствор тиосульфата натрия для инъекций (ОАО «Эксом» г. Ставрополь, Староморьевское шоссе, 9 Г, серия 090313).
1 мл раствора для инъекций количественно переносили в мерную колбу емкостью 250 и доводили до метки бидистиллированной водой. Рабочий раствор анализируемого образца получали повторным разбавлением в 200 раз.
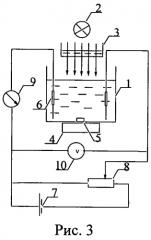
В сосуд для титрования (рис.3) помещали 40 мл 0,5 М раствора йодида калия, 10 мл раствора эозината натрия, 20 мл ацетатного буферного раствора с pH 5,6. Для получения фотогенерированного йода ячейку продувают 1-2 минуты воздухом и облучают стабилизированным источником света. Йод генерируют со скоростью 2,53·10-7 ммоль/с до содержания его 4·10-4 ммоль. О концентрации титранта судили по изменению силы тока в цепи амперометрической ячейки. После генерации йода отключали источник света и вводили 1 мл рабочего раствора, фиксируя при этом изменение показаний гальванометра. После достижения постоянства силы тока ячейку вновь продували воздухом в течение 2-3 минут, повторно облучали светом до достижения исходного количества йода в сосуде и измеряли время генерации, необходимое для восполнения убыли йода.
Для проведения последующих определений раствор, находящийся в сосуде для титрования, снова облучали светом, генерируя в нем определенное количество йода. Один и тот же поглотительный раствор позволяет проводить 10-20 определений. Содержание тиосульфата натрия определяли по градуировочным графикам, полученным по стандартным растворам (рис.1, 2). Достоверность полученных результатов контролировали по стандартной методике и методом добавок. Результаты определения натрия тиосульфата в растворе для инъекций представлены в таблицах 1, 2, 3.
Рис.1. График зависимости изменения силы тока от количества определяемого тиосульфата натрия (ΔΔn=5,0337m; R2=1)
Рис.2. График зависимости изменения силы тока от количества определяемого тиосульфата натрия (ΔΔτ=3,1328m; R2=1)
Рис.3. Установка для титрования веществ фотогенерированным йодом: 1 - сосуд для титрования; 2 - источник света; 3 - теплозащитный фильтр; 4 - магнитная мешалка; 5 - магнит; 6 - электроды; 7 - источник тока; 8 - делитель напряжения; 9 - гальванометр; 10 - вольтметр.
Результаты определения тиосульфата натрия, найденные фотохимическим методом по времени генерации (табл.1) и изменению силы тока (табл.2) согласуются между собой, а также с результатами, полученными по стандартной методике [Г.А. Мелентьева, Л.А. Антонова. Фармацевтическая химия. М.: Медицина. - 1986. - с.91, Международная фармакопея (третье издание). - Т.3. Спецификация для контроля качества фармацевтических препаратов. Всемирная организация здравоохранения. Женева. - 1990. - с.236]. Нижний предел определения тиосульфата натрия составляет 0,2 мкг по силе тока и 0,32 мкг по времени генерации йода в поглотительной ячейке.
| Таблица 1 | ||||||||
| Результаты определения тиосульфата натрия в растворе для инъекций, найденное по времени генерации (n=5, p=0,95) | ||||||||
| Анализируемая проба | Введено, мкг | ΔΔτ, с | Найдено, мкг | Sr, % | Найдено в мг/мл | |||
| Фотохимический метод | Sr, % | по ГОС фармации | Sr, % | |||||
| Раствор для инъекций - натрий тиосульфат | 0,0 | 18,7 | 5,98±0,30 | 5,0 | 299,0±14,6 | 4,9 | 299,0±15,0 | 5,0 |
| 5,0 | 34,4 | 10,98±30,42 | 3,8 | 299,0±14,6 | 4,9 | 300,0±15,0 | 5,0 | |
| 10,0 | 50,1 | 15,97±0,45 | 2,8 | 298,5±14,6 | 4,9 | 299,5±15,0 | 5,0 | |
| 0,0 | 18,8 | 6,01±0,30 | 5,0 | 300,5±14,5 | 4,8 | 299,7±14,5 | 4,8 | |
| 5,0 | 34,5 | 11,01±0,42 | 3,8 | 300,5±14,5 | 4,8 | 299,5±14,5 | 4,8 | |
| 10,0 | 50,1 | 15,97±0,45 | 2,8 | 298,5±14,5 | 4,9 | 299,0±14,5 | 4,8 |
| Таблица 2 | ||||||||
| Результаты определения тиосульфата натрия в растворе для инъекций, найденное по изменению силы тока (n=5, р=0,95) | ||||||||
| Анализируемая проба | Введено, мкг | ΔΔn, дел | Найдено, мкг | Sr, % | Найдено в мг/мл | |||
| Фотохимический метод | Sr, % | по ГОС фармации | Sr, % | |||||
| Раствор для инъекций - натрий тиосульфат | 0,0 | 30,0 | 5,95±0,30 | 5,0 | 297,5±14,6 | 4,9 | 299,0±15,0 | 5,0 |
| 5,0 | 55,2 | 10,95±0,43 | 3,9 | 297,5±14,6 | 4,9 | 300,0±15,0 | 5,0 | |
| 10,0 | 80,3 | 15,93±0,47 | 3,0 | 296,5±14,7 | 5,0 | 299,5±15,0 | 5,0 | |
| 0,0 | 30,1 | 5,97±0,30 | 5,0 | 298,5±14,6 | 4,9 | 299,7±14,5 | 4,8 | |
| 5,0 | 55,3 | 10,97±0,43 | 3,9 | 298,5±14,6 | 4,9 | 299,5±14,5 | 4,8 | |
| 10,0 | 80,5 | 15,97±0,47 | 2,9 | 298,5±14,6 | 4,9 | 299,0±14,5 | 4,8 |
Проведена валидационная оценка методики фотохимического определения тиосульфата натрия в растворе для инъекций по показателям - специфичность, линейность и аналитическая область методики, правильность и воспроизводимость. Специфичность, оцененная методом «введено - найдено», показала отсутствие влияния вспомогательных веществ (табл.1, 2) на определение тиосульфата натрия в растворе для инъекций. Зависимость между изменением силы тока (временем генерации) в цепи амперометрической установки и массой тиосульфата натрия имеет линейный характер, значение коэффициента линейной корреляции составляет 1,0000. Правильность и воспроизводимость оценивали путем сравнения полученных результатов с опорными значениями. Статистическая обработка 7 определений (табл.3) показала, что относительное стандартное отклонение составляет 0,3.
Опорное значение содержания тиосульфата натрия (300 мг/мл) лежит внутри доверительного интервала среднего значения (298,7±0,340 по силе тока, так и 298,9±0,278 по времени генерации), следовательно, систематическая ошибка отсутствует. Метод фотохимического титрования дает правильные результаты. Методика валидна по показателям специфичность, линейность и аналитическая область методики, правильность и воспроизводимость. Относительная ошибка среднего фотохимического определения тиосульфата натрия в растворе для инъекций составляет 0,4%.
| Таблица 3 | ||||||
| Метрологические характеристики методик фотохимического определения тиосульфата натрия в растворе для инъекций (р=0,95) | ||||||
| Анализируемая проба | Фотохимический метод | по ГОС фармации | ||||
| по времени генерации | по изменению силы тока | |||||
| Найдено, мг/мл | Метрологические характеристики | Найдено, мг/мл | Метрологические характеристики | Найдено, мг/мл | Метрологические характеристики | |
| Раствор для инъекций - натрий тиосульфат | 299,0 | Хср=298,9 | 298,5 | Хср=298,7 | 299,5 | Хср=299,7 |
| 299,0 | ΔХср=0,3 | 299,0 | ΔХср=0,3 | 300,0 | ΔХср=0,3 | |
| 299,0 | Sx=0,2236 | 298,5 | Sx=0,2739 | 299,5 | Sx=0,2550 | |
| 299,0 | Sr=0,001 | 299,0 | Sr=0,001 | 299,7 | Sr=0,001 | |
| 298,5 | εср=0,28% | 298,5 | εср=0,34% | 300,0 | εср=0,32% |
Фотогенерированный йод может быть использован для стандартизации раствора тиосульфата натрия. Осуществление способа приведено в примере 2.
Пример 2. Для осуществления способа готовили водный раствор тиосульфата натрия. Для этого 0,5000 г тиосульфата натрия (ч.д.а.) количественно перенесли в мерную колбу емкостью 250 мл и объем доводили до метки бидистиллированной водой. Рабочий раствор (2 мкг/мл) получали повторным разбавлением в 1000 раз.
Дальнейшее определение проводили по вышеуказанной методике. Результаты определения приведены в таблицах 4, 5.
Результаты определения тиосульфата натрия, найденные фотохимическим методом по времени генерации (табл.4) и изменению силы тока (табл.5), согласуются между собой, а также с результатами, полученными по стандартной методике [Г.А. Мелентьева, Л.А. АнтоноваФармацевтическая химия. М.: Медицина. - 1986. - с.91. Международная фармакопея (третье издание). - Т.3 Спецификация для контроля качества фармацевтических препаратов. Всемирная организация здравоохранения. Женева. - 1990. - с.236]. Относительное стандартное отклонение при определении тиосульфата натрия до 18,0 мкг не превышает 5,00%
| Таблица 5 | |||||||
| Результаты определения тиосульфата натрия в водном растворе, найденные по изменению силы тока (n=5, р=0,95) | |||||||
| Введено тиосульфата натрия | Δn, дел | ΔΔn, дел | Найдено в мкг | ||||
| Фотохимический метод | Sr, % | по ГОС фармации, | Sr, % | ||||
| V, мл | m N a 2 S 2 O 3 , мкг | ||||||
| 0,0 | 0,0 | 2,0 | - | - | - | - | |
| 1,0 | 2,0 | 11,9 | 9,9 | 1,98±0,10 | 5,1 | 1,98±0,11 | 5,6 |
| 2,0 | 4,0 | 22,0 | 20,0 | 3,98±0,18 | 4,5 | 4,00±0,18 | 4,5 |
| 3,0 | 6,0 | 32,1 | 30,1 | 6,00±0,18 | 3,0 | 6,00±0,18 | 3,0 |
| 4,0 | 8,0 | 41,9 | 39,9 | 7,94±0,24 | 3,0 | 7,98±0,24 | 3,0 |
| 5,0 | 10,0 | 52,5 | 50,2 | 9,96±0,28 | 2,8 | 10,0±0,28 | 2,8 |
| 6,0 | 12,0 | 62,8 | 60,8 | 12,06±0,33 | 2,7 | 11,96±0,33 | 2,8 |
| 7,0 | 14,0 | 72,2 | 70,2 | 13,94±0,38 | 2,7 | 14,00±0,38 | 2,7 |
| 8,0 | 16,0 | 82,1 | 80,1 | 15,92±0,44 | 2,8 | 15,90±0,44 | 2,8 |
| 9,0 | 18,0 | 92,5 | 90,5 | 17,98±0,49 | 2,7 | 17,90±0,49 | 2,7 |
| Таблица 4 | |||||||
| Результаты определения тиосульфата натрия в водном растворе, найденные по времени генерации (n=5, р=0,95) | |||||||
| Введено тиосульфата натрия | Δτ, с | ΔΔτ, с | Найдено в мкг | ||||
| Фотохимический метод | Sr, % | по ГОС фармации | Sr, % | ||||
| V, мл | m N a 2 S 2 O 3 , мкг | ||||||
| 0,0 | 0,0 | 1,5 | - | - | - | - | - |
| 1,0 | 2,0 | 7,6 | 6,1 | 1,95±0,10 | 5-1 | 1,98±0,11 | 5,6 |
| 2,0 | 4,0 | 24,0 | 12,5 | 3,97±0,17 | 4,3 | 4,00±0,18 | 4,5 |
| 3,0 | 6,0 | 20,2 | 18,7 | 5,97±0,18 | 3,0 | 6,00±0,18 | 3,0 |
| 4,0 | 8,0 | 26,5 | 25,0 | 7,97±0,23 | 2,9 | 7,98±0,24 | 3,0 |
| 5,0 | 10,0 | 32,9 | 31,4 | 10,03±0,27 | 2,7 | 10,0±0,28 | 2,8 |
| 6,0 | 12,0 | 39,2 | 37,7 | 12,03±0,33 | 2,7 | 11,96±0,33 | 2,8 |
| 7,0 | 14,0 | 45,4 | 43,9 | 14,00±0,37 | 2,6 | 14,00±0,38 | 2,7 |
| 8,0 | 16,0 | 51,7 | 50,2 | 16,00±0,45 | 2,8 | 15,90±0,44 | 2,8 |
| 9,0 | 18,0 | 57,8 | 56,3 | 17,95±0,48 | 2,7 | 17,90±0,49 | 2,7 |
Замена водного растворителя на органический приводит к изменению условий генерации йода, что сказывается на результатах определения тиосульфата натрия.
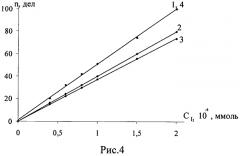
Первоначально была откалибрована установка в присутствии этилового спирта, ацетона и уксусной кислоты. Для этого измеряли показания гальванометра в отсутствие и в присутствии растворителей при добавлении раствора йода из микробюретки в систему, содержащую 40 мл 0.5 М раствора йодида калия, 20 мл ацетатного буферного раствора с pH 5,6. Результаты определения представлены в табл.6 и на рис.4.
| Таблица 6 | |||||
| Зависимость показаний гальванометра от концентрации йода в присутствии органических растворителей ( C I 2 1·10-4 М) | |||||
| Введено йода | Показания гальванометра, n | ||||
| V, мл | С·104, ммоль | H2O | органические растворители | ||
| C2H5OH | CCl4 | СН3СООН | |||
| 0,0 | 0,0 | 0,0 | 0 | 0 | 0,0 |
| 0,4 | 0,4 | 19,9 | 16,0 | 14,8 | 20,0 |
| 0,6 | 0,6 | 32,0 | 24,1 | 22,1 | 32,0 |
| 0,8 | 0,8 | 42,0 | 32,0 | 29,5 | 42,0 |
| 1,0 | 1,0 | 51,0 | 39,8 | 37,0 | 51,0 |
| 1,5 | 1,5 | 74,0 | 60,0 | 55,5 | 74,0 |
| 2,0 | 2,0 | 100,0 | 79,8 | 73,5 | 100,0 |
Рис.4. Зависимость показаний гальванометра от концентрации йода в водном растворе (1) и в присутствии 0,02 ммоль этанола (2), четыреххлористого углерода (3) и уксусной кислоты (4).
Из данных представленных в табл.6 и на рис.4 следует, что цена деления шкалы гальванометра по йоду в водных растворах и в присутствии уксусной кислоты одинакова (2,0·10-6 ммоль/дел), что свидетельствует об отсутствии протекания химической реакции между растворителем и реагентом.
Цена деления шкалы гальванометра по йоду в присутствии этилового спирта составляет 2,5·10-6 ммоль/дел, а в присутствии четыреххлористого углерода - 2,7·10-6 ммоль/дел. При этом в этих растворителях наблюдается линейная зависимость между показаниями гальванометра и концентрацией йода. Уменьшение чувствительности можно связать с частичным окислением спирта и испарением четыреххлористого углерода.
Введение ледяной уксусной кислоты, используемой в качестве растворителя, в раствор может привести к изменению pH, что повлечет к изменению скорости генерации йода. Авторами работы рекомендовано проводить фотогенерацию йода при оптимальных значениях pH 5÷9 [Додин Е.И. Фотохимический анализ / Е.И. Додин. М.: Металлургия. 1979. - С.54], которое создается использованием ацетатного буферного раствора.
Исследование влияния уксусной кислоты на изменение буферной емкости раствора, содержащего 40 мл 0,5 М раствора йодида калия, 20 мл ацетатного буферного раствора с pH 5,6 приведено в табл.7.
| Таблица 7 | |||||||
| Зависимость показаний pH-метра от количества уксусной кислоты, введенной в реакционную смесь | |||||||
| Введено уксусной кислоты, ммоль | 0,005 | 0,010 | 0,020 | 0,100 | 0,200 | 0,300 | 0,400 |
| pH | 5,58 | 5,57 | 5,54 | 5,37 | 5,22 | 5,11 | 5,02 |
Из полученных данных следует, что при концентрации уксусной кислоты менее 0,200 ммоль pH раствора остается практически постоянной. Следовательно, использование раствора уксусной кислоты в качестве растворителя не должно влиять на скорость генерирования йода (табл.8, рис.5).
| Таблица 8 | |||
| Зависимость показаний гальванометра от времени генерации йода при разных концентрациях уксусной кислоты | |||
| Время генерации йода τ, с | Показания гальванометра при концентрации уксусной кислоты в растворе, ммоль | ||
| 0,00 | 0,02 | 0,20 | |
| 0 | 0 | 0 | 0 |
| 10 | 16 | 16 | 15 |
| 20 | 32 | 32 | 31 |
| 30 | 48 | 48 | 48 |
| 40 | 64 | 64 | 63 |
| 50 | 80 | 80 | 79 |
Рис.5. Зависимость показаний гальванометра от времени генерации йода в отсутствии (1) и в присутствии (2) уксусной кислоты.
Из полученных данных видно, что скорость генерирования йода в водном растворе и в присутствии уксусной кислоты одинакова (2,53·10-7 ммоль/с), что вновь подтверждает отсутствие протекания химической реакции. Таким образом, уксусную кислоту можно использовать в качестве растворителя для перевода анализируемого вещества в раствор.
Применение уксусной кислоты для перевода тиосульфата натрия в раствор осуществлено в примере 3.
Пример 3. Для осуществления способа использовали водный раствор тиосульфата натрия. Для этого 0,5000 г тиосульфата натрия (ч.д.а.) количественно переносили в мерную колбу емкостью 250 мл, содержащую 10 мл ледяной уксусной кислоты, и объем доводили до метки бидистиллированной водой. Рабочий раствор (2 мкг/мл) получали повторным разбавлением в 1000 раз.
Дальнейшее определение проводили по вышеуказанной методике. Результаты определения приведены в таблицах 9, 10.
| Таблица 9 | |||||||
| Результаты определения тиосульфата натрия в уксуснокислой среде, найденные по изменению силы тока (n=5, р=0,95) | |||||||
| Введено тиосульфата натрия | Δn, дел | ΔΔn, дел | Найдено в мкг | ||||
| Фотохимический метод | Sr, % | по ГОС фармации | Sr, % | ||||
| V, мл | m N a 2 S 2 O 3 , мкг | ||||||
| 0,0 | 0,0 | 2,0 | - | - | - | - | |
| 2,0 | 4,0 | 22,0 | 20,0 | 3,98±0,18 | 4,5 | 3,97±0,18 | 4,5 |
| 4,0 | 8,0 | 42,0 | 40,0 | 7,96±0,25 | 3,1 | 7,90±0,24 | 3,0 |
| 6,0 | 12,0 | 62,4 | 60,4 | 11,98±0,33 | 2,8 | 11,96±0,33 | 2,8 |
| 8,0 | 16,0 | 82,0 | 80,0 | 15,90±0,44 | 2,8 | 15,90±0,44 | 2,8 |
| Таблица 10 | |||||||
| Результаты определения тиосульфата натрия в уксуснокислой среде, найденные по времени генерации (n=5, р=0,95) | |||||||
| Введено тиосульфата натрия | Δτ, с | ΔΔτ, с | Найдено в мкг | ||||
| Фотохимический метод | Sr, % | по ГОС фармации | Sr, % | ||||
| V, мл | m N a 2 S 2 O 3 , мкг | ||||||
| 0,0 | 0,0 | 1,5 | - | - | - | - | - |
| 2,0 | 4,0 | 24,0 | 12,5 | 3,97±0,17 | 4,3 | 4,00±0,18 | 4,5 |
| 4,0 | 8,0 | 26,5 | 25,0 | 7,97±0,24 | 3,0 | 7,98±0,24 | 3,0 |
| 6,0 | 12,0 | 39,0 | 37,5 | 11,96±0,32 | 2,7 | 11,96±0,33 | 2,8 |
| 8,0 | 16,0 | 51,5 | 50,0 | 15,95±0,44 | 2,8 | 15,90±0,44 | 2,8 |
Из данных табл.9, 10 следует, что полученные результаты характеризуются хорошей воспроизводимостью. Относительное стандартное отклонение при определении тиосульфата натрия в уксусно-водной среде не превышает 5,0%. Следовательно, уксусную кислоту можно использовать в качестве растворителя для количественного определения тиосульфата натрия.
Таким образом, предложенный фотохимический способ определения тиосульфата натрия в растворах экспрессен, не требует дорогостоящего оборудования, что позволяет использовать его в условиях обычной контрольно-аналитической лаборатории.
Способ определения тиосульфата натрия в растворах, характеризующийся введением анализируемой пробы в реакционный сосуд, содержащий соответствующее количество фотогенерированного йода, полученного путем продувания 1-2 минуты воздухом и облучения стабилизированным источником света реакционной смеси, состоящей из 0,5 М раствора йодида калия, ацетатного буферного раствора с pH 5,6 и сенсибилизатора эозината натрия, фиксированием изменения тока в ячейке и по достижении его постоянства повторным продуванием реакционной смеси воздухом в течение 2-3 минут и повторным ее облучением стабилизированным источником света до достижения исходного количества йода в сосуде, фиксированием времени генерации йода, затраченного на восполнение его убыли, определением количества тиосульфата натрия по градуировочному графику по изменению силы тока и времени генерации.