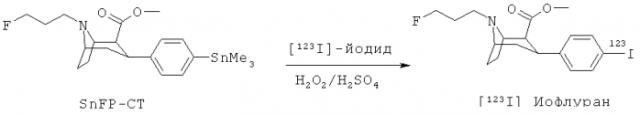Получение n-монофторалкилтропанов
Иллюстрации
Показать всеИзобретение относится к синтезу N-монофторалкилтропанов с использованием фторалкилйодидов, а также применению такого способа для получения нерадиоактивного тропанового промежуточного соединения формулы IV и последующего его превращения в 123I-меченое радиофармацевтическое средство DaTSCAN (123I-иофлупан). Способ заключается в алкилировании в присутствии основания соединения формулы (III) алкилирующим агентом формулы F-(CH2)mX, где m равно 2, 3 или 4, X представляет собой I. 5 н. и 5 з.п. ф-лы, 1 пр.
Реферат
Область изобретения
Настоящее изобретение относится к усовершенствованному синтезу N-монофторалкилтропанов с использованием фторалкилйодидов или фторалкилсульфонатных эфиров. Согласно изобретению предложено также применение такого способа для получения нерадиоактивного тропанового промежуточного FP-CIT (N-ω-фторпропил-2β-карбометокси-3β-(4-йодфенил)тропан) и последующего его превращения в 123I-меченое радиофармацевтическое средство DaTSCAN (123I-иофлупан). Предложено применение фторалкилйодидов или фторалкилсульфонатных эфиров в способе алкилирования по изобретению.
Предшествующий уровень техники
DaTSCAN™ 123I-иофлупан или 123I FP-CIT) получают следующим образом [Neumeyer et al, J. Med. Chem., 37, 1558-1561 (1994)]:
Содержащий триалкилолово нерадиоактивный предшественник SnFP-CT получают из нор-бета-CIT следующим образом [Neumeyer ег al, J. Med. Chem., 37, 1558-1561 (1994)]:
В Chi et al., J. Org. Chem., 52, 658-664 (1987) описан способ N-фторалкилирования амидов и аминов. Описанный химический процесс является нерадиоактивным, но разработан как подходящий для синтеза соответствующих 18F-меченых аналогов. Спиперон был использован в качестве модели амида для N-алкилирования амидов, и фенилпиперазин был использован в качестве модели амина для N-алкилирования аминов. Этот путь синтеза включает следующие стадии:
(1) замещение фторид-иона галогеноалкилтрифлата (т.е. трифторметансульфоната) с получением фторалкилгалогенида;
(2) N-алкилирование амида/амина фторалкилгалогенидом со стадии (1). Для N-алкилирования аминов Chi et al. используют только фторалкилбромиды.
В Shiue et al., J. Lab. Сотр. Radiopharm., 24, 55-64 (1987) описан следующий синтез [18F]-фторалкилгалогенидов:
Полученные [18F]-фторалкилгалогениды были использованы для N-алкилирования спироперидола, норметазоцина и лоразепама.
В Teng et al., Nucl. Med. Biol, 17(8), 811-817 (1990) описан синтез SCH аналогов:
Соединение 2a, раскрытое Teng, является нерадиоактивным (19F) производным, и его получают путем N-алкилирования соединения с R=Н 1-бром-3-фторпропаном. Соединение 2b, раскрытое Teng, является радиоактивным (18F) производным, и его получают путем N-алкилирования соединения с R=Н3-[18F]фтор-1-йод-пропаном.
Lannoye et al. [J. Med. Chem., 33, 2430-2437 (1990)] получали N-фторалкильные аналоги антагониста рецептора допамина D-2 раклоприда. Использованными алкилирующими агентами были 1-бром-3-фторпропан и 1-бром-2-фторэтан. В Halldin et al., Nucl. Med. Biol, 18(8), 871-881 (1991) раскрыто получение N-фторалкилсалициламидов, таких как раклоприд и этиклоприд, имеющих N-(CH2)n yF заместители, где n равно 2 или 3, и у равно 18 или 19. В этом способе синтеза использовано N-алкилирование заместителя вторичного амина бром-фторалканом Br-(CH2)n yF.
В Swahn et al., J. Lab. Сотр. Radiopharm., 38, 675-685 (1996) раскрыт синтез FP-CIT и соответствующего N-(2-фторэтильного) аналога (CIT-FE) посредством N-алкилирования нор-бета-CIT с использованием 1-бром-3-фторпропана и 1-бром-2-фторэтана соответственно.
Lundkvist et al. [Nucl. Med. Biol, 24, 621-627 (1997)] получали 18F-меченый аналог 123I-иофлупана, где радиоактивная метка 18F локализована в N-фторпропильной группе, посредством N-алкилирования нор-бета-CIT с использованием 18F-(CH2)3-Br.
Stehouwer ег al. [J. Med. Chem., 48, 7080-7083 (2005)] получали N-фторалкилфуран-замещенные тропаны следующим образом:
Yu et al. [Bioorg. Med. Chem., 16, 6145-6155 (2008)] получали N-производные фторалкилизохинолинкарбоксамида через N-алкилирование вторичного амида с использованием гидрида натрия и 1-бром-3-фторпропана или 1-бром-2-фторэтана.
Однако в настоящее время экспорт и импорт 1-бром-3-фторпропана (BFP) и родственных химических веществ запрещаются по всему миру из-за их разрушающих озоновый слой свойств. Таким образом, существует потребность в альтернативных жизнеспособных способах синтеза лекарственных средств и визуализирующих агентов, которые содержат N-фторалкильные заместители.
Настоящее изобретение
Традиционный путь синтеза N-монофторалкилтропанов требует использования бром-фторалканов формулы Br-(CH2)n yF, где n равно 2 или 3, и у равно 18 или 19. Представляется, что в данной области техники происходит сдвиг в сторону использования бромсодержащих соединений, а не йодоаналогов. Логика, как полагают, заключается в том, что при использовании реакционноспособного алкилирующего агента, такого как йодалкан, для простого алкилирования (например стерически затрудненных первичных аминов) наблюдается тенденция к образованию переалкилированных продуктов (например четвертичных аммониевых солей). Поэтому имеет место сдвиг в сторону использования бромалканов при простых алкилированиях, так как более низкая реакционная способность бромалкана дает возможность лучше контролировать степень алкилирования.
Проблема, связанная с такими бром-фторалканами, заключается в том, что они признаны разрушающими озоновый слой. Они, следовательно, все больше и больше признаются соответствующими регулирующими органами менее приемлемыми для использования, и, разумеется, производители экологически безопасных лекарственных средств или химических веществ не смогут их использовать. Следовательно, их коммерческая доступность прекращается, и их дальнейшее использование больше не является целесообразным. Однако существуют лекарственные и/или визуализирующие продукты, которые содержат такие N-монофторалкилтропаны.
Согласно настоящему изобретению предложено решение для продолжения изготовления таких желательных продуктов, лекарственных средств и/или визуализирующих агентов, которое исключает использование таких разрушающих озоновый слой химических веществ. Так, BFP относится к классу 1 разрушающих озоновый слой химических веществ с 0,02-0,7 ODP (потенциал разрушения озонового слоя) (относительно CFC-11, который имеет эталонное значение 1). 3-Фтор-1-йод-пропан (FIP) имеет точку кипения 127°С [J. Org. Chem., 121, 748-749 (1956)], поэтому он менее летучий, чем BFP (точка кипения 98-101°С). Перечень разрушающих озоновый слой химических веществ в Монреальском протоколе (который представляет собой договор о сокращении использования разрушающих озоновый слой веществ) включает органические молекулы, обычно алкилгалогениды, содержащие фтор, хлор или бром. Наиболее важным процессом (в отношении разрушения озонового слоя) является каталитическое разрушение озона атомарным хлором и бромом. Главным источником этих элементов являются CFC соединения (фреоны) и хладоны (бромфторсодержащие соединения). Однако йодсодержащие соединения не упоминаются, и в этом заключается преимущество йодсодержащих алкилирующих агентов по настоящему изобретению.
Алкилирующие агенты и способы по настоящему изобретению, как ожидается, быстрее осуществляют N-алкилирование, чем бромалканы предшествующего уровня техники. Кроме того, в случае аминов, которые плохо поддаются алкилированию, способ по настоящему изобретению с большей вероятностью будет обеспечивать улучшение.
Подробное описание изобретения
В первом аспекте настоящего изобретения предложен способ получения N-монофторалкилтропана формулы (IIIA):
включающий:
(1) предоставление предшественника, который содержит амин формулы
(III):
(2) алкилирование указанного предшественника алкилирующим агентом формулы F-(CH2)mX в присутствии основания и, возможно, в присутствии йодидной соли в подходящем растворителе с получением N-монофторалкилтропана формулы (IIIA),
где:
m равно 2, 3 или 4; и
X представляет собой I или -OSO2Ra, где Ra представляет собой C1-4алкил, С1-4перфторалкил или С5-8арил.
Предшественник формулы (III) известен в данной области как N-нор-бета-CIT.
Термин "основание" имеет его общепринятое химическое значение. Предпочтительным таким основанием является органическое основание. Предпочтительным органическим основанием является триэтиламин.
Под термином "йодидная соль " подразумевается соль, образованная йодид-ионом со щелочным металлом, предпочтительно йодид натрия или калия, или йодид четвертичного аммония (например йодид тетрабутиламмония). Предпочтительной такой солью является йодид натрия или калия, наиболее предпочтительно йодид калия.
Подходящими растворителями для реакции алкилирования на стадии (2) являются такие растворители, в которых и предшественник, и алкилирующий агент оба растворимы, а также растворители, которые стабильны в присутствии основания. Предпочтительные такие растворители включают толуол и DMF (диметилформамид), а также родственные растворители или их смеси. Растворители, содержащие кетонные или сложноэфирные функциональные группы, являются наименее предпочтительными.
Когда X представляет собой -OSO2Ra, и Ra представляет собой С5-8арил, тогда подходящие арильные группы включают фенильные группы, имеющие заместитель в положении 4, выбранный из метила (тозилат, или -OTs), брома (брозилат, или -OBs) и нитро (нозилат, или -ONs).
Тропан формулы (IIIA) и предшественник формулы (III) изображены без указания стереохимии. Приведенные структурные формулы охватывают все изомеры, диастереомеры и энантиомеры показанных химических структур.
Предпочтительные отличительные признаки
Предшественник согласно первому аспекту предпочтительно является синтетическим. Термин "синтетический" имеет общепринятое значение этого термина, т.е. изготовленный человеком, в отличие от выделенного из природных источников, например из организма млекопитающего. Такие соединения имеют преимущество в том, что их производство и профиль примесей можно полностью контролировать.
Для алкилирующих агентов согласно первому аспекту m предпочтительно равно 2 или 3, наиболее предпочтительно 3. Когда X представляет собой -OSO2Ra, тогда Ra предпочтительно выбран из -СН3 (мезилат -OMs), -CF3 (трифлат, -OTf) или -С6Н4СН3 (тозилат, или -OTs). В этом случае алкилирующий агент представляет собой сульфонатный эфир мезилат, трифлат или тозилат соответственно.
Алкилирующий агент предпочтительно представляет собой F-(CH2)mI с предпочтительными значениями т, указанными выше. Наиболее предпочтительным таким алкилирующим агентом является, следовательно, F-(СН2)3I.
В предшествующем уровне техники при алкилировании N-нор-бета-СIТ необходимо использовать йодид калия в качестве катализатора алкилирования с использованием 1-бром-3-фторпропана при нагревании в толуоле. Использование 3-фтор-1-фтор-пропана дает возможность применять более мягкие реакционные условия, но все же без переалкилирования. Когда X представляет собой I, тогда предпочтительно проводить способ согласно первому аспекту в отсутствии йодидной соли, что упрощает процедуру.
В структурной формуле (IIIA) предпочтительными значениями m являются значения, указанные выше, и, следовательно, наиболее предпочтительно m равно 3. Когда m=3, тогда продукт формулы (IIIA) представляет собой FP-CIT, или иофлупан. Предпочтительными алкилирующими агентами для получения соединения формулы (IIIA) являются агенты, которые определены выше, и, следовательно, наиболее предпочтительным алкилирующим агент является F-(CH2)3I/
Hор-бета-CIT может быть получен известным способом [Neumeyer et al., J. Med. Chem., 37, 1558-1561 (1994)]. Он также коммерчески доступен от АВХ GmbH, Heinrich-Glaeser-Strasse 10-14 D-01454 Radeberg, Germany.
Алкилирующие агенты формулы F-(CH2)mX, когда X=I, коммерчески доступны от Apollo Scientific (Whitefield Rd, Bredbury, Stockport, Cheshire SK6 2QR, USA) и SynQuest Laboratories, Inc. (PO Box 309, Alachua, FL 32616-0309, USA). Они также могут быть получены из соответствующего трифлата F-(CH2)mOTf (где Tf=трифлат) известным способом [Chi et al., J. Org. Chem., 52, 658-664 (1987)]. Фторированные спирты F-(CH2)mOH коммерчески доступны от Sigma-Aldrich и легко могут быть превращены в соответствующий сульфонатный эфир стандартными методами.
Несколько алкилирующих агентов, представляющих собой сульфонатные эфиры формулы F-(CH2)mOSO2Ra, также коммерчески доступны. Такие сульфонатные эфиры могут быть также получены стандартными способами (смотри, например, "March's Advanced Organic Chemistry", fifth edition, M.B. Smith and John Wiley & Sons 2001, page 1687, где суммированы сведения о способах получения таких эфиров сульфоновой кислоты).
Во втором аспекте настоящего изобретения предложен способ получения содержащего триалкилолово предшественника для радиойодинирования формулы IV:
включающий:
(1) осуществление способа согласно первому аспекту с получением N-монофторалкиламинного продукта формулы (IIIA);
(2) взаимодействие соединения формулы (IIIA) со стадии (1) с Sn2Rb 6 в присутствии подходящего катализатора с получением целевого предшественника для радиойодинирования формулы (IV);
где m такой, как определено в первом аспекте п.1, и
каждый R независимо представляет собой С1-4алкил.
Для способа согласно второму аспекту m и его предпочтительные аспекты являются такими, как определено в первом аспекте.
Металлоорганические предшественники формулы IV полезны для получения радиофармацевтических средств, как описано в третьем аспекте (ниже).
Предпочтительными группами Rb являются метил и бутил, более предпочтительно метил. Гексаметилдиолово коммерчески доступно от Sigma Aldrich. Гексабутилдиолово коммерчески доступно от Merck Schuchardt & Chemos. Получение и применение оловоорганических предшественников для радиойодирования описано в Bolton, J. Lab. Сотр. Radiopharm., 45, 485-528 (2002) и в Ali et al., Synthesis, 423-445 (1996).
В структурной формуле (IV) m предпочтительно равно 3, и Rb предпочтительно представляет собой метил, так что соединение формулы IV представляет собой SnFPCT:
В третьем аспекте настоящего изобретения предложено применение соединения формулы (I) или формулы (II), которые определены в первом аспекте, в качестве предшественника в способе получения согласно первому аспекту.
Для применения согласно третьему аспекту соединения формулы (I) или формулы (II) и их предпочтительные аспекты являются такими, как определено в первом аспекте.
В третьем аспекте настоящего изобретения предложен способ получения радиойодинированного тропана формулы (IIIB):
,
включающий:
(а) осуществление способа согласно первому аспекту с получением N-монофторалкиламинного продукта формулы (IIIA);
(б) осуществление способа согласно второму аспекту с получением предшественника для радиойодинирования формулы (IV);
(в) взаимодействие содержащего триалкилолово предшественника формулы (IV) со стадии (б) с источником радиоактивного йодида [xI]-йодида в присутствии подходящего окислителя с получением целевого продукта формулы (IIIB);
где xI представляет собой 124I или 123I.
Предпочтительные значения m в третьем аспекте такие, как определено в первом аспекте. В формуле (NIB) xI предпочтительно представляет собой 123I, более предпочтительно xI представляет собой 123I, и m равно 3, так что радиойодинированное соединение формулы (IIIB) представляет собой 123I-иофлупан.
Радиойодинированный тропан формулы (IIIB) предпочтительно получают в виде фармацевтической композиции вместе с биосовместимой средой-носителем. Термин "биосовместимая среда-носитель" относится к текучей среде, в частности к жидкости, в которой меченое соединение суспендировано или растворено, исходя из условия, что композиция является физиологически переносимой, т.е. что ее можно вводить в организм млекопитающего, не вызывая токсический эффект или чрезмерный дискомфорт. Подходящей биосовместимой средой-носителем является инъекционный жидкий носитель, такой как стерильная апирогенная вода для инъекций; водный раствор, такой как физиологический раствор (который предпочтительно может быть сбалансирован таким образом, чтобы конечный продукт для инъекций был либо изотоническим, либо не гипотоническим); водный раствор одного или более веществ, корректирующих тоничность (например солей из катионов плазмы с биосовместимыми противоионами), сахаров (например глюкозы или сахарозы), сахарных спиртов (например сорбита или маннита), гликолей (например глицерин) или других неионных полиолов (например~ полиэтиленгликолей, пропиленгликолей и т.п.). Биосовместимая среда-носитель может также содержать биосовместимые органические растворители, такие как этанол. Такие органические растворители полезны для солюбилизации более липофильных соединений или композиций. Предпочтительно биосовместимая среда-носитель представляет собой апирогенную воду для инъекций, изотонический физиологический раствор или водный раствор этанола. Такие водные растворы этанола могут иметь различные концентрации, но 5-10%-ный этанол предпочтителен для конечной композиции. Как указано выше, подходящий pH биосовместимой среды-носителя для внутривенных инъекций составляет от 4,0 до 10,5. Для 123I-меченых радиофармацевтических средств по настоящему изобретению подходящий рН биосовместимой среды-носителя составляет от 4,5 до 8,5, предпочтительно от 4,6 до 8,0, наиболее предпочтительно от 5,0 до 7,5.
Радиофармацевтические композиции по настоящему изобретению соответственно поставляются в шприце для клинических исследований или в контейнере, который снабжен укупорочным средством, пригодным для однократного или многократного прокалывания иглой для подкожных инъекций (например резиновой пробкой, обжатой колпачком) и сохраняющим полную стерильность. Такие контейнеры могут содержать однократные дозы ("стандартная доза") или многократные дозы для пациентов. Подходящие контейнеры представляют собой сосуд с герметичным укупорочным средством, позволяющим сохранять стерильность и/или радиоактивную безопасность и одновременно допускающим добавление и изъятие растворов шприцем. Предпочтительным таким контейнером является флакон, герметично укупоренный пробкой, причем газонепроницаемая пробка обжата дополнительным укупорочным средством (обычно из алюминия). Такие контейнеры имеют дополнительное преимущество в том, что пробка может выдерживать вакуум, если это желательно, например, для замены газа в свободном пространстве или дегазации растворов.
Когда радиофармацевтическое средство поставляется в многодозовом контейнере, предпочтительными являются такие контейнеры, которые представляют собой единый объемный флакон (например объемом от 10 до 30 см3), который содержит радиофармацевтическое средство в количестве, достаточном для введения доз многим пациентам. Таким образом, стандартные дозы для пациента можно отбирать в шприцы для клинического использования через различные интервалы времени на протяжении жизнеспособного срока службы препарата, находящегося в таком объемном флаконе, пригодного для клинической ситуации.
Радиофармацевтические шприцы, сконструированные для содержания однократной дозы для человека, или "стандартной дозы", предпочтительно представляют собой, следовательно, одноразовый или иной шприц, пригодный для клинического использования. Такие шприцы возможно могут быть снабжены защитным экраном для защиты оператора от радиоактивной дозы. Подходящие защитные экраны для радиофармацевтических шприцев известны в данной области, и различные конструкции таких защитных экранов коммерчески доступны и предпочтительно содержат либо свинец, либо вольфрам.
Радиофармацевтическая композиция возможно может также содержать дополнительные компоненты, такие как противомикробный консервант, рН-корректирующий агент или наполнитель. Под термином "противомикробный консервант" подразумевается агент, который ингибирует рост потенциально опасных микроорганизмов, таких как бактерии, дрожжи или плесневые грибы. Противомикробный консервант может также проявлять бактерицидные свойства в зависимости от дозы. Основная роль противомикробного(ых) консерванта(ов) по настоящему изобретению состоит в том, чтобы ингибировать рост любых таких микроорганизмов в радиофармацевтической композиции. Подходящий(е) противомикробный(ые) консервант(ы) включает(ют) парабены, т.е. метил-, этил-, пропил- или бутил-парабен или их смеси, бензиловый спирт, фенол, крезол, цетримид и тиомерсал. Предпочтительными противомикробными консервантами являются парабены.
Термин "рН-корректирующий агент" означает соединение или смесь соединений, используемых для обеспечения pH радиофармацевтической композиции в приемлемых пределах (приблизительно pH от 4,0 до 8,5) для введения человеку или млекопитающему. Подходящие такие pH-корректирующие агенты включают фармацевтически приемлемые буферы, такие как трицин, фосфатный буфер или TRIS [т.е. трис(гидроксиметил)аминоэтан], и фармацевтически приемлемые основания, такие как карбонат натрия, бикарбонат натрия или их смеси. Для 123I-FP-CIT предпочтительным буфером является фосфатный буфер.
Термин "наполнитель" означает фармацевтически приемлемый объемообразующий агент, который может облегчать обращение с материалом в процессе производства продукта. Подходящие наполнители включают неорганические соли, такие как хлорид натрия, и водорастворимые сахара или сахарные спирты, такие как сахароза, мальтоза, манит или трегалоза.
Радиофармацевтические средства по настоящему изобретению могут быть получены в асептических производственных условиях с получением желаемого стерильного, апирогенного продукта. Радиофармацевтические средства могут быть также получены в нестерильных условиях с последующей окончательной стерилизацией с использованием, например, гамма-излучения, автоклавированием, сухим нагревом, мембранной фильтрацией (иногда называемой стерильной фильтрацией) или химической обработкой (например этиленоксидом).
В четвертом аспекте настоящего изобретения предложено применение соединения формулы F-(CH2)mX в качестве алкилирующего агента для получения любого из следующих:
(1) соединение формулы (IIIA), как определено в первом аспекте;
(2) соединение формулы (IV), как определено во втором аспекте;
(3) соединение формулы (IIIB), как определено в третьем аспекте; где m и X такие, как определено в первом аспекте.
Для применения согласно четвертому аспекту m и X и их предпочтительные аспекты такие, как определено в первом аспекте; предпочтительные аспекты соединения формулы (IV) такие, как определено во втором аспекте; и предпочтительные аспекты соединения формулы (IIIB) такие, как определено в третьем аспекте.
В четвертом аспекте соединение формулы F-(CH2)mX предпочтительно применяют в качестве алкилирующего агента в способах получения, которые описаны в первом, втором и третьем аспектах.
В пятом аспекте настоящего изобретения предложено применение амина формулы (III), как определено в первом аспекте, в качестве предшественника в способе получения согласно первому аспекту.
Изобретение иллюстрируется неограничивающими Примерами, подробно описанными ниже. Пример 1 демонстрирует, что 3-фтор-1-йодпропан дает выходы, по меньшей мере сравнимые с выходами при использовании 1-бром-3-фторпропана в N-алкилировании N-нор-β-СIТ.
Пример 1: Альтернативный синтез FP-CIT с использованием 3-фтор-1-йодпропана
N-Hop-β-CIT (0,33 ммоль, 123 мг) растворяли в толуоле (20 мл/г, приблизительно 2 мл). К этому раствору добавляли 3-фтор-1-йодпропан (0,43 ммоль, 81 мг) и триэтиламин (0,45 ммоль, 45 мг). Реакционную смесь нагревали с обратным холодильником в инертной атмосфере (аргон/азот). Реакция по существу закончилась (по результатам проверки методом тонкослойной хроматографии; силикагелевые ТСХ-пластины элюировали смесью гексан-диэтиловый эфир-триэтиламин) через 6 часов. Растворитель удаляли выпариванием в вакууме, неочищенную реакционную смесь обрабатывали диэтиловым эфиром (6 мл) и эфирную фазу анализировали методом ВЭЖХ (обращено-фазовая С18, градиент ацетонитрил-вода-фосфатный буфер, УФ-детектирование при 230 нм). Неочищенный продукт содержал 87% целевого FP-CIT.
1. Способ получения N-монофторалкилтропана формулы (IIIA): включающий:(1) предоставление предшественника, который содержит амин формулы(III): (2) алкилирование указанного предшественника алкилирующим агентом формулы F-(CH2)mX в присутствии основания и возможно в присутствии йодидной соли в подходящем растворителе с получением N-монофторалкилтропана формулы (IIIA), где:m равно 2, 3 или 4; иX представляет собой I.
2. Способ по п. 1, где m равно 3 и алкилирующий агент представляет собой F-(CH2)3-I.
3. Способ получения содержащего триалкилолово предшественника для радиойодинирования формулы IV: включающий:(1) осуществление способа по п. 1 или 2 с получением N-монофторалкиламинного продукта формулы (IIIA);(2) взаимодействие соединения формулы (IIIA) со стадии (1) с Sn2Rb 6 в присутствии подходящего катализатора с получением целевого предшественника для радиойодинирования формулы (IV);где m такой, как определено в п. 1, икаждый Rb независимо представляет собой С1-4алкил.
4. Способ получения радиойодинированного тропана формулы (IIIB): включающий:(а) осуществление способа по п. 1 или 2 с получением N-монофторалкиламинного продукта формулы (IIIA);(б) осуществление способа по п. 3 с получением предшественника для радиойодинирования формулы (IV);(в) взаимодействие содержащего триалкилолово предшественника формулы (IV) со стадии (б) с источником радиоактивного йодида [xI]-йодида в присутствии подходящего окислителя с получением целевого продукта формулы (IIIB);где xI представляет собой 124I или 123I.
5. Способ по п. 4, где xI представляет собой 123I.
6. Способ по п. 4 или 5, где радиойодинированный тропан формулы (IIIB) получают в виде фармацевтической композиции вместе с биосовместимой средой-носителем.
7. Применение соединения формулы F-(CH2)mX в качестве алкилирующего агента для получения любого из следующих:(1) соединение формулы (IIIA), как определено в п. 1;(2) соединение формулы (IV), как определено в п. 3;(3) соединение формулы (IIIB), как определено в п. 4 или 5;где m и X такие, как определено в п. 1.
8. Применение по п. 7, где алкилирующий агент такой, как определено в п. 2.
9. Применение по п. 7 или 8, где способ получения такой, как определено в любом из пп. 1-6.
10. Применение амина формулы (III), как определено в п. 1, в качестве предшественника в способе получения по любому из пп. 1-6.