Средство для коррекции патологических изменений у жизнеспособного потомства, вызванных цитостатическим воздействием на организм матери
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к фармакологии, и касается расширения арсенала средств для коррекции патологических изменений состояния жизнеспособного потомства при цитостатическом воздействии. Для этого препарат глутоксим вводят крысам-самкам в дозе 50 мкг/кг за 5 дней до и через 5 дней после введения цитостатического препарата вепезид. Последний вводят однократно внутривенно в максимально переносимой дозе, равной 30 мг/кг. Установлено, что глутоксим может быть использован в качестве средства для коррекции патологических изменений у жизнеспособного потомства крыс, полученного от спаривания через 3 месяца после цитостатического воздействия. Применение глутоксима в качестве средства корригирующей терапии позволяет повысить эффективность и сократить ее побочные эффекты. 6 ил.
Реферат
Изобретение относится к области экспериментальной медицины и касается средства для коррекции патологических изменений жизнеспособного потомства крыс, вызванных цитостатическим воздействием на организм матери.
Имеющиеся клинические данные свидетельствуют о том, что у молодых пациенток, прошедших успешное химиотерапевтическое лечение по поводу онкологического заболевания, сохраняется фертильность и возникает желание родить ребенка [1]. В тоже время остается риск появления неполноценного потомства, поскольку цитостатические препараты, являясь заведомо генотоксическими соединениями, обладают способностью вызывать цитогенетические нарушения в половых клетках [2].
В настоящее время существуют данные о высоком риске врожденных патологий у потомства женщин, перенесших цитостатическое лечение по поводу онкологического заболевания [3]. В экспериментальных работах изучено состояние потомства крыс-самок, получавших цитостатические препараты до скрещивания с интактными крысами-самцами [4, 5]. Установлено, что это потомство характеризуется сниженным индексом выживаемости, повышенной эмбриональной гибелью. К патологическим изменениям жизнеспособного потомства относятся ряд признаков, таких как повышенное число патологических изменений внутренних органов, нарушение ориентировочно-исследовательского поведения (тест «открытое поле»), сниженная способность к обучению (тест «условный рефлекс пассивного избегания»), к избеганию стресс ситуации (тест Хандерсона в модификации Н.А. Бондаренко) [4, 5]. В связи с вышеизложенным поиск средств коррекции выявленных нарушений у потомства является актуальным. К числу таких фармпрепаратов относится средство растительного происхождения экстракт шлемника байкальского (ЭШБ). При его сочетанном введении с цитостатическим препаратом отмечалось снижение эмбриональной гибели, возрастание индекса выживаемости крысят [6]. Недостатком ЭШБ является отсутствие эффективности в отношении жизнеспособного потомства.
Известно лекарственное средство синтетического происхождения, используемое в качестве корректора патологических изменений у жизнеспособного потомства крыс-самок, перенесших цитостатическое воздействие [6]. Это препарат синтетического происхождения - месна. Препарат относится к SH-содержащим соединением (тиолы) и обладает антиоксидантной активностью. Установлено, что в жизнеспособном потомстве крыс-самок, получавших сочетанное введение цитостатического препарата и месны за 3 мес до спаривания, выявляется меньшее количество плодов с патологическими изменениями внутренних органов [6]. Данное лекарственное средство является наиболее близким к заявляемому по природе происхождения и выбрано в качестве прототипа.
Недостатком месны является недостаточная эффективность, наличие ряда побочных эффектов. Он может вызывать тошноту, рвоту, головную боль, снижение артериального давления, аллергические реакции [7]. Месна не обладает противоопухолевыми свойствами и при сочетанном введении с цитостатическими препаратами не усиливает их эффективность [7].
Задачей данного изобретения является расширение арсенала средств коррекции патологических изменений состояния потомства, полученного от спариванияя через 3 мес после введения цитостатического препарата с интактными крысами-самцами.
Поставленная задача достигается техническим решением, представляющим собой применение в качестве средства коррекции патологических изменений у потомства крыс-самок, спаренных через 3 мес после цитостатического воздействия, препарата глутоксим в дозе 50 мкг/кг за 5 дней до и через 5 дней после введения цитостатического средства.
Техническим результатом данного изобретения является расширение арсенала средств коррекции патологических изменений состояния потомства, полученного от спариванияя через 3 мес после введения цитостатического препарата с интактными крысами-самцами. Это приводит к повышению эффективности корригирующей терапии и сокращению ее побочных эффектов.
Глутоксим играет важную роль в регуляции метаболических процессов в клетках и тканях. Он приводит к восстановлению чувствительности поверхностно-клеточных рецепторов к регуляторным и транспортным молекулам пептидной природы, что определяет иммуномоделирующий, гемостимулирующий, токсикомодифицирующий эффекты препарата [7]. Глутоксим активирует антиперекисные ферменты, которые активируют внутриклеточные реакции тиолового обмена, а также процессы синтеза серо- и фосфоросодержащих макроэргических соединений, необходимых для нормального функционирования внутриклеточных регуляторных систем. В настоящее время показана целесообразность и возможность использования глутоксима в онкологической практике. Препарат используется при опухолях любой локализации как компонент противоопухолевой терапии с целью повышения чувствительности опухолевых клеток к химиотерапии, в том числе при развитии частичной или полной резистентности [8]. Глутаксим является практически нетоксичным соединением [7].
В результате проведенных нами экспериментальных исследований обнаружено неизвестное до сих пор свойство глутаксима - оказывать корригирующее влияние при патологических нарушениях у жизнеспособного потомства крыс-самок, перенесших цитостатическое воздействие.
Новое свойство глутоксима является для специалиста фактом неочевидным и не вытекает из уровня техники и не обнаружено в патентной и научно-медицинской литературе. Глутоксим может быть использован в медицинской практике в качестве средства коррекции патологических изменений жизнеспособного потомства женщин, перенесших цитостатическое воздействие. Преимуществом глутоксима по сравнению с месной является более широкий спектр положительного влияния на жизнеспособное потомство. Препарат приводит не только к снижению число плодов с патологическими изменениями наружных и внутренних органов, но и оказывает благоприятное влияние на ЦНС, а именно нормализует скорость формирования сенсорно-двигательных рефлексов (рефлекс «переворачивания на плоскости»), улучшает ориентировочно-исследовательское поведение (тест «открытое поле»); способность к обучению (тест «условный рефлекс пассивного избегания»); способность к адаптивному поведению (тест «избегания стресс-ситуации по Хандерсону в модификации Н.А. Бондаренко). Другим преимуществом глутоксима по сравнению с месной является отсутствие побочных эффектов и то, что он может быть компонентом противоопухолевой терапии [7].
Таким образом, предлагаемое изобретение соответствует критериям патентоспособности «новизна», «изобретательский уровень», «промышленная применимость».
Данное изобретение будет понятно из следующего описания и приложенных к нему рисунков (1-6).
На рис. 1-6
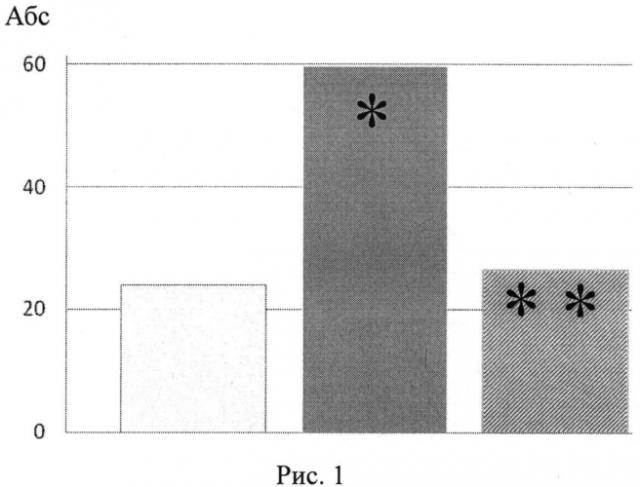
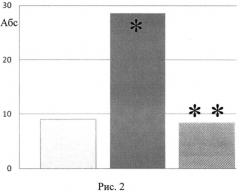
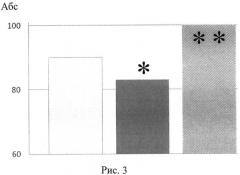
- фон (интактные животные), - контроль - потомство крыс-самок, получавших вепезид, - потомство крыс-самок, получавших вепезид + глутаксим
различия достоверны ∗по сравнению с фоном, при P≤0,05. - различия достоверны ∗∗по сравнению с группой вепезид, при P≤0,05).
На рис. 1 изображены данные подсчета количества жизнеспособных плодов с наружными патологическими изменениями потомства крыс-самок, которым вводили противоопухолевый препарат вепезид в сочетании с глутаксимом за 3 мес до спаривания с интактными самцами.
На рис. 2 изображены данные о количестве жизнеспособных плодов с патологическими изменениями внутренних органов потомства крыс-самок, которым вводили противоопухолевый препарат вепезид в сочетании с глутаксимом за 3 мес до спаривания с интактными самцами.
На рис. 3 изображено количество крысят (в процентах) со сформировавшимся рефлексом «избегания края» на 5-й день жизни в потомстве крыс-самок, которым вводили противоопухолевый препарат вепезид в сочетании с глутаксимом за 3 мес до спаривания с интактными самцами.
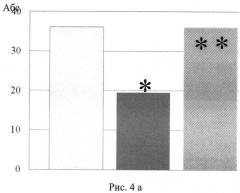
На рис.4 изображено количество пересеченных квадратов (а), поднятий на задние лапки (б) у крыс-самцов потомства крыс-самок, которым вводили противоопухолевый препарат вепезид в сочетании с глутаксимом за 3 мес до спаривания с интактными самцами (тест «открытое поле»).
На рис. 5 изображено время пребывания крыс-самцов в светлой камере во второй день опыта потомства крыс-самок, которым вводили противоопухолевый препарат вепезид в сочетании с глутаксимом за 3 мес до спаривания с интактными самцами (тест «условный рефлекс пассивного избегания»).
На рис. 6 изображено время поднятия на сетку у крыс-самцов потомства крыс-самок, которым вводили противоопухолевый препарат вепезид в сочетании с глутаксимом за 3 мес до спаривания с интактными самцами (тест «избегания стресс ситуации»).
Пример. Эксперименты были проведены на 45-и крысах-самках линии Вистар. Для скрещивания было использовано 24 крысы-самца. Животные были получены из лаборатории биологического моделирования НИИ фармакологии СО РАМН. Содержание крыс осуществлялось в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986). В качестве модели цитостатического воздействия был выбран широко используемый в онкологической практике препарат, принадлежащий к группе подофиллотоксинов, - вепезид (этопозид, Teva, Израиль). Препарат оказывает токсическое воздействие на жизнеспособное потомство при введении его в МПД крысам-самкам [9]. Так, его введение крысам-самкам за 3 мес до скрещивания приводит к повышению у потомства количества пловов с патологическими изменениями наружных и внутренних органов, угнетению скорости формирования сенсорно-двигательных рефлексов, снижает способность у потомства к обучению и к адаптивному поведению, т.е. оказывает токсическое действие на ЦНС [9]. Экспериментальные животные были разделены на 3 группы. Первая группа крыс представляла собой крыс интактных животных (фон), которые получали эквиобъемное количество растворителя вепезид. Крысам второй группы (контроль) вводили вепезид однократно, внутривенно в максимально переносимой дозе (МПД, равной 30 мг/кг), рассчитанной методом графического пробит-анализа. Крысы третьей группы получали глутоксим в дозе 50 мкг/кг за 5 дней до и 5 дней после введения цитостатического препарата. Через 3 мес после введения вепезида крыс-самок ссаживали с интактными самцами. Спаривание регистрировали с помощью вагинальных мазков. Часть самок умерщвляли методом смещения шейных позвонков на 20-й день беременности. Проводили макроскопический осмотр живых плодов. Затем плоды помещали в раствор Боуэна для фиксации и последующего исследования состояния внутренних органов по методу Вильсона [10]. Остальных самок оставляли до родов. Состояние потомства оценивали в течение 2 мес после рождения. На 5-й и 30-й день оценивали скорость формирования сенсорно-двигательных рефлексов. Так, на 5-й день изучали способность крысят к избеганию обрыва, на 20-й день жизни изучали скорость созревания сенсорно-двигательных рефлексов в тесте «открытое поле». На 60-й день жизни оценивали способность к обучению и способность к адаптивному поведению в тестах «условный рефлекс пассивного избегания (УРПИ) и способность избегать стресс ситуацию в тесте Хандерсона в модификации Н.А. Бондаренко [10, 11]. При статистической обработке использовали критерий Манна-Уитни и угловое преобразование Фишера.
В антенатальном периоде у потомства крыс-самок, получавших вепезид (контроль), выявлялось статистически значимое возрастание количества живых плодов с внешними патологическими изменениями и изменениями внутренних органов (рис. 1, 2). В постнатальном периоде наблюдалось снижение скорости формирования рефлекса «избегания края» (рис. 3), снижение горизонтальной и вертикальной двигательной активности и в тесте «открытое поле» (рис. 4). В тесте УРПИ было выявлено, что время нахождения крысят, полученных от самок, которым вводили вепезид, в светлой камере во второй день опыта оказалось сниженным (рис. 5), что свидетельствует о том, что в этой группе животных наблюдалось снижение способности к обучению. На фоне введения вепезида выявлялось также снижение способности потомства к избавлению от стресс-ситуации. Так, время поднятия на сетку возрастало в 5 раз (рис. 6).
Введение глутоксима нивелировало повреждающее действие вепезида на состояние потомства крыс-самок опытной группы. Из рис. 1 и рис. 2 видно, что при сочетанном введении препаратов количество плодов с патологическими изменениями внешних и внутренних органов достоверно снижалось и практически не отличалось от таковых у интактных животных (фон). Процент крысят со сформировавшимся рефлексом «избегания обрыва» в опытной группе животных статистически значимо превышал таковой в контроле и не отличался от фоновых значений (рис. 3). На рис. 4. представлены результаты изучения вертикальной и горизонтальной двигательной активности крысят опытной группы в условиях «открытого поля». Так, горизонтальная и вертикальная двигательная активность потомства после сочетанного введения вепезида и глутаксима крысам-самкам возрастала в 2-3 раза по сравнению с таковым при введении одного вепезида и не отличалась от фоновых значений (рис. 4аб.) Потомство крыс-самок, получавших вепезид и глутаксим, характеризовалось большей способностью к обучению, так как время нахождения в светлой камере на второй день опыта оказалось повышенным по сравнению с таковым в контроле и не отличалось от фоновых значений. (рис. 5). Потомство экспериментальной группы лучше адаптировалось в стресс-ситуации (тест Хандерсона). Так, на фоне сочетанного введения препаратов время поднятия на сетку составило 5,25±1,83, в то время как при использовании одного вепезида - 23,83±14,07.
Представленные данные свидетельствуют о том, что жизнеспособное потомство крыс-самок, получавших на фоне введения вепезида глутаксим, характеризовалось меньшим числом патологических изменений, чем потомства крыс-самок, получавших один вепезид, что позволяет сделать заключение о том, что глутаксим является эффективным средством корреции патологических изменений состояния потомства крыс-самок, перенесших цитостатическое воздействие.
Литература
1. Урманчеева А.Ф., Кутушева Г.Ф. Проблемы фертильности, контрацепции и заместительной терапии у пациенток после лечения рака молочной железы. // Практическая онкология. 2002. Т. 3, №1. С. 53.
2. Дурнев А.Д. Середенин С.Б. Мутагены скрининг и фармакологическая профилактика воздействий. М.: Медицина. 1998. С. 60.
3. Гавриленко Т.В., Заева Г.Е., Нечужкина И.В., Моисеенко Е.И., Козлова В.М., Сусулева Н.А., Шмаков Р.Г. Здоровье потомства пациентов, в детстве излеченных от онкологических заболеваний // В кн. Рак и репродукция под. ред. Параконной А.А. М., 2011. С. 102.
4. Боровская Т.Г., Гольдберг В.Г., Полуэктова М.Е., Пахомова А.В., Тимина Е.А., Гольдберг Е.Д. Состояние потомства крыс, получавших платиносодержащие цитостатические препараты. // Бюлл. эксперим. биол. и мед. 2004. Т. 138, №9. С 302-305.
5. Боровская Т.Г., Гольдберг В.Е., Щемерова Ю.А., Перова А.В., Тимина Е.А., Пахомова А.В. Оценка состояния потомства крыс, получавших ингибитор топоизомеразы II вепезид // Бюлл. эксперим. биол. и мед. 2006. - Т. 1. №5. С. 515-518.
6. Пахомова А.В. Гонадотоксические эффекты цитостатических препаратов. Автореф. Дис. биол. наук. Томск. 2004. С. 20-21.
7. Видаль Специалист // Справочник “Онкология”. - 2011. - С. 318. С. 204.-205.
8. Манихас Г.М., Филатова Е.И., Былинская Е.Н., Антонов В.Г., Константинов Е.М., Андрюшкова Ю.А. Применение препарата глутоксима при сочетанной лучевой терапии местно распространенного рака шейки матки // Российский онкологический журнал. - 2008. - №1. - С. 23-28.
9. Перова А.В. Экспериментальное изучение овариотоксических эффектов противоопухолевых препаратов растительного происхождения и пути их снижения.// Автореф. дис. биол наук. Томск. 2004. С. 16-17.
10. Дурнев А.Д. Смольникова Н.М. и др. Методические рекомендации по изучению репродуктивной токсичности лекарственных средств. / В кн. Руководство по проведению доклинических исследований лекарственных средств. Под ред. Миронова А.Н. // М.: Издание ФГБУ «НЦЭСМП2 2013. С. 90-91, 87.
11. Бондаренко Н.А. Рукопись деп. ВИНИТИ. 1980. №2038. С. 80. Средство для коррекции нарушений жизнеспособного потомства, вызванных цитостатическим воздействием.
Применение препарата глутоксим крысам-самкам в дозе 50 мкг/кг за 5 дней до и через 5 дней после введения цитостатического препарата вепезид однократно внутривенно в максимально переносимой дозе, равной 30 мг/кг, в качестве средства для коррекции патологических изменений у жизнеспособного потомства, полученного от спаривания через 3 месяца после цитостатического воздействия.