Способ приготовления оксидно-полиметаллических катализаторов на основе жаропрочных сплавов для парциального окисления углеводородов в синтез-газ
Иллюстрации
Показать всеИзобретение относится к способу приготовления оксидно-полиметаллических катализаторов, содержащих металлы платиновой группы, для окислительно-паровой конверсии углеводородов с получением оксида углерода и водорода. Способ включает обработку NiO и CO3O4 растворами нитратов Al, Се, Zr и соединений палладия Pd(NH3)4Cl2, платины Н2[PtCl6]·6Н2О и родия Н3[RhCl6], с последующей сушкой, закоксовывание полученного материала в токе метана при 550°C, получение пасты из данного материала, псевдобемита и тетраизопропоксилана, заполнение пор пенонихрома суспензией из полученного материала, удаление воды при 80°C, прокаливание 3 часа в атмосфере аргона при 1300°C, удаление углерода парами воды при 600°C в течение 3 часов. Технический результат заключается в создании высокоэффективного гетерогенного катализатора. 3 з.п. ф-лы, 7 табл., 4 пр.
Реферат
Изобретение относится к процессу приготовления гетерогенного катализатора для парциального окисления углеводородного сырья в синтез-газ кислородом воздуха или парами воды. В случае окисления метана и этана кислородом химические уравнения имеют вид:
СН4+0,5О2=СО+2Н2(Н2/СО=2)
С2Н6+O2=2СО+3Н2 (Н2/СО=1,5)
Для достижения оптимального соотношения Н2/СО, которое необходимо для процесса Фишера-Тропша или синтеза метанола, составляет 2, в реакционную смесь следует вводить пары воды, чтобы повысить это соотношение:
С2Н6+2H2O→2СО+5Н2 (Н2/СО=2,5)
Это в еще большей степени касается углеводородного сырья, которое содержит соединения с меньшим отношением Н/С.
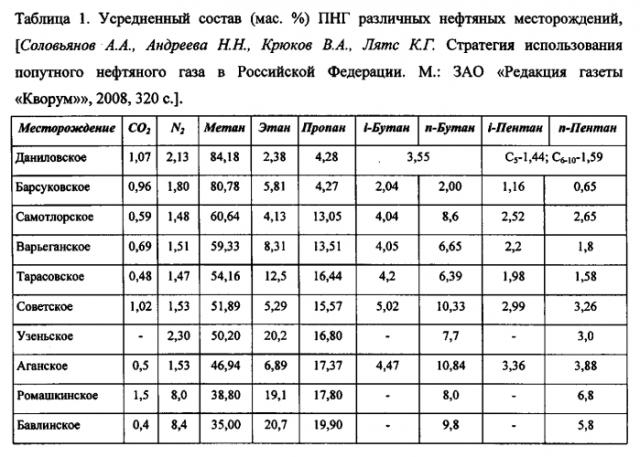
Создание высокопроизводительного катализатора, способного ускорять окислительно-паровую конверсию смесей углеводородов (табл. 1) без их предварительного разделения, является не только важной научной задачей, но и имеет также большое народно-хозяйственное значение. Актуальность этой проблемы определяется тем, что только в Российской Федерации из-за отсутствия соответствующей инфраструктуры на факелах сжигают огромные количества (свыше 50 млрд. м3/год) попутного нефтяного газа (ПНГ) в местах нефтедобычи, что приводит к большим экономическим потерям и создает угрозу для окружающей среды. Наличие эффективных каталитических систем позволит разработать компактные мобильные установки, производительность которых будет отвечать дебиту эксплуатируемых нефтяных скважин, что откроет путь к рациональной утилизации ПНГ в труднодоступных районах страны.
Трудности переработки ПНГ в синтез-газ в значительной степени обусловлены тем, что он содержит углеводороды, которые сильно отличаются по своей реакционной способности. Например, в ряду н-алканов C1-C7 значения констант их образования уменьшается на много порядков (табл. 2), что указывает на снижение их стабильности с увеличением молекулярной массы и повышение вероятности образования углерода.
Вследствие этого происходит интенсивное отложения кокса на поверхности катализатора и его быстрая дезактивация.
Сложность решения этой проблемы обусловлена тем, что катализаторы конверсии углеводородов в синтез-газ и их крекинга содержат одни и те же активные компоненты - металлы VIII группы. Наиболее распространенные подходы к снижению коксообразования включают оптимизацию условий процесса (подбор температурного режима, давления, времени контакта, сочетание разных окислителей). Важные результаты получены при разработке новых каталитических систем.
Для увеличения скорости удаления кокса с поверхности катализаторов в их состав вводят компоненты, проявляющие высокую активность в реакциях окисления. Наибольший эффект дает оксид церия, что особенно сильно проявляется в смешанных оксидах, например в Ce-Zr-O. Дисперсность активного металла в катализаторе является одним из факторов, влияющих на коксообразование, поскольку этот процесс является структурно чувствительным. Накопление углерода протекает с участием достаточно крупных частиц металла, размер которых соответствует диаметру растущих нанотрубок углерода. Предотвращение агломерации кластеров металлов достигается при использовании носителей, способных к сильному взаимодействию с активной фазой. Скорость коксообразования зависит от природы активных металлов. Присутствие в катализаторе элементов платиновой группы существенно замедляет этот процесс.
Авторы [Hotz N.; et al., AIChE Journal, 55(7), 1849-1859, 2009] предложили золь-гель метод приготовления пористого керамического катализатора нанесением in-situ наноразмерных частиц Rh/Ce-Zr-O. Данная система проявила высокую термическую и каталитическую стабильность в окислительной конверсии бутана в синтез-газ. Положительный эффект оксида церия проявляется и в случае систем Pt/СеО2/Al2O3 и Pt/CeZro2/Al2O3, когда CeO2 вводят в носитель [F.A.Silva et al., Appl. Catal. A: General 335 (2008) 145-152].
Наряду с вопросами о химическом составе катализаторов очень важной проблемой является состояние и форма катализатора. Варьирование этих параметров открывает путь к целенаправленному регулированию массопереноса и теплообмена, что необходимо для оптимизации технологии производства синтез-газа. В этом отношении весьма перспективными являются пористые монолитные катализаторы на основе жаростойких материалов (керамики, металлические сплавы и их комбинации), имеющих низкое аэродинамическое сопротивление.
Использование металлических носителей, таких как пенообразные материалы, сетки, перфорированную или гофрированную фольгу (RU 2204434, RU 2248932, RU 2268087, RU 2292237, RU 2320408), препятствует появлению локальных перегревов катализатора, благодаря их высокой теплопроводности, что увеличивает срок его службы.
Приготовление катализаторов, нанесенных на металлы с большой поверхностью, обычно включает предварительную окислительную обработку носителя, что существенно повышает их адгезионные свойства, обеспечивая стабильность таких систем. Дополнительной операцией для повышения эффективности композиционного материала является покрытие прокаленного в окислительной атмосфере металла (сплава) грунтовочным средством, например псевдобемитом, в слой которого вводятся активные компоненты.
Так, в работе (Bobrova L., Vernikovskaya N., Sadykov V. // Catal. Today. 2009. V. 144. P. 185) предложен катализатор LaCeZrOx(5.3wt.%) // LaNiPt(2wt.%) на фехралевой сетке, изготовленной из проволоки диаметром 2 мм. Метод его приготовления включал напыление слоя корунда на сетку с последующим нанесением γ-Al2O3 (3,6 мас. %) из соответствующей суспензии. Активная фаза была сформирована путем нанесения суспензии LaCeZrOx и влажной пропиткой раствором соединений La, Ni и Pt.
Однородность распределения активных частиц катализатора на носителе достигается различными методами. Например, в способе получения катализатора по патенту US 6103660, опубл. 15.08.2000, добиваются медленного гомогенного осаждения частиц предшественника активного компонента на частицах носителя: раствор предшественника активного компонента вводят в суспензию частиц носителя капиллярной инжекцией, при постоянном перемешивании. В качестве носителя используют γ-Al2O3 или смесь γ-Al2O3, стабилизированного лантаном, и смешанного оксида Ce/Zr, на которых осаждены ацетаты Се, Zr, Ва.
Катализатор разложения углеводородов по патенту ЕР 1759764, опубл. 07.03.2007, включает частицы активного металла (благородные металлы, а также Cr, Mn, Ti, Cu, Со, V и др., 0,025-10% мас. на катализатор) размером 0,5-50 нм, нанесенные на частицы прокаленного носителя размером 0,05-0,4 мкм любым известным способом (осаждение, пропитка, равновесная адсорбция и др.). Носитель содержит основные компоненты - Mg, Al, Ni (0,1-40% мас. на катализатор), Si (0,001-20% масс. на катализатор) в виде смешанных оксидов. Носитель получают термическим разложением смеси гидроксидов, образующихся в щелочной среде из водорастворимых солей и оксидов (Si - из силиката натрия). Частицы никеля в катализаторе могут иметь размер 1-20 нм.
В патентной заявке US 20120258857, опубл. 11.10.2012, описан способ получения катализатора автотермического риформинга, представляющего собой частицы смешанных оксидов магния, никеля и алюминия размером 40-300 нм, включающий синтез методом золь-геля предшественника слоистых гидроксидов Mg, Ni и Al из растворов солей соответствующих металлов, его высушивание, хотя бы частичное разложение при температуре 500-600°C и восстановление в среде H2-N2 при температуре 450-700°C с получением наноразмерных частиц. Катализатор отличается низкой скоростью закоксования, высокой активностью.
Из патентов RU 2320408, опубл. 27.03.2008, и RU 2356628, опубл. 27.05.2009, известны способы изготовления катализатора, который представляет собой жаростойкий армированный носитель, на котором методами пропитки с последующей термообработкой закреплены смешанные оксиды бария, марганца и кобальта. Смешанные оксиды состоят из крупноблочных агломератов с размерами в несколько мкм и с величиной первичных частиц 100-200 нм. Носитель - сетчатый материал Х23Ю5Т (фехраль). Оптимальными условиями работы катализатора являются: отношения O2/углерод=0,5-0,6, H2O/углерод=1,5-1,7, время контакта 0,3-0,4 с, температура 800-950°C. В продуктах реакции содержатся, об. %: водород 32, метан 1, диоксид углерода 12, монооксид углерода 11, азот 44. Изменение отношения вода/углерод в пределах 1,2-2,2 дает синтез-газ с отношением Н2/СО=2,3-3,65. Катализатор устойчив к образованию кокса, по крайней мере, в течение 100 ч испытаний.
Наиболее близким к заявленному является катализатор по патенту US 5130114, опубл. 14.07.1992 (прототип), для парового риформинга углеводородов включает носитель - оксид циркония, основной активный компонент - Rh и/или Ru и сокатализатор - хотя бы один элемент из группы Ni, Cr, Mg, Са, Y и другие РЗЭ. Высокую активность катализатора и медленное закоксование связывают со свойствами оксида циркония в качестве носителя, который может быть использован в смеси с другими носителями - SiO2, Al2O3, цеолитом. Пористый носитель может быть нанесен на металлическую подложку.
Решаемой технической задачей изобретения является создание высокоэффективного, простого в изготовлении универсального гетерогенного катализатора парциального окисления углеводородов воздухом или воздушно-паровой смесью при малом времени контакта (менее 1 с).
Задача решается путем использования гетерогенного катализатора, представляющего собой сложный композит из пористой смеси термостойких оксидов алюминия, циркония и церия с диспергированными в них активными компонентами (наноразмерные кластеры никеля и кобальта и их соединения), промотированные и защищенные от зауглероживания платиновыми металлами. Компоненты в виде катализаторной массы наносят на пенонихром.
Приготовление катализаторов включает следующие стадии.
1. Механическую смесь оксидов никеля и кобальта обрабатывали раствором, содержащим соответствующие количества нитратов Al, Се и цирконила, а также соединений палладия Pd(NH3)4Cl2), платины H2[PtCl6]·6H2O и родия H3[RhCl6]. Суммарная концентрация компонентов в растворе составляла 5-20%. Полученную суспензию сушили и нагревали до 500°C со скоростью 100°C/ч в атмосфере воздуха.
2. Полученный порошкообразный материал (5 г) закоксовывали в токе метана (4-5 л/ч) при 550°C в течение 1 ч, что приводило к полному восстановлению оксидов NiO и CO3O4 и соединений палладия, платины и родия до металлов и накоплению 5-10% углерода.
3. Из закоксованного образца, псевдобемита (содержание H2O 70 мас.%) и тетраизопропоксисилана готовили пасту и добавляли к ней воду при перемешивании до образования жидкой катализаторной массы. Массовое соотношение закоксованного образца/Al2O3/SIO2 составляло 8/87/5.
4. В катализаторную массу помещали цилиндр пенонихрома (диаметр 0,5 см, высота 1,2 см, вес 0,5 г), который был предварительно прокален на воздухе 2 часа при 900°C. Пенонихром имел открытую сообщающуюся пористость (75%), удельную поверхность 250 м2/г и плотность 2,1 г/см3. После заполнения пор цилиндр выдерживали при 80°C до постоянного веса, прокаливали при 1300°C 3 часа в атмосфере аргона и затем обрабатывали парами воды при 600°C 3 часа, что приводит к появлению транспортных каналов в результате полного удаления углерода.
Размер частиц в катализаторной массе определяли по данным, полученным методом РФА на дифрактометре Дрон-ЗМ (излучение CuKa, никелевый фильтр) со скоростью сканирования 1 град/мин в диапазоне углов 2θ 5-50°, при обработке спектров методом Ритвельда с использованием программы RIETAN 2000 [F. Izumi, Т. Ikeda, Mater. Sci. Forum, 2000, 198, 321]. Установлено, что размер частиц оксидов Ni и Со, полученных разложением нитратов, составляет более 150 нм, в то время как аналогичные параметры для промотированной NiCo-системы не превышают 30 нм. Подобные различия в размерах металлических частиц имеют место и для образцов, восстановленных метаном. Для приготовления NiCo-систем использовались оксиды Ni и Со с размером частиц более 150 нм, поэтому полученные факты свидетельствуют о существенном диспергировании исходных частиц. Это является необходимым условием достижения обратимости окислительно-восстановительных переходов при протекании каталитической реакции.
Отличительной особенностью предлагаемого способа является то, что для приготовления катализаторов используются оксидно-полиметаллические системы, которые обработаны метаном в условиях, обеспечивающих образование металлов и накопление определенного количества углерода. При прокаливании в атмосфере аргона пенонихрома со слоем катализаторной массы формируется прочное покрытие, которое, по данным РФА, состоит из смеси α-Al2O3 и муллита, в которую внедрены и наноразмерные частицы никеля и кобальта.
Прокаливание образца в токе аргона исключает окисление углерода и образование инертных шпинелей из оксидов Ni и Со и Al2O3. Последующее паровое удаление углерода приводит к появлению транспортных каналов, суммарный объем которых приближается к 4% от объема носителя. Эта оценка может быть сделана исходя из содержания и плотности (около 1 г/см3) углеродных трубок и плотности α- Al2O3 (около 4 г/см3). Общая удельная поверхность катализаторной массы лежит в интервале 15-25 м2/г, что было определено методом низкотемпературной адсорбции азота. Возможно, определенный вклад в эту величину вносят пустоты между частицами корунда.
Данное изобретение подтверждается следующими примерами.
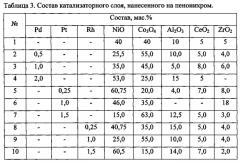
Пример 1. По выше приведенным методикам, варьируя соотношение компонентов и природу платинового металла, была приготовлена серия систем на основе пенонихрома с 5-10 мас. % катализаторного покрытия, составы которых приведены в табл. 3.
Таким образом, состав катализаторных покрытий на пенонихроме может быть выражен следующей обобщенной формулой (0-2%)Pd-(0-l,5%)Pt-(0-l,5%)Rh-(15-60%)NiO-(15-60%)Co3O4-(0-15%)Al2O3-(0-8%)CeO2-(0-18%)ZrO2.
Пример 2. Для демонстрации необходимости восстановления оксидов переходных металлов и их закоксовывания в токе метана был приготовлен катализатор №11 состава (мас. %): 1,5 Rh 60,5 NiO-15,0 Co3O4-14,0 Al2O3-7,0 СеО2-2,0 ZrO2. Эта система не подвергалась восстановлению и закоксовыванию в токе метана. Образец такого состава, полученный без нанесения на пенонихром, представлял собой стекловидную массу и имел удельную поверхность менее 1 м2/г.
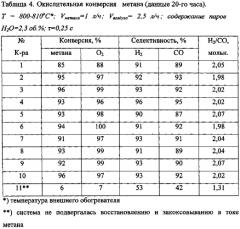
Пример 3. Испытания катализаторов в процессе окислительной конверсии метана кислородом воздуха с различным содержанием паров воды в реакционной смеси.
В табл. 4 представлены результаты по окислительной конверсии метана. Опыты проводили при внешнем нагреве 800-810°C, хотя, учитывая экзотермичность процесса, возможно, что в зоне реакции температура была заметно выше. Соотношение СН4/О2 составляло 0,5. Это необходимо для получения синтез-газа оптимального состава (Н2/СО=2), что и наблюдалось в проведенных опытах. Присутствие в реакционной смеси небольших количеств паров воды (2,3 об. %) не оказывало заметного влияния на состав образующегося синтез-газа.
Катализатор №1, который не содержит платиноидов, несколько уступал по активности системам с благородными металлами. Некоторый разброс полученных данных можно также объяснить различным соотношением промотирующих добавок. Следует отметить, что катализаторы после опыта сохраняли исходную массу, что указывает на высокую прочность катализаторного покрытия.
Обращает на себя внимание очень низкая активность образца №11, который по составу не отличался от катализатора №10, но не подвергался восстановлению и закоксовыванию в токе метана. Таким образом, этот факт демонстрирует необходимость восстановления оксидов переходных металлов и их закоксовывания, что обеспечивает формирование активной фазы пористой структуры.
Повышение содержания паров Н2О в смеси метан+воздух с 2,3 до 7,3 об. % оказывает определенное влияние на состав продуктов окислительной конверсия метана (табл. 5). В некоторой степени снижается конверсия кислорода и селективность образования моноксида углерода. В то же время несколько увеличивается конверсия метана и селективность по водороду. Очевидно, что это связано с протеканием реакций с участием H2O:
СН4+H2O→СО+3Н2
СО+H2O→Н2+CO2
Пример 4. Окислительно-паровая конверсия смеси метан+этан.
Данные по окислительной конверсии смеси метан+этан (объемное соотношение 2/1) с использованием кислорода воздуха приведены в табл. 6.
Этот процесс выражается следующим уравнением:
2СН4+С2Н6+2O2+8N2→4СО+7Н2+8N2(Н2/СО=1,75 мольн.)
Во всех случаях конверсия кислорода составляла 94-97%. Степень превращения этана приближалась к 100%, в то время как конверсия метана была несколько ниже, что, по-видимому, связано с различием реакционной способности этих углеводородов. Объем образующегося водорода и моноксида углерода определяется по уравнениям:
V(H2)=2S(H2)·[4K(CH4)+3К(С2Н6)]
V(CO)=S(CO)·[2K(CH4)+2K(C2H6)]
Соотношение Н2/СО, наблюдаемое в выбранных условиях, находилось в пределах 1,69 - 1,76, что соответствует окислительной конверсия смеси метан+этан данного состава.
Следующая серия опытов проведена со смесью метан+этан+воздух, которая содержала 9 об. % паров H2O (табл. 7).
Полученные данные свидетельствуют о том, что на изученных катализаторах наряду с окислительной конверсией углеводородов также протекает и взаимодействие алканов с H2O. Введение паров воды в реакционную смесь в количестве 9 об. % позволяет повысить мольное отношение Н2/СО почти до 2.
Приведенные выше данные демонстрируют, что разработанные катализаторы на основе пенонихрома не уступают по своей эффективности в окислительно-паровой конверсии метана и смеси метан+этан в синтез-газ системам, заявленным в прототипе. Данный способ применим для широкого круга каталитических систем, поскольку он позволяет создавать необходимую пористую структуру в различных индивидуальных и смешанных оксидах, а также предотвращать возможное образование стабильных соединений между активными компонентами и носителем.
1. Способ приготовления оксидно-полиметаллических катализаторов, содержащих металлы платиновой группы, для окислительно-паровой конверсии углеводородов с получением оксида углерода и водорода, отличающийся тем, что включает обработку NiO и CO3O4 растворами нитратов Al, Се, Zr и соединений палладия Pd(NH3)4Cl2, платины Н2[PtCl6]·6Н2О и родия Н3[RhCl6], с последующей сушкой, закоксовывание полученного материала в токе метана при 550°C, получение пасты из данного материала, псевдобемита и тетраизопропоксилана, заполнение пор пенонихрома суспензией из полученного материала, удаление воды при 80°C, прокаливание 3 часа в атмосфере аргона при 1300°C, удаление углерода парами воды при 600°C в течение 3 часов.
2. Способ по п. 1, отличающийся тем, что обработку NiO и Co3O4 ведут раствором с суммарной концентрацией 5-20%.
3. Способ по п. 1, отличающийся тем, что закоксовывание ведут до полного восстановления оксидов NiO и Co3O4 и соединений палладия, платины и родия до металлов и накопления 5-10% углерода.
4. Способ по п. 1, отличающийся тем, что пенонихром предварительно прокаливают на воздухе при 900°C в течение 2 часов.