Способ оценки эффективности коррекции сперматогенеза у животных в условиях воздействия микроволнового излучения
Иллюстрации
Показать всеИзобретение относится к медицине и может быть использовано для оценки эффективности коррекции сперматогенеза у животных в условиях воздействия микроволнового излучения. Проводят количественную оценку половых клеток семенника. Для этого самцам белых крыс перорально вводят селексен и аскорбиновую кислоту соответственно в дозах 1,5 и 500 мг/кг массы тела животного 1 раз в сутки в течение 50 дней. Через 14 дней на фоне введения селенсодержащего биокомплекса воздействуют микроволновым излучением с частотой 42 ГГц (λ=7,1 мм) в течение 30 дней по 30 минут ежедневно. По окончании схемы экспериментальных воздействий оценивают корректирующие свойства биокомплекса в отношении морфофункционального состояния эпидидимальных сперматозоидов по формуле: ИМФС=А+В, где ИМФС - индекс морфофункционального состояния, А - доля нормальных сперматозоидов относительно контроля, В - доля подвижных сперматозоидов относительно контроля. При значениях ИМФС меньше или равно 1,3 судят о неэффективной коррекции сперматогенеза, а при ИМФС больше 1,3 судят об эффективной коррекции сперматогенеза в условиях воздействия микроволнового излучения. Изобретение позволяет оценить эффективность коррекции сперматогенеза на фоне вводимого биокорректора. 2 табл., 3 ил., 3 пр.
Реферат
Изобретение относится к области медицины, а именно к области молекулярной физиологии и биохимии и может быть использовано для улучшения сперматогенеза у животных в условиях хронического воздействия микроволнового излучения крайне высоких частот.
Известен способ коррекции сперматогенеза, заключающийся в использовании селенсодержащего соединения (селенит натрия), добавляемого в условиях хронической интоксикации сероводородсодержащим газом Астраханского газового месторождения (Ушакова М.В. Функционирование репродуктивной системы самцов крыс при хроническом воздействии природных токсикантов: автореферат дис. … канд. биол. наук. - Астрахань, 2002. - 22 с.). Однако известный способ имеет следующие недостатки:
- в качестве протектора автором предлагается неорганическая форма селена (селенит натрия), которая, в отличие от органической, является трудноусвояемой;
- сам селенсодержащий протектор не дополнен никаким известным витамином-антиоксидантом (витамин Е, аскорбиновая кислота), способным усилить протекторные свойства селена;
- в качестве стресс-фактора был использован химический токсикант - Астраханский сероводородсодержащий природный газ.
Известны способы коррекции сперматогенеза животных с помощью комбинированного воздействия селена в органической форме и антиоксидантов (витамин Е, аскорбиновая кислота) (Echeverria-Alonzo S., Santos-Ricalde R., Centurion-Castro F., Ake-Lopez R., Alfaro-Gamboa M., Rodriquez-Buenfll J. Effects of dietary selenium and vitamin E on semen quality and sperm morphology of young boars during warm and fresh season // Journal of Animal and Veterinary Advances. - 2009. - Vol. 8, №11. - P. 2311-2317; Логинов П.В., Николаев A.A., Ветошкин P.B. Способ коррекции сперматогенеза у животных в условиях хронической интоксикации природным газом: пат. 2480221 Рос. Федерация. №2012107565/15; заявл. 28.02.2012; опубл. 27.04.2013, Бюл. №12. - 8 с.). Однако известные способы имеют следующие недостатки:
- в качестве экстремальных условий воздействия выступают следующие факторы: а) тепловой фактор (температура), связанный с сезонным ритмом, и б) химический фактор (природный газ);
- не приводится количественный критерий эффективности сперматогенеза в условиях воздействия неблагоприятных факторов на фоне использования биокорректора.
Известен способ оценки сперматогенеза по незрелым половым клеткам эякулята (Курило Л.Ф., Дубинская В.П., Остроумова Т.В и др. Оценка сперматогенеза по незрелым половым клеткам эякулята // Проблемы репродукции. - 1995. - Т. 1, №3. - С. 33-36). Однако известный способ имеет следующие недостатки:
- оценка сперматогенеза дается на основе анализа незрелых сперматогенных клеток, не причастных к процессу оплодотворения;
- не приводится количественный критерий эффективности сперматогенного процесса в целом.
Известен также способ-прототип количественной цитологической оценки эффективности сперматогенеза по патенту №2231979 от 15.06.2001 (опубл. 10.07.2004). Прототип имеет следующие недостатки:
- дается количественная оценка морфологических форм половых клеток тестикулярной ткани в целом;
- не учитываются кинетические характеристики зрелых половых клеток - сперматозоидов;
- не дается интегрированная оценка морфологии и кинетики сперматозоидов для интерпретации эффективности сперматогенного процесса.
Предлагаемое изобретение позволяет оценить эффективность коррекции сперматогенеза в условиях воздействия микроволнового излучения крайне высоких частот на фоне вводимого биокорректора с помощью интегрированного критерия морфофункционального состояния эпидидимальных сперматозоидов. Предлагаемым способом удается количественно оценить эффективность сперматогенеза в различных экспериментальных условиях относительно контрольных показателей.
Указанный технический результат достигается тем, что самцам белых крыс перорально вводят селексен и аскорбиновую кислоту соответственно в дозах 1,5 и 500 мг/кг массы тела животного 1 раз в сутки в течение 50 дней, а через 14 дней на фоне введения селенсодержащего биокомплекса воздействуют микроволновым излучением с частотой 42 ГГц (λ=7,1 мм) в течение 30 дней по 30 минут ежедневно, затем по окончании схемы экспериментальных воздействий оценивают корректирующие свойства биокомплекса в отношении морфофункционального состояния эпидидимальных сперматозоидов по формуле:
ИМФС=А+В, где
ИМФС - индекс морфофункционального состояния,
А - доля нормальных сперматозоидов относительно контроля,
В - доля подвижных сперматозоидов относительно контроля,
и при значениях ИМФС меньше или равно 1,3 судят о неэффективной коррекции сперматогенеза, а при ИМФС больше 1,3 судят об эффективной коррекции сперматогенеза в условиях воздействия микроволнового излучения.
У мелких грызунов микроволновое излучение даже миллиметрового диапазона вызывает угнетение сперматогенной функции (М.Г. Кузнецова. Функционирование репродуктивной системы самцов крыс под влиянием электромагнитного излучения миллиметрового диапазона. Автореф. дис. … канд. биол. наук. - Астрахань, 2009. - 24 с.; Николаев А.А., Кузнецова М.Г., Сердюков В.Г. Гонадотоксическое действие миллиметрового излучения: Монография. - Астрахань: Изд-во «ГБОУ ВПО АГМА», 2013. - 78 с.). В этой связи встает проблема коррекции сперматогенеза в условиях воздействия микроволнового излучения. В качестве надежного корректора может выступать биоэлемент селен (Полунин А.И., Луцкий Д.Л., Мирошников В.М. и др. Селен и цинк в коррекции мужской субфертильности: Учебное пособие для врачей. - Астрахань: АГМА, 2002. - 42 с.). Селен в органической форме обладает высокой степенью биодоступности и к тому же малотоксичен (Саноцкий И.В. Незаменимый селен. - М.: Ассоциация АКМ, 2001. - 96 с.). Животным вводили селен из расчета 350 мкг селена на 1 кг массы тела животного в сутки, что адекватно для половозрелых крыс с точки зрения уровня их метаболизма (Ушакова М.В. Функционирование репродуктивной системы самцов крыс при хроническом воздействии природных токсикантов. Автореферат дис. … канд. биол. наук. - Астрахань, 2002. - 22 с.). Аскорбиновую кислоту давали животным в умеренно повышенной дозе, опираясь на еще давние исследования Л. Полинга и других исследователей о роли высоких доз витамина С в регуляции репродуктивных процессов (Полинг Л. Витамин С и здоровье. М.: Наука, 1974. - 74 с.; Sharaf A., Gomaa N. Androgenicity in vitamins // Qualitas plantarum et material vegetabiles. - 1970. - Vol. 19, №4. - P. 369-374; Yousef M.I., Abdallah G.A., Kamel K.I. Effect of ascorbic acid and vitamin E supplementation on semen quality and biochemical parameters of male rabbits // Anim. Reprod. Sci. - 2003. Vol. 76, №1-2. - P. 99-111). Дополнение селексена аскорбиновой кислотой обеспечивает вывод избыточных количеств селена из организма и повышает его антиоксидантный статус (Bebne D. Studies in the distribution and characteristics of new mammalian selenium-containing proteins // Analyst. - 1995. - Vol. 120. - P. 823-825). Учитывая, что сперматогенный цикл у крыс составляет 48 дней (ВОЗ, 1967), животным была назначена 50-дневная диета, обогащенная селексеном и аскорбиновой кислотой. Через 2 недели после начала введения селексена и аскорбиновой кислоты начали воздействовать микроволновым излучением с частотой 42 ГГц. Указанная частота излучения относится к миллиметровому диапазону электромагнитных волн (микроволновое излучение крайне высокой частоты КВЧ), исходящих от целого ряда источников (радиолокаторы, медицинское оборудование, радиосвязь), с которыми человек имеет дело в повседневной жизни (ГОСТ 24375-80). Само воздействие микроволновым излучением осуществлялось «внутри» самого курса введения селексена и аскорбиновой кислоты (с третьей недели в течение 30 дней), что позволяло плавно вводить данный фактор физического стресса в экспериментальную модель, избежав таким образом погрешностей, вызванных первичными эффектами излучения в сочетании с сопутствующими манипуляциями над животными в отсутствие корректоров (селексена и аскорбиновой кислоты). Воздействие излучением осуществлялось в течение 30 минут, что моделирует условия реальной жизни (эффекты радиосвязи, воздействие медицинских приборов, воздействия магнитных полей, создаваемых радиолокационными установками).
Поскольку в эпидидимисе семенника происходит созревание сперматозоидов, анализу подвергалась суспензия эпидидимальных сперматозоидов. Для разработки интегрированного критерия оценки морфофункционального состояния семенников были взяты за основу два подхода: 1) количественная оценка морфологически нормальных форм сперматозоидов; 2) оценка кинетических свойств (подвижности) эпидидимальных сперматозоидов. Для создания интегрированного критерия удобно выражать количественные показатели относительно принятого стандарта. В классическом понимании таким стандартом может выступать контрольная (интактная) группа. Далее полученные относительные показатели (коэффициенты) складываются и получается критерий, учитывающий и кинетику, и морфологию клеток.
Процентное количество нормальных форм сперматозоидов вычисляют путем вычитания из 100% суммарного количества дефективных и мертвых сперматозоидов в процентах. Относительное количество нормальных сперматозоидов вычисляют путем деления процента нормальных форм сперматозоидов в опытной группе на процентное количество нормальных форм в контроле по формуле (1):
где А - доля нормальных сперматозоидов относительно контроля, Р и Рк - процентные количества дефективных сперматозоидов соответственно в опытной и контрольной группах, D и DK - процентные количества мертвых сперматозоидов соответственно в опытной и контрольной группах.
Коэффициент подвижности сперматозоидов будем оценивать путем вычисления доли подвижных сперматозоидов относительно контроля по формуле (2):
где В - доля подвижных сперматозоидов относительно контроля, М - подвижность эпидидимальных сперматозоидов в опытной группе, %, Мк - подвижность эпидидимальных сперматозоидов в контрольной группе, %.
Тогда интегрированный индекс морфофункционального состояния (ИМФС) эпидидимальных сперматозоидов будет учитывать коэффициенты А и В по формуле (3):
Кроме того, можно вычислить также средний коэффициент качества сперматозоидов (СККС) в процентах, поделив пополам показатель ИМФС и умножив на 100% по формуле (4):
Здесь деление индекса ИМФС пополам означает вычисление среднего значения от суммы А+В с последующим выражением полученного значения в процентах.
Создание способа оценки коррекции сперматогенной функции осуществлялось на 40 половозрелых самцах крыс линии Wistar массой 210±10 г на базе кафедры химии ГБОУ ВПО «Астраханская государственная медицинская академия» Минздрава России. Животные были разделены на 4 группы. Первая группа была контрольная (10 шт.). Во вторую группу (10 шт.) вошли животные, получавшие перорально селексен в сочетании с аскорбиновой кислотой в дозах соответственно 1,5 и 500 мг/кг массы тела животного в сутки в течение 50 дней. Третью группу составили животные, подвергавшиеся воздействию микроволнового излучения миллиметрового диапазона (λ=7,1 мм, частота f=42 ГГц) в течение 30 дней по 30 минут. Для создания электромагнитного поля использовали генератор монохроматических электромагнитных волн Явь-1-7,1 (Россия). В четвертую группу вошли животные, получавшие селексен в сочетании с аскорбиновой кислотой в вышеуказанных суточных дозах в течение 50 дней, а параллельно через 14 дней (с третьей недели) от начала введения указанных препаратов - подвергавшиеся воздействию микроволновым излучением с частотой 42 ГГц в течение 30 дней по 30 минут ежедневно.
Для оценки протекторных свойств селексена в сочетании с аскорбиновой кислотой в условиях воздействия микроволнового излучения исследовали эякулят белых крыс. Для этого по окончании опытов из хвостовой части эпидидимисов, разрезая их вдоль, вымывали семенную жидкость дозированным количеством физиологического раствора (эмпирически для крыс это количество 2-4 мл) (И.В. Саноцкий, В.Н. Фоменко. Отдаленные последствия влияния химических соединений на организм. - М.: Медицина, 1979. - 232 с.) и получали суспензию (эпидидимальные сперматозоиды у животных третьей группы выделяли на 7-й день после окончания воздействия микроволновым излучением). На часовом стекле в течение 2 минут эпидидимис активно перемещали для освобождения от части сперматозоидов (во избежание артефактов стеклянные палочки применять нельзя, используют отрезки отмытой резиновой трубки). Взвесь сперматозоидов наносили на предметные стекла, подсушивали на воздухе, фиксировали над пламенем и окрашивали любым красителем. Подсчет дегенеративных форм вели по отношению к количеству просчитанных в полях зрения сперматозоидов. Подсчет общего числа эпидидимальных сперматозоидов в суспензии производили в камере Горяева под окуляром светового микроскопа при увеличении 400х. Число спермиев подсчитывали в 5 больших квадратах камеры Горяева по диагонали. Кроме того, в нативной сперме определялось процентное соотношение между различными морфологическими формами сперматозоидов (дефективные, подвижные и мертвые). Дополнительно для подтверждения количественных показателей давалась общая характеристика морфофункционального состояния семенных канальцев на основе гистологических срезов. Срезы семенников толщиной 7 мкм изготавливали на микротоме "Microm НМ - 400" (Германия). Срезы окрашивали гематоксилинэозином. Полученные препараты изучались на универсальном микроскопе "Nu" (Германия), соединенном с цветной телевизионной камерой "Pixera" (США). Все полученные в ходе эксперимента данные статистически обработаны с помощью критерия Стьюдента (Лакин Г.Ф. Биометрия: Учебное пособие для биол. спец. вузов. - М.: Высшая школа, 1990. - 352 с.).
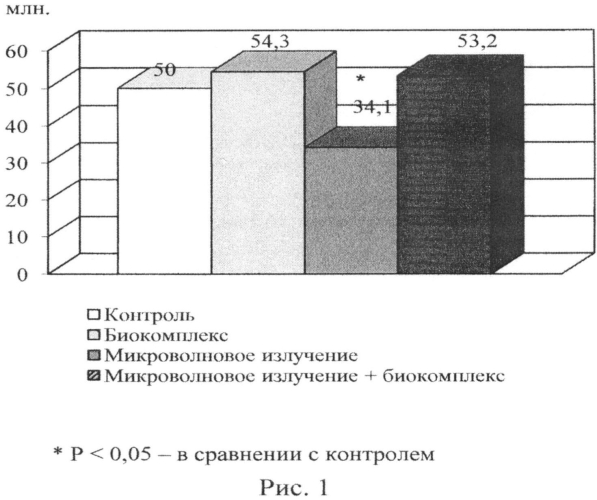
В предлагаемом способе достигнуты следующие результаты. Количество и морфофункциональные показатели эпидидимальных сперматозоидов у белых крыс в норме и в условиях экспериментальных воздействий отражены в таблице 1. Изменение количества эпидидимальных сперматозоидов под влиянием микроволнового излучения селенсодержащего биокомплекса (селексен + витамин С) и их сочетания отражено на рисунке 1. У животных, подвергнутых воздействию микроволнового излучения, отмечено сокращение общего количества эпидидимальных сперматозоидов в 1,5 раза в сравнении с контролем (Р<0,05) (таблица 1, рис. 1). Количество дефективных сперматозоидов (30,5%) возросло в 1,7 раз в сравнении с контролем (18,2%). Количество мертвых сперматозоидов возросло в 3 раза (30,2%) по сравнению с контролем (9,8%) (Р<0,001). Отсутствие подвижности сперматозоидов в основном связано с таким дефектом, как облом хвоста, что можно объяснить усилением процесса липопероксидации в условиях воздействия микроволнового излучения. Потребление селенсодержащего биокомплекса вызвало улучшение подвижности и способствовало повышению количества эпидидимальных сперматозоидов, по сравнению с контрольной группой животных. Количество мертвых сперматозоидов снижалось более чем в 2 раза по сравнению с контролем (Р<0,001). Улучшение кинетических свойств и жизнеспособности сперматозоидов при приеме указанного биокомплекса можно объяснить тем фактом, что в хвосте сперматозоидов крыс содержится селенопептид, который имеет важное структурное значение при сборке хвоста сперматозоидов (Ушакова М.В. Функционирование репродуктивной системы самцов крыс при хроническом воздействии природных токсикантов. Автореферат дис. … канд. биол. наук. - Астрахань, 2002. - 22 с.). Вместе с тем предварительное потребление животными селенсодержащего биокоимплекса способствовало снижению деструктивных последствий микроволнового излучения. Достоверно значимых отклонений от контроля по количеству сперматозоидов у животных, подвергавшихся воздействию микроволновым излучением и предварительно получавших указанный биопротектор, нами не было зафиксировано. Отмечалась тенденция к увеличению общего количества эпидидимальных сперматозоидов. Количество дефективных сперматозоидов в группе животных, подвергавшихся воздействию микроволнового излучения на фоне приема селенсодержащего биокомплекса, не отличалось достоверно от такового контрольной группы. Селенсодержащий биокомплекс способствовал некоторому улучшению подвижности сперматозоидов в условиях воздействия микроволнового излучения по сравнению с группой животных, подвергавшихся только воздействию излучения. Количество мертвых сперматозоидов было заметно ниже в условиях воздействия микроволнового излучения на фоне приема биокомплекса по сравнению с группой животных, подвергавшихся воздействию только излучения, хотя и не достигало контрольных значений.
Для подтверждения характера изменения морфофункционального состояния эпидидимальных сперматозоидов в различных экспериментальных условиях рассмотрим примеры количественной оценки морфофункционального состояния эпидидимальных сперматозоидов с помощью критерия ИМФС, пользуясь таблицей 1 и формулами (1-3).
Пример 1. Контрольная группа
Здесь в качестве опытной группы (в числителе) будет выступать сама контрольная группа, поэтому коэффициенты А и В будут равны единице, что отвечает 100%-ному стандарту.
1) Доля нормальных сперматозоидов относительно контроля:
2) Доля подвижных сперматозоидов относительно контроля:
3) ИМФС=А+В=1+1=2
Вывод: контрольное значение ИМФС в отсутствие экспериментальных воздействий, когда показатели А и В равны единице (контрольные стандарты), составляет величину 2.
Пример 2. Влияние селенсодержащего биокомплекса
Животным вводили селексен и аскорбиновую кислоту в дозах 1,5 и 500 мг/кг массы тела в соответствии со схемой, определенной для второй экспериментальной группы.
1) Доля нормальных сперматозоидов относительно контроля:
2) Доля подвижных сперматозоидов относительно контроля:
3)ИМФС=А+В=1,1+1,1=2,2
Вывод: повышение показателя ИМФС по сравнению с контролем в результате потребления селенсодержащего биокомплекса отражает факт повышения эффективности сперматогенеза.
Пример 3. Влияние микроволнового излучения
Животных подвергали воздействию микроволнового излучения с частотой 42 ГГц в соответствии со схемой, разработанной для третьей экспериментальной группы.
1) Доля нормальных сперматозоидов относительно контроля:
2) Доля подвижных сперматозоидов относительно контроля:
3) ИМФС=А+В=0,55+0,74=1,29≈1,3
Вывод: Микроволновое излучение с частотой 42 ГГц в указанной экспозиции вызвало падение показателя ИМФС до значения 1,3, что отражает негативные последствия излучения как на морфологию, так и на кинетику эпидидимальных сперматозоидов.
Пример 4. Влияние микроволнового излучения на фоне биокорректора.
Самцам белых крыс перорально вводили селесен и аскорбиновую кислоту в дозах 1,5 и 500 мг/кг массы тела в течение 50 дней. Через 14 дней после начала введения данного селенсодержащего биокомплекса начали воздействовать микроволновым излучением с частотой 42 ГГц (λ=7,1 мм) в течение 30 дней по 30 минут ежедневно. Воздействие осуществляли в затравочной камере, изготовленной из материалов, не экранирующих электромагнитное излучение. После окончания воздействия микроволнового излучения и фонового введения селенсодержащего биокомплекса у животных оценивали морфологические и кинетические параметры эпидидимальных сперматозоидов по формулам (1-3) на основе полученных показателей, отраженных в таблице 1.
1) Доля нормальных сперматозоидов относительно контроля:
2) Доля подвижных сперматозоидов относительно контроля:
3) ИМФС=А+В=0,85+0,82=1,67≈1,7.
Вывод: полученное значение ИМФС превосходит таковое для группы животных, подвергавшихся воздействию только микроволнового излучения (ИМФС=1,3), хотя и несколько ниже контрольного значения ИМФС, равного 2. Указанное обстоятельство свидетельствует в пользу эффективности коррекции сперматогенеза с помощью предлагаемого селенсодержащего биокомплекса в условиях воздействия микроволнового излучения крайне высоких частот.
Полученные значения ИМФС позволяют также рассчитать средние коэффициенты качества сперматозоидов (СККС) в процентах, учитывающие морфологию и кинетику эпидидимальных сперматозоидов по формуле (4).
Тогда получим следующие средние коэффициенты качества сперматозоидов для вышеописанных примеров.
1) Контрольная группа:
2) Влияние селенсодержащего биокомплекса:
3) Влияние микроволнового излучения:
4) Влияние микроволнового излучения на фоне биокорректора:
В обобщенном виде все полученные данные для расчета ИМФС и СККС приведены в таблице 2.
Таким образом, в условиях воздействия микроволнового излучения показатель ИМФС составляет величину 1,3, в то время как на фоне потребляемого животными селенсодержащего биокомплекса показатель ИМФС возрастает до значения 1,7. Следовательно, величина ИМФС больше 1,3 в условиях воздействия микроволнового излучения на фоне потребляемого биокорректора свидетельствует об эффективной коррекции сперматогенеза указанным биокомплексом, что подтверждается также данными морфологического анализа срезов тестикулярной ткани (рис. 2, 3). Значение ИМФС, меньшее или равное 1,3, говорит о неэффективной коррекции сперматогенеза в условиях воздействия микроволнового излучения крайне высоких частот.
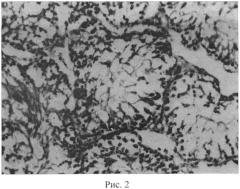
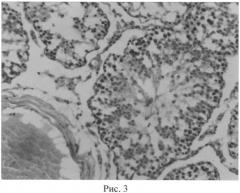
Структура извитых канальцев семенников животных, подвергнутых воздействию микроволнового излучения, отражена на рисунке 2 (окраска гематоксилинэозином; увел. 200х). В условиях воздействия микроволнового излучения наблюдалось полнокровие сосудов семенников и общее снижение половых клеток. Наблюдалось хаотичное расположение клеток сперматогенного эпителия на фоне в ряде случаев отслоения базальной мембраны. В отдельных случаях наблюдались множественные разрывы базальной мембраны, запустевание семенных канальцев либо неравномерная высота сперматогенного эпителия, что в целом позволяет говорить о признаках некроза сперматогенного эпителия (рис. 2). Структура извитых канальцев семенников животных, подвергнутых воздействию микроволнового излучения и получавших предварительно селенсодержащий биокомплекс, отражена на рисунке 3 (окраска гематоксилинэозином; увел. 200х). Сами семенные канальцы имеют правильную округлую форму. Предварительное введение биокомплекса способствовало заметному снижению деструктивных эффектов, вызываемых одним только микроволновым излучением. Семенные канальцы заполнены разными типами сперматогенных клеток. Ближе к просвету семенных канальцев можно видеть сперматозоиды. Высота сперматогенного эпителия визуально заметно выше по сравнению с таковой в группе животных, подвергнутых воздействию только микроволнового излучения.
Таким образом, предлагаемый способ оценки коррекции сперматогенеза в условиях воздействия микроволнового излучения позволяет сделать вывод об эффективности применяемого корректора на основе интегрированного показателя, учитывающего морфологические и кинетические характеристики эпидидимальных сперматозоидов. Предлагаемым способом удается также количественно оценить эффективность сперматогенеза в разных экспериментальных условиях.
Способ оценки эффективности коррекции сперматогенеза у животных в условиях воздействия микроволнового излучения, заключающийся в количественной оценке половых клеток семенника, отличающийся тем, что самцам белых крыс перорально вводят селексен и аскорбиновую кислоту соответственно в дозах 1,5 и 500 мг/кг массы тела животного 1 раз в сутки в течение 50 дней, а через 14 дней на фоне введения селенсодержащего биокомплекса воздействуют микроволновым излучением с частотой 42 ГГц (λ=7,1 мм) в течение 30 дней по 30 минут ежедневно, затем по окончании схемы экспериментальных воздействий оценивают корректирующие свойства биокомплекса в отношении морфофункционального состояния эпидидимальных сперматозоидов по формуле:ИМФС=А+В, гдеИМФС - индекс морфофункционального состояния,А - доля нормальных сперматозоидов относительно контроля,В - доля подвижных сперматозоидов относительно контроля,и при значениях ИМФС меньше или равно 1,3 судят о неэффективной коррекции сперматогенеза, а при ИМФС больше 1,3 судят об эффективной коррекции сперматогенеза в условиях воздействия микроволнового излучения.