Фармацевтический состав, содержащий один или более эфиров фумаровой кислоты в разлагаемой матрице
Иллюстрации
Показать всеФармацевтический состав в форме таблетки с эродируемой матрицей, содержащей один или более эфиров фумаровой кислоты, а также контролирующий скорость агент, представляющий собой гидроксипропилцеллюлозу и связующее, представляющее собой лактозу, при этом разложение указанной разлагаемой матрицы обеспечивает контролируемое высвобождение указанного эфира (эфиров) фумаровой кислоты. 7 н. и 12 з.п. ф-лы, 43 пр., 2 табл., 2 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к фармацевтическому составу, содержащему разлагаемую матрицу. В частности, настоящее изобретение относится к фармацевтическому составу, содержащему эродируемую матрицу, содержащую один или более эфиров фумаровой кислоты, а также один или более контролирующих скорость агентов, при этом разложение указанной разлагаемой матрицы обеспечивает контролируемое или замедленное высвобождение указанных эфиров фумаровой кислоты.
УРОВЕНЬ ТЕХНИКИ
Псориаз представляет собой хроническое заболевание кожи с высоким процентом генетической предрасположенности. Данное заболевание изменяется от обострения до периодов полного затишья. Пациенты, страдающие псориазом, могут иметь серьезные физические недостатки из-за внешних характеристик заболевания. Это влияет на все сферы жизни, такие как профессиональная карьера, а также личная и частная жизнь.
Возможности лечения, доступные до лечения согласно настоящему изобретению, ограничены, в частности, для пациентов с псориазом со степенью тяжести от средней до тяжелой, и многие из них обеспечивают лишь временное и краткосрочное улучшение, и/или обладают тяжелыми нежелательными эффектами/побочными эффектами. Поскольку псориаз обладает высокой частотой рецидивов, большинство пациентов должны проходить длительное лечение.
Эфиры фумаровой кислоты применяли для лечения псориаза со степенью тяжести от средней до тяжелой в течение более 30 лет. В 1994 году в Германии была одобрена определенная смесь диметилфумарата и солей моноэтилфумарата - Фумадерм® initial / Фумадерм® (Fumaderm® initial / Fumaderm®). Одна таблетка Фумадерма® с энтеросолюбильным покрытием содержит следующие активные компоненты: диметилфумарат 120 мг; этилгидрофумарат, кальциевая соль 87 мг; этилгидрофумарат, магниевая соль 5 мг; этилгидрофумарат, цинковая соль 3 мг и следующие другие компоненты: кроскармеллоза натрия, тальк, стеарат магния, красители Е171 и Е132, сополимер метакриловой кислоты и метилметакрилата (1:1), сополимер метакриловой кислоты и этилакрилата (1:1), Макрогол 6000 (Macrogol 6000), симетикон (simethicone), повидон, триэтилцитрат, микрокристаллическая целлюлоза, высокодисперсный диоксид кремния [Краткая характеристика лекарственного средства Фумадерм, версия от января 2009 года]. На сегодняшний день Фумадерм® представляет собой примерно 66% всех назначений для системного лечения псориаза в Германии. Однако высокая частота побочных эффектов является причиной прекращения некоторыми пациентами приема в начале лечения. Предполагается, что побочные эффекты со стороны желудочно-кишечного тракта и гиперемия могут быть, по меньшей мере частично, объяснены свойствами высвобождения прописанного состава, приводящими к возникновению высоких местных концентраций в кишечнике.
Авторы настоящего изобретения предполагают, что улучшение режима лечения может быть достигнуто путем введения фармацевтической композиции, предназначенной для доставки активного вещества контролируемым способом, т.е. способом, который является пролонгированным, замедленным, задержанным, медленным и/или отсроченным по сравнению с доставкой коммерчески доступного продукта.
Эфиры фумаровой кислоты, такие как диметилфумарат, могут быть подвержены распаду и гидролизу. Например, известно, что диметилфумарат больше подвержен гидролизу в щелочной/менее кислой среде по сравнению с более кислыми средами (Litjens et al, "In vitro pharmacokinetics of anti-psoriatic fumaric acid esters", BMC Pharmacology 2004, 4:22). Таким образом, считается, что диметилфумарат больше подвержен гидролизу в тонком кишечнике в сравнении с желудком. Помимо влияния pH, описанного выше, считается, что эстеразы способствует гидролизу эфиров фумаровой кислоты.
В WO 2006/037342 описаны фармацевтические композиции с контролируемым высвобождением, содержащие эфир (эфиры) фумаровой кислоты в качестве активного вещества (веществ), при этом характеристики контролируемого высвобождения позволяют в результате уменьшить побочные эффекты, связанные с ЖКТ (желудочно-кишечный тракт).
ЗАДАЧА ИЗОБРЕТЕНИЯ
Задачей вариантов реализации настоящего изобретения является получение фармацевтического состава с контролируемым или замедленным высвобождением, содержащего эфир (эфиры) фумаровой кислоты в качестве активного вещества (веществ), который демонстрирует уменьшенные побочные эффекты, связанные с ЖКТ (желудочно-кишечный тракт), и/или сниженную гиперемию по сравнению с составом Фумадерм®, известным из уровня техники. Другой задачей настоящего изобретения является обеспечение фармацевтического состава с контролируемым или замедленным высвобождением, содержащего эфир (эфиры) фумаровой кислоты в качестве активного вещества (веществ), который обладает улучшенным фармакокинетический профиль по сравнению с составами, известными из уровня техники. В частности, задачей настоящего изобретения является обеспечение фармацевтического состава с контролируемым или замедленным высвобождением, содержащего эфир (эфиры) фумаровой кислоты в качестве активного вещества (веществ), который демонстрирует сниженную вариабельность ППК (AUC) и/или значений Сщах по сравнению с составами с контролируемым высвобождением, известными из уровня техники. В частности, задачей настоящего изобретения является получение фармацевтического состава с контролируемым или замедленным высвобождением, содержащего эфир (эфиры) фумаровой кислоты в качестве активного вещества (веществ), который демонстрирует достаточную относительную биодоступность по сравнению, например, с составом Фумадерм®, известным из уровня техники. Конкретно, задачей настоящего изобретения является получение фармацевтического состава с контролируемым или замедленным высвобождением, содержащего эфир (эфиры) фумаровой кислоты в качестве активного вещества (веществ), который демонстрирует сниженную вариабельность ППК и/или значений Cmax по сравнению с составом Фумадерм®, известного уровня техники.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторами настоящего изобретения обнаружено, что контролируемое или замедленное высвобождение одного или более эфиров фумаровой кислоты может быть достигнуто посредством таблетки с разлагаемой матрицей. Продление высвобождения активного фармацевтического ингредиента (АФИ) можно контролировать с помощью количества контролирующего скорость полимера(ов) относительно других компонентов и предполагается, что высоких местных концентраций АФИ можно избежать или снизить.
Было обнаружено, что контролируемое или замедленное высвобождение одного или более эфиров фумаровой кислоты на фармацевтически соответствующем уровне может быть достигнуто, по сравнению с Фумадермом, из маленькой таблетки для улучшения соблюдения пациентом режима и схемы лечения, и при этом высоких местных концентраций АФИ можно избежать при обеспечении максимально полной доставки активного вещества в течение определенного периода времени после достижения участка всасывания, и в то же время может быть обеспечена сниженная вариабельность по сравнению с Фумадермом®.
Было обнаружено, что составы согласно настоящему изобретению демонстрируют хорошую корреляцию in vitro/in vivo. В соответствии с одним из аспектов, корреляцию in vitro/in vivo определяют путем сравнения времени для высвобождения 80% эфира фумаровой кислоты из составов в тесте на растворимость in vitro с Cmax, измеряемой in vivo после введения составов.
Авторы настоящего изобретения также предполагают, что контролируемое высвобождение АФИ путем эрозии матрицы минимизирует или уменьшает подвергание АФИ гидролизу в желудочно-кишечном тракте, тем самым уменьшая распад АФИ до абсорбции.
В соответствии с первым аспектом предполагается, что таким образом можно сохранить эффект лечения и в то же время существенно уменьшить некоторые или несколько нежелательных побочных эффектов или отрицательных эффектов, известных для Фумадерма®, или улучшить переносимость в сравнении с Фумадермом®.
В соответствии с другим аспектом предполагается, что таким образом можно достичь улучшенного эффекта лечения по сравнению с Фумадермом® и в то же время уменьшить нежелательные побочные эффекты, которые, как известно, возникают при лечении псориаза указанным известным из уровня техники Фумадермом®.
В соответствии с другим аспектом предполагается, что таким образом можно достичь улучшенного эффекта лечения при одновременном поддержании переносимости в сравнении с Фумадермом®.
В соответствии с другим аспектом предполагается, что таким образом можно достичь улучшенного эффекта лечения при одновременном улучшении переносимости в сравнении с Фумадермом®.
В соответствии с первым аспектом настоящее изобретение относится к фармацевтическому составу в форме таблетки с разлагаемой матрицей, содержащему:
i) от 10 масс.% до 80 масс.% одного или более эфиров фумаровой кислоты, выбранных из ди-(С1-С5)алкилэфиров фумаровой кислоты и моно-(С1-С5)алкилэфиров фумаровой кислоты, или их фармацевтически приемлемой соли в качестве активного вещества;
ii) 1-50 масс.% одного или более контролирующих скорость агентов; и энтеросолюбильное покрытие, при этом указанное энтеросолюбильное покрытие наносят на уровне, составляющем 1,5-3,5 масс.% от массы ядра, при этом разложение указанной разлагаемой матрицы обеспечивает контролируемое или замедленное высвобождение указанного активного вещества.
В соответствии с одним из аспектов настоящее изобретение относится к фармацевтическому составу в форме таблетки с разлагаемой матрицей, содержащему:
i) от 30 масс.% до 60 масс.% одного или более эфиров фумаровой кислоты, выбранных из ди-(С1-С5)алкилэфиров фумаровой кислоты и моно-(С1-С5)алкилэфиров фумаровой кислоты, или их фармацевтически приемлемой соли в качестве активного вещества;
ii) 3-40 масс.% одного или более контролирующих скорость агентов; и энтеросолюбильное покрытие, при этом указанное энтеросолюбильное покрытие наносят на уровне, составляющем 1,5-3,5 масс.% от массы ядра, при этом разложение указанной разлагаемой матрицы обеспечивает контролируемое или замедленное высвобождение указанного активного вещества.
В соответствии с одним из аспектов настоящее изобретение относится к фармацевтическому составу в форме монолитной таблетки с разлагаемой матрицей, содержащему:
i) от 10 масс.% до 80 масс.% одного или более эфиров фумаровой кислоты, выбранных из ди-(С1-С5)алкилэфиров фумаровой кислоты и моно-(С1-С5)алкилэфиров фумаровой кислоты, или их фармацевтически приемлемой соли в качестве активного вещества и
ii) 1-50 масс.% одного или более контролирующих скорость агентов; и энтеросолюбильное покрытие, при этом указанное энтеросолюбильное покрытие наносят на уровне, составляющем 1,5-3,5 масс.% от массы ядра, при этом разложение указанной разлагаемой матрицы обеспечивает контролируемое или замедленное высвобождение указанного активного вещества.
В соответствии с одним из аспектов настоящее изобретение относится к фармацевтическому составу в форме монолитной таблетки с разлагаемой матрицей, содержащему:
i) от 30 масс.% до 60 масс.% одного или более эфиров фумаровой кислоты, выбранных из ди-(С1-С5)алкилэфиров фумаровой кислоты и моно-(С1-С5)алкилэфиров фумаровой кислоты, или их фармацевтически приемлемой соли в качестве активного вещества;
ii) 3-40 масс.% одного или более контролирующих скорость агентов; и энтеросолюбильное покрытие, при этом указанное энтеросолюбильное покрытие наносят на уровне, составляющем 1,5-3,5 масс.% от массы ядра, при этом разложение указанной разлагаемой матрицы обеспечивает контролируемое или замедленное высвобождение указанного активного вещества.
В соответствии с одним из аспектов настоящее изобретение относится к фармацевтическому составу в форме таблетки с разлагаемой матрицей, содержащему:
А) ядро таблетки, содержащее:
i) 40-60 масс.% одного или более эфиров фумаровой кислоты, выбранных из ди-(С1-С5)алкилэфиров фумаровой кислоты и моно-(С1-С5)алкилэфиров фумаровой кислоты, или их фармацевтически приемлемой соли в качестве активного вещества,
ii) 4-6 масс.% контролирующего скорость агента;
iii) 35-55 масс.% связующего вещества;
В) энтеросолюбильное покрытие в количестве, составляющем примерно 1,5-3,5 масс.% от массы указанного ядра;
при этом разложение указанной разлагаемой матрицы приводит к высвобождению эфира фумаровой кислоты - при подвергании тесту на растворимость in vitro с использованием 0,1 Н соляной кислоты в качестве среды для растворения в течение первых 2 часов указанного теста, а затем 0,05 М фосфатного буфера с pH 6,8 в качестве среды для растворения - следующим образом:
в течение первых 2 часов после начала теста высвобождается от примерно 0 масс.% до примерно 5 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 3 часов после начала теста высвобождается от примерно 20 масс.% до примерно 75 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 4 часов после начала теста высвобождается от примерно 50 масс.% до примерно 98 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 5 часов после начала теста высвобождается от примерно 70 масс.% до примерно 100 масс.% общего количества эфира фумаровой кислоты, содержащегося в указанном составе.
В соответствии с одним из аспектов настоящее изобретение относится к фармацевтическому составу в форме таблетки с разлагаемой матрицей, содержащему:
A) ядро таблетки, содержащее:
i) 30-60 масс.% одного или более эфиров фумаровой кислоты, выбранных из ди-(С1-С5)алкилэфиров фумаровой кислоты и моно-(С1-С5)алкилэфиров фумаровой кислоты, или их фармацевтически приемлемой соли в качестве активного вещества,
ii) 3-6 масс.% контролирующего скорость агента;
iii) 35-65 масс.% связующего вещества;
B) энтеросолюбильное покрытие в количестве, составляющем примерно 1,5-3,5 масс.% от массы указанного ядра;
при этом разложение указанной разлагаемой матрицы приводит к высвобождению эфира фумаровой кислоты - при подвергании тесту на растворимость in vitro с использованием 0,1 Н соляной кислоты в качестве среды для растворения в течение первых 2 часов указанного теста, а затем 0,05 М фосфатного буфера с pH 6,8 в качестве среды для растворения - следующим образом:
в течение первых 2 часов после начала теста высвобождается от примерно 0 масс.% до примерно 5 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 3 часов после начала теста высвобождается от примерно 20 масс.% до примерно 75 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 4 часов после начала теста высвобождается от примерно 50 масс.% до примерно 98 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 5 часов после начала теста высвобождается от примерно 70 масс.% до примерно 100 масс.% общего количества эфира фумаровой кислоты, содержащегося в указанном составе.
В соответствии с одним из аспектов настоящее изобретение относится к фармацевтическому составу в форме монолитной таблетки с разлагаемой матрицей, содержащему:
A) ядро таблетки, содержащее:
i) 40-60 масс.% одного или более эфиров фумаровой кислоты, выбранных из ди-(С1-С5)алкилэфиров фумаровой кислоты и моно-(С1-С5)алкилэфиров фумаровой кислоты, или их фармацевтически приемлемой соли в качестве активного вещества,
ii) 4-6 масс.% контролирующего скорость агента;
iii) 35-55 масс.% связующего вещества;
B) энтеросолюбильное покрытие в количестве, составляющем примерно 1,5-3,5 масс.% от массы указанного ядра;
при этом разложение указанной разлагаемой матрицы приводит к высвобождению эфира фумаровой кислоты - при подвергании тесту на растворимость in vitro с использованием 0,1 Н соляной кислоты в качестве среды для растворения в течение первых 2 часов указанного теста, а затем 0,05 М фосфатного буфера с pH 6,8 в качестве среды для растворения - следующим образом:
в течение первых 2 часов после начала теста высвобождается от примерно 0 масс.% до примерно 5 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 3 часов после начала теста высвобождается от примерно 20 масс.% до примерно 75 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 4 часов после начала теста высвобождается от примерно 50 масс.% до примерно 98 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 5 часов после начала теста высвобождается от примерно 70 масс.% до примерно 100 масс.% общего количества эфира фумаровой кислоты, содержащегося в указанном составе.
В соответствии с одним из аспектов настоящее изобретение относится к фармацевтическому составу в форме монолитной таблетки с разлагаемой матрицей, содержащему:
A) ядро таблетки, содержащее:
i) 30-60 масс.% одного или более эфиров фумаровой кислоты, выбранных из ди-(С1-С5)алкилэфиров фумаровой кислоты и моно-(С1-С5)алкилэфиров фумаровой кислоты, или их фармацевтически приемлемой соли в качестве активного вещества,
ii) 3-6 масс.% контролирующего скорость агента;
iii) 35-65 масс.% связующего вещества;
B) энтеросолюбильное покрытие в количестве, составляющем примерно 1,5-3,5 масс.% от массы указанного ядра;
при этом разложение указанной разлагаемой матрицы приводит к высвобождению эфира фумаровой кислоты - при подвергании тесту на растворимость in vitro с использованием 0,1 Н соляной кислоты в качестве среды для растворения в течение первых 2 часов указанного теста, а затем 0,05 М фосфатного буфера с pH 6,8 в качестве среды для растворения - следующим образом:
в течение первых 2 часов после начала теста высвобождается от примерно 0 масс.% до примерно 5 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 3 часов после начала теста высвобождается от примерно 20 масс.% до примерно 75 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 4 часов после начала теста высвобождается от примерно 50 масс.% до примерно 98 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 5 часов после начала теста высвобождается от примерно 70 масс.% до примерно 100 масс.% общего количества эфира фумаровой кислоты, содержащегося в указанном составе.
В соответствии с одним из аспектов настоящее изобретение относится к фармацевтическому составу в форме таблетки с разлагаемой матрицей, содержащему:
A) ядро таблетки, содержащее:
i) 30-60 масс.% одного или более эфиров фумаровой кислоты, выбранных из ди-(С1-С5)алкилэфиров фумаровой кислоты и моно-(С1-С5)алкилэфиров фумаровой кислоты, или их фармацевтически приемлемой соли в качестве активного вещества,
ii) 3-6 масс.% контролирующего скорость агента;
iii) 35-65 масс.% связующего вещества;
B) энтеросолюбильное покрытие в количестве, составляющем примерно 1,5-3,5 масс.% от массы указанного ядра;
при этом разложение указанной разлагаемой матрицы приводит к высвобождению эфира фумаровой кислоты - при подвергании тесту на растворимость in vitro с использованием 0,1 Н соляной кислоты в качестве среды для растворения в течение первых 2 часов указанного теста, а затем 0,05 М фосфатного буфера с pH 6,8 в качестве среды для растворения - следующим образом:
в течение первых 2 часов после начала теста высвобождается от примерно 0 масс.% до менее примерно 10 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 3 часов после начала теста высвобождается от примерно 20 масс.% до примерно 75 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 4 часов после начала теста высвобождается от примерно 50 масс.% до примерно 98 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 5 часов после начала теста высвобождается от примерно 70 масс.% до примерно 100 масс.% общего количества эфира фумаровой кислоты, содержащегося в указанном составе.
В соответствии с одним из аспектов настоящее изобретение относится к фармацевтическому составу в форме монолитной таблетки с разлагаемой матрицей, содержащему:
A) ядро таблетки, содержащее:
i) 30-60 масс.% одного или более эфиров фумаровой кислоты, выбранных из ди-(С1-С5)алкилэфиров фумаровой кислоты и моно-(С1-С5)алкилэфиров фумаровой кислоты, их или фармацевтически приемлемой соли в качестве активного вещества,
ii) 3-6 масс.% контролирующего скорость агента;
iii) 35-65 масс.% связующего вещества;
B) энтеросолюбильное покрытие в количестве, составляющем примерно 1,5-3,5 масс.% от массы указанного ядра;
при этом разложение указанной разлагаемой матрицы приводит к высвобождению эфира фумаровой кислоты - при подвергании тесту на растворимость in vitro с использованием 0,1 Н соляной кислоты в качестве среды для растворения в течение первых 2 часов указанного теста, а затем 0,05 М фосфатного буфера с pH 6,8 в качестве среды для растворения - следующим образом:
в течение первых 2 часов после начала теста высвобождается от примерно 0 масс.% до менее примерно 10 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 3 часов после начала теста высвобождается от примерно 20 масс.% до примерно 75 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 4 часов после начала теста высвобождается от примерно 50 масс.% до примерно 98 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 5 часов после начала теста высвобождается от примерно 70 масс.% до примерно 100 масс.% общего количества эфира фумаровой кислоты, содержащегося в указанном составе.
В соответствии с одним из аспектов настоящее изобретение относится к фармацевтическому составу в форме таблетки с разлагаемой матрицей, содержащему:
A) ядро таблетки, содержащее:
i) 30-60 масс.% диметилфумарата,
ii) 3-6 масс.% гидроксипропилцеллюлозы;
iii) 35-65 масс.% лактозы;
B) энтеросолюбильное покрытие в количестве, составляющем примерно 1,5-3,5 масс.% от массы указанного ядра;
при этом разложение указанной разлагаемой матрицы приводит к высвобождению диметилфумарата - при подвергании тесту на растворимость in vitro с использованием 0,1 Н соляной кислоты в качестве среды для растворения в течение первых 2 часов указанного теста, а затем 0,05 М фосфатного буфера с pH 6,8 в качестве среды для растворения - следующим образом:
в течение первых 2 часов после начала теста высвобождается от примерно 0 масс.% до примерно 5 масс.% диметилфумарата, содержащегося в указанном составе, и/или
в течение первых 3 часов после начала теста высвобождается от примерно 20 масс.% до примерно 75 масс.% диметилфумарата, содержащегося в указанном составе, и/или
в течение первых 4 часов после начала теста высвобождается от примерно 50 масс.% до примерно 98 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 5 часов после начала теста высвобождается от примерно 70 масс.% до примерно 100 масс.% общего количества диметилфумарата, содержащегося в указанном составе.
В соответствии с одним из аспектов настоящее изобретение относится к фармацевтическому составу в форме монолитной таблетки с разлагаемой матрицей, содержащему:
A) ядро таблетки, содержащее:
i) 30-60 масс.% диметилфумарата,
ii) 3-6 масс.% гидроксипропилцеллюлозы;
iii) 35-65 масс.% лактозы;
B) энтеросолюбильное покрытие в количестве, составляющем примерно 1,5-3,5 масс.% от массы указанного ядра;
при этом разложение указанной разлагаемой матрицы приводит к высвобождению диметилфумарата - при подвергании тесту на растворимость in vitro с использованием 0,1 Н соляной кислоты в качестве среды для растворения в течение первых 2 часов указанного теста, а затем 0,05 М фосфатного буфера с pH 6,8 в качестве среды для растворения - следующим образом:
в течение первых 2 часов после начала теста высвобождается от примерно 0 масс.% до примерно 5 масс.% диметилфумарата, содержащегося в указанном составе, и/или
в течение первых 3 часов после начала теста высвобождается от примерно 20 масс.% до примерно 75 масс.% диметилфумарата, содержащегося в указанном составе, и/или
в течение первых 4 часов после начала теста высвобождается от примерно 50 масс.% до примерно 98 масс.% эфира фумаровой кислоты, содержащегося в указанном составе, и/или
в течение первых 5 часов после начала теста высвобождается от примерно 70 масс.% до примерно 100 масс.% общего количества диметилфумарата, содержащегося в указанном составе.
В настоящем контексте термин «масс.%» относится к проценту по массе каждого компонента в ядре таблетки, что, таким образом, исключает любые внешние покрытия или пленки.
В соответствии с другим аспектом настоящее изобретение относится к способу получения состава согласно настоящему изобретению, включающему следующие этапы:
a) Растворение или суспендирование либо одного из, либо как эфира фумаровой кислоты, так и контролирующего скорость агента в форме полимерного матричного вещества в воде с получением водной суспензии указанных веществ;
b) Нанесение указанной водной суспензии распылением на гранулы эфира фумаровой кислоты и/или связующего вещества в течение периода времени, достаточного для получения на них равномерного покрытия;
c) Сушка полученных гранул;
d) Возможно просеивание или измельчение указанных гранул;
e) Приготовление смеси с любыми фармацевтически приемлемыми наполнителями и добавками по существу известным способом с получением состава в виде таблетки;
f) Нанесение энтеросолюбильного покрытия на указанный состав в виде таблетки по существу известным способом;
при этом любой или все из вышеуказанных этапов осуществляют при такой температуре, чтобы температура продукта не превышала 45ºС.
Известно, что, например, диметилфумарат может утрачиваться при сублимации, а сублимация более выражена при более высоких температурах.
В соответствии с некоторыми аспектами изготовление составов согласно настоящему изобретению осуществляют при относительно низкой температуре для минимизации или уменьшения сублимации, и включая несколько промежуточных этапов и минимальное вовлечение немеханизированных этапов. Данные факторы способствуют тому, чтобы процесс изготовления был масштабируемым и осуществимым в промышленных условиях и в промышленном масштабе. В соответствии с некоторыми аспектами было обнаружено, что составы согласно настоящему изобретению могут быть изготовлены в более крупном масштабе, таком как по меньшей мере 15 кг, таком как по меньшей мере 20 кг, таком как по меньшей мере 30 кг.
В соответствии с другим аспектом настоящее изобретение относится к способу получения состава согласно настоящему изобретению, включающему следующие этапы:
a) Растворение или суспендирование контролирующего скорость агента в форме полимерного матричного вещества в воде с получением водной суспензии указанного вещества;
b) Нанесение указанной водной суспензии распылением на гранулы эфира фумаровой кислоты в течение периода времени, достаточного для получения на них равномерного покрытия;
c) Сушка полученных гранул;
d) Возможно просеивание или измельчение указанных гранул;
e) Приготовление смеси с любыми фармацевтически приемлемыми наполнителями и добавками по существу известным способом с получением состава в виде таблетки;
f) Нанесение энтеросолюбильного покрытия на указанный состав в виде таблетки по существу известным способом;
при этом любой или все из вышеуказанных этапов осуществляют при такой температуре, чтобы температура продукта не превышала 45ºС.
В соответствии с другим аспектом настоящее изобретение относится к способу получения состава согласно настоящему изобретению, включающему следующие этапы:
a) Возможно просеивание или измельчение кристаллов эфира фумаровой кислоты;
b) Смешивание указанных кристаллов эфира фумаровой кислоты, контролирующего скорость агента в форме полимерного матричного вещества и любых фармацевтически приемлемых наполнителей и добавок путем прямого прессования с получением состава в виде таблетки;
с) Нанесение энтеросолюбильного покрытия на указанный состав в виде таблетки по существу известным способом;
при этом любой или все из вышеуказанных этапов осуществляют при такой температуре, чтобы температура продукта не превышала 45ºС.
В соответствии с другим аспектом фармацевтический состав согласно настоящему изобретению предназначен для применения для лечения псориаза, псориатического артрита, нейродермита, воспалительного заболевания кишечника, такого как болезнь Крона и неспецифический язвенный колит, полиартрита, рассеянного склероза (PC), юношеского сахарного диабета, тиреоидита Хашимото, болезни Грейвса, СКВ (системной красной волчанки), синдрома Шегрена, пернициозной анемии, хронического активного (волчаночного) гепатита, ревматоидного артрита (РА), волчаночного нефрита, миастении гравис, увеита, рефракторного увеита, весеннего конъюнктивита, обыкновенной пузырчатки, склеродермии, неврита зрительного нерва, боли, такой как корешковая боль, боль, связанная с радикулопатией, нейропатическая боль или ишиас/ишиасная боль, трансплантации органов (предупреждение отторжения), саркоидоза, липоидного некробиоза или анулярной гранулемы.
Другой аспект настоящего изобретения представляет собой применение фармацевтического состава согласно настоящему изобретению для получения лекарственного средства для лечения псориаза, псориатического артрита, нейродермита, воспалительного заболевания кишечника, такого как болезнь Крона и неспецифический язвенный колит, полиартрита, рассеянного склероза (PC), юношеского сахарного диабета, тиреоидита Хашимото, болезни Грейвса, СКВ (системной красной волчанки), синдрома Шегрена, пернициозной анемии, хронического активного (волчаночного) гепатита, ревматоидного артрита (РА), волчаночного нефрита, миастении гравис, увеита, рефракторного увеита, весеннего конъюнктивита, обыкновенной пузырчатки, склеродермии, неврита зрительного нерва, боли, такой как корешковая боль, боль, связанная с радикулопатией, нейропатическая боль или ишиас/ишиасная боль, трансплантации органов (предупреждение отторжения), саркоидоза, липоидного некробиоза или анулярной гранулемы.
Другой аспект настоящего изобретения представляет собой способ лечения псориаза, псориатического артрита, нейродермита, воспалительного заболевания кишечника, такого как болезнь Крона и неспецифический язвенный колит, полиартрита, рассеянного склероза (PC), юношеского сахарного диабета, тиреоидита Хашимото, болезни Грейвса, СКВ (системной красной волчанки), синдрома Шегрена, пернициозной анемии, хронического активного (волчаночного) гепатита, ревматоидного артрита (РА), волчаночного нефрита, миастении гравис, увеита, рефрактерного увеита, весеннего конъюнктивита, обыкновенной пузырчатки, склеродермии, неврита зрительного нерва, боли, такой как корешковая боль, боль, связанная с радикулопатией, нейропатическая боль или ишиас/ишиасная боль, трансплантации органов (предупреждение отторжения), саркоидоза, липоидного некробиоза или анулярной гранулемы, при этом указанный способ включает пероральное введение пациенту, нуждающемуся в этом, эффективной дозы фармацевтического состава согласно настоящему изобретению.
ПОЯСНЕНИЯ К ЧЕРТЕЖАМ
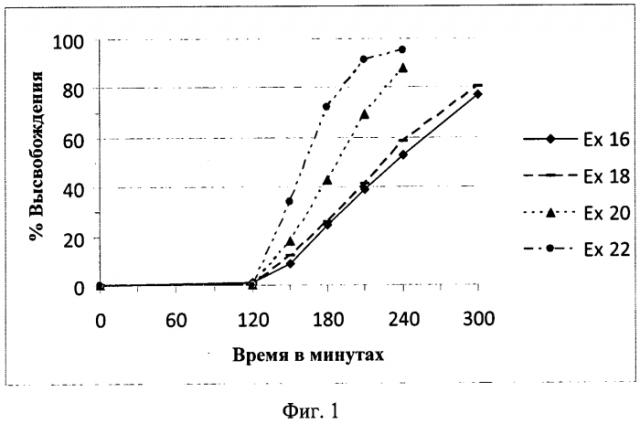
На Фиг.1 показаны характеристики растворения in vitro при 37ºС с использованием прибора с лопастью для растворения при 100 об/мин с использованием 0,1 Н соляной кислоты в качестве среды для растворения в течение первых 2 часов теста, а затем 0,05 М фосфатного буфера с pH 6,8 в качестве среды для растворения для оставшегося периода проведения теста покрытых пленкой или энтеросолюбильным покрытием таблеток с разлагаемой матрицей согласно настоящему изобретению, как описано в Примерах 16, 18, 20 и 22.
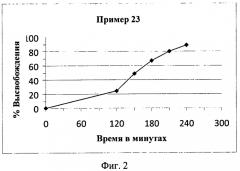
На Фиг.2 показаны характеристики растворения in vitro при 37ºС с использованием прибора с лопастью для растворения при 100 об/мин с использованием 0,1 Н соляной кислоты в качестве среды для растворения в течение первых 2 часов теста, а затем 0,05 М фосфатного буфера с pH 6,8 в качестве среды для растворения для оставшегося периода проведения теста покрытой пленкой таблетки с разлагаемой матрицей согласно настоящему изобретению, как описано в Примере 23.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем контексте термин «АФИ», который представляет собой аббревиатуру «активного фармацевтического ингредиента», и термин «активное вещество» являются взаимозаменяемыми и относятся к эфиру (эфирам) фумаровой кислоты, который должен высвобождаться из фармацевтического состава согласно настоящему изобретению.
В настоящем контексте термин «контролируемое или замедленное высвобождение» относится к высвобождению из состава, предназначенного для высвобождения эфира фумаровой кислоты пролонгированным, ретардированным, медленным и/или отсроченным способом по сравнению с высвобождением коммерчески доступного продукта Фумадерм при тестировании в сопоставимых условиях (например, для исследований in vivo: эквиваленты доз со стандартизированной пищей или без нее и т.д., или для исследований in vitro: эквиваленты доз, прибор для проведения теста на растворимость и условия, включающие, например, композицию, объем и температуру используемой среды для растворения, скорость вращения и т.д.).
Высвобождение in vivo можно тестировать путем измерения концентрации в плазме в заранее определенные периоды времени и, таким образом, путем получения графика зависимости концентрации в плазме от времени для рассматриваемого эфира фумаровой кислоты или, при необходимости, его метаболита. Кроме того, предполагается, что метаболизм происходит уже в желудочно-кишечном тракте или при прохождении слизистой оболочки желудочно-кишечного тракта, или при первом прохождении через печеночное кровообращение. Соответственно, при введении диметилфумарата соответствующим компонентом для обнаружения в плазме может являться монометиловый эфир, а не диметиловый эфир фумаровой кислоты.
Также могут быть использованы другие тесты для определения или измерения высвобождения активного вещества in vivo. Таким образом, животные (например, карликовые свиньи, собаки и т.д.) могут быть использованы в качестве модели. Указанные животные получают исследуемые композиции и после определенных периодов времени забирают образцы крови и определяют содержание активного компонента (или его метаболита, при необходимости) в плазме или конкретных органах, или экстрагируют из содержимого кишечника.
Другой тест включает использование конкретного сегмента кишечника животного или человека. Указанный сегмент помещают в подходящее устройство, содержащее две камеры (донор и получатель), отделенные сегментом, и исследуемую композицию помещают в подходящую среду в одну камеру (донорную камеру). Композиция будет высвобождать активное вещество, которое затем переносится через сегмент кишечника. Соответственно, в подходящие интервалы времени концентрацию активного вещества (или, при необходимости, метаболита) измеряют в камере-получателе.
Специалист в данной области техники сможет применить вышеуказанный способ к конкретной композиции.
Относительно способов in vitro, доступны известные способы, в частности, способы, описанные в официальных фармакопейных статьях, таких как, например, Фармакопея США (USP) или Европейская Фармакопея. Специалисту в данной области техники известно какой способ выбрать и как выбрать конкретные условия для проведения теста in vitro. Например, USP предписывает проведение тестов in vitro при 37+/-1,0, например, 37+/-0,5 градусах по Цельсию/по стоградусной шкале. В соответствии с одним из аспектов подходящий тест на растворимость представляет собой тест, в котором характеристики растворения определяют, как описано в Фармакопее США при 37ºС с использованием прибора с лопастью для рас