Соединения пиримидинилиндола
Иллюстрации
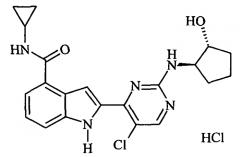
Показать всеИзобретение относится к новому соединению формулы (I) или его фармацевтически приемлемой соли, обладающим свойствами ингибитора ΙΚΚβ и TNFα. Соединение может найти применение при лечении воспалительных заболеваний, таких как ревматоидный артрит, хроническая обструктивная болезнь легких, астма, рассеянный склероз и воспалительные заболевания кишечника, или раковых заболеваний, таких как множественная миелома, рак толстой кишки, рак поджелудочной железы и рак яичников, посредством ингибирования ΙΚΚβ. Соединение может быть использовано с дополнительным терапевтическим агентом, выбранным из винкристина, камптотецина гидрохлорида (СРТ-11), лефуномида, дексаметазона и TNFα. Предпочтительны соединения формулы (I), соответствующие 2-{5-хлор-2-[(1R,2R)-2-гидроксициклопентиламино]пиримидин-4-ил}-N-циклопропил-1H-индол-4-карбоксамиду и 2-{5-хлор-2-[(1R,2S)-2-гидроксициклопентиламино]пиримидин-4-ил}-N-циклопропил-1H-индол-4-карбоксамиду.
(I)
8 н. и 22 з.п. ф-лы, 4 табл., 2 пр.
Реферат
Настоящее изобретение относится к пиримидинилиндольным соединениям, композициям и их применению в терапевтических целях, в частности при лечении рака и воспалительных заболеваний.
IKKβ является ключевой киназой, регулирующей сигнальные пути, связанные с воспалением и стрессом, в связи с чем полагают, что она связана с развитием различных заболеваний человека от рака до воспалительных заболеваний.
Пиримидинилиндольные соединения, которые применяют в качестве ингибиторов киназ, уже известны в данной области. См. WO 04089913 (ингибиторы IKKP), WO 06038001, и WO 06075152. Кроме того, в данной области также известны соединения пиримидинилбензотиофена, которые применяют в качестве ингибиторов IKKβ. См. WO 07092095.
Существует необходимость в эффективных ингибиторах IKKβ, которые можно применять для лечения рака или воспалительных заболеваний. Существует также потребность в таких соединениях, которые проявляют синергетический эффект в сочетании с TNFα или винкристином (VCR).
Настоящее изобретение относится к новым соединениям пиримидинилиндола для клинического применения при лечении рака и воспалительных заболеваний посредством ингибирования IKKβ. В частности, настоящее изобретение относится к новым пиримидинилиндольным соединениям формулы:
или фармацевтически приемлемым солям этого соединения.
Настоящее изобретение также относится к способу лечения ракового заболевания, выбранного из группы, состоящей из множественной миеломы, рака толстой кишки, крупноклеточного рака легкого, глиобластомы, рака поджелудочной железы и рака яичников у млекопитающего, способ включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения согласно настоящему изобретению или его соли.
Настоящее изобретение также относится к способу лечения воспалительных заболеваний выбранных из группы, состоящей из ревматоидного артрита, хронической обструктивной болезни легких, бронхиальной астмы, рассеянного склероза и воспалительных заболеваний кишечника у млекопитающего, способ включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения согласно настоящему изобретению или его соли.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение согласно настоящему изобретению или его соль в комбинации с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или наполнителями. В частном варианте реализации настоящего изобретения композиция дополнительно содержит один или более других терапевтических агентов. В другом варианте реализации дополнительным терапевтическим агентом является TNFα. Согласно другому варианту реализации дополнительным терапевтическим агентом является винкристин.
Настоящее изобретение также описывает соединение или его соль для применения в терапии. Настоящее изобретение также описывает соединение или его соль для применения в лечении ракового заболевания. Дополнительно, настоящее изобретение относится к применению соединения согласно настоящему изобретению или его соли в производстве лекарственного средства для лечения ракового заболевания. В частности, раковое заболевание выбрано из группы, состоящей из множественной миеломы, рака толстой кишки, крупноклеточного рака легкого, крупноклеточный рак легкого, глиобластома, рак поджелудочной железы и рака яичников. Одним из вариантов реализации является множественная миелома. Другим вариантом реализации является рак толстой кишки. Другим вариантом реализации является крупноклеточный рак легкого. Другим вариантом реализации является глиобластома. Другим вариантом реализации является рак поджелудочной железы. Другим вариантом реализации является рак яичников. Настоящее изобретение также описывает соединения настоящего изобретения или их соли для применения при лечении воспалительных заболеваний. Кроме того, настоящее изобретение относится к применению соединения согласно настоящему изобретению или его соли в производстве лекарственного средства для лечения воспалительных заболеваний. В частности, такое воспалительное заболевание выбрано из группы, состоящей из ревматоидного артрита, хронической обструктивной болезни легких, бронхиальной астмы, рассеянного склероза и воспалительных заболеваний кишечника. Одним из вариантов реализации является ревматоидный артрит. Другим вариантом реализации является хроническая обструктивная болезнь легких. Другим вариантом реализации является астма. Другим вариантом реализации является рассеянный склероз. Другим вариантом реализации является воспалительные заболевания кишечника. Кроме того, настоящее изобретение относится к фармацевтической композиции для лечения ракового заболевания, выбранного из группы, состоящей из множественной миеломы, рака толстой кишки, крупноклеточного рака легкого, глиобластомы, рака поджелудочной железы и рака яичников, при этом активным компонентом такой композиции является соединение настоящего настоящему изобретению или его соль. Дополнительно, настоящее изобретение относится к фармацевтической композиции для лечения воспалительных заболеваний выбранных из группы, состоящей из ревматоидного артрита, хронической обструктивной болезни легких, бронхиальной астмы, рассеянного склероза и воспалительного заболевания кишечника, при этом активным компонентом такой композиции является соединение согласно настоящему изобретению или его соль.
Соединения и соли согласно настоящему изобретению получают по существу так, как проиллюстрировано как в схемах, так и в примерах. Кроме того, все соединения настоящего изобретения и их соли существуют в виде диастереомеров или энантиомеров благодаря замещениям в циклопентиловом кольце. Использование конкретных диастереомеров в качестве реагентов позволяет получить оптически чистые соединения. Оптически чистые соединения также можно получить с помощью хроматографии/хиральной хроматографии на основе смеси диастереоизомеров или рацематов, соответствующих соединениям настоящего изобретения или его солям.
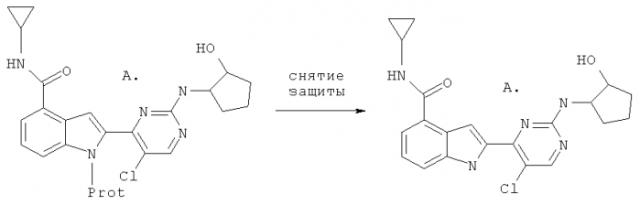
Схема I
Синтез соединений согласно настоящему изобретению
Prot=этоксиметил или трет-бутоксикарбонил
Соединения настоящего изобретения получают посредством снятия защиты с защищенных предшественников (A) с помощью обработки HCl, трифторуксусной кислотой (TFA) или п-толуолсульфокислотой (TsOH) в метаноле или этаноле.
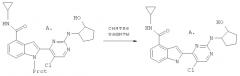
Схема II
Синтез предшественников (А)
Предшественники A получают двумя путями, как показано выше. В верхней реакции, индол-4-карбоновая кислота (B) связывается с циклопропиламином в присутствии дегидратирующего агента такого, как бензотриазол-1-илокситрис(диметиламино)-фосфония гексафторфосфат (ВОР) или дициклогексилкарбодиимид. Специалистам в области органического синтеза известно, что такие реакции амидной конденсации можно проводить на любой стадии органического синтеза, ведущего к соединениям формулы (I).
В нижней реакции 2-аминоциклопентанол (D) замещает хлор в хлорпиримидиновом промежуточном продукте (C) в присутствии основания такого, как гидрид натрия, диизопропилэтиламин (DIPEA) или карбонат калия при повышенной температуре (70-130°C) в таких растворителях, как диметилсульфоксид (ДМСО) или диметилформамид (DMF). Специалистам в области органического синтеза известно, что такие реакции замещения хлора можно проводить на любой стадии органического синтеза, ведущего к соединениям настоящего изобретения (I).
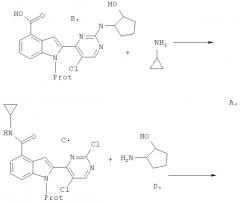
Схема III
Синтез карбоновой кислоты (B)
Индол-4-карбоновые кислоты (B) получают путем замещения хлора в пиримидиниловом эфире (E) на 2-аминоциклопентанол (D) аналогично нижней реакции из Схемы II с последующим омылением промежуточного эфира карбоновой кислоты.
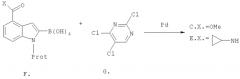
Схема IV
Синтез пиримидинилхлоридов (C) и (E)
Пиримидинилхлориды (C) и (E) получают путем катализируемых палладием реакций связывания между индол-2-борной кислотой (F или их С1-C3 алкильные эфиры борной кислоты) и коммерчески доступными трихлорпиримидинами (G). Катализатором является либо Pd(OAc)2, Pd(PPh3)4, либо PdCl2(dppf), при этом реакции связывания проходят при повышенной температуре (50-110°C) в полярных апротонных растворителях, например, тетрагидрофуране (ТГФ).
Индольные предшественники (H), которые являются коммерчески доступными или которые получают с помощью методов, описанных в литературе, сначала защищают по N1-положению в присутствии основания с помощью хлорметилэтилового эфира, C1-C3 триалкилсилилхлоридов, или ди-трет-бутилдикарбоната с последующим замещением водорода в положении 2 индола на литий и обработкой С1-C3 триалкилэфирами борной кислоты с получением борной кислоты или боратов (F).
Настоящее изобретение включает различные стереоизомеры и их смеси. Стереоизомеры представляют собой энантиомеры и диастереомеры, а также смеси энантиомеров или диастереомеров. Индивидуальные стереоизомеры соединений согласно настоящему изобретению могут быть получены синтетическим путем из коммерчески доступных исходных материалов, которые содержат асимметричные или хиральные центры, или посредством получения рацемических смесей с последующим разделением с помощью методов, хорошо известных специалистам в данной области. Примером такого разделения могут служить: (1) присоединение смеси энантиомеров к хиральному вспомогательному реагенту, разделение полученной смеси диастереомеров с помощью перекристаллизации или хроматографии, и, если это необходимо, выделение оптически чистого продукта, свободного от вспомогательного реагента, согласно методу, описанному в Furniss, Hannaford, Smith и Tatchell, "Учебник практической органической химии Вогеля", 5-е издание (1989), Longman Scientific & Technical, Essex CM20 2JE, Англия, или (2) прямое разделение смеси оптических энантиомеров на хиральных хроматографических колонках или (3) дробные методы перекристаллизации.
Для того чтобы дать названия следующим соединениям, используют ChemDraw Ultra 10.0.
Соединение 1
N-циклопропил-2-(2,5-дихлорпиримидин-4-ил)-1-(этоксиметил)-1H-индол-4-карбоксамид
(A) Получение метил-1-(этоксиметил)-1H-индол-4-карбоксилата. В атмосфере азота к раствору метил-1-(этоксиметил)-1H-индол-4-карбоксилата (80 г, 0.46 моль) в ТГФ (700 мл) добавляли гексаметилдисилазид калия (1M в ТГФ, 550 мл, 0.55 моль) по каплям при 0°C. Смесь перемешивали при 0°C в течение 30 минут (мин), после чего добавляли хлорметилэтиловый эфир (51 мл, 0.55 моль) при 0-5°С. После этого реакционную смесь перемешивали при комнатной температуре в течение 3 часов (ч), осторожно охлаждали с помощью 300 мл воды и экстрагировали этилацетатом (ЕА, 3×300 мл). Объединенные экстракты промывали насыщенным водным раствором хлорида натрия (2×400 мл), затем сушили над Na2SO4, фильтровали и концентрировали. Остаток 5 очищали с помощью хроматографии на силикагеле и получали соединение, указанное в названии (80 г, 75%). MS (m/z): 234 (М+Н)+.
(B) Получение 1-(этоксиметил)-1H-индол-4-карбоновой кислоты.
К раствору метилового эфира 1-(этоксиметил)-1H-индол-4-карбоновой кислоты (135 г, 0.58 моль) в метаноле (2 л) добавляли водный раствор гидроксида натрия (68 г, 1.74 моль в 340 мл H2O). Реакционную смесь перемешивали при 50°C в течение 3 часов. Летучие вещества удаляли в вакууме. Остаток подкисляли HCl (2 М) до pH=3-4, затем экстрагировали ЕА (2×700 мл). Объединенные экстракты промывали насыщенным водным раствором хлорида натрия (2×250 мл), сушили над безводным Na2SO4, концентрировали и получали соединение, указанное в названии (123 г, 96%). MS (m/z): 15 220(М+Н)+.
(C) Получение N-циклопропил-1-(этоксиметил)-1H-индол-4-карбоксамида.
К раствору 1-(этоксиметил)-1H-индол-4-карбоновой кислоты (123 г, 0.56 моль) в ТГФ (1,5 л) добавляли циклопропиламин (58 мл, 0.84 моль) и триэтиламин (ТЭА, 167 мл, 20 1.12 моль), а затем O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (240 г, 0.62 моль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Летучие вещества удаляли в вакууме. Остаток перемешивали в ЕА (1.5 л) и HCl (0.5%, 1 л) в течение 10 минут. Органический слой отделяли, промывали насыщенным водным раствором хлорида натрия (3×100 мл),
25 сушили над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле и получали соединение, указанное в названии (110 г, 77%). MS (m/z): 259 (М+Н)+.
(D) Получение N-циклопропил-2-(2,5-дихлорпиримидин-4-ил)-1 -(этоксиметил)-1H-30 индол-4-карбоксамида.
К раствору диизопропиламина (DIPA, 147 мл, 1.04 моль) в безводном ТГФ (600 мл) добавляли н-BuLi (2.5 М в гексане, 420 мл, 1.04 моль) при температуре -50°C. После добавления смесь перемешивали при -20°C в течение 30 минут, после чего охлаждали до -70°C. Затем добавляли раствор N-циклопропил-1-(этоксиметил)-1H-индол-4-карбоксамида (60 г, 0.23 моль) и три(изопропил)бората (56,4 мл, 0.25 моль) в безводном ТГФ (300 мл). Реакционную смесь перемешивали при -70°C в течение 30 мин. Реакционную смесь медленно нагревали до комнатной температуры, перемешивали в течение 1 ч, а затем охлаждали водным раствором K3PO4·3H2O (195 г, 0.74 моль, 700 мл воды). Сырую реакционную смесь дегазировали и продували азотом три раза. Добавляли 2,4,5-трихлорпипримидин (51 г, 0.27 моль) и дифенилфосфиноферроцендихлорид палладия (PdCl2(dppf)·CH2Cl2, 19.2 г, 0.023 моль), перемешивали в атмосфере азота при температуре кипячения в течение 1.5 часов. Летучие вещества удаляли в вакууме. Остаток экстрагировали с помощью дихлорметана (DCM, 3×500 мл). Объединенные экстракты промывали насыщенным водным раствором хлорида натрия (3×100 мл), сушили над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле и получали соединение, указанное в названии (30 г, 32%). MS (m/z): 405 [(М+1)+, 35Cl, 35Cl], 407 [(М+1)+, 35Cl, 37Cl] и 409 [(М+1)+, 37Cl, 37Cl].
Пример 1
2-{5-Хлоро-2-[(1R,2S)-2-гидроксициклопентиламино]пиримидин-4-ил}-N-циклопропил-1H-индол-4-карбоксамид гидрохлорид
Смесь N-циклопропил-2-(2,5-дихлорпиримидин-4-ил)-1-(этоксиметил)-1H-индол-4-карбоксамид (10 г, 25 ммоль), (1S,2R)-2-аминоциклопентанол гидрохлорид (4.1 г, 30 ммоль) и DIPEA (5 мл, 30 ммоль) в ДМСО (70 мл) перемешивали при 100°C в течение 3 ч, затем выливали в воду и экстрагировали ЕА. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия, сушили над Na2S04 и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле и получали 2-{5-Хлоро-2-[(1R,2S)-2-гиброксициклопентилшино]пиримидин-4-ил}-N-циклопропил-1-(этоксиметил)-1H-индол-4-карбоксамид (7 г, 60.3%). MS (m/z): 470 (35Cl) и 472 (37Cl) (М+Н)+.
Полученный продукт (7 г, 14.9 ммоль) перемешивали с хлористым водородом (6 М в метаноле, 210 мл, 1.26 моль) при 45°C в течение 12 часов. Осадок отфильтровывали, промывали метанолом, сушили в вакууме и получали соединение, указанное в названии (4.7 г, 70%). MS (m/z): 412 (35Cl) и 414 (37Cl) (М+Н)+.
Пример 2
2-{5-Хлоро-2-[(1R,2R)-2-гидроксициклопентиламино]пиримидин-4-ил}-N-циклопропил-1H-индол-4-карбоксамид гидрохлорид
Смесь N-циклопропил-2(2,5-дихлорпиримидин-4-ил)-1-(этоксиметил)-1H-индол-4-карбоксамид (30 г, 75 ммоль), (1R,2R)-2-аминоциклопентанол гидрохлорид (12.3 г, 90 ммоль) и DIPEA (37.5 мл, 225 ммоль) в ДМСО (150 мл) перемешивали при 80°C в течение 16 ч, затем выливали в воду (1 л) и экстрагировали ЕА (2×500 мл). Объединенные экстракты промывали насыщенным водным раствором хлорида натрия (500 мл), сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле и получали соединение, указанное в названии 2-{5-Хлоро-2-[(1R,2R)-2-гидроксициклопентиламино]пиримидин-4-ил}-N-циклопропил-1H-индол-4-карбоксамид гидрохлорид (33 г, 93%). МС (м/г): 470 (35Cl) и 472 (35Cl) (M+H)+.
Указанный выше продукт (33 г, 70 ммоль) перемешивали с хлористым водородом (6 М в метаноле, 1 л, 6 моль) при 45°C в течение 16 часов. Осадок отфильтровывали, промывали метанолом (2×300 мл), сушили в вакууме и получали соединение, указанное в названии (26.8 г, 85%). MS (m/z): 412 (35Cl) и 414 (37Cl) (M+H)+.
Внутрисуставное введение доминантно-негативного IKKβ значительно уменьшало тяжесть адъювант-индуцированного артрита у крыс (Tak PP et al., Arthritis Rheum. (2001) 44(8)1897-1907). IKKβ-нокаутные клетки имеют значительные дефекты в экспрессии TNFα-индуцированных цитокинов, хемокинов, или молекул адгезии. С помощью обусловленного или тканеспецифического нокаута IKKβ было обнаружено, что эта киназа необходима для выживания и пролиферации периферических В-клеток и для предотвращения апоптоза, опосредованного TNFα (Li Z-W, Omori AS, Labuda T, Karin М, Rickert RC, ″IKKβ is required for peripheral В cell survival и proliferation″ The J. Immunol, (2003), 170:4630-4637; Maeda S, Chang L, et al. ″IKKβ is required for prevention of apoptosis mediated by cell-bound but not by circulating TNFα″ Immunity, (2003), 19:725-737). Более того, удаление IKKβ из миелоидных клеток также сократило рост колит-ассоциированной опухоли (Greten FR и др., Cell, (2004), 118:285-296). Кроме того, несколько групп исследователей показало, что ингибиторы киназы IKKβ могут вызывать торможение роста клеток и/или усиление TNFα- или TRAIL-индуцированной гибели клеток у различных линий раковых клеток (Takaomi et al. Clinical Cancer Res., (2005), Vol 11:1974-82; Hideshima et al., JBC, (2002) 277:16639-47; Lam et al. Clinical Cancer Res., (2005) Vol 11:28-40).
Кроме того, WO07092095 описывает ингибиторы IKKβ, используемые для лечения множественной миеломы, рака толстой кишки, крупноклеточного рака легкого, глиобластомы, и рака яичников.
Оценка биологических свойств
Биологические свойства соединения согласно настоящему изобретению определяли с помощью следующих исследований. Ингибиторную активность соединения настоящего изобретения в отношении IKKβ оценивали с помощью ферментативного IKKβ-киназного анализа, который измеряет фосфорилирование IκВα субстрата соответствующими киназами, и с помощью анализа жизнеспособности, который измеряет способность соединений ингибировать рост клеток в различных опухолевых клеточных линиях, включая ВхРС-3 и SKOV3-luc. Противоопухолевые эффекты соединения согласно настоящему изобретению определяли как с помощью IVTI (in vivo ингибирование мишени) U87MG модели, которая позволяет оценить эффект изучаемого соединения на ингибирование экспрессии гена TNFα в U87MG ксенотрансплантатах, так и с помощью нескольких моделей эффективности ксенотрансплантата, включая влияние индивидуального соединения на рост опухоли рака яичников человека SKOV-3x-FF-Luci у голых мышей, и комбинированное изучение действия соединения с винкристином (VCR) на ксенотрансплантат рака яичника человека SKOV-3x-FF-Luci или с КПП-11 на ксенотрансплантат рака толстой кишки человека НТ-29. Противовоспалительную активность соединения настоящего изобретения определяли с помощью липополисахаридной (ЛПС) IVTI (in vivo ингибирование мишени) модели, которая позволяет оценить способность соединения ингибировать ЛПС-индуцированную продукцию цитокинов в плазме у мышей.
Противовоспалительную активность соединения настоящего изобретения исследовали как в IVTI (in vivo ингибирование мишени), так и IVEF (in vivo эффективность) моделях. Липополисахаридные (ЛПС) IVTI модели как у мышей, так и у крыс, использовали для оценки способности соединения ингибировать ЛПС-индуцированную продукцию цитокинов в плазме. Модель коллаген-индуцированного артрита (CIA) у мышей и крыс использовали для оценки противовоспалительного и анти-цитокинового эффектов. Модели овальбумин (OVA)-индуцированного воспаления легких у мышей и крыс использовали для оценки влияния соединения на OVA-индуцированное воспаление дыхательных путей. Модель экспериментального аутоиммунного энцефаломиелита (ЕАЕ) у мышей, модель рассеянного склероза у животных, и модель динитробензолсульфокислота (DNBS)-индуцированного колита у крыс также использовали для оценки противовоспалительного и анти-цитокинового эффектов.
Эти исследования показали, что Примеры 1 и 2 являются эффективными ингибиторами IKKβ, и, по меньшей мере, одно из соединений имеет противовоспалительную или противораковую активность.
IKKβ-киназный анализ
IKKβ-киназный анализ использовали для оценки влияния соединения согласно настоящему изобретению на ферментативную активность IKKβ киназы. IKKβ-киназный анализ проводили in vitro с использованием набора IKKβ-ингибиторов для скрининга (Calbiochem., Кат. №СВА044). Все реакции (50 мкл) выполняли, добавляя 10 мкл буфера для киназы (компонент набора, №JA9130), 10 мкл GST - IκВα субстрата (субстрат IKKβ, компонент набора, №JA9127), 10 мкл IKKβ (2,5 нг/лунка, компонент набора, №481404), 10 мкл испытуемого соединения (ДМСО раствор) или H2O, и 10 мкл ATP/MgCl2 (компонент набора, №JA7914), а затем инкубировали при 30°C в течение 30 мин. Содержимое лунок затем отбрасывали. Каждую лунку хорошо промывали 3 раза 200 мкл 1х буфера для промывки (компонент набора, №JA1617, разведение 1:20). 100 мкл конъюгата антител против фосфорилированного IκВα (Ser32/Ser36) (компонент набора, №JA9126) добавляли в каждую лунку и инкубировали при комнатной температуре в течение 1 часа. Затем лунки промывали 3 раза 1х буфером для промывки (компонент набора, №JA1617, разведение 1:20), 200 мл/лунка. После чего в каждую лунку добавляли по 100 мкл HRP-конъюгата (компонент набора, №JA7643) и инкубировали при комнатной температуре в течение 1 часа. Затем лунки промывали 3 раза по 200 мкл 1х буфера для промывки (компонент набора, №JA1617, разведение 1:20) и добавляли по 100 мкл конъюгата субстрата ТМБ в каждую лунку (компонент набора, №JA1608). Планшет инкубировали при комнатной температуре до изменения цвета раствора. Затем 100 мкл Stop-раствора для ИФА (компонент набора, №JA1616) добавляли в каждую лунку. Данные получали при 450 нм с опорной длиной волны 570 нм с помощью MultiScan (Thermo Labsystems). Для каждого соединения испытывали по 8 концентраций (от 10 мкМ до 0.003 мкМ), используя схему последовательных разведений 1:3. У всех примеров соединений согласно настоящему изобретению IC50<0.1 мкМ. Например, Пример 1 имеет IC50=0.015 мкМ, которая указывает на то, что соединение является эффективным ингибитором IKKβ.
В качестве альтернативы, 1ККβ-киназный анализ проводили in vitro с использованием набора для анализа Z'-Lyte™ Kit-Ser/Thr 5 Peptide (Invitrogen, Кат. №PV3178). Все реакции (20 мкл) проводили при смешивании 0,8 мкл испытуемого соединения в растворе ДМСО, 10 мкл киназно-пептидной смеси или фосфо-пептидного раствора (Invitrogen, Кат. №PV3219, разбавленного 1.33х буфером для киназы), 5 мкл 1,33×буфера для киназы (Invitrogen, Кат. №PV3189, 5х раствор, разбавленный дистиллированной водой) или раствор АТФ (5 мкМ), и 4.2 мкл дистиллированной воды. Компоненты смешивали в 384-луночном планшете для анализа (Corning, Кат. №3575) и инкубировали при комнатной температуре в течение 1 часа. Затем в каждую лунку добавляли по 10 мкл реакционного раствора [реакционный реагент В (Invitrogen, Кат. №PV3296) / реакционный буфер (Invitrogen, Кат. №PV3127)=1:128], перемешивали и инкубировали при комнатной температуре еще 1 час. После чего киназную реакцию останавливали путем добавления 10 мкл стоп-реагента (Invitrogen, Кат.№PV3094). Планшет анализировали с помощью Wallac 1420 VICTOR3 Multilabel счетчика (PERKIN ELMERTM) при длинах волн флуоресценции 445 нм и 520 нм. Анализ характеризуется MSR=2.14. Изначально протестировано 8 концентраций соединения (от 10 мкМ до 0.003 мкМ) с использованием 1:3 схемы последовательных разведений. Пример 2 имеет IC50=0.058 мкМ. Этот результат показывает, что Пример 2 также является эффективным ингибитором IKKβ.
Тест жизнеспособности клеток
Для оценки биологической активности соединения в лабораторных условиях проводится тест жизнеспособности клеток, при котором IKKβ рецептор играет важную роль в выживании и пролиферации клеток. После того, как IKKβ путь блокируется ингибиторами, клетка может пойти путем апоптоза или смерти. Тест жизнеспособности клеток предоставляет информацию о выживаемости клеток после обработки ингибиторами IKKβ.
ВхРС-3 клетки (АТСС CRL-1687; клеточная линия рака поджелудочной железы человека) выращивали в среде Roswell Park Memorial Institute (RPMI) 1640 (Gibco#A10491-01) с добавлением 10% эмбриональной бычьей сыворотки (FBS) (Gibco#10099-141). SKOV3-luc клетки (АТСС, клеточная линия карциномы яичников человека) выращивали в среде 5а Маккоя (Gibco#16600) с добавлением 10% FBS (Gibco#10099-141). Для тестирования соединения ВхРС-3 и SKOV3-luc клетки высевали в количестве 2000 и 5000 клеток/лунку соответственно в 100 мкл соответствующей среды, указанной выше для каждой клеточной линии, в 96-луночные планшеты за 20 ч до начала обработки. Клетки обрабатывали тестируемым соединением в восьми различных концентрациях в присутствии 0,5% ДМСО в течение 72 часов. Гибель клеток в каждой лунке определяли с помощью добавления 20 мкл реагента «Реагент Одного Раствора» (CELLTITER 96® «Анализ Клеточной Пролиферации Одним Водным Раствором», Promega#G3580). Через 2-4 ч инкубации при температуре 37°C оптическую плотность измеряли при 492 нм с помощью микропланшетного ридера. Ингибирование жизнеспособности клеток определяли при сравнении опытных клеток с контрольными, для обработки которых не использовали тестируемое соединение.
В процессе комбинированного исследования при использовании соединения совместно с другими противоопухолевыми агентами BxPC-3 и SKOV3-luc клетки высевали в количестве 2000 и 5000 клеток/лунку соответственно в 100 мкл соответствующей среды, указанной выше для каждой клеточной линии, в 96-луночные планшеты за 20 ч до обработки. Клетки обрабатывали испытуемым соединением в нескольких концентрациях в течение 30 минут, а затем подвергали действию 5 нг/мл TNFα или 0.15-0.6 нМ VCR (винкристин сульфат) в течение дополнительных 72 часов. Гибель клеток в каждой лунке определяли с помощью добавления 20 мкл реагента «Реагент Одного Раствора» (CELLTITER 96® Анализ Клеточной Пролиферации Одним Водным Раствором, Promega#G3580). Через 2-4 ч инкубации при температуре 37°C, оптическую плотность измеряли при 492 нм с помощью микропланшетного ридера.
Ингибирование жизнеспособности клеток определяли при сравнении опытных клеток с контрольными, для обработки которых не использовали тестируемое соединение. Например, результаты комбинированного исследования с использованием Примера 1 подробно представлены в Таблице 1. Пример 1 демонстрирует синергетические эффекты в отношении подавления роста опухолевых клеток ВхРС-3 и SKOV3 в комбинации с TNFα или с VCR (эффекты Примера 1 увеличиваются или усиливаются, см. таблицу 2 - у BxPC-3 клеточной линии: только Пример 1 (2.5 нМ) - 16,48% ингибирования; только TNFα (5 нг/мл) - 5.73% ингибирования; TNFα (5 нг/мл)+Пример 1 (2.5 мкМ) - 87.75% ингибирования; также у ВхРС-3 клеточной линии: только пример 1 (25 мкМ) - 11,5% ингибирования; только Винкристин (0.15 мкМ) - 5.73% ингибирования; Винкристин (0,15 мкМ)+Пример 1 (25 мкМ) - 80.25% ингибирования). Эти данные свидетельствуют о терапевтической пользе Примера 1 в сочетании с TNFα или VCR для лечения рака яичников и рака поджелудочной железы.
| Таблица 1. | ||
| Комбинированное использование Примера 1 с другими противораковыми агентами | ||
| Клеточная линия | Агенты | Средняя степень ингибирования |
| Вхрс-3 | TNFα (5 нг/мл) | 5.73% |
| Пример 1 (2.5 мкМ) | -16.48% | |
| TNFα (5 нг/мл)+Пример 1 (2.5 мкМ) | 87.75% | |
| Bxpc-3 | Винкристин (0.15 мкМ) | 9.48% |
| Пример 1 (25 мкМ) | 11.53% | |
| Винкристин (0.15 мкМ)+Пример 1 (25 мкМ) | 80.25% | |
| Skov3-luc | Винкристин (0.25 мкМ) | 24.96% |
| Пример 1 (12.5 мкМ) | 21.76% | |
| Винкристин (0.25 мкМ)+Пример 1 (12.5 мкМ) | 82.29% |
Ингибирование экспрессии гена TNFα в ксенотрансплантате U87MG
TNFα стимулирует сигнальный путь IKKβ и запускает экспрессию гена TNFα. Чтобы убедиться, что мишенью соединения in vivo является IKKβ, соединение проверяли на его способность ингибировать TNFα индуцированную экспрессию гена TNFα в ксенотрансплантате U87MG (клеточная линия глиобластомы человека). Опухолевые клетки U87MG в количестве 3×106 имплантировали подкожно в правый бок самкам бестимусных голых мышей BALB/C (6-8 недель). Через 10-12 дней, когда объем опухоли достиг 200-300 мм, животных случайным образом разделили на следующие группы: контроль (без стимуляции TNFα), модель (стимуляция TNFα), и группа, которой вводили тестируемое соединение: 10, 30, 60 и 100 мг/кг (наряду со стимуляцией TNFα). Тестируемое соединение вводили голым мышам перорально за 2 ч до извлечения опухоли. TNFα (R&D, Кат. №210-ТА) в концентрации 8 мкг/кг вводили внутривенно за 1 ч до извлечения опухоли.
Тотальную РНК экстрагировали, используя RNEASY® mini Kit (QIAGEN®, Кат. №74126). Синтез кДНК осуществляли, используя высокоэффективный набор для обратной транскрипции кДНК (ABI, Кат. №4368813). Количественный ПЦР реального времени выполняли в системе 7500 для ПЦР реального времени (Applied Biosystems), используя соответствующие праймеры/пробы для гена GAPDH человека (ABI Hs99999905_ml) и гена TNFα человека (ABI Hs00174128_ml), и главную смесь АВ gene Absolute QPCR ROX 2X master mix(AB-1139/B).
Экспрессию гена TNFα нормализовали по экспрессии гена β-актина. Уровень экспрессии генов анализировали с помощью ПЦР машины. Степень ингибирования (%)=(Уровень экспрессии гена TNFα в группе «Модель» - Уровень экспрессии гена TNFα в группе «Терапия») / (Уровень экспрессии гена TNFα в группе «Модель» - Уровень экспрессии гена TNFα в группе «Контроль»)×100%. Результаты для Примера 1 подробно изложены в Таблице 2. Пример 1 ингибирует TNFα индуцированную экспрессию гена TNFα в U87MG ксенотрансплантате дозозависимым образом.
| Таблица 2. | |
| Влияние Примера 1 на TNFα-индуцированную экспрессию гена TNFα в модели U87MG ксенотрансплантата | |
| Группы | Степень ингибирования (%) |
| Контроль (без TNFα) | - |
| Модель (в присутствии TNFα) | - |
| Пример 1-10 мг/кг - 2 ч | 49.1 |
| Пример 1-30 мг/кг - 2 ч | 68.5 |
| Пример 1-60 мг/кг - 2 ч | 86.2 |
| Пример 1-100 мг/кг - 2 ч | 94.9 |
Результаты для Примера 2 подробно изложены в Таблице 3. Пример 2 ингибирует 5 TNFα-индуцированную экспрессию гена TNFα в U87MG ксенотрансплантате дозозависимым способом.
| Таблица 3. | |
| Влияние Примера 2 на TNFα-индуцированную экспрессию гена TNFα в модели U87MG ксенотрансплантата | |
| Группы | Степень ингибирования (%) |
| Контроль | - |
| Модель | - |
| Пример 2-3 мг/кг | 10.7 |
| Пример 2-10 мг/кг | 25.3 |
| Пример 2-30 мг/кг | 69.7 |
| Пример 2-60 mg/kg | 87.8 |
Результаты показали, что Примеры 1 и 2 ингибируют TNFα-индуцированную экспрессию гена TNFα в U87MG ксенотрансплантате дозозависимым образом.
Противоопухолевое действие на ксенотрансплантат рака яичников человека SKOV-3x-FF-Luci
SKOV-3x-FF-Luci клеточную линию рака яичников человека (АТСС) культивировали в среде 5 а Маккоя, содержащей 10% эмбриональной телячьей сыворотки (FCS). Самкам nu/nu мышей BALB/C (6-8 недель) вводили перитонеально по 0,2 мл клеточной суспензии, содержащей 2×106 клеток. Мышей разделили на пять групп через шесть дней после имплантации клеток. Тестируемое соединение в количестве 60, 90 и 150 мг/кг перорально вводили животным последовательно в течение 21 дня, используя режимы - дважды в день (bid) или трижды в день (tid). Мышам в контрольной группе вводили среду-носитель (10% Acacia при pH 2.1, дважды в день). В конце лечения, всех мышей усыпляли с помощью CO2, а опухоли в брюшной полости, диафрагмальной мышце, брыжейке, печени, селезенке, яичниках извлекали, собирали и объединяли вместе для измерения их общего веса. Оценивали вес опухоли и степень ингибирования (IR). Степень ингибирования рассчитывали по формуле: IR=% (вес опухоли в контроле - вес опухоли после лечения) / вес опухоли в контроле ×100%. Результаты применения примера 1 подробно изложены в таблице 4. Пример 1 значительно подавляет рост опухоли яичников человека с IR=76,31% в дозах 60 мг/кг (трижды в день) у голых мышей (P<0.01, Т-критерий Стьюдента). Эти данные свидетельствуют о терапевтической пользе Примера 1 для лечения рака яичников.
| Таблица 4. | ||||
| Влияние Примера 1 на рост опухоли SKOV-3x-FF-luci у голых мышей | ||||
| Группа | Животное (начало/конец) | Tumor Weight (g) (Mean±S.D.) | IR | P Valueνs Контроль |
| Контроль (10% Acacia pH 2.1, bid, q8h) | 8/8 | 2.148±0.530 | - | - |
| Пример 1 (60 мг/кг, tid, q6h) | 8/8 | 0.509±0.193 | 76.31% | 0.0001 |
Кроме того, оценивали противоопухолевый эффект тестируемого соединения на рост опухоли рака яичников человека SKOV-3x-FF-Luci у голых мышей. SKOV-3x-FF-Luci клеточную линию (АТСС) культивировали в среде 5а Маккоя, содержащей 10% эмбриональной телячьей сыворотки. Самкам мышей nu/nu BALB/C (6-7 недель) перитонеально вводили по 0,2 мл клеточной суспензии, содержащей 2×106 клеток. Мышей случайным образом разделили на четыре группы через шесть дней после имплантации клеток. Тестируемое соединение в дозах 30 и 100 мг/кг перорально вводили животным два раза в день последовательно в течение 23 дней. Мышам из контрольной группы вводили среду-носитель (10% Acacia) два раза в день. Мышам из положительной контрольной группы вводили Цисплатин (4 мг/кг) через хвостовую вену один раз в неделю. В конце терапии всех мышей усыпляли с помощью CO2, а опухолевые узелки в брюшной полости, диафрагмальной мышце, брыжейке, печени, селезенке, яичниках извлекали, собирали и объединяли для измерения общего веса. Степень ингибирования: IR%=(вес опухоли в контроле - вес опухоли после терапии лекарством) / вес опухоли в контроле×100%. Пример 2 имеет степень ингибирования опухоли (IR) 59,3% и 93,9% в количестве 30 и 100 мг/кг соответственно. При проведении монотерапии Пример 2 также ингибирует рост опухоли SKOV-3x-FF-Luci. Эти данные свидетельствуют о терапевтической пользе Примера 2 для лечения рака яичников.
Противоопухолевое действие на ксенотрансплантат рака толстой кишки человека НТ-29 Показано, что ингибитор IKKβ в комбинации с СРТ-11 подавляет рост опухоли НТ-29 (Lagadec Р, E Griessinger, Nawrot MP et al. Br J. Cancer (2008) 98, 335-344). Противоопухолевый эффект соединения в комбинации с СРТ-11 исследовали в отношении ксенотрансплантата рака толстой кишки человека НТ-29. Противоопухолевые эффекты соединения изучали в отношении ксенотрансплантата рака толстой кишки человека НТ-29 при одновременном введении СРТ-11, так и без него, согласно методу, описанному в литературе (Lagadec Р, Griessinger Е, Nawrot MP, et al. Br J. Cancer (2008) 98, 335-344).
Клеточную линию аденокарциномы толстой кишки человека НТ-29 получали из АТСС и культивировали в среде 5а Маккоя, содержащей 10% эмбриональной телячьей сыворотки. Самцам мышей nu/nu BALB/C (6-7 недель) вводили подкожно в правый бок 0,1 мл клеточной суспензии, содержащей 3.0×106 клеток. Мышей разделили на шесть групп через семь дней после клеточной имплантации. Тестируемое соединение вводили перорально два раза в день в количестве 60 и 20 мг/кг, а СРТ-11 в дозе 20 мг/кг вводили перитонеально два раза в неделю. В комбинированной терапии СРТ-11 давали через 1 час после введения тестируемого соединения. Мышам из контрольной группы перорально вводили среду-носитель (10% Acacia, pH 2.1) два раза в день, и перитонеально вводили физиологический раствор два раза в неделю. Два ортогональных диаметра опухоли измеряли с помощью цифрового штангенциркуля с верньером три раза в неделю. Объем опухоли (TV) измеряли и записывали в течение периода лечения по формуле: TV=длина×ширина2/2. Ингибирование роста опухоли (TGI), исходя из абсолютного значения объема опухоли, рассчитывали по следующей формуле, где V0 - объем опухоли в день 0 (день распределения на группы), a Vt - объем опухоли в день измерения t: TGI=[1-(V-VO) группа, получавшая лекарство/(V-V0) группа, получавшая среду-носитель]×100%. Мышей усыпляли при наличии следующих условий: 1) Конец исследования (День 66); 2) Индивидуальные TV>4000 мм3, 3) изъязвление индивидуальной опухоли. Пример 1 при проведении монотерапии не препятствовал росту опухоли НТ-29 при пероральном введении в количестве 60 или 20 мг/кг, но в сочетании с СРТ-11 (20 мг/кг, внутрибрюшинно) он усиливал противоопухолевый эффект СРТ-11 в этих дозах (P<0,05, T-критерий Стьюдента).
В сочетании с СРТ-11 Пример 1 проявляет противоопухолевые эффекты в отношении модели ксенотрансплантата рака толстой кишки человека НТ-29, что указывает на участие Примера 1 в подавлении опухолевого роста. Эти данные свидетельствуют о терапевтической пользе Примера 1 в сочетании с СРТ-11 для лечения рака толстой кишки.
Противоопухолевое действие Винкристина на ксенотрансплантат SKOV-3x-FF-Luci (VCR)
В целях расширения спектра