Внеклеточная гиалуронидаза из streptomyces koganeiensis
Иллюстрации
Показать всеИзобретение относится к области биохимии и биотехнологии. Представлена гиалуронидаза из Streptomyces koganeiensis АТСС 31394, включающая N-концевую аминокислотную последовательность AGENGATTTFDGPVA и имеющая молекулярную массу 21,6 кДа, изоэлектрическую точку (pI) в диапазоне от 4,4 до 4,8 и ферментативную активность свыше 40000 МЕ/мг и менее 50000 МЕ/мг. Описана фармацевтическая или ветеринарная композиция, содержащая указанную гиалуронидазу в смеси с по меньшей мере одним подходящим вспомогательным веществом и/или носителем для лечения заболеваний или состояний, для которых требуется или полезно разложение гиалуроновой кислоты в тканях или органах. Предложено применение указанной гиалуронидазы в качестве реагента для количественного/качественного определения гиалуроновой кислоты. Способ получения гиалуронидазы по настоящему изобретению, включающий следующие стадии: a) концентрация ультрафильтрацией через фильтр с отсечением 10 кДА, диализ супернатанта, полученного после ферментации Streptomyces koganeiensis АТСС 31394, хроматография на слабом катионообменнике элюированием колонки натрий-ацетатным буфером при рН 4,5 и выделение белковой фракции с гиалуронидазной активностью; b) диафильтрация и хроматография на сильном анионообменнике белковой фракции с гиалуронидазной активностью со стадии a), выделение белковой фракции с гиалуронидазной активностью элюированием колонки буфером TRIS-HC1 и NaCl при рН 8 и выделение белковой фракции с гиалуронидазной активностью; c) хроматография на сильном катионообменнике элюированием колонки буфером фосфата натрия при рН 4,8 белковой фракции с гиалуронидазной активностью со стадии b) и выделение белковой фракции с гиалуронидазной активностью; d) хроматография на сильном анионообменнике белковой фракции с гиалуронидазной активностью со стадии c) после доведения рН до значения 5 и элюирование колонки буфером ацетата натрия, затем понижение рН до 4 и элюирование колонки буферным раствором ацетата натрия, таким образом получая две различные белковые фракции с различной гиалуронидазной активностью, и выбор одной, проявляющей более высокую гиалуронидазную активность. Изобретение позволяет получить выделенный белок гиалуронидазы, проявляющей более высокую гиалуронидазную активность. 4 н. и 7 з. п. ф-лы, 9 ил., 5 табл., 3 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
Гиалуронидаза является гидролитическим ферментом, который расщепляет гиалуроновую кислоту до D-глюкуроновой кислоты и N-ацетилглюкозамина; так или иначе она также способна разлагать другие кислотные мукополисахариды соединительной ткани. Например, высокие концентрации гиалуронидазы обнаружены в щечном аппарате пиявок, в ядах змей, пчел, скорпионов и в супернатантах культур патогенных бактерий, таких как пневмококки, β-гемолитические стрептококки и Staphylococcus aureus. Гиалуронидаза в теле человека обнаружена в роговице, цилиарном теле, селезенке, коже и семенниках. Высокое количество гиалуронидазы также обнаружено в сперматозоидах, что обеспечивает возможность преодолеть барьер гиалуроновой кислоты, который защищает яйцеклетки.
Гиалуронидаза используется в лекарственных средствах для лечения отека, местных воспалительных состояний, геморроя и озноба и облегчает подкожное введение некоторых активных компонентов. Сообщалось, что некоторые гиалуронидазы способны определить значительное сокращение размера инфаркта миокарда [1]. В ветеринарии она используется в растворах антибиотиков для лечения заболеваний животных, таких как коровий мастит. Кроме того, гиалуронидаза может быть использована в качестве аналитического реагента в ряде биологических исследований, например в качественном или количественном определении гиалуроновой кислоты.
Получение и очистка в промышленном масштабе бактериальной или животной гиалуронидазы являются трудными из-за нестабильности фермента в водном растворе и снижения активности после очистки.
В US 4258134 и соответствующем европейском патенте EP 0005751 [2] раскрывается гиалуронидаза, полученная диализом и ионообменной хроматографией на DEAE- и СМ-целлюлозе супернатанта культуры Streptomyces koganeiensis ATCC 31394.
Теперь было установлено, что такая белковая фракция, полученная после двух стадий хроматографии, действительно состоит из значительного числа белковых компонентов (приблизительно 68 на двумерном электрофорезе), но только один из них проявляет высокую гиалуронидазную активность и хорошую стабильность.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к гиалуронидазе из Streptomyces koganeiensis ATCC 31394, включающей N-концевую аминокислотную последовательность, показанную в SEQ ID No 1.
Фермент также характеризуется молекулярной массой, составляющей 21,6 кДа, изоэлектрической точкой (pI), составляющей между 4,4-4,8 и ферментативной активностью, равной или большей 40000 МЕ/мг.
Гиалуронидаза по изобретению может быть получена способом, включающим следующие стадии:
a) хроматография на слабом катионообменнике супернатанта, полученного после ферментации Streptomyces koganeiensis ATCC 31394, и выделения белковой фракции, проявляющей гиалуронидазную активность;
b) диафильтрация и хроматография на сильном анионообменнике белковой фракции, проявляющей гиалуронидазную активность, полученную на стадии a), и выделение белковой фракции, проявляющей гиалуронидазную активность;
c) хроматография на сильном катионообменнике белковой фракции с активностью гиалуронидазы, полученной на стадии b), и выделение белковой фракции с активностью гиалуронидазы;
d) хроматография на сильном анионообменнике белковой фракции, проявляющей гиалуронидазную активность, полученной на стадии c), и выделение белковой фракции, проявляющей гиалуронидазную активность.
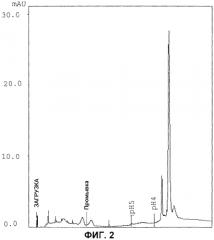
Ферментация микроорганизма может быть выполнена известными методами, в частности методом, раскрытым в US 4258134. Супернатант, полученный после ферментации, собирают, центрифугируют и фильтруют. Кроме того, до начала стадий хроматографии в соответствии с изобретением может быть выполнена дополнительная обработка супернатанта для удаления остаточных частиц из культуры, используя способы и методики, известные специалисту в данной области. Обычно выполняют концентрирование и диализ центрифугированного и отфильтрованного супернатанта. Как правило, концентрирование выполняют ультрафильтрацией на соответствующих полиэфирсульфоновых фильтрах с отсечением в диапазоне от 5 до 15 кДа, предпочтительно 10 кДа; обычно супернатант концентрируют в 8-12 раз, предпочтительно в 10 раз. Как только гиалуронидазную активность устанавливают соответствующим анализом, например модифицированным анализом Дорфмана [3], то концентрированный супернатант диализируют буферным раствором, который выбирают в зависимости от слабой катионообменной смолы, используемой на стадии a), так, чтобы гиалуронидаза находилась при таких значениях pH, при которых возможно связывание со смолой; такая смола включает карбоксиалкильные обменные группы, предпочтительно карбоксиметильные группы, такие как смола "CM-Sepharose® Fast Flow". После соответствующего уравновешивания смолы тем же буферным раствором, которым проводили диализ, образец загружали и проводили элюирование тем же раствором для удаления несвязанных белков, после чего увеличивали pH элюирования связанных белков. Если используют смолу «CM-Sepharose® Fast Flow», то диализ, уравновешивание смолы и элюирование несвязанных белков выполняют 50 мМ раствором натрия ацетата, pH 4,0, а элюирование связанных белков проводят 50 мМ раствором ацетата натрия, pH 4,5. Связанные белки, которые показывают высокую гиалуронидазную активность, объединяют в одну фракцию и хроматографируют на сильном анионообменнике [стадия b)]. Перед обработкой объединенные фракции очищают диафильтрацией, которую выполняют средствами и методами, известными специалисту в данной области, используя такой буферный раствор, при котором гиалуронидаза прочно связывается анионообменной смолой, использованной на стадии b). Такая смола включает триалкиламмониевые группы, как правило, триметиламмониевые группы, такие как смола HiTrap® Q XL (колонка на 5 мл). После уравновешивания смолы тем же раствором, что использовали для диафильтрации, загружали фракцию, полученную на стадии a), и затем выполняли элюирование тем же раствором для удаления несвязанных белков; затем постепенно увеличивали ионную силу элюента для элюирования связанных белков. В соответствии с предпочтительным вариантом осуществления использовали смолу HiTrap® Q XL и диафильтрацию, выравнивание колонки и элюирование несвязанных белков выполняли 50 мМ буферным раствором Tris-HCl, pH 8, тогда как элюирование связанных белков выполняли добавлением к растворителю в повышенной концентрации NaCl. После первого элюирования 50 мМ Tris-HCl, 35 мМ раствора NaCl, pH 8 и затем 50 мМ Tris-HCl, 200 мМ раствора NaCl, pH 8 были получены две фракции, и только вторая из них, элюированная раствором, содержащим 200 мМ NaCl, показала гиалуронидазную активность. Эту фракцию разбавляли в 8-12 раз, предпочтительно в 10 раз, буферным раствором, чтобы обеспечить прочное связывание гиалуронидазы с катионообменной смолой, используемой на стадии c). Смола содержит сульфоновые группы, предпочтительно сульфонилалкильные группы, более предпочтительно сульфонилпропильные группы; в соответствии с особенно предпочтительным вариантом осуществления изобретения используют смолу "HiTrap® SP FF". В частности, после уравновешивания смолы тем же буферным раствором, которым разбавляли фракцию гиалуронидазы, полученную на стадии b), и загружали образец, выполняли промывку тем же буферным раствором (приблизительно 20 объемов слоя), после чего элиюировали связанные белки, постепенно увеличивая pH растворителя. Как правило, если используют смолу HiTrap® SP FF, то разбавление, выравнивание колонки и промывку выполняют 20 мМ буферным раствором фосфата натрия, pH 4, а элюирование выполняют 50 мМ буфером фосфата натрия, pH 4,8; фракции с высокой гиалуронидазной активностью объединяют в одной фракции, которую хроматографии на сильном анионообменнике [стадия d)]. Обычно, перед хроматографией, такую фракцию разбавляли в 8-12 раз, предпочтительно в 10 раз, подходящим выравнивающим буфером, который обеспечивает возможность связывания гиалуронидазы с выбранной смолой. Смола для стадии d) представляет собой сильную анионообменную смолу, включающую четверичные аммониевые группы; предпочтительно, используется колонка ResourceQ®. После загрузки образца выполняют промывку с тем же выравнивающим буфером, и затем проводят элюирование связанных белков, постепенно снижая pH на 0,5 единиц до pH 4. Если используют колонку ResourceQ®, то разбавление гиалуронидазной фракции, выравнивание колонки и промывку после загрузки образца выполняют 20 мМ ацетатом натрия, pH 5,5; постепенно понижая pH, как указано выше, получали первую фракцию белков при pH 5 и две фракции белков при pH 4; вторая фракция, элюированная при pH 4, показала поглощение при 280 нм и ферментативную активность большую, чем у других двух фракций, как показано на фиг.2. После 12%-SDS-PAGE хроматографирования этой фракции и окраски серебром (фиг.6) наблюдали одну полосу белка с кажущейся молекулярной массой, составляющей приблизительно 25 кДа. В частности кажущаяся молекулярная масса 99% гиалуронидазы, очищенной вышеупомянутым описанным способом, составляет приблизительно 25 кДа. Такой белок включает только приблизительно 5% гиалуронидазы в супернатанте, полученном после ферментации; следовательно, способ позволяет получить приблизительно 20-кратное увеличение концентрации с приблизительно 30% выходом.
По сравнению с другими известными гиалуронидазами, гиалуронидаза по изобретению весьма устойчива в водном растворе, не чувствительна к действию протеолитических ферментов и имеет чистоту ВЭЖХ более 98% (фиг.5a-5h), которая требуется в случае терапевтического применения; следовательно, она может быть использована как отдельно, так и в комбинации с другими активными компонентами, для получения фармацевтических или ветеринарных композиций для лечения заболеваний, для которых требуется или полезно разложение гиалуроновой кислоты, присутствующей в органе или ткани, которая воздействует на заболевание.
Благодаря высокой стабильности в водном растворе гиалуронидазы по изобретению могут также быть приготовлены в форме водных композиций, таких как растворы, гидрофильные кремы, гидрогели, а также в форме липофильных продуктов, таких как мази или масляные кремы.
Что касается применения у человека, то гиалуронидаза по изобретению может быть использована для получения фармацевтических композиций для лечения отека, в частности травматического отека, или воспалительных состояний, таких как геморроидальный синдром; кроме того, она может быть использована для получения композиций для лечения ознобов. Гиалуронидаза по изобретению также может быть использована в комбинации с другими лекарственными средствами, для которых требуется или полезно увеличение биодоступности.
Например, для лечения травматического отека особенно полезно применение комбинации гиалуронидазы по изобретению с антикоагулянтом и/или фибринолитическим средством. Такие комбинации также могут необязательно содержать одно или более стероидных или нестероидных противовоспалительных средств. Кроме того, сульфатированная гиалуроновая кислота, которая, как известно, проявляет, помимо противовоспалительных свойств, также антитромбические свойства и свойства антикоагулянта, может также быть добавлена в такие композиции с проявлением полезных эффектов. Пример сульфатированной гиалуроновой кислоты, которая может быть использована, раскрывается, например, в EP 0702699.
Комбинации гиалуронидазы по изобретению с другими активными компонентами также приводят к дополнительным положительным эффектам в случае инъекционных форм, содержащих активные компоненты с относительно высокими молекулярными массами, например, моноклональные антитела, цитокины или ферменты, которые обычно вводятся внутривенно; гиалуронидаза обеспечивает возможность их подкожного введения по так называемой методике EASI (Подкожная инфузия с увеличением содержания ферментов), которая в основном используется для замещения жидкостей у неизлечимых пациентов, для снижения или отмены ухода за больным. Гиалуронидаза по изобретению может также использоваться для получения фармацевтических композиций для лечения резистентных солидных опухолей; фактически, при расщеплении гиалуроновой кислоты она снижает давление интерстициальной жидкости в опухоли, замедляя или ингибируя ее рост. По этой же причине она также усиливает эффективность противоопухолевых активных компонентов, которые необязательно содержатся в комбинации. Следовательно, дополнительный аспект изобретения относится к фармацевтическим композициям, содержащим гиалуронидазу в комбинации с одним или более противоопухолевыми активными компонентами, такими как алкалоиды барвинка (винбластин, винкристин, винорелбин) и таксаны (паклитаксел).
Дополнительное терапевтическое применение гиалуронидазы в соответствии с изобретением относится к лечению IgE-опосредованных аллергических форм посредством усиленной ферментной гипосенсибилизации (EPD = Усиленная ферментная гипосенсибилизация), которая представляет собой введение крайне низких доз аллергенов для десенсибилизации чувствительных субъектов. При связывании гиалуронидазы с аллергеном становится возможным повысить эффективность лечения, поскольку аллерген быстрее достигает места действия. Следовательно, дополнительный объект изобретения представляет собой фармацевтические композиции, содержащие гиалуронидазу в комбинации с одним или более аллергенами, которые вызывают IgE-опосредованные аллергические реакции. Гиалуронидаза также может применяться в качестве диффундирующего фактора для лекарственных средств для одонтологического применения для лечения заболеваний полости рта, например, местных анестетиков и антибиотиков; следовательно, в соответствии с дополнительным аспектом, изобретение относится к фармацевтическим композициям, содержащим гиалуронидазу по изобретению в комбинации с одним или более местных анестетиков или антибиотиков.
В офтальмологии гиалуронидаза позволяет заметно ускорять лечение спонтанных кровотечений стекловидного тела и может быть использована как отдельно, так и в комбинации с другими активными компонентами, для получения фармацевтических форм для офтальмологического применения, таких как растворы, суспензии, гели, кремы и мази, для лечения указанных кровотечений.
Что касается возможности ветеринарного применения, то гиалуронидаза по изобретению может эффективно применяться для лечения заболеваний, таких как коровий мастит; в этом случае, гиалуронидаза может быть введена в комбинации с антибиотиками, такими как пенициллин G, цефалоспорины I-IV поколения и потенциированные аминопенициллины.
Фармацевтические композиции могут быть приготовлены способами и с использованием вспомогательных веществ, известных специалисту в данной области, например в соответствии с таковыми, раскрытыми в Remington, "The Science and the Practice of Pharmacy", 21st ed. (Lippincott, Williams & Wilkins); такие композиции включают, в частности, инъекционные препараты и препараты для местного применения для кожного, трансдермального и офтальмологического нанесения. В частности, препараты для местного применения для эпидермального нанесения могут быть выбраны из кремов, гелей, мазей и спреевых растворов, тогда как препараты для местного применения для офтальмологического нанесения могут быть выбраны из кремов, гелей, растворов для мазей и суспензий. Как отмечалось ранее, благодаря ее стабильности в водном растворе, гиалуронидаза по изобретению может быть использована для получения препаратов на водной основе; выбор между составами на водной и масляной основе может быть выполнен специалистом в данной области, на основе общих знаний в области фармацевтической технологии, в зависимости от другого компонента, присутствующего в композиции.
В заключение, гиалуронидаза по изобретению может быть использована в качестве реагента для биохимических анализов для качественного/количественного определения гиалуроновой кислоты.
ОПИСАНИЕ ФИГУР
Фиг.1: 2D электрофорез CM-целлюлозной фракции, позитивной по гиалуронидазной активности, из супернатанта культуры Streptomyces koganeiensis ATCC 31394.
Фиг.2: хроматограмма гиалуронидазы из Streptomyces koganeiensis, полученной на колонке для хроматографирования Resource Q® [стадия d].
Фиг.3: 12% SDS-PAGE изображение протеинов фракций, полученных в результате каждой стадии очистки по изобретению в сравнении с изображением белков супернатанта.
Фиг.4: ВЭЖХ анализ чистоты гиалуронидазы на колонке фильтрации в геле Bio-Sil Sec [стадия d)].
Фиг.5a-5h: SDS-PAGE анализ и спектры поглощения секвенированной с N-конца гиалуронидазы, полученной на стадии d).
Фиг.6: неденатурированный SDS-PAGE анализ для определения гиалуронидазной активности; сравнение гиалуронидазы, полученной на стадии d), и гиалуронидазы, полученной по US 4258134.
Фиг.7: масс-спектрометрическое определение молекулярной массы гиалуронидазы, полученной на стадии d).
Фиг.8: определение изоэлектрической точки гиалуронидазы, полученной на стадии d).
Фиг.9: сравнение ферментативных активностей небольших количеств коммерческих гиалуронидаз и гиалуронидазы по изобретению.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Далее изобретение будет более подробно раскрываться в экспериментальной части, которая показывает наилучший способ осуществления изобретения, который не должен рассматриваться как ограничение.
МАТЕРИАЛЫ И МЕТОДЫ
Культуры микроорганизмов
S. koganeiensis получали из Американской коллекции типовых культур (ATCC 31394) и культивировали, как описано в [2]. Если вкратце, то микроорганизмы выращивали в 1 литре питательной среды [(20 г/л дрожжевого экстракта (Organotechnie) и 5 г/л соевого пептона (Solabia), pH 6,9)] при 30°C, взбалтывая при 150 об/мин и в течение приблизительно 16 часов. Для роста, культуры использовали для инокуляции ферментер на 50 литров (Biostat U, B.BRAUN), содержащий 30 литров подходящей среды [(10 г/л дрожжевого экстракта (Organotechnie), 5 г/л соевого пептона (Solabia), 3 г/л солодового экстракта (Costantino), 3 г/л декстрина 1 типа (Sigma), 0,2 г/л пеногасителя (SIGMA)]. Перед инокуляцией pH доводили до 7,0 NaOH; во время ферментации pH проверяли, но не контролировали, и температуру поддерживали при 30°C во время ферментации, тогда как встряхивание сохраняли при 300 об/мин, с аэрированием 1,6 VVM (объем воздуха на объем питательной среды в минуту). Ферментацию выполняли в течение 48 часов, такого периода времени, которой соответствовал получению самой высокой ферментативной активности гиалуронидазы (1×105-1,3×105 МЕ/л) в супернатанте культуры.
В конце ферментации культуру центрифугировали при 5000 об/мин в течение 30 мин при 4°C (SORVALL Evolution RC) и фильтровали через 0,2 мкм полиэфирсульфоновые тангенциальные поточные фильтры, таким способом удаляли биомассу Streptomyces koganeiensis (представляющую собой округлые гифальные агрегаты 1-4 мм в диаметре) и получали очищенный супернатант, содержащий гиалуронидазу.
Определение активности гиалуронидазы
Активность гиалуронидазы измеряли по модифицированной методике Дорфмана [3]. Если кратко, то продукт, полученный после хроматографии на DEAE- и CM-целлюлозе, разбавляли 0,03 М фосфатным буфером, 0,82% NaCl, pH 6,3, и 1 мл полученного раствора смешивали с 1 мл субстратного буфера (0,03 М фосфатного буфера, 0,82% NaCl, pH 6,3), содержащего 0,5 мг гиалуроновой кислоты. Ферментацию проводили при 37°C в течение 30 минут, и в завершение инкубационного процесса создавали помутнение, добавляя 4 мл кислотно-основного раствора сыворотки лошади (SIGMA). Измеряли оптическую плотность при 640 нм через точно 30 мм после добавления кислотно-основного раствора сыворотки лошади. Стандарт гиалуронидазы из семенников млекопитающих (EDQM, Гиалуронидаза FIP, H1115000), содержащий 328 МЕ/мг, использовали для создания стандартной кривой, и, используя эту кривую, рассчитывали активность образцов (в единицах).
Хроматография
Смолы и колонки для хроматографии закупали у GE Helthcare Life Sciences и хранили в соответствии с технической документацией, представленной поставщиком. Стадии уравновешивания и элюирования выполняли на системе для жидкостной хроматографии быстрого разрешения (FPLC; AKTA explorer 100, GE Healthcare) при скорости потока 40-50 мл/мин для первой хроматографии и 5 мл/мин для последующих хроматографий. В конце каждой стадии хроматографии активность гиалуронидазы оценивали по модифицированной методике исследования по Дорфману, описанной на предыдущей стадии.
Для оценки чистоты при помощи гель-фильтрации использовали установку для ВЭЖХ LC-10AD (SHIMADZU) с колонкой Bio-Sil SEC (BIO-RAD), элюирование проводили 0,05 М NaH2PO4, 0,05 М Na2HPO4, 0,15 М NaCl, 6,6 pH, при 1 мл/мин. Длина волны поглощения составила 214 нм (SPD-10A, SHIMADZU). Чистоту белка определяли, используя программное обеспечение LC solution 1.21 SP1.
Электрофорез SDS-PAGE
Электрофорез на полиакриламидном геле проводили в присутствии додецил сульфата натрия (SDS-PAGE) по методу Леммли [4] на 12% полиакриламидном геле, используя Mini-protean 3 (BIO-RAD) в соответствии с инструкциями поставщика. Молекулярную массу очищенного белка оценивали по стандарту белка c низкой молекулярной массой (BIO-RAD).
Двумерный электрофорез и изоэлектрическое фокусирование
Анализируемую белковую фракцию смешивали в подходящем нагрузочном буфере и переносили на стрипы IPG pH 3-10 (ReadyStrips 7 cm, BIO-RAD); стрипы инкубировали при 25°C до адсорбции образцов и загружали в PROTEAN IEF Cell (BIO-RAD) для изоэлектрического фокусирования (IEF).
В конце цикла изоэлектрического фокусирования (первое измерение) стрипы уравновешивают в соответствующих нагрузочном и рабочем буферах, затем их загружают для второго измерения 12% SDS-PAGE, используя ячейки Mini-Protean 3 (BIO-RAD).
Денситометрические исследования
Полиакриламидные гели, соответствующим образом окрашенные Silver Stain Plus (BIO-RAD) или Кумасси (BIO-RAD), обрабатывали на лабораторном блоке получения изображений ImageQuant 300 TL (GE Healthcare), при этом исследование (количественное и качественное) выполняли, используя программное обеспечение для визуального анализа ImageQuant TL (GE Healthcare). Тогда как исследование изображений 2D SDS-PAGE проводили на программном обеспечении ImageMaster 2D Platinum 6.0 (GE Healthcare).
Масс-спектрометрия
Масс-спектрометрические исследования для определения молекулярной массы выполняли, используя масс-спектрометр Ultraflex III TOF/TOF (BRUKER) и маркеры Bruker Protein Mix 1, тогда как идентификацию белка выполняли, используя точные значения массы пептидов, определенные системой MALDI-MS Voyager DE-PRO (Applied Biosystems).
Секвенирование с N-конца
Терминальное секвенирование аминокислоты с N-конца выполняли по методике разложения по Эдману, используя импульсный жидкофазный автоматизированный белковый секвенатор (ABI-Perkm Elmer Mod. 477A). Использовали программное обеспечение BLAST [5] для поиска на гомологию видов Streptomyces в банке данных GenBank и в проекте геном, доступные через Интернет.
Сравнение ферментативной активности различных типов гиалуронидаз
Ферментативный потенциал гиалуронидазы по изобретению оценивали в сравнении с ферментативной активностью некоторых наиболее используемых коммерческих гиалуронидаз (стандарт гиалуронидазы FIP, бычья тестикулярная гиалуронидаза типа 1-S (SIGMA), бычья тестикулярная гиалуронидаза типа VI-S (SIGMA), овечья тестикулярная гиалуронидаза типа V (SIGMA), гиалуронидаза из Streptomyces hyalurolyticus (SIGMA)), используя методику ферментативного анализа, выбранного выше, и значения активности показаны на фиг.9 как МЕ/мг (концентрацию белка определяли с помощью набора реагентов для определения белка по BCA, PIERCE).
ПРИМЕР 1 (Справочный пример)
ПОЛУЧЕНИЕ, ОЧИСТКА И ИССЛЕДОВАНИЕ ГИАЛУРОНИДАЗЫ
ИЗ STREPTOMYCES KOGANEIENSIS ПО US 4258134
S. koganeiensis 31394 ATCC культивировали, как описано в «материалах и методах»; супернатант, полученный центрифугированием, должным образом отфильтрованный через фильтр с тангенциальным потоком, хроматографировали на слабом анионнообменнике на DEAE-целлюлозе. Вкратце, 1,2 кг DEAE-целлюлозы уравновешивали буфером 25 мМ фосфата натрия, pH 7,0 и упаковывали, затем супернатант, осветленный тем же буфером, загружали в колонку и элюировали буфером 25 мМ фосфата натрия, pH 7,0, содержащим 250 мМ NaCl; после хроматографии фракцию, обладающую активностью гиалуронидазы, собирали и концентрировали ультрафильтрацией, проводили диализ 10 объемами ацетатного буфера (pH 5,0) и проводили хроматографию на слабом катионообменнике на колонке из СМ-целлюлозы. Элюирование выполняли элюирующим ацетатным буфером с градиентом 0,005-0,1 М. Фракцию с положительной активностью гиалуронидазы собирали после хроматографии, концентрировали ультрафильтрацией и проводили диализ 10 объемами дистиллированной воды (MilliQ, Millipore). Таким образом, полученный продукт фильтровали через полиэфирсульфоновый фильтр на 0,2 мкм и проводили исследование для определения активности гиалуронидазы, SDS-PAGE, двумерный электрофорез и денситометрический анализ.
Что касается двумерного электрофореза, результаты которого показаны на фиг.1, 600 мкл аликвоты фракции с гиалуронидазной активностью, полученной после хроматографии, концентрировали до объема приблизительно 20 мкл (приблизительно 864 U гиалуронидазы), используя колонку 5 k BIOMAX (Millipore). Концентрированную аликвоту смешивали с 125 мкл нагрузочного буфера (8 М мочевина, 2% CHAPS, 50 мМ дитиотреитола (DTT), 0,2% (масс./об.) амфолита Bio-Lyte 2/10 и синего бромфенола) и переносили на стрипы IPG pH 3-10 (ReadyStrips 7 см, BIO-RAD), инкубировали образец на стрипе при 25°C в течение 11 часов. Через 11 часов после абсорбции образца стрип помещали в ячейку PROTEAN IEF (BIO-RAD) для изоэлектрического фокусирования (IEF).
В конце стадии изоэлектрического фокусирования (первое направление), стрипы уравновешивали сначала в течение 15 минут первым буфером [(6 М мочевины, 2%-SDS, 0,375 M Tris-HCl (pH 8,8), 20% глицерина и 2% (масс./об.) DTT], затем вторым буфером [6 М мочевины, 2% SDS, 0,375 M Tris-HCl (pH 8,8), 20% глицерина]. После уравновешивания стрипы нагружали по второму направлению на 12% SDS-PAGE, используя ячейки Mini-Protean 3 (BIO-RAD). После завершения электрофореза, гель окрашивали кумасси PhastGel Blue R и проанализировали, после сканирования, используя программное обеспечение, описанное в «Материалах и методах» (фиг.1).
ПРИМЕР 2
ПОЛУЧЕНИЕ, ОЧИСТКА И ИССЛЕДОВАНИЕ ГИАЛУРОНИДАЗЫ ИЗ STREPTOMYCES KOGANEIENSIS ПО ИЗОБРЕТЕНИЮ
2a) Получение и очистка
Подготовка образца
Очищенный супернатант (приблизительно 30 литров), полученный после ферментации Streptomyces koganeiensis ATCC 31394, как описано в Материалах и методах, концентрировали в 10 раз ультрафильтрацией через полиэфирсульфоновые фильтры с отсечением на 10 кДа и измеряли его гиалуронидазную активность. Концентрированный супернатант затем диализировали (10 объемов) 50 мМ раствором натрия ацетата при pH 4,0 и выполняли стадию a).
Стадия a) Хроматография на слабом катионообменнике
Концентрированный и диализированный супернатант загружали в 200 мл геля CM-Sepharose® Fast Flow (GE Healthcare), помещенного в колонку XK-50 (GE Healthcare) и уравновешивали 10 объемами слоя (объем слоя, BV) 50 мМ натрий-ацетатного буфера при pH 4,0.
После загрузки колонку промывали 3 BV того же буфера, затем связанные белки элюировали 3 BV 50 мМ буферного раствора ацетата натрия, pH 4,5. Элюированные белки собирали в одну фракцию, объемом приблизительно 200 мл, и исследовали на предмет наличия гиалуронидазной активности.
Стадия b) Диафильтрация и хроматография на сильном анионообменнике
Выполняли диафильтрацию фракции, проявляющей ферментную активность, полученную на стадии a), 10 раз 50 мМ Tris-HCl, pH 8, уравновешивающим буфером, после чего загружали в колонку HiTrap® Q XL (5 мл), предварительно уравновешенную 20 BV такого же буфера. После загрузки образца, выполняли промывку 20 BV буфера, затем связанные белки сначала элюировали 12 BV 50 мМ буфера Tris-HCl, 35 мМ NaCl, pH 8 для удаления примесей, включающих неактивные белки, после чего фракцию с ферментной активностью элюировали 14 BV 50 мМ буфера Tris-HCl, 200 мМ NaCl, pH 8, и собирали до конечного объема приблизительно 50 мл. Выравнивание, промывку и элюирование выполняли при скорости потока 5 мл/мин.
Стадия c) Хроматография на сильном катионообменнике
Фракцию, полученную на стадии b), разбавляли в 10 раз 20 мМ буфером ацетата натрия, pH 4, и загружали в колонку HiTrap® SP FF, предварительно уравновешенную 20 BV такого же раствора. После первой промывки 20 BV того же раствора, связанные белки элюировали 10 BV 50 мМ буфера фосфата натрия, pH 4,8. Элюированные белки собирали во фракцию, объемом приблизительно 45 мл, и исследовали на предмет наличия ферментативной активности гиалуронидазы. Выравнивание, промывку и элюирование выполняли при скорости потока 5 мл/мин.
Стадия d) Хроматография на сильном анионообменнике
Фракцию с ферментативной активностью, полученную на стадии c), разбавляли в 10 раз 20 мМ буфером ацетата натрия, pH 5,5 и загружали в колонку Resource Q®, предварительно уравновешенную 20 BV того же буфера. После загрузки образца, выполняли промывку 20 BV того же буфера, затем понижали pH до 5 и проводили элюирование 10 BV раствора для удаления примесей, включающих неактивные белки. Затем pH дополнительно снижали до 4 и выполняли элюирование 15 BV буфера. Второй пик, элюированный при этом значении pH, с более высоким поглощением, собирали до конечного объема приблизительно 10-15 мл, и ультрафильтровали и диализировали 10 объемами воды MilliQ (Millipore). Выравнивание, промывку и элюирование выполняли при скорости потока 5 мл/мин.
Затем все элюированные белковые фракции, проявляющие или непроявляющие, а также проявляющие незначительную ферментативную активность, исследовали 12% SDS-PAGE, как описано в Материалах и Методах, а затем окрашивали серебряным красителем в соответствии с инструкциями от производителя; во всех фракциях, проявляющих наибольшую гиалуронидазную активность, отмечали наличие белкового связывания при приблизительно 25 кДа (фиг.3).
2b) Анализ и исследование
ВЭЖХ анализ гель-фильтрации
Проводили фильтрацию в геле на колонке ВЭЖХ фракции, полученную на стадии d), как описано в Материалах и Методах. Результаты анализа показаны на фиг.4.
Масс-спектрометрия
Проводили 12% SDS-PAGE электрофорез фракции, полученной на стадии d). В конце анализа гель окрашивали Кумасси Brilliant Blue G-250 (BIO-RAD), и белок, вырезанный из геля, расщепляли трипсином (BIO-RAD). Диаграмму масс пептидов получали на системе MALDI-MS Voyager DE-PRO (Applied Biosystems). Полученные массы пептидов использовали для поиска по банкам данных для идентификации белков.
Секвенирование с N-конца
Проводили SDS-PAGE электрофорез на 12% геле фракции, полученную на стадии d), затем выполняли блоттинг на мембране из дифторполивинилидена (BIO-RAD) и окрашивали по инструкции производителя. Полосу нарезали скальпелем для получения наименее возможного размера (3 мм × 10 мм) и загружали в реакционную камеру секвенатора.
Определение активности гиалуронидазы без денатурации SDS-PAGE
Белковые образцы белка, исследуемые на предмет наличия ферментативной активности гиалуронидазы [гиалуронидаза и несвязанные белки, полученные на стадии d), и гиалуронидаза, полученная по US 4258134 хроматографией], разделяли в двух повторах на нативном 8% полиакриламидном геле, пропитанном 0,17 мг/мл гиалуроновой кислотой. После завершения электрофореза, гель промывали три раза 0,1 М формиатом натрия, 0,5 М NaCl, pH 4,0 и инкубировали в течение ночи в таком же растворе при 37°C. Гель промывали три раза 3% уксусной кислотой и окрашивали в течение 2 часов при комнатной температуре в 0,5% (масс./об.) Alcian blue (SIGMA) и 3% растворе уксусной кислоты. Затем гель обесцвечивали 7% раствором ацетата натрия по меньшей мере в течение 1 часа.
Белки, которые проявляли гиалуронидазную активность, проявлялись как бледные полосы на синем фоне геля [6]. Нативный-PAGE, выполненный аналогично, но с окрашиванием Кумасси Brilliant Blue G-250 (BIO-RAD), использовали в качестве контроля (фиг.6).
Пассивное элюирование белка из нативного полиакриламидного геля
Полосу с белком, проявляющим активность гиалуронидазы, извлекали из нативного полиакриламидного геля, окрашенного кумасси Brilliant Blue G-250, и помещали в стерильную пробирку на 1,5 мл, добавляли 0,5 мл элюирующего буфера (50 мМ Tris-HCl, 150 мМ NaCl и 0,1 мМ EDTA; pH 7,5) к вырезанному кусочку геля так, чтобы он был полностью погружен. Кусочек геля гомогенизировали стерильным пестиком и инкубировали в орбитальном шейкере при 30°C в течение ночи. После инкубации гомогенизированный гель центрифугировали при 5000-10000 × g (центрифуга 5402, eppendorf) в течение 10 мин, очень тщательно отделяли супернатант и перемещали в новую пробирку на 1,5 мл. Концентрировали в 10 раз на колонке BIOMAX 5k (Millipore), супернатант проверяли на наличие элюированного белка SDS-PAGE, затем проводили исследование на гиалуронидазную активность и, в качестве подтверждения, выполняли N-концевое секвенирование (фиг.5).
Определение молекулярной массы белка масс-спектрометрией
1 мкл гиалуронидазы (приблизительно 0,5 мкг) смешивали с 1 мкл раствора, включающего 20 мкг/мл синаповой кислоты (SA) в 50% ацетонитриле с 0,1% трифторуксусной кислоты (ТФК). Полученную смесь перемещали на пластину MALDI и проводили исследование, как изложено в Материалах и Методах. Результаты анализа показаны на фиг.7.
Изоэлектрическое фокусирование
20 мкл аликвоты (20 мкг) гиалуронидазы, полученной на стадии d), смешивали с 125 мкл загрузочного буфера [8 М мочевины, 2% CHAPS, 50 мМ дитиотреитол (DTT), 0,2% (масс./об.) амфолита Bio-Lyte 2/10 и бромфеноловый синий], и помещали на стрипы IPG pH 3-10 (ReadyStips 7 см, BIO-RAD), инкубировали образец на стрипе при 25°C в течение 11 часов. Через 11 часов после адсобрции образцов, изоэлектрическое фокусирование (IEF) стрипов выполняли в PROTEAN IEF Cell (BIO-RAD). После завершения изоэлектрического фокусирования стрип сушили на фильтровальной бумаге (Whatman), увлажненной водой MilliQ, и окрашивали в течение 45 минут раствором для окрашивания геля IEF (BIO-RAD). Стрип обесцвечивали в течение 1 часа или дольше обесцвечивающим раствором (обесцвечивающий раствор, Кумасси R-250, BIO-RAD). Изоэлектрическую точку образца определяли по отношению к изоэлектрическим точкам референсных стандартов (Маркер IEF pH 3-10, SERVA). Результаты анализа показаны на фиг.8.
Сравнение ферментативной активности различных типов гиалуронидаз
Результаты этого исследования показывают, что гиалуронидаза по изобретению проявляет активность приблизительно в три раза большую, чем у наиболее активной из таковых, используемых для сравнения (фиг.9).
Секвенирование
Секвенированием с N-конца, которое выполняли, как описано в Материалах и Методах, установили следующую аминокислотную последовательность:
Ala-Gly-Glu-Asn-Gly-Ala-Thr-Thr-Thr-Phe-Asp-Gly-Pro-Val-Ala (SEQ ID No.1)
ПРИМЕР 3 - Фармацевтические препараты
| Препарат 1 - Гидрофильный гель | |
| Компоненты | Количество(МЕ или мг/л на г геля) |
| Гиалуронидаза | 150 МЕ |
| Карбомер 974Р | 15 мг |
| Глицерин | 100 мг |
| Пропиленгликоль | 66,75 мг |
| Триэтаноламин (TEA) | 13,25 мг |
| Полиэтиленгликоль 400 | 66,75 мг |
| Метил п-гидроксибензоат | 2 мг |
| Пропил п-гидроксибензоат | 0,2 мг |
| Очищенная вода | q.s. до 1 г |
Метил- и пропилпарабен растворяли в очищенной воде при 80°C. После охлаждения раствора до комнатной температуры добавляли гиалуронидазу, взбалтывая до тех пор, пока полностью не растворилась, после чего добавляли полиэтиленгликоль 400, продолжая взбалтывать до тех пор, пока не растворится. Добавляли к этому раствору Carbomer® 974P, продолжая взбалтывать до однородной дисперсии и полной гидратации, затем добавляли TEA для загущения водной фазы. В конце, при постоянном взбалтывании добавляли глицерин и пропиленгликоль.
| Препарат 2 - Гидрофильный крем (эмульсия типа масло-в-воде) | |
| Компоненты | Количество(МЕ или мг/л на г геля) |
| Гиалуронидаза | 150 МЕ |
| Tefose 1500 | 110 мг |
| Глицерин | 80 мг |
| Стеариновая кислота | 33 мг |
| Парафиновое масло | 40 мг |
| Метил п-гидроксибензоат | 1 мг |
| Очищенная вода | q.s. до 1 г |
Для получения масляной фазы вазелиновое масло, стеариновую кислоту и 1500 Tefose® расплавляли при встряхивании при 50°C. Отдельно готовили водную фазу из исходного раствора метилпарабена при 80°C с последующим охлаждением до комнатной температуры и добавляли глицерин и гиалуронидазу при встряхивании до полного растворения.
Водную фазу добавляли в масляную фазу для начала эмульгирован