Вакцины на основе свиного вируса torque teno и способы диагностики инфекций, вызванных этим вирусом
Иллюстрации
Показать всеИзобретения касаются инфекционной молекулы нуклеиновой кислоты, кодирующей инфекционный вирус Torque teNO свиней (PTTV), которая содержит по меньшей мере одну копию геномной последовательности, выбранной из группы, состоящей из последовательностей, соответствующих генотипам или подтипам PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA, а также биологически функциональной плазмиды или вирусного вектора, содержащего такую инфекционную нуклеотидную геномную последовательность, и клетки-хозяина, содержащей такую плазмиду или вектор. Кроме того, представленные изобретения предусматривают живые, аттенюированные, экспрессируемые при использовании вектора и очищенные рекомбинантные капсидные субъединичные или убитые вирусные вакцины для защиты против PTTV инфекции, а также способы иммунизации свиней против PTTV вирусной инфекции путем введения такой вакцины. Охарактеризованные изобретения могут быть использованы для предотвращения инфекции, вызываемой вирусом Torque teNO свиней. 11 н. и 12 з.п. ф-лы, 53 ил., 5 табл., 24 пр.
Реферат
Настоящая заявка претендует на преимущества предварительной заявки США на патент №61/235,833, поданной 21 августа 2009 г., и предварительной заявки США на патент №61/316,519, поданной 23 марта 2010 г., описания которых включены в данную заявку посредством отсылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ДАННОЕ ИЗОБРЕТЕНИЕ
Данная заявка относится к вакцинам для защиты от инфекции, вызванной свиным вирусом Torque TeNO (Торкве Тено) (TTV), и инфекций, вызванных инфекционными ДНК-клонами свиного TTV (PTTV), и к их применению. Данное изобретение относится также к диагностике инфекции, вызванной свиным вирусом Torque TeNO (PTTV), особенно инфекции, вызванной различными типами и типоспецифическими вирусами PTTV, и инфекции, вызванной многими штаммами различных генотипов.
УРОВЕНЬ ТЕХНИКИ
Вирус Torque TeNO (TTV) был впервые обнаружен в 1997 г в Японии у пациента с пост-трансфузионным гепатитом не-А и не-Е типа (Nishizawa, Т., Okamoto, H., Konishi, K., Yoshizawa, H., Miyakawa, Y., and Mayumi, M. (1997). A NOvel DNA virus (TTV) associated with elevated transaminase levels in posttransfusion hepatitis of unkNOwn etiology. Biochem Biophys Res Commun 241(1), 92-7).
С тех пор было идентифицировано большое число человеческих штаммов TTV и две группы TTV - родственных вирусов, обозначенных как вирус Torque teNO mini (TTMV) и вирус Torque teNO midi (TTMDV) с высокими показателями распространения в сыворотке и других тканях здоровых людей (HiNO, S., and Miyata, H. (2007). Torque teNO virus (TTV): current status. Rev. Med. Virol. 17(1), 45-57; Okamoto, H. (2009a). History of discoveries and pathogenicity of TT viruses. Curr. Top. Microbiol. ImmuNOl 331, 1-20). Человеческие TTV, TTMV и TTMDV представляют собой сферические вирусы без оболочки, содержащие геномы кольцевой однонитевой ДНК (онДНК) длиной 3,6-3,9, 2,8-2,9 и 3,2 т.н., соответственно, и теперь они классифицируются в новом семействе вирусов Anelloviridae в Intemationa Committee on TaxoNOmy of Viruses (ICTV; http://www.ictvonline.org/virusTaxoNOmy.asp?bhcp=1) (Biagini, P. (2009). Classification of TTV and related viruses (anelloviruses). Curr. Top.Microbiol. ImmuNOl. 331, 21-33). Эти три группы вирусов, относящихся к TTV, проявляют высокую степень гетерогенности, при этом каждая группа состоит из множества геногрупп и генотипов (Biagini, P., Gallian, Р., Cantaloube, J.F., Attoui, H., de Micco, P., and de Lamballerie, X. (2006). Distribution and genetic analysis of TTV and TTMV major phylogenetic groups in French blood doNOrs. J. Med. Virol. 78 (2), 298-304; Jelcic, I., Hotz-Wagenblatt, A., Hunziker, A., Zur Hausen, H., and de Villiers, E. M. (2004). Isolation of multiple TT virus geNOtypes from spleen biopsy tissue from a Hodgkin's disease patient: geNOme reorganization and diversity in the hypervariable region. J. Virol. 78(14),7498-507). Сообщалось о распространении множественных инфекций, вызванных TTV с различными генотипами, а также двойных или тройных инфекций, вызванных TTV, TTMV и TTMDV, у людей, и эти инфекции рассматриваются как обычные события у здоровых людей (Niel, С., Saback, F.L., and Lampe, E. (2000)). Ко-инфекция, вызванная многими штаммами TTV, относящимися к различным генотипам, распространена у здоровых взрослых людей в Бразилии (J. Clin. Microbiol. 38(5), 1926-30; NiNOmiya, M., Takahashi, M., HoshiNO, Y., Ichiyama, K., Simmonds, P., and Okamoto, H. (2009). Analysis of the entire geNOmes of torque teNO midi virus variants in chimpanzees: infrequent cross-species infection between humans and chimpanzees. J. Gen. Virol. 90 (Pt 2), 347-58; Okamoto, H. (2009a). History of discoveries and pathogenicity of TT viruses. Curr. Top.Microbiol. ImmuNOl.331, 1-20; Takayama, S., Miura, Т., Matsuo, S., Taki, M., and Sugii, S. (1999). Prevalence and persistence ofaNOvel DNA TT virus (TTV) infection in Japanese haemophiliacs. Br. J. Haematol. 104 (3), 626-9).
TTV вызывают инфекцию не только у людей, но также и у различных видов животных, включая нечеловеческих приматов, тупай, свиней, скот, кошек, собак и морских львов (Biagini, Р., Uch, R., Belhouchet, M., Attoui, H., Cantaloube, J. F., Brisbarre, N., and de Micco, P. (2007). Circular geNOmes related to anelloviruses identified in human and animal samples by using a combined rolling-circle amplification / sequence-independent single primer amplification approach. J. Gen. Virol. 88(Pt 10), 2696-701; Inami, Т., Obara, Т., Moriyama, M., Arakawa, Y., and Abe, K. (2000). Full-length nucleotide sequence of a simian TT virus isolate obtained from a chimpanzee: evidence for a new TT virus-like species. Virology 277(2), 330-5; Ng, Т. F., Suedmeyer, W. K., Wheeler, E., Gulland, F., and Breitbart, M. (2009). NOvel anellovirus discovered from a mortality event of captive California sea lions. J. Gen. Virol.90 (Pt 5), 1256-61; Okamoto, H. (2009b). TT viruses in animals. Curr. Top.Microbiol. ImmuNOl. 331, 35-52; Okamoto, H., Nishizawa, Т., Takahashi, M., Tawara, A., Peng, Y., Kishimoto, J., and Wang, Y. (2001). GeNOmic and evolutionary characterization of TT virus (TTV) in tupaias and comparison with species-specific TTV in humans and NOn-human primates. J Gen Virol. 82(Pt 9), 2041-50; Okamoto, H., Nishizawa, Т., Tawara, A., Peng, Y., Takahashi, M., Kishimoto, J., Tanaka, Т., Miyakawa, Y., and Mayumi, M. (2000a). Species-specific TT viruses in humans and NOnhuman primates and their phylogenetic relatedness. Virology 277(2), 368-78; Okamoto, H., Takahashi, M., Nishizawa, Т., Tawara, A., Fukai, K., Muramatsu, U., Naito, Y., and Yoshikawa, A. (2002). GeNOmic characterization of TT vimses (TTV) in pigs, cats and dogs and their relatedness with species-specific TTV in primates and tupaias. J, Gen. Virol. 83 (Pt 6), 1291-7). Кроме того, шимпанзе также инфицируются TTMV и TTMDV (NiNOmiya, M., Takahashi, M., HoshiNO, Y., Ichiyama, K., Simmonds, P., and Okamoto, H. (2009). Analysis of the entire geNOmes of torque teNO midi virus variants in chimpanzees: infrequent cross-species infection between humans and chimpanzees. J. Gen. Virol. 90(Pt 2), 347-58; Okamoto et al., 2000a, supra). Хотя размеры геномов идентифицированных штаммов TTV у животных, особенно TTV у животных, не являющихся приматами, сравнительно меньше, чем у штаммов TTV человека, они имеют одну и ту же структуру генома с минимум двумя частично перекрывающимися открытыми рамками считывания (ORF1 и ORF2), транслированными из отрицательной ДНК, а также с коротким отрезком нетранслированного участка (UTR) с высоким содержанием (около 90%) GC (гуанина и цитозина) (Okamoto, 2009b, supra). Аранжировка ORF TTV очень похожа на аранжировку вируса анемии цыплят (CAV), принадлежащего к роду Gyrovirus в семействе Circoviridae, но отличается от аранжировки свиных цирковирусов (PCV) типов 1 (PCV1) и 2 (PCV2), которые тоже классифицируются в том же самом семействе (Davidson, I., and Shulman, L. M. (2008). Unraveling the puzzle of human anello virus infections by comparison with avian infections with the chicken anemia virus. Virus Res. 137(1), 1-15; HiNO, S., and Prasetyo, A.A. (2009). Relationship of Torque teNO virus to chicken anemia virus. Curr. Top Microbiol. ImmuNOl.331, 117-30). Геномы PCV1 и PCV2 являются амбисмысловыми, причем ORF1 кодирована геномной нитью и ORF2 кодирована антигеномной нитью (HiNO and Miyata, 2007, supra). Недавно шаблон для транскрипции и транслированные продукты обоих генотипов 1 и 6 человеческого TTV были идентифицированы путем трансфекции соответствующих инфекционных ДНК - клонов TTV в культивируемые клетки (Mueller, В., Maerz, A., Doberstein, K., Finsterbusch, Т., and Mankertz, A. (2008). Gene expression of the human Torque TeNO Virus isolate P/1C1. Virology 381(1), 36-45; Qiu, J., Kakkola, L., Cheng, F., Ye, C., Soderlund-Venermo, M., Hedman, K., and Pintel, D. J. (2005)). (Mueller, В., Maerz, A., Doberstein, K., Finsterbusch, Т., and Mankertz, A. (2008). Gene expression of the human Torque TeNO Virus isolate P/1C1. Virology 381(1), 36-45; Qiu, J., Kakkola, L., Cheng, F., Ye, C., Soderlund-Venermo, M., Hedman, K., and Pintel, D.J. (2005). Человеческий цирковирус TTV генотипа 6 экспрессирует шесть белков после трансфекции клона с полной длиной (J. Virol. 79(10), 6505-10). Экспрессия по меньшей мере шести белков, обозначенных как ORF1, ORF2, ORF1/1, ORF2/2, ORF1/2 и ORF2/3, из трех или более спланированных мРНК была описана Kakkola, L., Hedman, K., Qiu, J., Pintel, D., and Soderlund-Venermo, M. (2009). Replication of and protein synthesis by TT viruses. Curr. Top Microbiol. ImmuNOl. 331, 53-64; Mueller et al., 2008, supra; Qiu et al., 2005, supra). Соответственно, является вероятным, что, когда станут доступными дополнительные данные, касающиеся животного TTV, предполагаемую структуру генома животного TTV можно будет модифицировать.
Хотя TTV был впервые идентифицирован у пациента с криптогенным гепатитом, последовавшие затем исследования не позволили получить доказательство значительной роли TTV в патогенезе гепатита или других болезней (HiNO and Miyata, 2007, supra; Maggi, F., and Bendinelli, M. (2009). ImmuNObiology of the Torque teNO viruses and other anelloviruses. Curr. Top Microbiol. Immunol. 331, 65-90; Okamoto, 2009a, supra)). Хотя считают, что человеческий TTV не связан непосредственно с болезнью, недавно было установлено, что свиной TTV (PTTV) частично способствует экспериментальной индукции свиного дерматита и синдрома нейропатии (PDNS), соединенных с возникновением репродуктивно/респираторного синдрома у свиней (PRRSV) (Krakowka, S., Hartunian, С., Hamberg, A., Shoup, D., Rings, M., Zhang, Y., Allan, G., and Ellis, J.A. (2008). Evaluation of induction of porcine dermatitis and nephropathy syndrome in gNOtobiotic pigs with negative results for porcine circovirus type 2. Am. J. Vet. Res. 69(12), 1615-22), а также с экспериментальной индукцией мультисистемного синдрома истощения после отъема поросят от свиноматки (PMWS), соединенного с инфекцией, вызванной PCV2 в модели гнобиотической свиньи (Ellis, J.A., Allan, G., and Krakowka, S. (2008). Effect of coinfection with geNOgroup 1 porcine torque teNO vims on porcine circovirus type 2-associated postweaning multisystemic wasting syndrome in gNOtobiotic pigs. Am. J. Vet. Res. 69(12), 1608-14). Эти данные позволили предположить, что свиной вирус TTV является патогенным для свиней. Однако необходимы более глубокие исследования с биологически чистой формой вируса PTTV для полной характеристики болезней и патологических изменений, связанных с инфекцией, вызванной PTTV.
По сравнению с человеческим TTV информация о геноме PTTV очень ограничена. В настоящее время описаны только одна геномная последовательность с полной длиной и две геномные последовательности с почти полной длиной для PTTV у свиней в Японии и в Бразилии, соответственно (Niel, С., Diniz-Mendes, L., and Devalle, S. (2005). Rolling-circle amplification of Torque teNO virus (TTV) complete geNOmes from human and swine sera and identification ofaNOvel swine TTV geNOgroup. J. Gen. Viro.l 86(Pt 5), 1343-7; Okamoto et al., 2002, supra.). Среди трех известных штаммов PTTV были сгруппированы вместе штаммы Sd - TTV31 и TTV - 1р в геногруппе 1 (PTTV1), в то время как TTV - 2р был единственным штаммом, классифицированным в геногруппе 2 (PTTV2) (Niel et al., 2005, supra). Однако классификация в геногруппах представляет собой расплывчатую концепцию в таксономии вирологии и необходима дальнейшая и более точная классификация PTTV, но она может быть сделана только тогда, когда станут доступными другие геномные последовательности с полной длиной новых штаммов PTTV, представляющих собой многие генотипы.
Ранее было показано, что инфекции, вызванные PTTV, широко распространены у свиней в шести странах, включая США, Канаду, Испанию, Китай, Корею и Таиланд (McKeown, N. Е., Fenaux, M., Halbur, P.G., and Meng, X.J. (2004). Molecular characterization of porcine TT virus, an orphan virus, in pigs from six different countries. Vet. Microbiol. 104 (1-2), 113-7).
Вопрос о том, играют ли TTV значительную роль в патогенезе различных заболеваний у свиней или нет, до сих пор остается спорным. На примере модели гнобиотической свиньи было показано, что сама по себе инфекция, вызванная PTTV1, не приводит к развитию каких - либо клинических болезней, но вызывает патологические изменения (Krakowka, S. and Ellis, J.A., 2008. Evaluation of the effects of porcine geNOgroup 1 torque teNO virus in gNOtobiotic swine. Am. J. Vet. Res. 69, 1623-9). У свиней, экспериментально зараженных и PTTV1, и вирусом репродуктивно - респираторного синдрома у свиней (PRRSV), развивались клинический свиной дерматит и синдром нефропатии (PDNS) (Krakowka, S., Hartunian, С., Hamberg, A., Shoup, D., Rings, M., Zhang, Y., Allan, G. and Ellis, J.A., 2008. Evaluation of induction of porcine dermatitis and nephropathy syndrome in gNOtobiotic pigs with negative results for porcine circovirus type 2. Am. J. Vet. Res. 69, 1615-22), в то время, как у свиней, зараженных как PTTV1, так и свиным цирковирусом типа 2 (PCV2), наблюдался хронический мультисистемный синдром истощения после отъема поросят от свиноматки (PMWS) (Ellis et al., 2008, supra). Хотя PCV2 рассматривается как агент, в основном вызывающий клинический PMWS или болезни, ассоциируемые с PCV (PCVAD), в Испании наблюдалось сильное распространение инфекции, вызванной PTTV2, у свиней, страдающих от PMWS с низким содержанием PCV2 или не содержащих PCV2, по сравнению со свиньями без PMWS (Kekarainen et al., 2006, supra). Все эти данные позволяют предположить, что свиные TTV могут служить как ко-факторы, участвующие в запуске и усилении развития болезней у свиней.
Свиной TTV был обнаружен в образцах свиной сыворотки, фекалий, слюны, спермы и тканей у инфицированных свиней, что показывает, что он передается различными путями, включая вертикальную и горизонтальную трансмиссию (Kekarainen et al., 2007, supra; Pozzuto, Т., Mueller, В., Meehan, В., Ringler, S.S., Mclntosh, K.A., Ellis, J.A., Mankertz, A. and Krakowka, S., 2009. In utero transmission of porcine torque teNO viruses. Vet. Microbiol. 137, 375-9; Sibila, M., Martinez-GuiNO, L., Huerta, E., Llorens, A., Mora, M., Grau-Roma, L., Kekarainen, T. and Segales, J., 2009. Swine torque teNO virus (TTV) infection and excretion dynamics in conventional pig farms. Vet. Microbiol. 139, 213-8). Однако в настоящее время обнаружение наличия инфекции, вызванной TTV, основано на применении обычного метода ПЦР. Таким образом, до сих пор не были разработаны ни метод серологического анализа, ни система вирусной культуры. В частности, методы "вложенной ПЦР" с амплификацией консервативных участков в UTR PTTV1 и PTTV2, соответственно, разработанные группой испанских исследователей, нашли широкое распространение (Kekarainen et al., 2006, supra). Так как показатель распространения вируса, по всей видимости, связан со степенью серьезности клинических болезней, как показывает PCVAD, вызванная PCV2 (Opriessnig, Т., Meng, X.J. and Halbur, P.G., 2007. Porcine circoviros type 2 associated disease: update on current termiNOlogy, clinical manifestations, pathogenesis, diagNOsis, and intervention strategies. J. Vet. Diagn. Invest. 19, 591-615), было бы важнее определить вирусную нагрузку свиного TTV методом количественной ПЦР в режиме реального времени, чем наличие ДНК в TTV методом обычной ПЦР. Кроме того, ПЦР в режиме реального времения является более надежным, быстрым и менее дорогим методом по сравнению с методом обычной ПЦР. Недавно были описаны два метода ПЦР в режиме реального времени, основанные на применении пробы TaqMan, для выявления и количественного определения двух видов свиного TTV (Brassard, J., Gagne, M.J., Houde, A., Poitras, E. and Ward, P., 2009. Development of a real-time TaqMan PCR assay for the detection of porcine and bovine Torque teNO virus. J. Appl. Microbiol. NOv 14, 2009, E pub. ahead of print; Gallei, A., Pesch, S., Esking, W.S., Keller, C. and Ohiinger, V.F., 2009. Porcine Torque teNO virus: Determination of viral geNOmic loads by geNOgroup-specific multiplex rt-PCR, detection of frequent multiple infections with geNOgroups 1 or 2, and establishment of viral full-length sequences. Vet. Microbiol. Dec 21, 2009, E pub. ahead of print). Основной недостаток методов, основанных на применении проб, заключается в том, что могут быть получены ложные отрицательные результаты, если пробу - связывающие последовательности содержат мутации (Anderson, T.P., WerNO, A.M., BeyNOn, K.A. and Murdoch, D.R., 2003. Failure to geNOtype herpes simplex virus by real-time PCR assay and melting curve analysis due to sequence variation within probe binding sites. J. din. Microbiol. 41,2135-7).
С учетом высокой степени гетерогенности среди последовательностей известных штаммов свиного TTV, ожидают вариации пробу - связывающих последовательностей в полевых штаммах PTTV. Метод ПЦР в режиме реального времени, основанная на применении красителя SYBR Green является альтернативным методом, позволяющим избежать возникновения этой проблемы несмотря на его довольно низкую специфичность и обеспечивающим универсальный путь обнаружения и количественного определения вариантов свиного TTV. Более того, анализ кривых плавления (МСА) после проведения ПЦР в режиме реального времени, основанной на применении красителя SYBR Green, обеспечивает специфичность реакции и позволяет осуществить мультиплексное обнаружение различных типов вируса (Ririe, K.M., Rasmussen, R.P. and Wittwer, C.T., 1997. Product differentiation by analysis of DNA melting curves during the polymerase chain reaction. Anal. Biochem. 245, 154-60). Методы ПЦР в режиме реального времени, основанные на применении красителя SYBR Green, были успешно применены в отношении различных человеческих и вирусов животных (Gibellini, D., Gardini, F., Vitone, F., Schiavone, P., Furlini, G. and Re, M.C., 2006. Simultaneous detection of HCV and HIV-1 by SYBR Green real time multiplex RT-PCR technique in plasma samples. Mol. Cell Probes 20, 223-9; Martinez, E., Riera, P., Sitja, M., Fang, Y., Oliveira, S. and Maldonado, J., 2008. Simultaneous detection and geNOtyping of porcine reproductive and respiratory syndrome virus (PRRSV) by real-time RT-PCR and amplicon melting curve analysis using SYBR Green. Res. Vet. Sci. 85, 184-93; Mouillesseaux, K.P., Klimpel, K.R. and Dhar, A.K., 2003. Improvement in the specificity and sensitivity of detection for the Taura syndrome virus and yellow head virus of penaeid shrimp by increasing the amplicon size in SYBR Green real-time RT - PCR. J. Virol. Methods 111, 121-7; Wilhelm, S., Zimmermann, P., Selbitz, H.J. and Truyen, U., 2006. Real-time PCR protocol for the detection of porcine parvovirus in field samples. J. Virol. Methods 134, 257-60)
В настоящее время о PTTV-специфическом гуморальном ответе известно мало. Так как методы с применением ПЦР не отражают развития инфекции, вызванной PTTV, у свиней, для оценки преобладания серотипа PTTV и характеристики роли PTTV в развитии болезней у свиней необходимо применять эффективный метод твердофазного иммуноферментного анализа(ELISA).
Таким образом, до сих пор нет субъединичной, инактивированной или живой вакцины от свиных TTV. Желательно и предпочтительно осуществить экспрессию рекомбинантных капсидных белков PTTV из различных генотипов с целью создания субъединичных вакцин и получить инфекционные молекулярные ДНК-клоны PTTV из разных генотипов для распространения биологически чистой формы PTTV в системе клеточной культуры, которая применяется для создания инактивированных или живых вакцин.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Данное изобретение предусматривает молекулу инфекционной нуклеиновой кислоты ("клон инфекционной ДНК") свиного вируса Torque teNO (PTTV), представляющую собой молекулу нуклеиновой кислоты, кодирующую инфекционный PTTV, которая содержит по меньшей мере одну копию геномной последовательности, имеющей степень гомологичности равную по меньшей мере 80% по отношению к геномной последовательности, выбранной из группы, состоящей из генотипов PTTV 1а-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA.
Согласно одному аспекту данного изобретения предусмотрены клоны инфекционной ДНК PTTV по п.1 формулы изобретения, характеризующиеся тем, что геномная последовательность выбрана из последовательностей, описываемых в SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11 и SEQ ID NO:12.
Настоящее изобретение предусматривает также биологически функциональную плазмиду или вирусный вектор, содержащие инфекционные геномы PTTV Данное изобретение предусматривает подходящую клетку - хозяина, трансфецированную плазмидой или вирусным вектором клона инфекционной ДНК.
Данное изобретение предусматривает инфекционный PTTV, продуцированный клетками, трансфецированными клонами инфекционной ДНК PTTV. Настоящее изобретение относится также к вирусной вакцине, содержащей нетоксичный физиологически приемлемый носитель и иммуногенное количество члена, выбранного из группы, состоящей из (а) молекулы нуклеиновой кислоты, содержащей по меньшей мере одну копию геномной последовательности, имеющей степень гомологичности равную по меньшей мере 80% по отношению к геномной последовательности, выбранной из группы, состоящей из генотипов PTTV Ia-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA или ее комплементарную нить, (б) биологически функциональной плазмиды или вирусного вектора, содержащих молекулу нуклеиновой кислоты, содержащую по меньшей мере одну копию геномной последовательности, имеющей степень гомологичности равную по меньшей мере 80% по отношению к геномной последовательности, выбранной из группы, состоящей из генотипов PTTV 1а-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA или ее комплементарную нить, и (в) авирулентного инфекционного непатогенного PTTV, который содержит по по меньшей мере одну копию геномной последовательности, имеющей степень гомологичности, равную по меньшей мере 80% по отношению к геномной последовательности, выбранной из группы, состоящей из генотипов PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA.
В соответствии с одним аспектом данного изобретения вакцина содержит живой вирус PTTV, полученный из клонов инфекционного PTTV. Согласно другому аспекту данного изобретения вакцина содержит инактивированный вирус PTTV, полученный из клонов инфекционного PTTV.
Данное изобретение предусматривает очищенные рекомбинантные белки, экспрессированные из генов капсида ORF1 генотипов PTTV или подтипов PTTV1a-VA, PTTV1b-VA и PTTV2c-VA в бактериальную систему для экспрессии и применение этих рекомбинантных капсидных белков в качестве субъединичной вакцины против инфекций, вызванных PTTV. Согласно одному из вариантов данного изобретения рекомбинантные капсидные белки, применяемые в составе субъединичных вакцин, экспрессированы в системе экспрессии бакуловирусов и в других векторных системах экспрессии.
Согласно еще одному аспекту данного изобретения вакцина дополнительно содержит адъювант.
Данное изобретение предусматривает также способ иммунизации свиньи против вирусной инфекции, вызванной PTTV, включающий введение свинье иммунологически эффективного количества вирусной вакцины.
Согласно еще одному аспекту данного изобретения указанный способ включает введение свинье рекомбинантного субъединичного капсидного белка, молекулы инфекционной нуклеиновой кислоты или живого вируса PTTV.
Согласно другому аспекту данного изобретения указанный способ включает парентеральное, интраназальное, интрадермальное или трансдермальное введение вакцины свинье.
Данное изобретение предусматривает также выделенный полинуклеотид, состоящий из нуклеотидной последовательности PTTV1a-VA, представленной в SEQ ID NO:9.
Данное изобретение предусматривает также выделенный полинуклеотид, состоящий из нуклеотидной последовательности PTTV1b-VA, представленной в SEQ ID NO:10.
Данное изобретение предусматривает также выделенный полинуклеотид, состоящий из нуклеотидной последовательности PTTV2b-VA, представленной в SEQ ID NO:11.
Данное изобретение предусматривает также выделенный полинуклеотид, состоящий из нуклеотидной последовательности PTTV2c-VA, представленной в SEQ ID NO:12.
Настоящее изобретение предусматривает также субъединичную вакцину, содержащую иммуногенный фрагмент полипептидной последовательности или полного белка, транслированный согласно полинуклеотидной последовательности, выбранной из группы, состоящей из of ORF1, ORF2, ORF1/1 и ORF2/2 генотипов PTTV или подтипов PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA, в частности ORF 1, кодирующей капсидный белок.
Согласно еще одному аспекту данного изобретения полинуклеотидная последовательность выбрана из группы, состоящей из ORF1 генотипов PTTV или подтипов PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA.
Согласно другому аспекту данного изобретения полинуклеотидная последовательность представляет собой ORF 1 генотипов PTTV1a.
Согласно еще одному аспекту данного изобретения полинуклеотидная последовательность представляет собой ORF 1 генотипов PTTV1b.
Согласно одному аспекту данного изобретения полипептидная последовательность выбрана из группы, состоящей из последовательностей, представленных в SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27 и SEQ ID NO:28.
Согласно другому аспекту данного изобретения полипептидная последовательность представляет собой SEQ ID NO:13. Согласно другому аспекту данного изобретения полипептидная последовательность представляет собой SEQ ID NO:14. Согласно другому аспекту данного изобретения полипептидная последовательность представляет собой SEQ ID NO:16. Согласно одному конкретному варианту данного изобретения полипептидная последовательность представляет собой С-концевой участок (а.к. 310-625) SEQ ID NO:16. Согласно другому аспекту данного изобретения полипептидная последовательность представляет собой SEQ ID NO:20.
Согласно другому аспекту данного изобретения вакцина дополнительно содержит адъювант.
Данное изобретение предусматривает также способ иммунизации свиньи против вирусной инфекции, вызванной PTTV, включающий введение свинье иммунологически эффективного количества вирусной вакцины, содержащей иммуногенный фрагмент полипептидной последовательности или полного белка, транслированный согласно полинуклеотидной последовательности, выбранной из группы, состоящей из of ORF1, ORF 2, ORF1/1 и ORF2/2 генотипов PTTV или подтипов PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA.
Согласно одному аспекту данного изобретения указанный способ включает введение свинье иммуногенного фрагмента или рекомбинантного капсидного белка.
Согласно другому аспекту данного изобретения указанный способ включает парентеральное, интраназальное, интрадермальное или трансдермальное введение вакцины свинье. Согласно еще одному аспекту данного изобретения указанный способ включает введение свинье вакцины в лимфу или внутримышечно.
Настоящее изобретение относится также к способу диагностики инфекции. вызванной PTTV1 и количественного определения вирусной нагрузки PTTV1, включающий экстрагирование ДНК из образца, предположительно инфицированного PTTV1, проведение полимеразной цепной реакции (PCR) с помощью праймеров, содержащих последовательности, представленные в SEQ ID NO:29 и SEQ ID NO:30, и детектирование специфической амплификации PTTV1. Согласно одному из аспектов данного изобретения полимеразная цепная реакция представляет собой ПЦР в режиме реального времени с применением красителя SYBR Green.
Данное изобретение предусматривает также способ диагностики инфекции, вызванной PTTV2, и количественного определения вирусной нагрузки PTTV2, включающий экстрагирование ДНК из образца, предположительно инфицированного PTTV2, проведение полимеразной цепной реакции (PCR) с помощью праймеров, содержащих последовательности, представленные в SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31 и SEQ ID NO:32, и детектирование специфической амплификации PTTV2. Согласно одному из аспектов данного изобретения полимеразная цепная реакция представляет собой ПЦР в режиме реального времени с применением красителя SYBR Green.
Данное изобретение предусматривает также способ одновременных детектирования и диагностики инфекции, вызванной PTTV1 и PTTV2, включающий экстрагирование ДНК из образца, предположительно инфицированного PTTV, проведение полимеразной цепной реакции (PCR) с помощью праймеров, содержащих последовательности, представленные в SEQ ID NO:31 и SEQ ID NO:32, и детектирование специфической амплификации PTTV1 и PTTV2. Согласно одному из аспектов данного изобретения полимеразная цепная реакция представляет собой ПЦР в режиме реального времени с применением красителя SYBR Green.
Кроме того, данное изобретение предусматривает также способ одновременного детектирования и диагностики инфекции, вызванной PTTV1a и PTTV1b, включающий экстрагирование ДНК из образца, предположительно инфицированного PTTV1, проведение первой полимеразной цепной реакции (PCR) с помощью праймеров, содержащих последовательности, представленные в SEQ ID NO:33 и SEQ ID NO:34, проведение второй полимеразной цепной реакции (PCR) с помощью праймеров, содержащих последовательности, представленные в SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37 и SEQ ID NO:38, и детектирование специфической амплификации PTTV1a и PTTV1b.
Данное изобретение предусматривает также способ диагностики инфекции, вызванной PTTV, включающий иммобилизацию иммуногенного фрагмента полипептидной последовательности, транслированный согласно полинуклеотидной последовательности, выбранной из группы, состоящей из ORF1, ORF2, ORF1/1 и ORF2/2 генотипов PTTV или подтипов PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA; контактирование образца сыворотки свиньи, предположительно инфицированной PTTV, с иммобилизованным иммуногенным фрагментом и детектирование захваченного антитела, специфического к иммуногенному фрагменту.
Согласно одному аспекту данного изобретения полинуклеотидная последовательность выбрана из группы, состоящей из ORF1 генотипов PTTV или подтипов PTTV1a-VA, PTTV1b-VA, PTTV2b-VA и PTTV2c-VA.
Согласно одному аспекту данного изобретения полинуклеотидная последовательность представляет собой ORF1 генотипа PTTV1a-VA вируса PTTV.
Согласно другому аспекту данного изобретения полинуклеотидная последовательность представляет собой ORF1 генотипа PTTV1b-VA вируса PTTV.
Согласно еще одному аспекту данного изобретения полинуклеотидная последовательность представляет собой ORF1 подтипа PTTV2c-VA вируса PTTV.
Согласно другому аспекту данного изобретения полипептидная последовательность выбрана из группы, состоящей из последовательностей, представленных SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27 и SEQ ID NO:28.
Согласно одному варианту данного изобретения полипептидная последовательность представлена в SEQ ID NO:13. Согласно другому варианту данного изобретения полипептидная последовательность представлена в SEQ ID NO:14. Согласно одному варианту данного изобретения полипептидная последовательность представлена в SEQ ID NO:16. Согласно одному конкретному варианту данного изобретения полипептидная последовательность представляет собой С-концевой участок (а.к. 310-625) SEQ ID NO:16. Согласно другому аспекту данного изобретения полипептидная последовательность представляет собой SEQ ID NO:20.
Настоящее изобретение предусматривает три стандартизованных метода твердофазного иммуноферментного анализа (ELISA) для диагностики инфекций, вызванных PTTV и детектирования антител в сыворотке свиней, которые инфицированы генотипами PTTV1а-VA, PTTV1b-VA вируса PTTV и всеми известными подтипами PTTV типа 2.
Диагностические тесты ELISA основаны на применении экспрессированной бактериями или экспрессированной бакуловирусами ORF1 капсидного белка генотипов PTTV1a-VA, PTTV1b-VA и PTTV2c-VA вируса PTTV.
Согласно другому аспекту данного изобретения детектирование захваченного антитела осуществляется методом Вестерн-блоттинга. Согласно еще одному аспекту данного изобретения детектирование захваченного антитела осуществляется методом твердофазного иммуноферментного анализа (ELISA).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Указанные выше признаки изобретения будут более понятны из следующего подробного описания данного изобретения в сочетании с чертежами, на которых:
Фигуры 1А и 1В представляют собой схематическую диаграмму геномных структур, стратегии геномного клонирования и сборки четырех штаммов свиного вируса TTV группы 1 (типа 1) и группы 2 (типа 2), прототипов американского штамма.
На фигуре 2 представлено PASC (парное сравнение последовательностей), сравнение нуклеотидных последовательностей 121 штамма TTV, которые имеются в базе данных GenBank. Показаны род, вид, типы, подтипы, варианты и соответствующие проценты идентичности нуклеотидных последовательностей.
Фигура 3А иллюстрирует филогенетическое дерево, сконструированное методом объединения соседей, основанным на применении полноразмерных геномных нуклеотидных последовательностей.
Фигура 3В иллюстрирует филогенетические деревья, сконструированные на основе предсказанных аминокислотных последовательностей ORF1 с помощью семи штаммов свиного TTV.
Фигура 3С иллюстрирует филогенетические деревья, сконструированные на основе предсказанных аминокислотных последовательностей ORF1/1 с помощью семи штаммов свиного TTV.
Фигура 3D иллюстрирует филогенетические деревья, сконструированные на основе предсказанных аминокислотных последовательностей ORF2 с помощью семи штаммов свиного TTV.
Фигура 3Е иллюстрирует филогенетические деревья, сконструированные на основе предсказанных аминокислотных последовательностей ORF2/2 с помощью семи штаммов свиного TTV.
На Фигуре 4 показано выравнивание полных аминокислотных последовательностей ORF1 среди семи штаммов TTV.
На Фигуре 5 показано выравнивание полных аминокислотных последовательностей ORF2 среди семи штаммов TTV.
Фигура 6А иллюстрирует кривые плавления продуктов ПЦР PTTV1 в режиме реального времени после 40 циклов амплификации образцов стандартной матрицы (показано голубым цветом) и 20 образцов свиной сыворотки.
Фигура 6В иллюстрирует кривые плавления продуктов ПЦР PTTV2 в режиме реального времени после 40 циклов амплификации образцов стандартной матрицы и 20 образцов свиной сыворотки.
На фигурах 7А-7В показаны результаты анализа кривых плавления (МСА) продуктов дуплексной ПЦР PTTV1/PTTV2 с применением красителя SYBR Green в режиме реального времени.
Фигура 8 представляет выравнивание нуклеотидных последовательностей, расположенных HaN - концевом участке предполагаемой ORF1 для семи штаммов PTTV.
На Фигурах 9А и 9В показаны профили гидрофильности и консервативные участки четырех известных свиных TTV2.
Фигуры 10А и 10В иллюстрируют экспрессию и очистку рекомбинантного капсидного белка ORF1 PTTV2c.
На Фигурах 11А и 11В показаны репрезентативные результаты анализа семи образцов свиной сыворотки методом Вестерн-блоттинга.
Фигура 12 иллюстрирует согласованность результатов анализа PTTV2-ORF1 методами Вестерн-блоттинга и ELISA.
На Фигуре 13 приведены графики Бокса - Вискера, показывающие зависимость количества антител к PTTV2 в сыворотке свиней от вирусной нагрузки для 138 свиней из разных источников.
Фигура 14А показывает ретроспективную оценку вирусной нагрузки PTTV2.
Фигура 14В отражает количество антител к капсидному белку PTTV2-ORF1 для 10 свиней, выращенных до достижения 2 мес. после прибытия.
Фигуры 15А-15С иллюстрируют стадии экспрессии и очистки рекомбинантного капсидного белка ORF 1 в PTTV1a и PTTV1b и
на Фигуре 16 представлены примеры результатов анализов PTTV1a - ORF1 методом Вестерн-блоттинга в образцах сыворотки, отобранных у свиней на ферме в штате Висконсин.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
В соответствии с данным изобретением в одном конкретном примере указанные выше четыре новые подтипа свиного вируса TTV были выделены у одного борова в Виргинии.
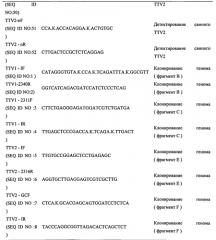
На Фигуре 1А оба генома PTTV1 и PTTV2 показаны жирным шрифтом и номера и направления четырех предполагаемых ORF (ORF1, ORF2, ORF1/1 и ORF2/2) указаны стрелками. Показаны также участки, обогащенные GC. Пунктирными линиями в кружках А и D показаны участки, использованные для детектирования PTTV1 и PTTV2, соответственно, в образцах сыворотки и спермы методом вложенной ПЦР. Кружки В и С, показанные пунктирными линиями, показывают два перекрывающихся фрагмента ПЦР для геномного клонирования PTTV1, а пунктирные кружки Е и F показывают два перекрывающихся фрагмента ПЦР для геномного клонирования PTTV2. Места положения праймеров, использованных в этом опыте (см. Таблицу 1), также показаны в соответствующих позициях.
Один образец сыворотки, отобранный у борова (SR # 5), дал положительный результат для PTTV1 и PTTV2 в первом раунде ПЦР, что свидетельствует о большей вирусной нагрузке, он был использован для последующего клонирования полных геномов PTTV. Неожиданно оказалось, что первоначальные попытки применения двух наборов праймеров (NG372 / NG373 и NG384 / NG385) в случае обращенной ПЦР для клонирования первого штамма Sd - TTV31 PTTV с целью амплификации вирусной геномной ДНК оказались неудачными (Okamoto et al., 2002, supra). После нескольких попыток продукт ПЦР не был получен.
Основываясь на исходной последовательности участка А PTTV1 и участка D PTTV2, получали две новые пары праймеров (TTVl-If(SEQ ID NO:1)/TTV1-2340R (SEQ ID NO:2) и TTV1-2311F(SEQ ID NO:3)/TTV1-IR(SEQ ID NO:4)) с целью амплификации участков В и С, перекрывающих предполагаемый геном PTTV1, и две дополнительных пары праймеров (TTV2-IF(SEQ ID NO:5)/TTV2-2316R(SEQ ID NO:6) и TTV2-GCF(SEQID NO:7)/TTV2-IR(SEQ ID NO:8)) с целью амплификации участков Е и F, перекрывающих предполагаемый геном PTTV2, соответственно (Фигура 1 А и Таблица 1). Праймеры TTV1-2340R (SEQ ID NO:2) и TTV1-231 IF (SEQ ID NO:3) были получены из общей последовательности в штаммах Sd-TTV31 (Okamoto et al., 2002, supra) и TTV-lp (Niel et al., 2005), которая отсутствует в штамме TTV-2p PTTV2 (Niel et al., 2005, supra), в то время как праймеры TTV2-2316R(SEQID NO:6) и TTV2-GCF(SEQID NO:7) были получены из последовательности штамма TTV - 2р, которая отсутствует в двух штаммах PTTV1. Каждый из полученных четырех разных продуктов ПЦР с ожидаемыми размерами был инсерцирован в клонирующий вектор с тупым концом и полученные рекомбинантные плазмиды были трансформированы в Escherichia coli. Были идентифицированы от восьми до пятнадцати положительных (белого цвета) клонов для каждого конструкта, представляющие фрагменты В, С, Е и F, затем они были секвенированы.
Неожиданно оказалось, что у одной и той же свиньи существуют два типа PTTV в геногруппе 1 и в геногруппе 2, что показало наличие последовательностей в каждом конструкте. Для дифференцировки и сборки четырех штаммов PTTV проводили сравнение последовательностей с тремя известными штаммами PTTV, Sd - TTV31, TTV - 1р и TTV - 2р (Фигуры 1В and 1С).
На Фигуре 1В показаны стадии дифференцировки и сборки полных геномных последовательностей штаммов PTTV 1а - VA и PTTV1b - VA вируса PTTV1 с фрагментами ПЦР В и С, которые затем подвергали клонированию. Инициирующие кодоны ORF1 и ORF2 во фрагменте В, а также терминирующие кодоны ORF1 во фрагменте С отмечены знаками "^" или "*". Соответствующие последовательности двух известных штаммов PTTV1, Sd - TTV31 и TTV - 1р, также показаны. Консервативные последовательности заштрихованы, а пунктиром показаны делеции нуклеотидов.
В случае PTTV1 инициирующий кодон ATG и терминирующий кодон TGA предполагаемой ORF1 расположены во фрагментах В и С, соответственно (Фигура 1В). Расположение кодонов в двух группах PTTV1 было разным, у первого кодона идентично Sd - TTV31 и у второго - идентично TTV - 1р (Фигура 1В). Кроме того, инициирующие кодоны ORF2 в двух группах также располагались в разных местах, что соответствовало ORF1. Более того, филогенетические анализы для четырех разных последовательностей участка В (две по данным секвенирования и две в штаммах Sd - TTV31 и TTV - 1р) и четырех разных последовательностей на участке С подтвердили, что первая последовательность кластеризовалась с Sd - TTV31, а вторая - кластеризовалась с TTV - 1р (эти данные не показаны). Следовательно, мы смогли дифференцировать и собрать две группы библиотек последовательностей из обоих фрагментов В и С в два генома PTTV1 полной длины, которые были обозначены как штаммы PTTV1a-VA (SEQ ID NO:9) and PTTV1b-VA (SEQ ID NO:10), соответственно (см. Фигуру 1 В).
На Фигуре 1С показаны стадии дифференцировки и сборки полных геномных последовательностей штаммов PTTV2b-VA и PTTV2c-VA с фрагментами ПЦР Е и F, которые затем подвергались клонированию. Показана соответствующая последовательность штамма TTV - 2р, а консервативные последовательности заштрихованы. Пунктирными линиями обозначены делеции в нуклеотидах. Соответственно показаны уникальные нуклеотиды с перекрывающимся участком (пунктирные линии) для каждого штамма ("непрерывный" "AG " нуклеотид " в PTTV2b-VA (SEQ ID NO:11) и два единичных нуклеотида "А" и "G" в PTTV2c-VA (SEQ ID NO:12)).
Процесс дифференцировки двух штаммов PTTV2 проходил легче. Уникальный непрерывный "AG " нуклеотид, расположенный на перекрывающемся участке двух ПЦР-фрагментов был общим для двух групп последовательностей из фрагментов Е и F, соответст