Композиция, применимая в качестве ротавирусной вакцины, и способ ее получения
Иллюстрации
Показать всеПредставлены композиция и способ ее получения. Охарактеризованная композиция содержит: эффективное количество вирусного антигена, который представляет собой живой аттенуированный ротавирус, предварительно обработанный 0,1% сывороточным альбумином человека, и фармацевтически приемлемый буфер. Способ получения композиции включает выращивание культуры клеток Vero, первоначально культивированной в присутствии 5% фетальной сыворотки теленка и 0,1% сывороточного альбумина человека, инфицирование такой культуры клеток Vero живым аттенуированным ротавирусом, размножения вируса в клеточной культуре и добавление к указанному вирусу фармацевтически приемлемого буфера. Представленные изобретения могут быть использованы для профилактики ротавирусной инфекции и/или ротавирусного гастроэнтерита. 2 н. и 9 з.п. ф-лы, 17 ил., 4 табл., 2 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к вакцинным составам, содержащим ротавирусы, способные давать более высокое значение титра и проявлять свойства повышенной стабильности. Состав может быть в жидкой или лиофилизированной форме и имеет увеличенный срок годности, сохраняя при этом свою терапевтическую эффективность. Изобретение также относится к способам получения таких вирусов и способам получения таких составов. Кроме того, изобретение относится к профилактическим и терапевтическим способам их применения.
УРОВЕНЬ ТЕХНИКИ
Существует ряд вакцин против вирусов человека, которые применяют в настоящее время. Такие вакцины включают вакцины против вируса гепатита A, вируса гепатита B, вируса гриппа, вируса японского энцефалита B, вируса кори, вируса эпидемического паротита, вируса краснухи (MMR), вируса полиомиелита, вируса бешенства, вируса натуральной оспы, вируса ветряной оспы и опоясывающего лишая, вируса желтой лихорадки. В добавление к возрастающему количеству вакцинных продуктов существуют различные композиции или составы, применяемые и разрабатываемые для данной вакцины. Успешное применение живых вирусных вакцин зависит не только от правильного выбора и доставки вируса, но также от поддержания достаточного титра или активности, необходимых для иммунного ответа. Присущая живым вирусам лабильность представляет собой особенную проблему при приготовлении составов, связанную со стабилизацией и сохранением жизнеспособности вакцины во время производства, хранения и введения. Существует ряд составов, известных в данной области, для получения ротавирусных вакцин, но они обладают недостатками, связанными с одной или несколькими проблемами, имеющими отношение к стабильности при хранении.
Ротавирус представляет род вирусов, содержащих двухцепочечную РНК, в семействе Reoviridae и передается фекально-оральным путем. Он инфицирует клетки, которые выстилают тонкий кишечник, и продуцирует энтеротоксин, который индуцирует гастроэнтерит, приводя к тяжелой диарее и иногда к смерти в результате обезвоживания. Ротавирусная инфекция является наиболее значимой причиной связанной с диареей смерти новорожденных и детей младшего возраста. Каждый год ротавирусный гастроэнтерит приводит к гибели 310000-590000 новорожденных и детей младшего возраста во всем мире.
Все ротавирусные вакцины, разработанные до настоящего времени, основаны на живых штаммах ротавирусов, которые были выделены из организма человека или животных и подвергнуты реассортации in vitro, адаптированы к культурам клеток и затем приготовлены в виде составов для пероральной доставки. И моновалентные, и поливалентные основанные на вирусах животных штаммы проявили эффективность в качестве кандидатов для вакцин.
Штамм ротавируса человека 116E, природный реассортант человека-быка и природно аттенуированный штамм, представляет собой штамм G9 человека, в который в природе был встроен один ген VP4 быка (VP = вирусный белок), гомологичный участку гена P[11]. Штамм I321, также называемый G10P [11], главным образом, содержит гены быка и имеет только два генных участка человеческого происхождения, VP5 и VP7. Два указанных штамма ротавирусной вакцины были получены по отдельности в виде опытных партий жидких составов моновалентной пероральной ротавирусной вакцины для клинических испытаний, проводимых в Индии.
Bharat Biotech International Ltd. (BBIL) получили штаммы ротавирусов человека, 116E и I321, из Национального института здравоохранения (NIH) согласно договору о передаче материалов с Национальным институтом аллергии и инфекционных болезней (NIAID), NIH, Bethesda, USA. Исходные штаммы 116E (G9[P11]) и I321 (G10P[11]) адаптировали для выращивания в культуре клеток пассированием в первичных клетках почки африканской зеленой мартышки (AGMK), затем в клеточном субстрате MA104 и затем в серийно пересеваемых клетках AGMK (SPAGMK). Клеточные субстраты MA104 и SPAGMK не одобрены Национальным регулирующим органом (NRA) для получения коммерческих вакцин. Поэтому предпочтительна адаптация 116E и I321 и других штаммов ротавирусных вакцин к одобренному, сертифицированному, лицензированному и полностью охарактеризованному клеточному субстрату, подобному субстрату на основе клеток Vero и/или к диплоидным клеткам человека, подобным MRC-5.
Предшествующий уровень техники, известный авторам изобретения, включает документ WO 02/11540 A1, в котором описаны составы ротавирусных вакцин, которые содержат буферные средства, подходящие для перорального введения ротавирусных вакцин. Составы, описанные в WO 02/11540 A1, также содержат соединения для стабилизации композиций вакцин, препятствующей потере активности. Более конкретно, для композиций, описанных в WO 02/11540, требуется сахара, фосфат и по меньшей мере один карбоксилат, по меньшей мере один сывороточный альбумин человека или аминокислота, выбранная из глутамата, глутамина и аргинина. Однако достигаемые стабильности сильно варьируют, особенно при температурах выше 20°C, что проявляется в значительных потерях активности составов, описанных в WO 02/11540 A1.
В WO 99/62500 (далее '500), WO 2005/058356 ('356) A2 и WO 2001/012797 ('197) описано использование стабилизаторов вакцин для получения вакцинных составов и лиофилизированных вакцин, стабильные при хранении вирусные композиции, способ разделения вариантов ротавирусов и живая аттенуированная ротавирусная жидкая вакцина. В '500 описана лиофилизированная вакцина против кори-эпидемического паротита-краснухи, полученная с использованием стабилизатора, состоящего из гидролизованного желатина, сорбита, фосфата, хлорида натрия, сахарозы, бикарбоната, глюкозы, сывороточного альбумина человека и цитрата. В изобретении сделана ставка на двойное присутствие повышенного количества дисахарида и многоатомного спирта при pH от 6,0 до 7,0 для обеспечения термостабильности. Несмотря на потребность в определенном количестве ингредиентов, делающих изобретение дорогостоящим, не удается добиться стабильности при температуре окружающей среды. Это в свою очередь добавляет к требованиям наличие специальной инфраструктуры для хранения вакцины, что делает изобретение еще более дорогостоящим. Однако большинство таких составов обеспечивают ограниченную стабильность при хранении и поэтому являются нерентабельными.
В документе PCT/IN07/00190, озаглавленном «Композиция, применимая в качестве вакцины», описана стабильная вакцина. Сущность изобретения сконцентрирована вокруг совместного действия первого белка, который представляет собой сывороточный альбумин человека, второго белка, который по меньшей мере частично гидролизован, и сочетания трех разных сахаров. Кроме того, изобретение также основано на включении трипсина в культуральную среду во время адаптации вирусов. Заявленная вакцина стабильна в течение 3 недель при 37°C, в течение шести месяцев при 25°C и в течение одного года при 2°C-8°C.
Из приведенного выше описания, очевидно, что несмотря на указанные успехи в области приготовления составов вакцин, сохраняется явная потребность в живой рентабельной вирусной вакцине с повышенной термостабильностью и сроком годности.
Настоящее изобретение удовлетворяет такую потребность, обеспечивая живой или живой аттенуированный вирус, который обладает улучшенными свойствами и повышенной стабильностью, либо в форме объединенной массы из трех отдельных сборов вируса из одной и той же партии, либо в жидком или лиофилизированном составе. Стабильность в отношении вируса (например, ротавируса или ротавирусной вакцины) в настоящем описании следует понимать как титр вируса в данной временной точке, начиная от момента сбора из культивируемых клеток, на протяжении стадии получения общей нефасованной массы до приготовленной в виде состава вакцины. Авторы изобретения после длительного исследования смогли разработать композицию согласно настоящему изобретению, применимую в качестве вакцины, которая имеет повышенную стабильность в виде получаемой общей массы и в виде приготовленного состава, в частности, при температуре окружающей среды.
Повышенная стабильность в статистически значимых показателях может быть достигнута в случае применения вируса, который контактировал с или был подвергнут воздействию сывороточного альбумина человека во время стадии роста и размножения вируса в культуре клеток. В целях настоящего изобретения полагают, что вирус подвергается контактированию с или подвергается воздействию сывороточного альбумина человека, когда инфицированные вирусом клетки-хозяева размножаются в среде для культивирования/среде для роста клеток с добавлением сывороточного альбумина человека. Вирус или популяция вирусов, которые таким образом были подвергнуты воздействию сывороточного альбумина человека, называют «предварительно обработанным» вирусом. Вирус, который не был подвергнут воздействию сывороточного альбумина человека, называют в настоящем описании «обычным вирусом». Предварительно обработанный вирус, либо на стадии общей массы, либо в форме состава, т.е. вакцины/приготовленной в виде состава вакцины имеет более высокую стабильность (в статистически значимых показателях), чем обычный вирус.
Настоящее изобретение дополнительно показывает, что стабильность вируса, либо предварительно обработанного вируса, либо обычного вируса, в составе также может быть дополнительно повышена или, по меньшей мере, может поддерживаться, т.е. стабильность может быть сохранена или, как минимум, может быть замедлено постепенное достижение нуля или нулевой стабильности при хранении в случае использования на практике систем (i) и (ii): Согласно системе (i), чтобы достичь повышенной или более длительной стабильности, вирус готовят в виде состава, содержащего невирусный белок или гидролизат такого белка или растительный белок или аналогичный белок, такой как сывороточный альбумин человека. Примером гидролизата может быть без ограничения гидролизат лактальбумина, дрожжевой гидролизат, пептон, гидролизат желатина и гидролизат яичного белка. Растительные белки включают без ограничения белок кукурузы, белок пшеницы, белок нута обыкновенного, белок фасоли обыкновенной, белок чечевицы, белок лимской фасоли, белок турецких бобов, соевый белок, белок лущеного гороха. Сывороточный альбумин человека имеет природное или рекомбинантное происхождение. Вирус готовят в виде состава с невирусным белком или гидролизатом такого белка просто добавлением в состав, используемый для получения вакцины невирусного белка или гидролизата такого белка. Подразумевают, что такая система (i) представляет собой однокомпонентную систему. Согласно системе (ii) вирус подвергают контактированию с невирусным белком или гидролизатом такого белка, как в однокомпонентной системе, и 1-2 дисахаридами в результате добавления в состав, используемый для получения вакцины, белка или гидролизата белка и 1-2 дисахаридов. Подразумевают, что такая система (ii) представляет собой двух- или трехкомпонентную систему, в зависимости от того, добавляют ли в состав, содержащий вирус, один дисахарид (двухкомпонентная система) или сочетание двух разных дисахаридов (трехкомпонентная система). При практическом использовании системы (ii) уровни стабильности, наблюдаемые в однокомпонентной системе, дополнительно повышаются.
Таким образом, в одном общем аспекте в настоящем изобретении предлагаются композиции, содержащие предварительно обработанный вирус или обычный вирус, обладающий повышенной и/или более длительной стабильностью.
Новизна изобретения состоит в добавлении в культуральную среду сывороточного альбумина человека при размножении вируса, чтобы получить вирусный антиген и вакцинный состав с повышенным значением титра, увеличенным сроком годности и термостабильностью даже без добавления стабилизаторов. Срок годности может быть дополнительно увеличен при добавлении стабилизаторов, которые описаны выше. Это приводит к получению терапевтически улучшенной вакцины с внедрением простого экономически выгодного рентабельного способа. Кроме технического усовершенствования изобретение также удовлетворяет критерию ACID экономической значимости.
ЦЕЛЬ ИЗОБРЕТЕНИЯ
Основной целью настоящего изобретения является получение композиции, применимой в качестве ротавирусной вакцины, имеющей повышенный срок годности, при этом устраняя недостатки соответствующего известного уровня техники.
Другой целью является получение составов вакцин, содержащих живые аттенуированные ротавирусы, способные давать более высокое значение титра, проявлять свойства повышенной стабильности при температурах окружающей среды.
Состав может быть в жидкой или лиофилизированной форме и имеет увеличенный срок годности, сохраняя при этом свою терапевтическую эффективность/активность.
Изобретение также относится к способам получения таких вирусов и способам получения таких составов.
Изобретение, кроме того, относится к профилактическим и терапевтическим способам сдерживания ротавирусных инфекций посредством введения составов вакцин субъектам, страдающим такими инфекциями.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Титр вирусов, указанный на фигурах, соответствовал количеству бляшкообразующих единиц (БОЕ) в 0,5 мл собранной или конечной массы ротавируса 116E и приготовленной в виде состава вакцины. На различных фигурах, приведенных в настоящей публикации, указание «биологический способ 1» означает, что исходным используемым материалом является обычный вирус, и указание «биологический способ 2» означает, что исходным используемым материалом является предварительно обработанный вирус. Если не указано иное, данные на фигурах представляют стабильность предварительно обработанного вируса. На фиг.1-12H показаны данные для жидких составов (жид. = жидкий), а на фиг.13A-17C показаны данные для лиофилизированных составов (лиоф. = лиофилизированный). Числовые показатели, выраженные в процентах, означают значения по массе для состава (композиции). Например, следует понимать, что указание «80% сахароза» означает 80% масс. сахарозы в составе (масс./об.). Среднеквадратическая ошибка в случае всех временных точек находилась в диапазоне от ±0,40 до ±0,45.
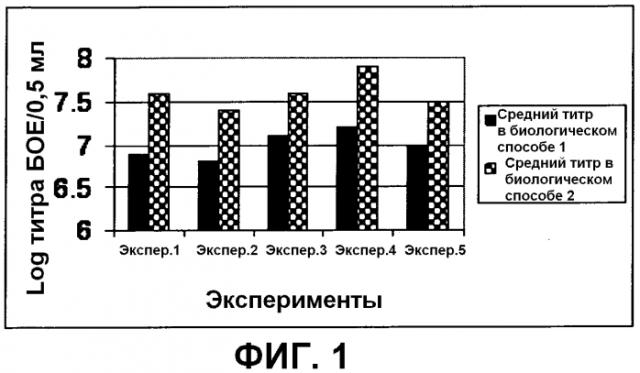
На фиг.1 показан средний титр, получаемый при сборах в случае биологического способа 1 (обычный вирус) и биологического способа 2 (предварительно обработанный вирус) в пяти экспериментах.
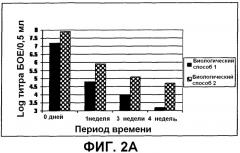
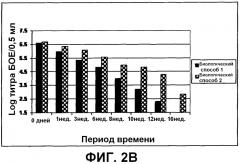
На фиг.2 показаны данные о стабильности для собранных вирусов, обычного вируса (биологический способ 1) и предварительного обработанного вируса (биологический способ 2), в каждом случае в отсутствие (фиг. 2A) или в присутствии (фиг. 2B) стабилизаторов, а именно, 5% LAH, 80% сахарозы и 0,5% трегалозы, в жидком составе при 37°C.
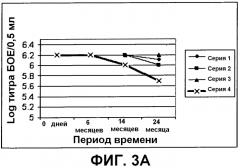
На фиг.3 (жид.) показаны данные о стабильности предварительно обработанного вируса в четырех разных составах при 2-8°C (3A), 25°C (3B) и 37°C (3C). В каждом случае: серия 1 относится к составу с 2,5% гидролизата лактальбумина; серия 2 относится к составу с 10% гидролизата лактальбумина и 0,5% трегалозы; серия 3 относится к составу с 20% гидролизата лактальбумина; и серия 4 относится к составу с сочетанием 2,5% гидролизата лактальбумина, 0,5% крахмала и 0,5% трегалозы.
На фиг.4 (жид.) показаны данные о стабильности ротавируса в составе, содержащем и не содержащем 5% гидролизата лактальбумина + 80% сахарозы + 0,5% трегалозы, который хранили при 2-8°C (4A), 25°C (4B) и 37°C (4C).
На фиг.5 (жид.) показаны данные о стабильности ротавируса в четырех разных составах при 2-8°C (5A), 25°C (5B) и 37°C (5C). В каждом случае: серия 1 относится к составу, содержащему сочетание 20% гидролизата лактальбумина и 0,5% трегалозы; серия 2 относится к составу, содержащему сочетание 10% гидролизата лактальбумина, 1,0% лактозы; серия 3 относится к составу, содержащему сочетание 5% гидролизата лактальбумина, 80% сахарозы; и серия 4 относится к составу, содержащему сочетание 10% гидролизата лактальбумина и 50% мальтозы.
На фиг.6 (жид.) показаны данные о стабильности ротавируса в четырех разных составах при 2-8°C (6A), 25°C (6B) и 37°C (6C). В каждом случае: серия 1 относится к составу, содержащему сочетание 0,5% гидролизата лактальбумина, 10% соевого белка и 1,0% трегалозы; серия 2 относится к составу с сочетанием 0,5% гидролизата лактальбумина, 10% соевого белка и 1,0% лактозы; серия 3 относится к составу с сочетанием 5% гидролизата лактальбумина, 2,5% соевого белка и 80% сахарозы; и серия 4 относится к составу с сочетанием 5% гидролизата лактальбумина, 2,5% соевого белка и 50% мальтозы.
На фиг.7 (жид.) показаны данные, свидетельствующие о высокой стабильности ротавируса в четырех разных составах при -2-8°C (7A), 25°C (7B) и 37°C (7C). В каждом случае: серия 1 относится к составу, содержащему сочетание 10% гидролизата лактальбумина, 10% сахарозы и 1,0% трегалозы; серия 2 относится к составу, содержащему сочетание 10% гидролизата лактальбумина, 5% мальтозы и 1,0% трегалозы; серия 3 относится к составу, содержащему сочетание 2,5% гидролизата лактальбумина, 80% сахарозы и 1% трегалозы; и серия 4 относится к составу, содержащему сочетание 2,5% гидролизата лактальбумина, 50% мальтозы и 1% трегалозы.
На фиг.8 (жид.) показаны данные о стабильности ротавируса в четырех разных составах при 2-8°C (8A), 25°C (8B) и 37°C (8C). В каждом случае: серия 1 относится к составу с сочетанием обычного вируса, 5% гидролизата лактальбумина, 80% сахарозы и 0,5% трегалозы; серия 2 относится к составу, содержащему сочетание предварительно обработанного вируса, 5% гидролизата лактальбумина, 80% сахарозы и 0,5% трегалозы; серия 3 относится к составу с сочетанием обычного вируса, 0,1% рекомбинантного сывороточного альбумина человека (rHSA) и 80% сахарозы и 0,5% трегалозы; серия 4 относится к составу с сочетанием предварительно обработанного вируса, 0,1% rHSA, 80% сахарозы и 0,5% трегалозы; серия 5 относится к составу, содержащему сочетание обычного вируса, 80% сахарозы и 0,5% трегалозы; и серия 6 относится к составу, содержащему сочетание предварительно обработанного вируса, 80% сахарозы и 0,5% трегалозы.
На фиг.9 (жид.) показаны данные о стабильности ротавируса в пяти разных составах при 37°C.
На фиг.10 (жид.) показана стабильность ротавируса при низком титре в пяти разных составах при 2-8°C (10A) и 37°C (10B).
На фиг.11A (жид.) показаны данные о стабильности составов предварительно обработанных ротавирусов, содержащих 20% гидролизованного пептона, при 2-8°C, 25°C и 37°C.
На фиг.11B (жид.) показаны данные о стабильности составов предварительно обработанных ротавирусов, содержащих сочетание 20% гидролизованного пептона, 1% трегалозы и 0,02% фукозы, при 2-8°C, 25°C и 37°C.
На фиг.11C (жид.) показаны данные о стабильности составов предварительно обработанных ротавирусов, содержащих 20% гидролизата яичного белка, при 2-8°C, 25°C и 37°C.
На фиг.11D (жид.) показаны данные о стабильности составов предварительно обработанных ротавирусов, содержащих сочетание 20% гидролизата яичного белка, 0,5% трегалозы, 1% D-сорбита и 0,5% маннозы, при 2-8°C, 25°C и 37°C.
На фиг.11E (жид.) показаны данные о стабильности составов предварительно обработанных ротавирусов, содержащих 20% гидролизата лактальбумина, при 2-8°C, 25°C и 37°C.
На фиг.11F (жид.) показаны данные о стабильности составов предварительно обработанных ротавирусов, содержащих сочетание 20% гидролизата лактальбумина, 0,5% трегалозы, при 2-8°C, 25°C и 37°C.
На фиг. 11G (жид.) показаны данные о стабильности составов предварительно обработанных ротавирусов, содержащих 20% дрожжевого гидролизата, при 2-8°C, 25°C и 37°C.
На фиг.11H (жид.) показаны данные о стабильности составов предварительно обработанных ротавирусов, содержащих сочетание 20% дрожжевого гидролизата, 5% мальтозы и 0,5% лактозы, при 2-8°C, 25°C и 37°C.
На фиг.12A (жид.) показаны данные о стабильности составов обычных ротавирусов, содержащих 20% гидролизованного пептона, при 2-8°C, 25°C и 37°C.
На фиг.12B (жид.) показаны данные о стабильности составов обычных ротавирусов, содержащих сочетание 20% гидролизованного пептона, 1% трегалозы и 0,02% фукозы, при 2-8°C, 25°C и 37°C.
На фиг.12C (жид.) показаны данные о стабильности составов обычных ротавирусов, содержащих 20% гидролизата яичного белка, при 2-8°C, 25°C и 37°C.
На фиг.12D (жид.) показаны данные о стабильности составов обычных ротавирусов, содержащих сочетание 20% гидролизата яичного белка, 0,5% трегалозы, 1% D-сорбита и 0,5% маннозы, при 2-8°C, 25°C и 37°C.
На фиг.12E (жид.) показаны данные о стабильности составов обычных ротавирусов, содержащих 20% гидролизат лактальбумина, при 2-8°C, 25°C и 37°C.
На фиг.12F (жид.) показаны данные о стабильности составов обычных ротавирусов, содержащих сочетание 20% гидролизата лактальбумина, 0,5% трегалозы, при 2-8°C, 25°C и 37°C.
На фиг.12G (жид.) показаны данные о стабильности составов обычных ротавирусов, содержащих 20% дрожжевого гидролизата, при 2-8°C, 25°C и 37°C.
На фиг.12H (жид.) показаны данные о стабильности составов обычных ротавирусов, содержащих сочетание 20% дрожжевого гидролизата, 5% мальтозы и 0,5% лактозы, при 2-8°C, 25°C и 37°C.
На фиг.13 (лиоф.) показаны данные о стабильности ротавируса в четырех разных лиофилизированных составах при 2-8°C (13A), 25°C (13B) и 37°C (13C). В каждом случае: серия 1 относится к составу с 0,5% сывороточного альбумина человека и 12% сахарозы; серия 2 относится к составу с 0,5% гидролизата лактальбумина, 0,5% трегалозы; серия 3 относится к составу с 0,5% соевого белка и 0,5% трегалозы; и серия 4 относится к 0,25% поливинилпирролидина, 0,5% трегалозы.
На фиг.14 (лиоф.) показаны данные о стабильности ротавируса в четырех разных лиофилизированных составах при 2-8°C (14A), 25°C (14B) и 37°C (14C). В каждом случае: серия 1 относится к составу с 0,5% сывороточного альбумина человека, 12% сахарозы и 0,1% крахмала; серия 2 относится к составу с 0,5% гидролизата лактальбумина, 0,5% трегалозы и 0,1% крахмала; серия 3 относится к составу с 0,5% соевого белка, 0,5% трегалозы и 0,1% крахмала; и серия 4 относится к 0,25% поливинилпирролидина, 0,5% трегалозы и 0,1% крахмала.
На фиг.15 (лиоф.) показаны данные о стабильности ротавируса в четырех разных лиофилизированных составах при 2-8°C (15A), 25°C (15B) и 37°C (15C). В каждом случае: серия 1 относится к составу с 0,5% сывороточного альбумина человека, 12% сахарозы, 0,1% крахмала и 304 мМ бикарбоната; серия 2 относится к составу с 0,5% гидролизата лактальбумина, 0,5% трегалозы, 0,1% крахмала и 304 мМ бикарбоната; серия 3 относится к составу с 0,5% соевого белка, 0,5% трегалозы, 0,1% крахмала и 304 мм бикарбоната; серия 4 относится к 0,25% поливинилпирролидина, 0,5% трегалозы, 0,1% крахмала и 304 мМ бикарбоната.
На фиг.16 (лиоф.) показаны данные о стабильности ротавируса в четырех разных лиофилизированных составах при 2-8°C (16A), 25°C (16B) и 37°C (16C). В каждом случае: серия 1 относится к составу с 0,5% сывороточного альбумина человека, 12% сахарозы и 0,1% аравийской камеди; серия 2 относится к составу с 0,5% гидролизата лактальбумина, 0,5% трегалозы и 0,1% аравийской камеди; серия 3 относится к составу с 0,5% соевого белка, 0,5% трегалозы и 0,1% аравийской камеди; и серия 4 относится к 0,25% поливинилпирролидина, 0,5% трегалозы и 0,1% аравийской камеди.
На фиг.17 (лиоф.) показаны данные о стабильности ротавируса в четырех разных лиофилизированных составах при 2-8°C (17A), 25°C (17B) и 37°C (17C). В каждом случае: серия 1 относится к составу с 0,5% гидролизата лактальбумина, 0,25% поливинилпирролидина; серия 2 относится к составу с 0,5% гидролизата лактальбумина и 0,1% аравийской камеди; серия 3 относится к составу с 0,5% гидролизата лактальбумина и 0,1% пиридоксина·HCl; и серия 4 относится к 0,5% гидролизата лактальбумина и 0,1% крахмала.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предлагается композиция, содержащая:
(a) вирусный антиген, который представляет собой живой аттенуированный ротавирус, и
(b) фармацевтически приемлемый буфер с физиологическим pH,
при этом стабильность композиции в отношении титра вируса повышена, так как влияние вируса, размножающегося в присутствии сывороточного альбумина человека, на стабильность выше, чем вируса, размножаемого в отсутствие сывороточного альбумина человека.
Согласно одному из вариантов композиция дополнительно может содержать по меньшей мере один из стабилизаторов, содержащий невирусный белок, или по меньшей мере частично гидролизованный гидролизат такого белка, или один дисахарид, или сочетание 2 дисахаридов.
Невирусным белком или гидролизатом белка может быть такой белок или гидролизат, как гидролизат лактальбумина, дрожжевой гидролизат, гидролизат желатина, гидролизат яичного белка, гидролизованный пептон или растительный белок, выбранный из белка кукурузы, белка пшеницы, белка нута обыкновенного, белка фасоли обыкновенной, белка чечевицы, белка лимской фасоли, белка турецких бобов, соевого белка, белка лущеного гороха или аналогичного белка, примером такого белка является сывороточный альбумин человека, предпочтительно гидролизат лактальбумина или гидролизованный соевый белок, более предпочтительно гидролизат лактальбумина.
Согласно другим вариантам используемым дисахаридом может быть такой как трегалоза или сочетание 2 дисахаридов, состоящее из сахарозы и трегалозы.
Таким образом, композиция согласно настоящему изобретению, может содержать (a) вирусный антиген, который представляет собой живой аттенуированный ротавирус, (b) фармацевтически приемлемый буфер с физиологическим pH и (c) невирусный белок или гидролизат белка.
Композиция, которая раскрыта в настоящем описании выше, может содержать
(i) вирусный антиген, который представляет собой живой аттенуированный ротавирус, который описан в настоящей публикации выше, с титром в диапазоне от 103 до 108,5 БОЕ/0,5 мл,
(ii) фармацевтически приемлемый буфер, представляющий собой фосфатно-цитратный буфер (310/100 мМ) с pH от 6,8 до 8,0, в качестве разбавителя/носителя,
(iii) гидролизат белка, который представляет собой гидролизат лактальбумина, в диапазоне 20-30% масс./об., и
(iv) дисахарид, представляющий собой трегалозу примерно 0,5% масс./об. или сахарозу примерно 80% масс./об., и другой дисахарид, представляющий собой трегалозу примерно 0,5% масс./об.
Композиция содержит живой аттенуированный ротавирус, способный давать повышенный титр в среднем от минимум 0,8 log до максимум 1,1 log на миллилитр при хранении в условиях окружающей среды, по сравнению с живым аттенуированным ротавирусом, размножаемым в отсутствие сывороточного альбумина человека.
Кроме того, указанный живой аттенуированный ротавирус размножают в присутствии 0,1% рекомбинантного сывороточного альбумина человека.
Согласно другому аспекту изобретения также предлагается способ получения живого аттенуированного ротавируса по п.1, включающий в себя:
(i) инфицирование клеток-хозяев живым аттенуированным ротавирусом;
(ii) выращивание инфицированных клеток в среде для культивирования клеток, позволяющей поддерживать рост указанных клеток, при этом в указанную среду добавлен сывороточный альбумин человека, и сбор указанного ротавируса, способного проявлять улучшенную стабильность.
В одном конкретном аспекте настоящее изобретение относится к композиции, содержащей живой и предварительно обработанный вирус (или популяцию вирусов) с определенной стабильностью, при этом стабильность вируса характеризуют посредством сравнения с обычным живым вирусом (или популяцией вирусов), который не размножался в присутствии сывороточного альбумина человека (как в случае вируса, называемого предварительно обработанным), и в случае которого обнаружено падение титра на log 4, больше чем различие между 4,5 и 7,5 БОЕ/0,5 мл, когда обе композиции с живым предварительно обработанным вирусом или живым обычным вирусом хранили при 37°C в течение четырех недель после сбора. Композиция содержит фармацевтически приемлемый буфер с добавлением или без добавления стабилизатора, такого как гидролизат белка, пептон, растительный белок или дисахарид, в составе. В другом конкретном аспекте настоящее изобретение относится к композиции, содержащей живой и предварительно обработанный вирус (или популяцию вирусов), способный давать титр, в среднем повышенный от минимум 0,8 log до максимум 1,1 log на миллилитр при хранении в условиях окружающей среды, по сравнению с обычным живым вирусом, и фармацевтически приемлемый буфер, и предварительно обработанный вирус способен давать такой титр без добавления в композицию какого-либо стабилизатора, такого как гидролизат невирусного белка, пептон, растительный белок и дисахарид.
В каждом из указанных выше аспектов в тех случаях, когда предполагается дополнительный стабилизатор, наиболее предпочтительным дополнительным стабилизатором является гидролизат лактальбумина. Дисахарид (например, трегалоза) или сочетание разных дисахаридов (например, сахарозы и трегалозы) являются следующими предпочтительными стабилизаторами в композиции, содержащей гидролизат лактальбумина. В одном варианте гидролизат лактальбумина в композиции имеет концентрацию примерно 5% масс./об., сахароза - примерно 80% масс./об., и трегалоза - примерно 0,5% масс./об. Композиция может содержать рекомбинантный сывороточный альбумин человека (например, 0,1% масс./об.) в качестве еще одного дополнительного стабилизатора.
В одном варианте вирус является живым ротавирусом, таким как живой аттенуированный ротавирус. Предпочтительно живой вирус является живым вирусом человека, таким как ротавирус человека. В особенно предпочтительном варианте ротавирусом человека является ротавирус штамма 116E или I321. Композиция согласно настоящему изобретению представляет собой вакцину. В одном варианте композиция согласно настоящему изобретению может содержать живой аттенуированный ротавирус с титром в диапазоне от 103 до 108,5 БОЕ/0,5 мл. Живой ротавирус является предварительно обработанным ротавирусом.
В другом общем аспекте предлагается способ получения живого аттенуированного предварительно обработанного ротавируса. Способ включает в себя стадии инфицирования клеток-хозяев живым аттенуированным ротавирусом, выращивания инфицированных клеток в среде для культивирования клеток с добавлением сывороточного альбумина человека, которая позволяет поддерживать рост клеток, и сбора предварительно обработанного ротавируса. Собранный предварительно обработанный ротавирус проявляет улучшенную стабильность по сравнению с необработанным предварительно или обычным вирусом.
В еще одном общем аспекте настоящее изобретение также относится к способу адаптации вируса к подходящему клеточному субстрату, такому как клетки Vero, серийно пересеваемые в подходящей среде, каждый пассаж осуществляют в среде в отсутствие или в присутствии сывороточного альбумина человека, полученного от человека, или рекомбинантного сывороточного альбумина человека.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям и способам, связанным с живыми аттенуированными ротавирусами. Живые аттенуированные ротавирусы проявляют свойства повышенной стабильности и применимы для предотвращения ротавирусной инфекции и/или ротавирусного гастроэнтерита у детей.
В частности, настоящее изобретение относится к различным подходам и системам для получения ротавирусных композиций, которые проявляют повышенную стабильность в данной временной точке и стабильность, поддерживаемую в течение определенного периода времени при хранении. Один из подходов заключается в применении предварительно обработанных вирусов в качестве исходного материала в композициях согласно изобретению. Другой подход заключается в применении различных стабилизаторов для получения повышенной стабильности, когда используемый вирус является предварительно обработанным вирусом.
Как определено выше, вирус или популяция вирусов, собранных из культур клеток, размножаемых в среде, содержащей сывороточный альбумин человека, называют «предварительно обработанным» вирусом или популяцией вирусов. И наоборот, вирус или популяцию вирусов, собранных из культур клеток в среде, не содержащей сывороточного альбумина человека, называют «обычным» вирусом или популяцией вирусов. Живой аттенуированный ротавирус иногда в настоящем описании называют вирусным антигеном или антигеном вакцины.
Как описано выше, предварительно обработанный вирус проявляет свойства повышенной стабильности по сравнению с обычным вирусом. Каждый из вирусов, и предварительно обработанный вирус, и обычный вирус, проявляют стабильность, более длительно поддерживаемую во время хранения в составе с добавлением одного или нескольких стабилизаторов, по сравнению с составом без добавок. Следует понимать, что стабилизаторы, используемые для поддержания стабильности, независимо от того, является или не является вирус, используемый в качестве исходного материала для состава после сбора, предварительно обработанным, в широком смысле входят в три разных системы компонентов.
Однокомпонентная система содержит невирусный белок или гидролизат такого белка в виде части состава. Невирусный белок или гидролизат белка служит в качестве стабилизатора. Двухкомпонентная система содержит дисахарид в дополнение к невирусному белку или гидролизату такого белка. В двухкомпонентной системе и дисахарид, и белок или его гидролизат служат в качестве стабилизаторов. Трехкомпонентная система подобна двухкомпонентной системе, но содержит дополнительный дисахарид, отличный от дисахарида в двухкомпонентной системе.
В находящейся одновременно на рассмотрении заявке авторов настоящего изобретения № 842/CHE/2006, авторы описали композицию, содержащую вирусный антиген; первый белок, выбранный из сывороточного альбумина человека или рекомбинантного альбумина человека, и второй белок, который по меньшей мере частично гидролизован, выбранный из гидролизата лактальбумина, дрожжевого гидролизата, пептона и гидролизата яичного белка, и предпочтительно сочетание трех разных дисахаридов, при этом используемый вирус не размножают в присутствии HSA. Жидкая композиция проявляет стабильность в течение 3-4 недель при 37°C, шесть месяцев при 25°C и один год при 2°C-8°C, тогда как лиофилизированная композиция проявляет стабильность в течение более чем 50 недель при 2°C-8°C, 25°C, 37°C.
Жидкая композиция согласно настоящему изобретению стабильна в течение 6 недель при 37°C, в течение 6 месяцев при 25°C и 24 месяцев при 2-8°C.
Лиофилизированная композиция согласно настоящему изобретению стабильна в течение 16 недель при 37°C, в течение 6 месяцев при 25°C и 24 месяцев при 2-8°C.
Композиции могут представлять собой жидкие композиции или лиофилизированные (сухая форма). Настоящее изобретение относится к живым аттенуированным ротавирусам и их композициям, проявляющим улучшенную и повышенную стабильность при хранении при 2-8°C или в условиях окружающей среды в течение длительного периода времени. Условия окружающей среды могут представлять собой преобладающие в данном месте и обычные атмосферные условия (например, 25°C), но не превышающие примерно 37°C. Композиции согласно настоящему изобретению способны поддерживать свою способность к иммунизации во время получения и в течение периода времени, необходимого для срока годности коммерческой вакцины (т.е. композиции являются стабильными).
Таким образом, композиция согласно настоящему изобретению проявляет стабильность в течение более длительного периода вследствие размножения вируса в присутствии сывороточного альбумина человека, по сравнению с его добавлением извне.
В одном примере композиция согласно настоящему изобретению содержит вирусный антиген (предварительно обработанный или обычный вирус), невирусный белок или белок, который отличается от вирусного антигена. Следует понимать, что термин «невирусный белок» означает любой из белков: лактальбумин, гидролизат дрожжевого белка, желатин, яичный белок или растительный белок, который представляет собой белок кукурузы, белок пшеницы, белок нута обыкновенного, белок фасоли обыкновенной, белок чечевицы, белок лимской фасоли, белок турецких бобов, соевый белок, белок лущеного гороха и сывороточный альбумин человека, все природного или рекомбинантного происхождения. Предпочтительно белок, по меньшей мере, частично гидролизован. Другими словами, гидролизаты таких белков или пептон можно использовать в композициях согласно настоящему изобретению.
Предполагается, что фраза «белок, по меньшей мере, частично гидролизован», в используемом в настоящем описании смысле относится к варианту, когда гидролизуемый белок был, по меньшей мере, част