Система культивирования плюрипотентных стволовых клеток
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, в частности к выращиванию колоний клеток. Система культивирования плюрипотентных стволовых клеток состоит из соединенных между собой системы управления и блока культивирования. При этом блок культивирования содержит один или более отсеков культивирования с установленными на нем устройством введения агента, изменяющего эпигенетический статус клетки, по крайней мере, одним устройством введения, по крайней мере, одного модификатора, восстанавливающего генетический статус клетки, отвечающий за клеточный цикл, устройством введения монооксида азота, устройством введения ингибитора пролиферации и устройством введения ингибитора апоптоза. Причем упомянутые устройства выполнены с возможностью перемещения по внешней стороне блока культивирования плюрипотентных стволовых клеток и поочередного введения их содержимого в отсеки культивирования. Система позволяет выращивать плюрипотентные стволовые клетки, поддерживать их жизнеобеспечение и предупреждать канцерогенез впоследствии полученных из них дифференцированных клеток. 2 з.п. ф-лы, 2 ил., 1 пр.
Реферат
Изобретение относится к биотехнологии, в частности к выращиванию колоний клеток. Система культивирования плюрипотентных стволовых клеток может использоваться как отдельное устройство либо как составная часть биопринтера.
Известно два основных метода культивирования клеток - непроточный, в котором клетки вводят в фиксированный объем среды, и проточный, в котором обеспечивают необходимые гомеостатические условия без изменения концентрации питательных веществ и метаболитов, а также числа клеток (http://www.biotechnolog.ru/acell/acell1_5.htm,%2016.01.2013).
Главная проблема заключается в том, что на данный момент не существует ни одной системы культивирования клеток, способной автоматически выращивать и проводить генную реабилитацию плюрипотентных стволовых клеток, в частности индуцированных, которые сильно подвержены онкогенным мутациям.
Наиболее близким аналогом является трехмерная система для культивирования клеток BioLevitator, которая способна с помощью субстрата GEM поддерживать клеточную культуру высокой плотности, а также с помощью магнитной технологии Global Eukaryotic Microcarrier (GEM) проводить с ними различные манипуляции для распределения и изучения ().
Недостатком системы-прототипа является то, что ее работа направлена, в первую очередь, на изучение культивируемых клеток, при этом она не способна излечивать клетки от жизненно важных деструктивных мутаций.
Задачей предложенного изобретения является разработка компактной и удобной системы культивирования плюрипотентных стволовых клеток.
Техническим результатом предложенного изобретения является обеспечение возможности с помощью системы культивирования выращивать плюрипотентные стволовые клетки, поддерживать их жизнеобеспечение и предупреждать канцерогенез впоследствии полученных из них дифференцированных клеток.
Технический результат достигается системой культивирования плюрипотентных стволовых клеток, включающей соединенные между собой систему управления и блок культивирования плюрипотентных стволовых клеток, содержащий один или более отсеков культивирования, с установленными на нем устройством введения агента, изменяющего эпигенетический статус клетки, по крайней мере, одним устройством введения, по крайней мере, одного модификатора, восстанавливающего генетический статус клетки, отвечающий за клеточный цикл, устройством введения монооксида азота, устройством введения ингибитора пролиферации и устройством введения ингибитора апоптоза, причем упомянутые устройства выполнены с возможностью перемещения по внешней стороне блока культивирования плюрипотентных стволовых клеток и поочередного введения их содержимого в отсеки культивирования.
Система управления может быть установлена непосредственно на блоке культивирования плюрипотентных стволовых клеток.
Устройства введения модификаторов, восстанавливающих генетический статус клетки, отвечающий за клеточный цикл, могут представлять собой устройство введения белка Bax и устройство введения белка Bak.
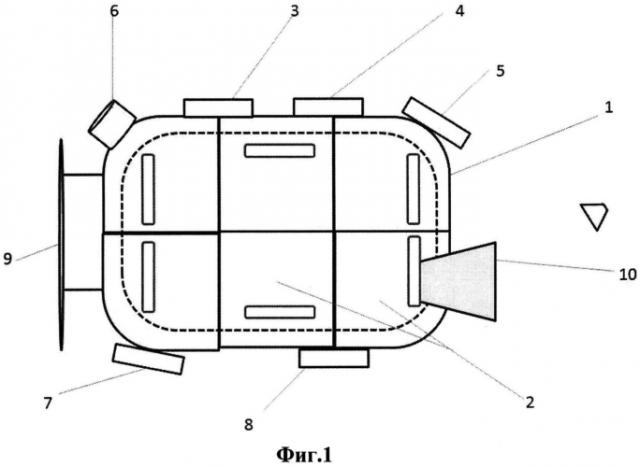
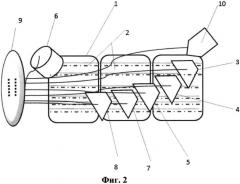
Схема наилучшего исполнения предложенной системы культивирования плюрипотентных стволовых клеток представлена на фиг. 1 (вид сверху) и фиг. 2 (вид сбоку). Цифрами обозначены следующие элементы:
1 - блок культивирования плюрипотентных стволовых клеток,
2 - отсеки культивирования плюрипотентных стволовых клеток,
3 - устройство введения агента, изменяющего эпигенетический статус клетки,
4 - устройство введения белка Bax,
5 - устройство введения белка Bak,
6 - устройство введения монооксида азота,
7 - устройство введения ингибитора пролиферации,
8 - устройство введения ингибитора апоптоза,
9 - система управления,
10 - механизм смены питательной среды.
Система управления может быть установлена на биопринтере, в состав которого входит система культивирования плюрипотентных стволовых клеток, либо непосредственно на блоке культивирования, что делает данную систему удобной в эксплуатации.
Работа предложенной системы культивирования плюрипотентных стволовых клеток направлена на ликвидацию наиболее известных и широко изученных полиморфизмов гена ТР53, приводящих к онкогенезу клеток, а именно на то, чтобы исключить:
- замену гуанина на цитозин в 4-м экзоне (Ех4+119 G>C, Arg72Pro, rs1042522),
- замену гуанина на аденин в 6-м интроне (IVS6+62 G>A, rs1625895),
- инсерцию/делецию 16 п.н. в 3-м интроне (INDEL, IVS3 16 bp, rs17878362).
Блок культивирования плюрипотентных стволовых клеток (1) представляет собой клеточный инкубатор с набором ячеистых силиконовых форм (луночных планшетов), между которыми размещены перегородки. В каждую ячейку формы помещена мембрана для клеточной культуры.
Отсеки культивирования плюрипотентных стволовых клеток представляют собой разделенные между собой перегородками участки инкубатора.
В качестве устройств введения (3), (4), (5), (7), (8) используются жидкостные дозаторы. Например, можно использовать жидкостной дозатор «ДЖ».
В качестве устройства введения (6) можно использовать всевозможные газовые дозаторы. Из широко распространенных можно использовать, например, дозатор автоматический газовый ДАГ-1М.
Механизм смены питательной среды может быть исполнен в двух вариантах (10).
Первый вариант представляет собой жидкостный дозатор и задвижку. Для использования этого варианта на дне каждой ячейки должно быть расположено отверстие с клапаном. Края мембраны должны быть непрерывно приклеены к краям ячейки. Для смены питательной среды задвижка открывает клапан, старая питательная среда вытекает из ячейки, после чего дозатор посредством трубки впрыскивает в ячейку новую питательную среду. После добавления необходимого количества питательной среды трубка дозатора отсоединяется от ячейки и вместе с тем отверстие на дне ячейки закрывается клапаном.
Второй вариант механизма смены питательной среды представляет собой лабораторный манипулятор. Для использования этого варианта края мембраны должны быть приклеены к зафиксированной относительно корпуса блока культивирования пластине с отверстиями, а именно края каждой мембраны должны быть прикреплены к краям отверстия в пластине. Лабораторный манипулятор захватывает луночный планшет и вынимает его из отсека культивирования плюрипотентных стволовых клеток (2), после чего помещает в указанный отсек луночный планшет с другой питательной средой.
При помещении колонии стволовых клеток в отсеки культивирования (2), встроенные в блок культивирования (1), система управления (9) посредством анализатора, установленного на электронном микроскопе (на фиг. не показан), встроенном в блок культивирования, считывает информацию о наличии и обширности полиморфизмов, о которых упоминалось ранее, а также о скорости протекания апоптоза и пролиферации клеток и подает сигнал устройствам ввода (3-8), посредством которых в среду культивирования вводятся агент, изменяющий эпигенетический статус клетки, белок Bax и белок Bak (частный случай модификаторов, восстанавливающих генетический статус клетки, отвечающий за клеточный цикл), монооксид азота, ингибитор пролиферации и ингибитор апоптоза. С помощью измерителей концентраций указанных соединений, от которых соответствующий сигнал поступает в систему управления, последняя способна корректировать ввод указанных компонентов в среду культивирования. При наличии вышеперечисленных генетических полиморфизмов система управления подает сигнал о вводе в среду культивирования модификаторов, восстанавливающих генетический статус клетки, отвечающий за клеточный цикл (например, белков Bax и Bak), а также способствующий процессу восстановления монооксида азота. При высокой скорости апоптоза система управления подает сигнал о вводе ингибитора апоптоза. При высокой скорости пролиферации и одновременном наличии онкогенных полиморфизмов в генах клеток система управления подает сигнал о вводе в среду культивирования ингибитора пролиферации.
В каждом отсеке культивирования могут выращиваться разные культуры плюрипотентных клеток. В зависимости от этого устройства ввода (3-8) могут вводить в каждый отсек разное количество соответствующих компонентов.
При необходимости механизм смены питательной среды (10) может пересеивать клетки в другую среду с другим набором компонентов.
Культивирование лабораторно полученных индуцированных плюрипотентных стволовых клеток в присутствии агента, изменяющего эпигенетический статус клетки (например, деметилирующего агента, ингибитора деацетилазы гистонов или их сочетания), позволит сделать эпигенетический статус клеток «подвижным».
Для того чтобы скорость разрушения клеток не превышала скорость поглощения их разрушенного материала соседними клетками, что, в свою очередь, приводит к воспалительным процессам, необходимо урегулировать проницаемость наружной мембраны митохондрий клеток, отвечающую за поглощение и переработку отмершего материала. Существенную роль в повышении проницаемости наружной мембраны митохондрий играют белки Bax и Bak. Они встраиваются в наружную мембрану митохондрий и олигомеризуются. При этом нарушается целостность внешней мембраны митохондрий. Функционирование белков Bax и Bak зависит от их предварительной активации, например, белками Bid и Bim, которые относятся к подсемейству ВНЗ белков (Льюин Б. и др. Клетки. - М.: БИНОМ. Лаборатория знаний, 2011. - 951 с.).
С другой стороны, активация и функционирование Bax и Bak может блокироваться антиапоптотическими белками семейства Bcl-2: Bcl-2, Bcl-xL, Mcl-1 и др. В свою очередь, антиапоптотические белки также могут блокироваться белками-депрессорами (например, Bad), относящимися к подсемейству ВН3 белков. В итоге достигается комбинированная регуляция мембранной проницаемости митохондрий и соответственно апоптоза за счет взаимодействия апоптотических, антиапоптотических, а также ВН3 белков-активаторов и депрессоров. Регуляция функций ВН3 белков осуществляется на уровне транскрипции, стабильности молекул, при взаимодействии с другими белками и при различных модификациях (Льюин Б. и др. Клетки. - М.: БИНОМ. Лаборатория знаний, 2011. - 623 с.).
Несмотря на то что на данном этапе невозможно установить все причины нарушения апоптоза, добавление белков bax и bak в среду культивации ("молодых" клеток) способно выровнять скорость разрушения и поглощения отмерших клеток за счет регуляции проницаемости наружной мембраны митохондрий. Кроме того, в присутствии агента, изменяющего эпигенетический статус клетки, это позволит «починить» ген ТР53, нарушенная модификация которого обнаружена в клетках около 50% раковых опухолей.
Это явление можно объяснить следующим. На наличие и частоту мутаций гена TP53 существенно влияют факторы окружающей среды, в том числе изменение параметров апоптоза, которое можно спровоцировать белками bax и bak. Повышение активности гена ТР53 в присутствии агента, изменяющего эпигенетический статус клетки, может повышать восприимчивость клеток к сигналам входа в апоптоз через опосредованное влияние белка р53 на экспрессию генов bax и bcl2. Такие р53-опосредованные изменения экспрессии генов bax и bcl2 могут изменять соотношение количества белков Bax и Bcl2, тем самым переводя клетку в состояние повышенной чувствительности к апоптозу. Таким образом, помимо химического выравнивания скорости разрушения и поглощения клеток, белки bax и bak через непосредственное влияние на апоптоз способны также оказывать обратное воздействие на ген ТР53, которое заключается в предварительном повреждении с последующей его нормальной структуризацией.
Если культивирование стволовых клеток проводить в присутствии монооксида азота, это позволит несложным способом произвести дополнительную активацию гена ТР53 для его последующей "починки".
При этом следует отметить, что вследствие строгого "посттрансляционного контроля активации белка р53" непосредственно сама по себе высокая концентрация белка р53 не ведет к собственной активации и "починке" гена ТР53.
Для ускорения "выздоровления" индуцированных плюрипотентных стволовых клеток их культивирование в присутствии агента, изменяющего эпигенетический статус клетки, а также культивирование в отсутствие указанного агента предпочтительно проводить в присутствии ингибитора пролиферации.
Культивирование индуцированных плюрипотентных стволовых клеток предпочтительно проводить также в присутствии, по меньшей мере, одного ингибитора апоптоза.
В то время как за счет белков bak и bax клеточная смерть проходит посредством апоптоза, биохимия которого данными белками и регулируется, ингибитор апоптоза желателен для контроля его скорости.
Пример осуществления
Из фибробластов кончика хвоста мыши получали химически индуцированные плюрипотентные стволовые клетки (ХИПСК). Для этого указанные фибробласты были разморожены и посеяны в луночный планшет в питательную среду RPMI-1640 с глутамином. Изначальная плотность монослоя фибробластов составляла 20%. Через 18,5 часов после рассева плотность монослоя достигла 40%.
По достижении заданной плотности в питательную среду были введены три фактора химического перепрограммирования, представляющие собой низкомолекулярные соединения: вальпроевую кислоту, хлорид лития, 4-[4-(1,3-бензодиоксол-5-ил)-5-(2-пиридинил)-1Н-имидазол-2-ил]бензамид (ингибитор SB-431542, чистота 99%). Также в среду был введен концентрированный диметилсульфоксидный раствор N-[(1,2-дигидро-4,6-диметил-2-оксо-3-пиридинил)метил]-3-метил-1-[(1S)-1-метилпропил]-6-[6-1-пиперазинил)-3-пиридинил]-1Н-индол-4-карбоксиамид (ингибитор метилтрансферазы GSK126, чистота 98%).
Через 35 часов клетки были пересеяны в один из отсеков культивирования, расположенный в блоке культивирования, в луночный планшет с питательной средой RPMI-1640 с глутамином. В среду заранее был введен агент, изменяющий эпигенетический статус клетки, в качестве которого был взят 5-аза-2′-дезоксицитидин, протеин Bax (марки 6А7) и протеин Bak (марки (G-23)-G). В указанную среду был также добавлен ингибитор пролиферации, представлявший собой композицию из дельта-глобиновой цепи гемоглобина и фармацевтически приемлемого носителя.
В описанных условиях клетки культивировали в течение 7 часов.
После этого среда была заменена на питательную среду RPMI-1640 с глутамином. Последующее культивирование проводили в течение 9 часов в атмосфере, содержащей монооксид азота.
Для выращенных индуцированных плюрипотентных клеток среду заменили на питательную среду Игла MEM с солями Эрла без глутамина, в которую был добавлен фактор роста нервов - Mouse Nerve Growth Factor (mNGF). Дальнейшую дифференцировку клеток проводили в течение 32 часов.
Среднее ядерно-цитоплазматическое отношение в клетках составляло 0,04. Ядрышко имело плохую выраженность. Наличие диспергированного хроматина в ядре обнаружено не было. Данные показатели свидетельствуют о высокой степени созревания клеток.
Длительное наблюдение за колонией полученных клеток не выявило признаков канцерогенеза.
Представленные экспериментальные данные, а также доступность средств для изготовления предложенной системы культивирования и ее относительно несложная конструкция свидетельствуют о том, что система может обеспечить выращивание плюрипотентных стволовых клеток, поддержку их жизнеобеспечения и предупреждение канцерогенеза впоследствии полученных из них дифференцированных клеток.
1. Система культивирования плюрипотентных стволовых клеток, включающая соединенные между собой систему управления и блок культивирования плюрипотентных стволовых клеток, содержащий один или более отсеков культивирования, с установленными на нем устройством введения агента, изменяющего эпигенетический статус клетки, по крайней мере, одним устройством введения, по крайней мере, одного модификатора, восстанавливающего генетический статус клетки, отвечающий за клеточный цикл, устройством введения монооксида азота, устройством введения ингибитора пролиферации и устройством введения ингибитора апоптоза, причем упомянутые устройства выполнены с возможностью перемещения по внешней стороне блока культивирования плюрипотентных стволовых клеток и поочередного введения их содержимого в отсеки культивирования.
2. Система культивирования по п. 1, отличающаяся тем, что система управления установлена непосредственно на блоке культивирования плюрипотентных стволовых клеток.
3. Система культивирования по п. 1 или 2, отличающаяся тем, что устройства введения модификаторов, восстанавливающих генетический статус клетки, отвечающий за клеточный цикл, представляют собой устройство введения белка Вах и устройство введения белка Ваk.